2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 课后选练(含答案)
文档属性
| 名称 | 2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 课后选练(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 593.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 11:05:21 | ||
图片预览



文档简介
2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 课后选练含答案
沪教版(全国)第6章 溶解现象 课后选练
一、选择题。
1、(双选)下列有关洗涤的说法中错误的是( )
A.用汽油溶解衣物上的油渍 B.用洗洁精溶解餐具上的油污
C.用水清洗蒸发皿中少量食盐 D.内壁有碘的试管用水清洗
2、下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )
A. 100 g 水中溶解了 10 g 硝酸钾
B. 100 g 硝酸钾溶液中有 10 g 硝酸钾
C.将 10 g 硝酸钾溶于 90 g 水中所得的溶液
D.将硝酸钾与水按 1 ∶9 的质量比配制的溶液
3、下列说法正确的是( )
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
4、20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
5、如图是利用海水提取粗盐的过程,有关该过程的说法不正确的是( )
A.海水进入贮水池,海水的成分不变
B.蒸发池中发生的是化学变化
C.可以通过过滤从结晶池中得到粗盐和母液
D.粗盐中含有可溶性杂质和不溶性杂质
6、(双选)下列实验方案错误的是( )
A.除去食盐溶液中的蔗糖:将混合液进行过滤
B.氧气的验满:把带火星的木条伸入到集气瓶内
C.铁丝在氧气中燃烧:将红热的铁丝伸入盛有氧气的集气瓶中(瓶中事先留一点水)
D.鉴别氢氧化钠固体和硝酸铵固体:取样溶于水,测量溶解前后液体温度的变化
7、在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
8、甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液
9、实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是( )
A.氯化钠固体中含有杂质 B.用量筒量取水时仰视读数
C.加水溶解固体时有水洒出 D.配制好的溶液装瓶中时有少量洒出
10、粗盐中含有较多可溶性杂质(氯化镁、氯化钙等)和不溶性杂质,按如图流程进行“粗盐提纯”实验,说法不正确的是( )
A.得到的精盐是混合物
B.粗盐变为精盐是物理变化
C.加热蒸发时,待水分全部蒸干才熄灭酒精灯
D.玻璃棒用了3次,作用各不相同
11、(双选)对下列实验现象的描述不正确的题( )
A.镁在空气中燃烧发出耀眼的白光生成白色固体
B.硝酸铵在水中溶解时,溶液温度降低
C.红磷在空气中燃烧产生出大量的白色烟雾
D.细铁丝在氧气中燃烧火星四射生成黑色四氧化三铁
12、稀释质量分数为 98% (密度为 1.84 g/mL) 的浓硫酸,配制 500 mL 质量分数为 20%的稀硫酸 (密度为 1. 14 g/mL),稀释时需用的水的体积约为( )
A.436.8 mL B.453.7 mL C.456.0 mL D.458.3 mL
13、有关溶液的说法正确的是( )
A.溶液都是无色的 B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量 D.溶液都是均一、稳定的混合物
14、(双选)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.氯化钠 C.汽油 D.蔗糖
15、将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为( )
A.9.8% B.10.0% C.10.9% D.11.1%
二、填空题。
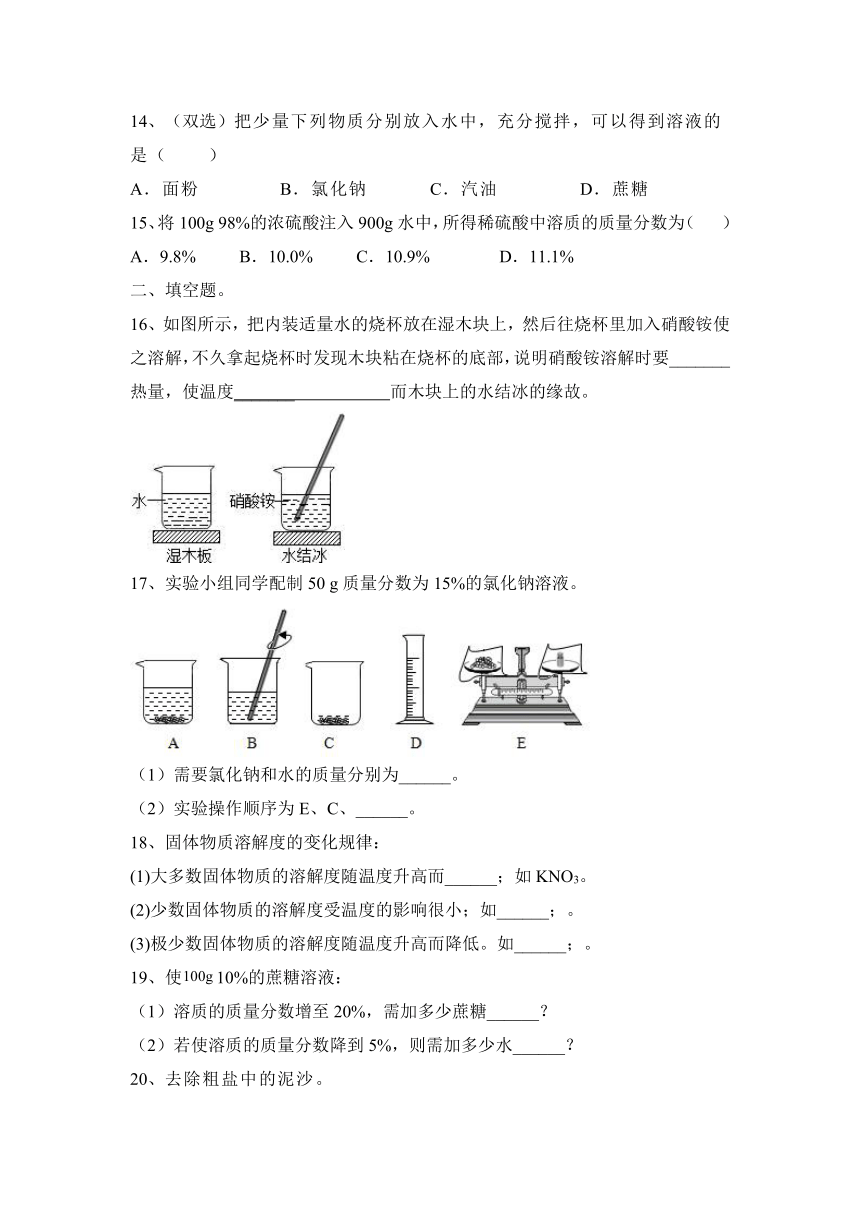
16、如图所示,把内装适量水的烧杯放在湿木块上,然后往烧杯里加入硝酸铵使之溶解,不久拿起烧杯时发现木块粘在烧杯的底部,说明硝酸铵溶解时要_______热量,使温度_______ 而木块上的水结冰的缘故。
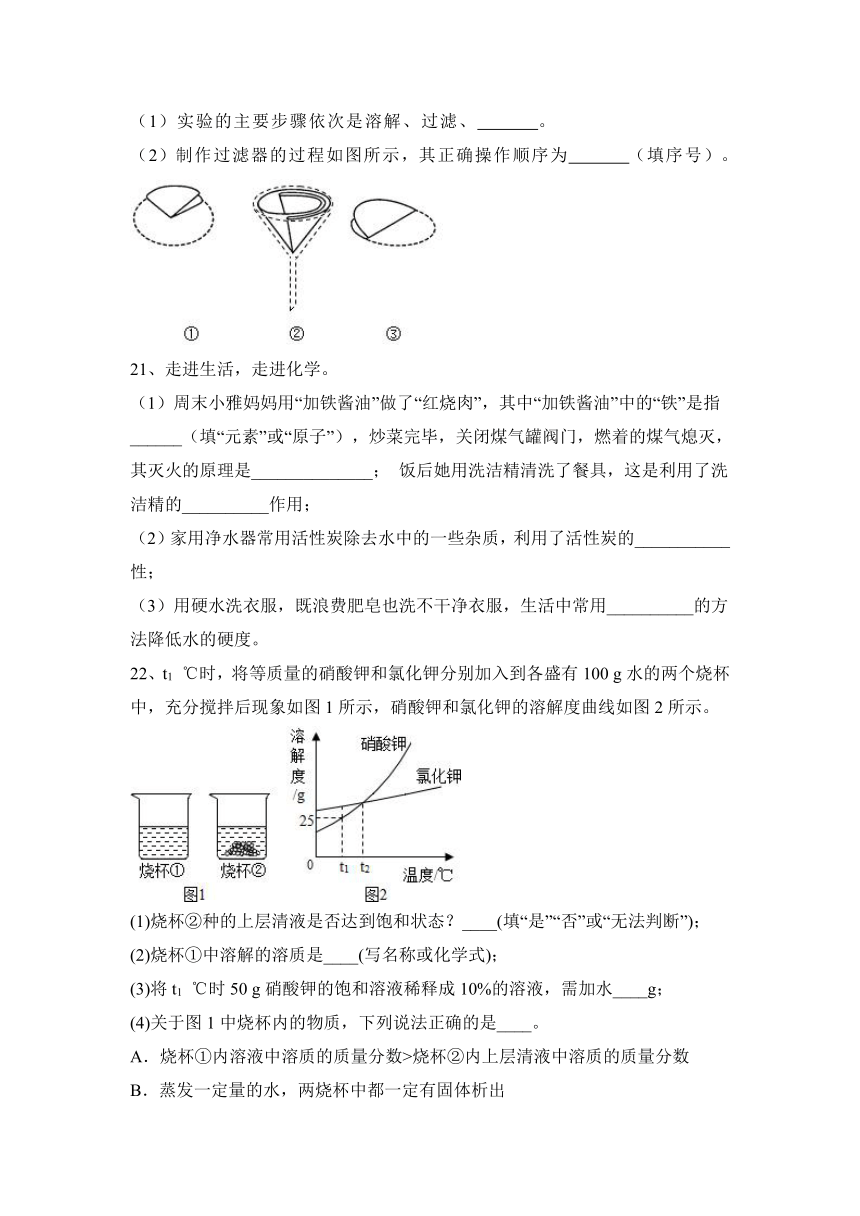
17、实验小组同学配制50 g质量分数为15%的氯化钠溶液。
(1)需要氯化钠和水的质量分别为______。
(2)实验操作顺序为E、C、______。
18、固体物质溶解度的变化规律:
(1)大多数固体物质的溶解度随温度升高而______;如KNO3。
(2)少数固体物质的溶解度受温度的影响很小;如______;。
(3)极少数固体物质的溶解度随温度升高而降低。如______;。
19、使10%的蔗糖溶液:
(1)溶质的质量分数增至20%,需加多少蔗糖______?
(2)若使溶质的质量分数降到5%,则需加多少水______?
20、去除粗盐中的泥沙。
(1)实验的主要步骤依次是溶解、过滤、 。
(2)制作过滤器的过程如图所示,其正确操作顺序为 (填序号)。
21、走进生活,走进化学。
(1)周末小雅妈妈用“加铁酱油”做了“红烧肉”,其中“加铁酱油”中的“铁”是指______(填“元素”或“原子”),炒菜完毕,关闭煤气罐阀门,燃着的煤气熄灭,其灭火的原理是______________; 饭后她用洗洁精清洗了餐具,这是利用了洗洁精的__________作用;
(2)家用净水器常用活性炭除去水中的一些杂质,利用了活性炭的___________性;
(3)用硬水洗衣服,既浪费肥皂也洗不干净衣服,生活中常用__________的方法降低水的硬度。
22、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态?____(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是____(写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水____g;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
23、回答下列问题
(1)固体的溶解度指在一定______下,某固态物质在______溶剂里达到______状态所溶解的______。
(2)20℃时,氯化钠在水中的溶解度为36 g,意思是20℃时,______水中达到______状态时溶解氯化钠的质量为______;或者20℃时,______水中______可溶解氯化钠的质量为36 g。
(3)物质的溶解性是根据______℃时的溶解度规定的,当该温度下物质的溶解度______10 g时,为易溶物质。
a.固体的溶解度从几个要素进行规定?______
b.要比较两种物质的溶解度,需要注意什么问题?______
三、推断题。
24、某兴趣小组提纯含少量泥沙的粗盐,一般经过如图甲所示操作流程:
(1)操作①中玻璃棒的作用_________。
(2)溶液蒸发时溶质的质量分数随时间的变化如图乙所示下表是食盐的溶解度表:
温度(C) 10 20 30 40 50 60 70 80 90 100
食盐(克) 35.5 36.0 36.3 36.6 37.0 37.3 37.8 38.3 38.9 39.8
图乙
假设C时刻溶液的温度为90°C,请你查找资料计算出此时溶质的质量分数___________。
(3)实验结束后称量获得的精盐,计算发现精盐的质量明显偏小,其原因可能有_______(填数字序号)。
①溶解时,溶解不够充分②过滤时,滤渣没有清洗③蒸发时,液滴飞残
④蒸发后所得的食盐很潮湿⑤转移后,蒸发皿上还沾有食盐
四、综合应用题。
25、某化学兴趣小组在老师的带领下,来到实验室完成以下2个实验。
(一)常见气体的制取:
(1)用装置A制取O2,检查装置气密性的方法是_________,试管中反应的化学方程式为_____。
(2)用装置C收集H2,气体应从导管口_______(选填“a”或“b”)通入。
(3)通常情况下,乙烯(化学式为C2H4)是一种无色、难溶于水、密度与空气接近的气体。实验室常用40%的乙烯利溶液和氢氧化钠固体在常温下反应制取乙烯,则其发生装置与收集装置的组合为______(填字母序号)。
(二)对含有MgCl2的粗盐进行提纯,步骤如图:
(4)步骤②中,玻璃棒的作用是_______。
(5)步骤④中,滤纸上的滤渣除含有泥沙等杂质外还有_______(填化学式)。
(6)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是 (填字母)。
A.稀硫酸 B.稀盐酸 C.硫酸铜 D.稀硝酸
(7)步骤⑥中当出现_______时,停止加热。
五、计算题。
26、汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3。若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克。求:
(1)630克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克?
2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 课后选练含答案
沪教版(全国)第6章 溶解现象 课后选练
一、选择题。
1、(双选)下列有关洗涤的说法中错误的是( )
A.用汽油溶解衣物上的油渍 B.用洗洁精溶解餐具上的油污
C.用水清洗蒸发皿中少量食盐 D.内壁有碘的试管用水清洗
【答案】BD
2、下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )
A. 100 g 水中溶解了 10 g 硝酸钾
B. 100 g 硝酸钾溶液中有 10 g 硝酸钾
C.将 10 g 硝酸钾溶于 90 g 水中所得的溶液
D.将硝酸钾与水按 1 ∶9 的质量比配制的溶液
【答案】A
3、下列说法正确的是( )
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
【答案】C
4、20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
【答案】C
5、如图是利用海水提取粗盐的过程,有关该过程的说法不正确的是( )
A.海水进入贮水池,海水的成分不变
B.蒸发池中发生的是化学变化
C.可以通过过滤从结晶池中得到粗盐和母液
D.粗盐中含有可溶性杂质和不溶性杂质
【答案】B
6、(双选)下列实验方案错误的是( )
A.除去食盐溶液中的蔗糖:将混合液进行过滤
B.氧气的验满:把带火星的木条伸入到集气瓶内
C.铁丝在氧气中燃烧:将红热的铁丝伸入盛有氧气的集气瓶中(瓶中事先留一点水)
D.鉴别氢氧化钠固体和硝酸铵固体:取样溶于水,测量溶解前后液体温度的变化
【答案】AB
7、在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
【答案】A
8、甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液
【答案】A
9、实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是( )
A.氯化钠固体中含有杂质 B.用量筒量取水时仰视读数
C.加水溶解固体时有水洒出 D.配制好的溶液装瓶中时有少量洒出
【答案】C
10、粗盐中含有较多可溶性杂质(氯化镁、氯化钙等)和不溶性杂质,按如图流程进行“粗盐提纯”实验,说法不正确的是( )
A.得到的精盐是混合物
B.粗盐变为精盐是物理变化
C.加热蒸发时,待水分全部蒸干才熄灭酒精灯
D.玻璃棒用了3次,作用各不相同
【答案】C
11、(双选)对下列实验现象的描述不正确的题( )
A.镁在空气中燃烧发出耀眼的白光生成白色固体
B.硝酸铵在水中溶解时,溶液温度降低
C.红磷在空气中燃烧产生出大量的白色烟雾
D.细铁丝在氧气中燃烧火星四射生成黑色四氧化三铁
【答案】CD
12、稀释质量分数为 98% (密度为 1.84 g/mL) 的浓硫酸,配制 500 mL 质量分数为 20%的稀硫酸 (密度为 1. 14 g/mL),稀释时需用的水的体积约为( )
A.436.8 mL B.453.7 mL C.456.0 mL D.458.3 mL
【答案】B
13、有关溶液的说法正确的是( )
A.溶液都是无色的 B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量 D.溶液都是均一、稳定的混合物
【答案】D
14、(双选)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.氯化钠 C.汽油 D.蔗糖
【答案】BD
15、将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为( )
A.9.8% B.10.0% C.10.9% D.11.1%
【答案】A
二、填空题。
16、如图所示,把内装适量水的烧杯放在湿木块上,然后往烧杯里加入硝酸铵使之溶解,不久拿起烧杯时发现木块粘在烧杯的底部,说明硝酸铵溶解时要_______热量,使温度_______ 而木块上的水结冰的缘故。
【答案】吸收 降到0℃以下
17、实验小组同学配制50 g质量分数为15%的氯化钠溶液。
(1)需要氯化钠和水的质量分别为______。
(2)实验操作顺序为E、C、______。
【答案】(1)7.5g和42.5g (2) D、A、B
18、固体物质溶解度的变化规律:
(1)大多数固体物质的溶解度随温度升高而______;如KNO3。
(2)少数固体物质的溶解度受温度的影响很小;如______;。
(3)极少数固体物质的溶解度随温度升高而降低。如______;。
【答案】(1)升高 (2)NaCl (3)Ca(OH)2
19、使10%的蔗糖溶液:
(1)溶质的质量分数增至20%,需加多少蔗糖______?
(2)若使溶质的质量分数降到5%,则需加多少水______?
【答案】
20、去除粗盐中的泥沙。
(1)实验的主要步骤依次是溶解、过滤、 。
(2)制作过滤器的过程如图所示,其正确操作顺序为 (填序号)。
【答案】蒸发;③①②
21、走进生活,走进化学。
(1)周末小雅妈妈用“加铁酱油”做了“红烧肉”,其中“加铁酱油”中的“铁”是指______(填“元素”或“原子”),炒菜完毕,关闭煤气罐阀门,燃着的煤气熄灭,其灭火的原理是______________; 饭后她用洗洁精清洗了餐具,这是利用了洗洁精的__________作用;
(2)家用净水器常用活性炭除去水中的一些杂质,利用了活性炭的___________性;
(3)用硬水洗衣服,既浪费肥皂也洗不干净衣服,生活中常用__________的方法降低水的硬度。
【答案】元素 清除可燃物(或隔离可燃物) 乳化 吸附 煮沸
22、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态?____(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是____(写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水____g;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
【答案】(1) 是 (2)氯化钾 (3)50 (4)A
23、回答下列问题
(1)固体的溶解度指在一定______下,某固态物质在______溶剂里达到______状态所溶解的______。
(2)20℃时,氯化钠在水中的溶解度为36 g,意思是20℃时,______水中达到______状态时溶解氯化钠的质量为______;或者20℃时,______水中______可溶解氯化钠的质量为36 g。
(3)物质的溶解性是根据______℃时的溶解度规定的,当该温度下物质的溶解度______10 g时,为易溶物质。
a.固体的溶解度从几个要素进行规定?______
b.要比较两种物质的溶解度,需要注意什么问题?______
【答案】(1) 温度 100g 饱和 质量
(2) 100g 饱和 36g 100g 最多
(3) 20 大于 一定温度、溶剂质量100g、饱和溶液、溶解质量 温度相同
三、推断题。
24、某兴趣小组提纯含少量泥沙的粗盐,一般经过如图甲所示操作流程:
(1)操作①中玻璃棒的作用_________。
(2)溶液蒸发时溶质的质量分数随时间的变化如图乙所示下表是食盐的溶解度表:
温度(C) 10 20 30 40 50 60 70 80 90 100
食盐(克) 35.5 36.0 36.3 36.6 37.0 37.3 37.8 38.3 38.9 39.8
图乙
假设C时刻溶液的温度为90°C,请你查找资料计算出此时溶质的质量分数___________。
(3)实验结束后称量获得的精盐,计算发现精盐的质量明显偏小,其原因可能有_______(填数字序号)。
①溶解时,溶解不够充分②过滤时,滤渣没有清洗③蒸发时,液滴飞残
④蒸发后所得的食盐很潮湿⑤转移后,蒸发皿上还沾有食盐
【答案】转移固体 28% ①②③⑤
四、综合应用题。
25、某化学兴趣小组在老师的带领下,来到实验室完成以下2个实验。
(一)常见气体的制取:
(1)用装置A制取O2,检查装置气密性的方法是_________,试管中反应的化学方程式为_____。
(2)用装置C收集H2,气体应从导管口_______(选填“a”或“b”)通入。
(3)通常情况下,乙烯(化学式为C2H4)是一种无色、难溶于水、密度与空气接近的气体。实验室常用40%的乙烯利溶液和氢氧化钠固体在常温下反应制取乙烯,则其发生装置与收集装置的组合为______(填字母序号)。
(二)对含有MgCl2的粗盐进行提纯,步骤如图:
(4)步骤②中,玻璃棒的作用是_______。
(5)步骤④中,滤纸上的滤渣除含有泥沙等杂质外还有_______(填化学式)。
(6)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是 (填字母)。
A.稀硫酸 B.稀盐酸 C.硫酸铜 D.稀硝酸
(7)步骤⑥中当出现_______时,停止加热。
【答案】(1)将导管置于水中,用手紧握试管,观察导管口是否有气泡冒出,有气泡冒出,说明装置气密性良好;
(2)b (3)BD (4)搅拌,加速溶解
(5) (6)B (7)大部分固体析出
五、计算题。
26、汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3。若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克。求:
(1)630克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克?
【答案】(1)525毫升; (2)180克
沪教版(全国)第6章 溶解现象 课后选练
一、选择题。
1、(双选)下列有关洗涤的说法中错误的是( )
A.用汽油溶解衣物上的油渍 B.用洗洁精溶解餐具上的油污
C.用水清洗蒸发皿中少量食盐 D.内壁有碘的试管用水清洗
2、下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )
A. 100 g 水中溶解了 10 g 硝酸钾
B. 100 g 硝酸钾溶液中有 10 g 硝酸钾
C.将 10 g 硝酸钾溶于 90 g 水中所得的溶液
D.将硝酸钾与水按 1 ∶9 的质量比配制的溶液
3、下列说法正确的是( )
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
4、20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
5、如图是利用海水提取粗盐的过程,有关该过程的说法不正确的是( )
A.海水进入贮水池,海水的成分不变
B.蒸发池中发生的是化学变化
C.可以通过过滤从结晶池中得到粗盐和母液
D.粗盐中含有可溶性杂质和不溶性杂质
6、(双选)下列实验方案错误的是( )
A.除去食盐溶液中的蔗糖:将混合液进行过滤
B.氧气的验满:把带火星的木条伸入到集气瓶内
C.铁丝在氧气中燃烧:将红热的铁丝伸入盛有氧气的集气瓶中(瓶中事先留一点水)
D.鉴别氢氧化钠固体和硝酸铵固体:取样溶于水,测量溶解前后液体温度的变化
7、在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
8、甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液
9、实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是( )
A.氯化钠固体中含有杂质 B.用量筒量取水时仰视读数
C.加水溶解固体时有水洒出 D.配制好的溶液装瓶中时有少量洒出
10、粗盐中含有较多可溶性杂质(氯化镁、氯化钙等)和不溶性杂质,按如图流程进行“粗盐提纯”实验,说法不正确的是( )
A.得到的精盐是混合物
B.粗盐变为精盐是物理变化
C.加热蒸发时,待水分全部蒸干才熄灭酒精灯
D.玻璃棒用了3次,作用各不相同
11、(双选)对下列实验现象的描述不正确的题( )
A.镁在空气中燃烧发出耀眼的白光生成白色固体
B.硝酸铵在水中溶解时,溶液温度降低
C.红磷在空气中燃烧产生出大量的白色烟雾
D.细铁丝在氧气中燃烧火星四射生成黑色四氧化三铁
12、稀释质量分数为 98% (密度为 1.84 g/mL) 的浓硫酸,配制 500 mL 质量分数为 20%的稀硫酸 (密度为 1. 14 g/mL),稀释时需用的水的体积约为( )
A.436.8 mL B.453.7 mL C.456.0 mL D.458.3 mL
13、有关溶液的说法正确的是( )
A.溶液都是无色的 B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量 D.溶液都是均一、稳定的混合物
14、(双选)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.氯化钠 C.汽油 D.蔗糖
15、将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为( )
A.9.8% B.10.0% C.10.9% D.11.1%
二、填空题。
16、如图所示,把内装适量水的烧杯放在湿木块上,然后往烧杯里加入硝酸铵使之溶解,不久拿起烧杯时发现木块粘在烧杯的底部,说明硝酸铵溶解时要_______热量,使温度_______ 而木块上的水结冰的缘故。
17、实验小组同学配制50 g质量分数为15%的氯化钠溶液。
(1)需要氯化钠和水的质量分别为______。
(2)实验操作顺序为E、C、______。
18、固体物质溶解度的变化规律:
(1)大多数固体物质的溶解度随温度升高而______;如KNO3。
(2)少数固体物质的溶解度受温度的影响很小;如______;。
(3)极少数固体物质的溶解度随温度升高而降低。如______;。
19、使10%的蔗糖溶液:
(1)溶质的质量分数增至20%,需加多少蔗糖______?
(2)若使溶质的质量分数降到5%,则需加多少水______?
20、去除粗盐中的泥沙。
(1)实验的主要步骤依次是溶解、过滤、 。
(2)制作过滤器的过程如图所示,其正确操作顺序为 (填序号)。
21、走进生活,走进化学。
(1)周末小雅妈妈用“加铁酱油”做了“红烧肉”,其中“加铁酱油”中的“铁”是指______(填“元素”或“原子”),炒菜完毕,关闭煤气罐阀门,燃着的煤气熄灭,其灭火的原理是______________; 饭后她用洗洁精清洗了餐具,这是利用了洗洁精的__________作用;
(2)家用净水器常用活性炭除去水中的一些杂质,利用了活性炭的___________性;
(3)用硬水洗衣服,既浪费肥皂也洗不干净衣服,生活中常用__________的方法降低水的硬度。
22、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态?____(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是____(写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水____g;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
23、回答下列问题
(1)固体的溶解度指在一定______下,某固态物质在______溶剂里达到______状态所溶解的______。
(2)20℃时,氯化钠在水中的溶解度为36 g,意思是20℃时,______水中达到______状态时溶解氯化钠的质量为______;或者20℃时,______水中______可溶解氯化钠的质量为36 g。
(3)物质的溶解性是根据______℃时的溶解度规定的,当该温度下物质的溶解度______10 g时,为易溶物质。
a.固体的溶解度从几个要素进行规定?______
b.要比较两种物质的溶解度,需要注意什么问题?______
三、推断题。
24、某兴趣小组提纯含少量泥沙的粗盐,一般经过如图甲所示操作流程:
(1)操作①中玻璃棒的作用_________。
(2)溶液蒸发时溶质的质量分数随时间的变化如图乙所示下表是食盐的溶解度表:
温度(C) 10 20 30 40 50 60 70 80 90 100
食盐(克) 35.5 36.0 36.3 36.6 37.0 37.3 37.8 38.3 38.9 39.8
图乙
假设C时刻溶液的温度为90°C,请你查找资料计算出此时溶质的质量分数___________。
(3)实验结束后称量获得的精盐,计算发现精盐的质量明显偏小,其原因可能有_______(填数字序号)。
①溶解时,溶解不够充分②过滤时,滤渣没有清洗③蒸发时,液滴飞残
④蒸发后所得的食盐很潮湿⑤转移后,蒸发皿上还沾有食盐
四、综合应用题。
25、某化学兴趣小组在老师的带领下,来到实验室完成以下2个实验。
(一)常见气体的制取:
(1)用装置A制取O2,检查装置气密性的方法是_________,试管中反应的化学方程式为_____。
(2)用装置C收集H2,气体应从导管口_______(选填“a”或“b”)通入。
(3)通常情况下,乙烯(化学式为C2H4)是一种无色、难溶于水、密度与空气接近的气体。实验室常用40%的乙烯利溶液和氢氧化钠固体在常温下反应制取乙烯,则其发生装置与收集装置的组合为______(填字母序号)。
(二)对含有MgCl2的粗盐进行提纯,步骤如图:
(4)步骤②中,玻璃棒的作用是_______。
(5)步骤④中,滤纸上的滤渣除含有泥沙等杂质外还有_______(填化学式)。
(6)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是 (填字母)。
A.稀硫酸 B.稀盐酸 C.硫酸铜 D.稀硝酸
(7)步骤⑥中当出现_______时,停止加热。
五、计算题。
26、汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3。若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克。求:
(1)630克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克?
2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 课后选练含答案
沪教版(全国)第6章 溶解现象 课后选练
一、选择题。
1、(双选)下列有关洗涤的说法中错误的是( )
A.用汽油溶解衣物上的油渍 B.用洗洁精溶解餐具上的油污
C.用水清洗蒸发皿中少量食盐 D.内壁有碘的试管用水清洗
【答案】BD
2、下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )
A. 100 g 水中溶解了 10 g 硝酸钾
B. 100 g 硝酸钾溶液中有 10 g 硝酸钾
C.将 10 g 硝酸钾溶于 90 g 水中所得的溶液
D.将硝酸钾与水按 1 ∶9 的质量比配制的溶液
【答案】A
3、下列说法正确的是( )
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
【答案】C
4、20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
【答案】C
5、如图是利用海水提取粗盐的过程,有关该过程的说法不正确的是( )
A.海水进入贮水池,海水的成分不变
B.蒸发池中发生的是化学变化
C.可以通过过滤从结晶池中得到粗盐和母液
D.粗盐中含有可溶性杂质和不溶性杂质
【答案】B
6、(双选)下列实验方案错误的是( )
A.除去食盐溶液中的蔗糖:将混合液进行过滤
B.氧气的验满:把带火星的木条伸入到集气瓶内
C.铁丝在氧气中燃烧:将红热的铁丝伸入盛有氧气的集气瓶中(瓶中事先留一点水)
D.鉴别氢氧化钠固体和硝酸铵固体:取样溶于水,测量溶解前后液体温度的变化
【答案】AB
7、在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
【答案】A
8、甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液
【答案】A
9、实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是( )
A.氯化钠固体中含有杂质 B.用量筒量取水时仰视读数
C.加水溶解固体时有水洒出 D.配制好的溶液装瓶中时有少量洒出
【答案】C
10、粗盐中含有较多可溶性杂质(氯化镁、氯化钙等)和不溶性杂质,按如图流程进行“粗盐提纯”实验,说法不正确的是( )
A.得到的精盐是混合物
B.粗盐变为精盐是物理变化
C.加热蒸发时,待水分全部蒸干才熄灭酒精灯
D.玻璃棒用了3次,作用各不相同
【答案】C
11、(双选)对下列实验现象的描述不正确的题( )
A.镁在空气中燃烧发出耀眼的白光生成白色固体
B.硝酸铵在水中溶解时,溶液温度降低
C.红磷在空气中燃烧产生出大量的白色烟雾
D.细铁丝在氧气中燃烧火星四射生成黑色四氧化三铁
【答案】CD
12、稀释质量分数为 98% (密度为 1.84 g/mL) 的浓硫酸,配制 500 mL 质量分数为 20%的稀硫酸 (密度为 1. 14 g/mL),稀释时需用的水的体积约为( )
A.436.8 mL B.453.7 mL C.456.0 mL D.458.3 mL
【答案】B
13、有关溶液的说法正确的是( )
A.溶液都是无色的 B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量 D.溶液都是均一、稳定的混合物
【答案】D
14、(双选)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.氯化钠 C.汽油 D.蔗糖
【答案】BD
15、将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为( )
A.9.8% B.10.0% C.10.9% D.11.1%
【答案】A
二、填空题。
16、如图所示,把内装适量水的烧杯放在湿木块上,然后往烧杯里加入硝酸铵使之溶解,不久拿起烧杯时发现木块粘在烧杯的底部,说明硝酸铵溶解时要_______热量,使温度_______ 而木块上的水结冰的缘故。
【答案】吸收 降到0℃以下
17、实验小组同学配制50 g质量分数为15%的氯化钠溶液。
(1)需要氯化钠和水的质量分别为______。
(2)实验操作顺序为E、C、______。
【答案】(1)7.5g和42.5g (2) D、A、B
18、固体物质溶解度的变化规律:
(1)大多数固体物质的溶解度随温度升高而______;如KNO3。
(2)少数固体物质的溶解度受温度的影响很小;如______;。
(3)极少数固体物质的溶解度随温度升高而降低。如______;。
【答案】(1)升高 (2)NaCl (3)Ca(OH)2
19、使10%的蔗糖溶液:
(1)溶质的质量分数增至20%,需加多少蔗糖______?
(2)若使溶质的质量分数降到5%,则需加多少水______?
【答案】
20、去除粗盐中的泥沙。
(1)实验的主要步骤依次是溶解、过滤、 。
(2)制作过滤器的过程如图所示,其正确操作顺序为 (填序号)。
【答案】蒸发;③①②
21、走进生活,走进化学。
(1)周末小雅妈妈用“加铁酱油”做了“红烧肉”,其中“加铁酱油”中的“铁”是指______(填“元素”或“原子”),炒菜完毕,关闭煤气罐阀门,燃着的煤气熄灭,其灭火的原理是______________; 饭后她用洗洁精清洗了餐具,这是利用了洗洁精的__________作用;
(2)家用净水器常用活性炭除去水中的一些杂质,利用了活性炭的___________性;
(3)用硬水洗衣服,既浪费肥皂也洗不干净衣服,生活中常用__________的方法降低水的硬度。
【答案】元素 清除可燃物(或隔离可燃物) 乳化 吸附 煮沸
22、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态?____(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是____(写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水____g;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
【答案】(1) 是 (2)氯化钾 (3)50 (4)A
23、回答下列问题
(1)固体的溶解度指在一定______下,某固态物质在______溶剂里达到______状态所溶解的______。
(2)20℃时,氯化钠在水中的溶解度为36 g,意思是20℃时,______水中达到______状态时溶解氯化钠的质量为______;或者20℃时,______水中______可溶解氯化钠的质量为36 g。
(3)物质的溶解性是根据______℃时的溶解度规定的,当该温度下物质的溶解度______10 g时,为易溶物质。
a.固体的溶解度从几个要素进行规定?______
b.要比较两种物质的溶解度,需要注意什么问题?______
【答案】(1) 温度 100g 饱和 质量
(2) 100g 饱和 36g 100g 最多
(3) 20 大于 一定温度、溶剂质量100g、饱和溶液、溶解质量 温度相同
三、推断题。
24、某兴趣小组提纯含少量泥沙的粗盐,一般经过如图甲所示操作流程:
(1)操作①中玻璃棒的作用_________。
(2)溶液蒸发时溶质的质量分数随时间的变化如图乙所示下表是食盐的溶解度表:
温度(C) 10 20 30 40 50 60 70 80 90 100
食盐(克) 35.5 36.0 36.3 36.6 37.0 37.3 37.8 38.3 38.9 39.8
图乙
假设C时刻溶液的温度为90°C,请你查找资料计算出此时溶质的质量分数___________。
(3)实验结束后称量获得的精盐,计算发现精盐的质量明显偏小,其原因可能有_______(填数字序号)。
①溶解时,溶解不够充分②过滤时,滤渣没有清洗③蒸发时,液滴飞残
④蒸发后所得的食盐很潮湿⑤转移后,蒸发皿上还沾有食盐
【答案】转移固体 28% ①②③⑤
四、综合应用题。
25、某化学兴趣小组在老师的带领下,来到实验室完成以下2个实验。
(一)常见气体的制取:
(1)用装置A制取O2,检查装置气密性的方法是_________,试管中反应的化学方程式为_____。
(2)用装置C收集H2,气体应从导管口_______(选填“a”或“b”)通入。
(3)通常情况下,乙烯(化学式为C2H4)是一种无色、难溶于水、密度与空气接近的气体。实验室常用40%的乙烯利溶液和氢氧化钠固体在常温下反应制取乙烯,则其发生装置与收集装置的组合为______(填字母序号)。
(二)对含有MgCl2的粗盐进行提纯,步骤如图:
(4)步骤②中,玻璃棒的作用是_______。
(5)步骤④中,滤纸上的滤渣除含有泥沙等杂质外还有_______(填化学式)。
(6)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是 (填字母)。
A.稀硫酸 B.稀盐酸 C.硫酸铜 D.稀硝酸
(7)步骤⑥中当出现_______时,停止加热。
【答案】(1)将导管置于水中,用手紧握试管,观察导管口是否有气泡冒出,有气泡冒出,说明装置气密性良好;
(2)b (3)BD (4)搅拌,加速溶解
(5) (6)B (7)大部分固体析出
五、计算题。
26、汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3。若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克。求:
(1)630克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克?
【答案】(1)525毫升; (2)180克
