2022—2023学年化学沪教版(全国)九年级下册第七章 应用广泛的酸、碱、盐 课后选练题(有答案)
文档属性
| 名称 | 2022—2023学年化学沪教版(全国)九年级下册第七章 应用广泛的酸、碱、盐 课后选练题(有答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 233.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-28 00:00:00 | ||
图片预览



文档简介
2022—2023学年化学沪教版(全国)九年级下册第七章 应用广泛的酸、碱、盐 课后选练题
沪教版(全国)第七章 应用广泛的酸、碱、盐
一、选择题。
1、“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是( )
A.先变蓝后变紫 B.变红后颜色不再改变
C.先变无色后变红 D.先变红后变紫
2、下列物质中,易溶于水其水溶液显碱性的物质是( )
A.氢氧化钾 B.石灰石 C.氢氧化铁 D.消石灰
3、下列说法中正确的是( )
A.凡是盐都可以食用 B.凡是碱都可溶于水
C.凡是酸溶液都含有氢离子 D.凡是生成盐和水的反应都是中和反应
4、下列关于物质的性质与其用途的对应关系正确的是( )
A.氯化钠有咸味,可作调味品
B.一氧化碳可燃,可用于冶炼金属
C.活性炭具有吸附性,可降低水的硬度
D.洗涤剂有乳化作用,可用于除去水垢
5、实验操作是否规范直接影响实验能否成功,下列操作正确的是( )
A.测定溶液pH时,用玻璃棒蘸取待测液滴在放于白色瓷板或玻璃片上的试纸上,把试纸显示的颜色与标准比色卡对照
B.为防止液体溅到试管外,应将胶头滴管伸入试管内滴加液体
C.点燃可燃性气体之前,一定要检验可燃性气体的纯度
D.稀释浓硫酸时,应将水慢慢的沿烧杯内壁倒入浓硫酸中,并不断搅拌
6、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
7、下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
8、下列盐中不能由金属与酸发生置换反应直接得到的是( )
A.ZnCl2 B.FeSO4 C.MgCl2 D.CuSO4
9、下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
10、根据下列实验现象,可以判断其溶液一定呈酸性的是( )
A.滴加酚酞试液显红色的溶液 B.滴加石蕊试液显蓝色的溶液
C.能够与碱发生反应的溶液 D.常温下,pH<7的溶液
11、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
12、如图所示,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
①试管内液面上升 ②试管内溶液变红
③试管内液面不上升 ④试管内溶液变蓝 ⑤试管内溶液不变色
A.①② B.①④ C.②③ D.③⑤
13、由于我国北方某些城市在严冬时节曾用食盐融雪,造成土壤中含盐浓度偏高,使路旁的树木死亡。目前专家已研究出一种新型的融雪剂,既能融化冰雪,又能起施肥养护树木的作用,具有上述作用的新型融雪剂的是( )
A.氯化钠 氯化钙 B.氯化钠 氯化镁
C.氯化钠 醋酸钙 醋酸镁 D.尿素 硝酸钙 硝酸镁
*14、欲将含有盐酸的氯化钙溶液调至中性,得到氯化钙溶液,在没有指示剂的情况下,应加入的试剂是( )
A.Na2CO3 B.CaO C.Ca(OH)2 D.CaCO3
15、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
二、填空题。
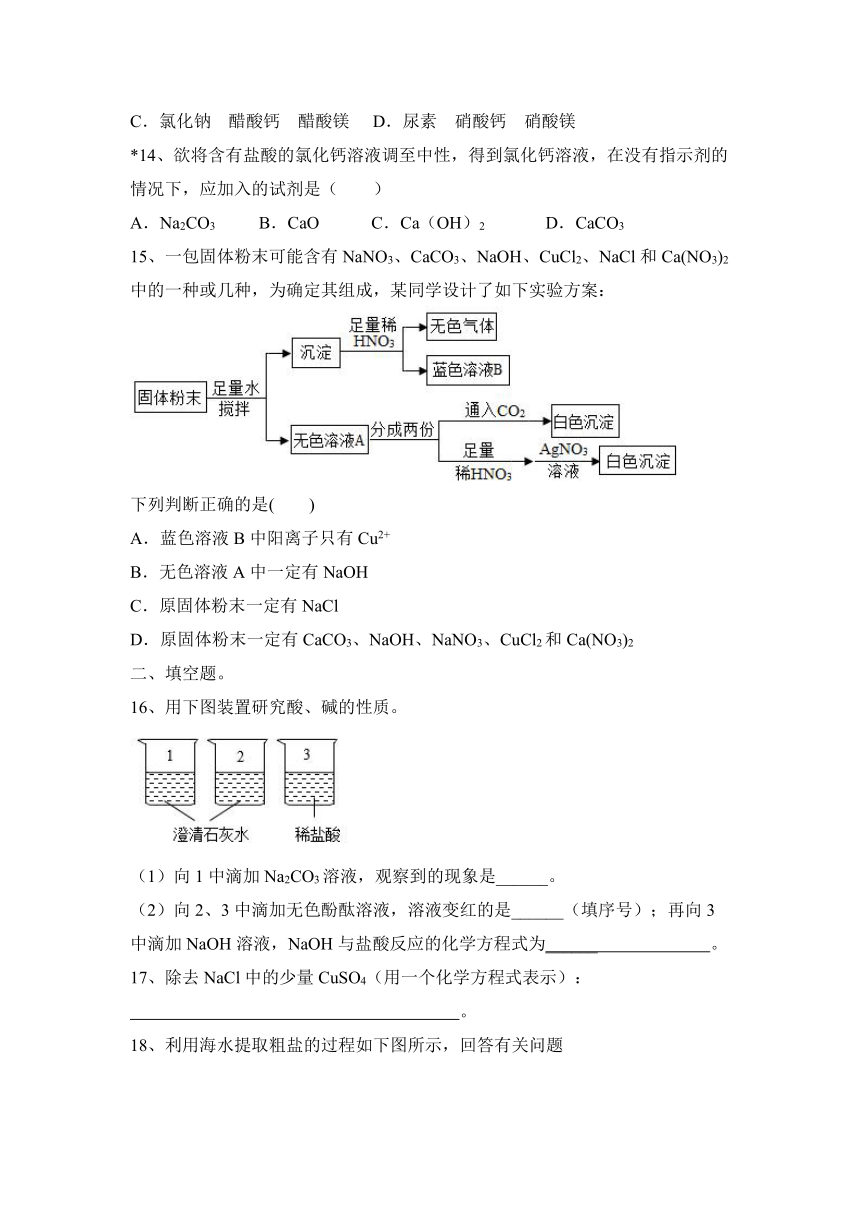
16、用下图装置研究酸、碱的性质。
(1)向1中滴加Na2CO3溶液,观察到的现象是______。
(2)向2、3中滴加无色酚酞溶液,溶液变红的是______(填序号);再向3中滴加NaOH溶液,NaOH与盐酸反应的化学方程式为______ 。
17、除去NaCl中的少量CuSO4(用一个化学方程式表示):
。
18、利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
19、某年苏州市初中化学实验操作考查内容为“溶液酸碱性的检验”,请根据实验回答下列问题。
(1)测得碳酸饮料的pH 7(填“<”或“=”或“>”)。
(2)下列使用pH试纸的方法中,正确的是 (填序号)。
A.将pH试纸剪成几段使用
B.将pH试纸直接插入待测液中
C.将pH试纸放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸湿润后放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
E.读数时,在30秒内将pH试纸呈现的颜色与标准比色卡对照
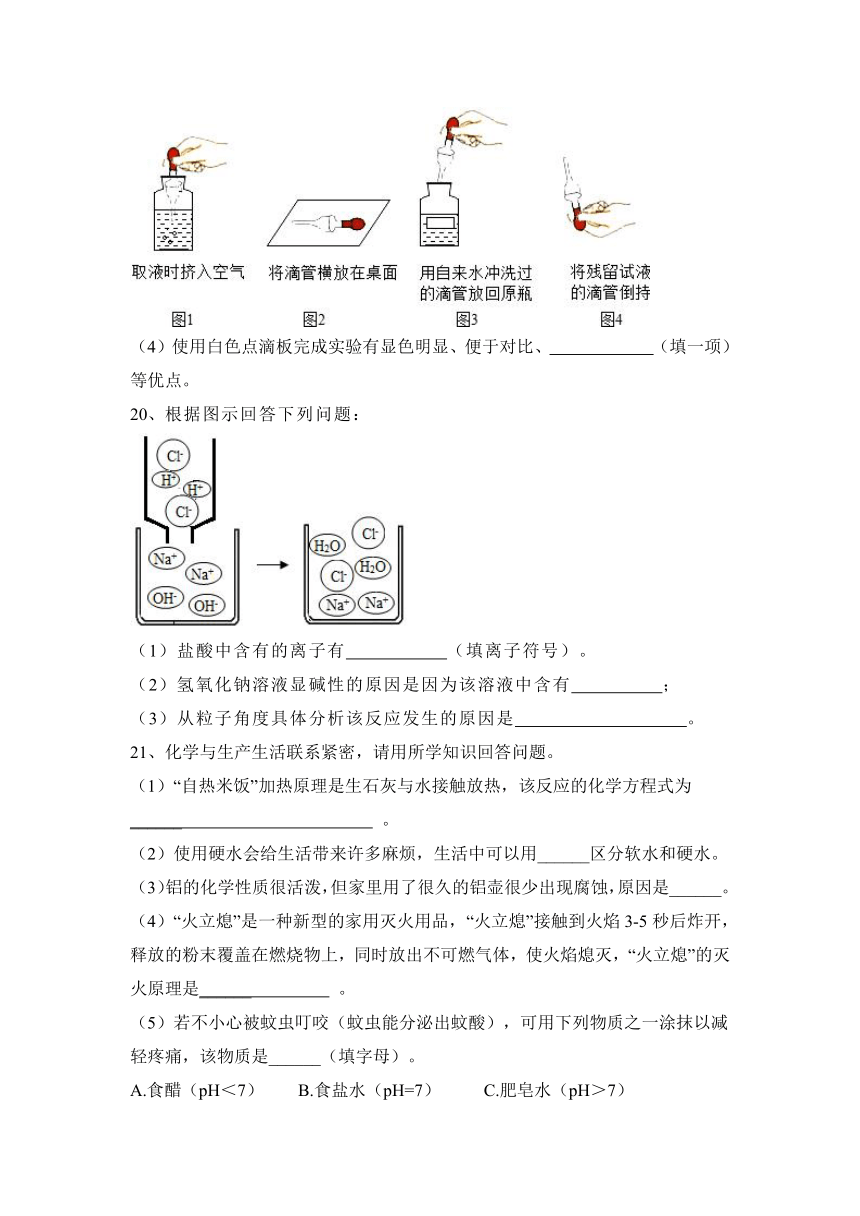
(3)本次实验中滴管使用出现了如图1~图4所示的四种常见错误操作。请你从这四幅图中任意选择一幅(请写明所选图的序号),具体说明改正错误的方法 。
(4)使用白色点滴板完成实验有显色明显、便于对比、 (填一项)等优点。
20、根据图示回答下列问题:
(1)盐酸中含有的离子有 (填离子符号)。
(2)氢氧化钠溶液显碱性的原因是因为该溶液中含有 ;
(3)从粒子角度具体分析该反应发生的原因是 。
21、化学与生产生活联系紧密,请用所学知识回答问题。
(1)“自热米饭”加热原理是生石灰与水接触放热,该反应的化学方程式为______ 。
(2)使用硬水会给生活带来许多麻烦,生活中可以用______区分软水和硬水。
(3)铝的化学性质很活泼,但家里用了很久的铝壶很少出现腐蚀,原因是______。
(4)“火立熄”是一种新型的家用灭火用品,“火立熄”接触到火焰3-5秒后炸开,释放的粉末覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭,“火立熄”的灭火原理是______ 。
(5)若不小心被蚊虫叮咬(蚊虫能分泌出蚊酸),可用下列物质之一涂抹以减轻疼痛,该物质是______(填字母)。
A.食醋(pH<7) B.食盐水(pH=7) C.肥皂水(pH>7)
22、用化学式填空:
①小苏打 ②熟石灰 ③氨气 ④硫酸铜
⑤硫酸 ⑥氢氧化钠 ⑦食盐 ⑧硝酸钾
(1)清除金属表面铁锈
(2)使饼干松脆可口
(3)改良酸性土壤
(4)配制波尔多液的盐
(5)一种复合肥料
(6)腌制食品
(7)用于造纸的碱
(8)可作氮肥的气体 。
23、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3)________,硫酸钾(K2SO4)________,
碳酸钾(K2CO3)________。 (2)碳酸钙(CaCO3)________,
碳酸钡(BaCO3)________,碳酸铜(CuCO3)________。
(3)氯化铵(NH4Cl)________,硝酸铵(NH4NO3)________,
碳酸铵〔(NH4)2CO3〕________。
三、实验题。
24、进行如下实验,研究物质的性质。
(1)D中溶液变为红色,说明硫酸锌溶液显_____ (填“酸性”或“碱性”)。
(2)溶液变为蓝色的有_____ (填字母序号,下同)。
(3)作为空白对照实验的是_____ 。
(4)再向B烧杯中加入适量石灰水,溶液变为紫色,用化学方程式解释其原因 _____ 。
四、综合应用题。
25、酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________ (写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
五、计算题。
26、石灰石是生产玻璃、氯化钙等多种化工产品的原料.某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实 验 1 2 3 4
加入样品质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
(1)第 次反应中矿石有剩余;
(2)表中m值是 ;
(3)试计算这种石灰石中碳酸钙的质量分数。
2022—2023学年化学沪教版(全国)九年级下册第七章 应用广泛的酸、碱、盐 课后选练题
沪教版(全国)第七章 应用广泛的酸、碱、盐
一、选择题。
1、“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是( )
A.先变蓝后变紫 B.变红后颜色不再改变
C.先变无色后变红 D.先变红后变紫
【答案】D
2、下列物质中,易溶于水其水溶液显碱性的物质是( )
A.氢氧化钾 B.石灰石 C.氢氧化铁 D.消石灰
【答案】A
3、下列说法中正确的是( )
A.凡是盐都可以食用 B.凡是碱都可溶于水
C.凡是酸溶液都含有氢离子 D.凡是生成盐和水的反应都是中和反应
【答案】C
4、下列关于物质的性质与其用途的对应关系正确的是( )
A.氯化钠有咸味,可作调味品
B.一氧化碳可燃,可用于冶炼金属
C.活性炭具有吸附性,可降低水的硬度
D.洗涤剂有乳化作用,可用于除去水垢
【答案】A
5、实验操作是否规范直接影响实验能否成功,下列操作正确的是( )
A.测定溶液pH时,用玻璃棒蘸取待测液滴在放于白色瓷板或玻璃片上的试纸上,把试纸显示的颜色与标准比色卡对照
B.为防止液体溅到试管外,应将胶头滴管伸入试管内滴加液体
C.点燃可燃性气体之前,一定要检验可燃性气体的纯度
D.稀释浓硫酸时,应将水慢慢的沿烧杯内壁倒入浓硫酸中,并不断搅拌
【答案】AC
6、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
【答案】C
7、下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
【答案】C
8、下列盐中不能由金属与酸发生置换反应直接得到的是( )
A.ZnCl2 B.FeSO4 C.MgCl2 D.CuSO4
【答案】D
9、下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
【答案】C
10、根据下列实验现象,可以判断其溶液一定呈酸性的是( )
A.滴加酚酞试液显红色的溶液 B.滴加石蕊试液显蓝色的溶液
C.能够与碱发生反应的溶液 D.常温下,pH<7的溶液
【答案】D
11、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
【答案】C
12、如图所示,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
①试管内液面上升 ②试管内溶液变红
③试管内液面不上升 ④试管内溶液变蓝 ⑤试管内溶液不变色
A.①② B.①④ C.②③ D.③⑤
【答案】A
13、由于我国北方某些城市在严冬时节曾用食盐融雪,造成土壤中含盐浓度偏高,使路旁的树木死亡。目前专家已研究出一种新型的融雪剂,既能融化冰雪,又能起施肥养护树木的作用,具有上述作用的新型融雪剂的是( )
A.氯化钠 氯化钙 B.氯化钠 氯化镁
C.氯化钠 醋酸钙 醋酸镁 D.尿素 硝酸钙 硝酸镁
【答案】D
*14、欲将含有盐酸的氯化钙溶液调至中性,得到氯化钙溶液,在没有指示剂的情况下,应加入的试剂是( )
A.Na2CO3 B.CaO C.Ca(OH)2 D.CaCO3
【答案】D
15、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
【答案】B
二、填空题。
16、用下图装置研究酸、碱的性质。
(1)向1中滴加Na2CO3溶液,观察到的现象是______。
(2)向2、3中滴加无色酚酞溶液,溶液变红的是______(填序号);再向3中滴加NaOH溶液,NaOH与盐酸反应的化学方程式为______ 。
【答案】(1) 澄清石灰水变浑浊 (2) 2 NaOH+HCl=NaCl+H2O
17、除去NaCl中的少量CuSO4(用一个化学方程式表示):
。
【答案】CuSO4 + Ba(OH)2 = BaSO4↓+ Cu(OH)2↓
18、利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
【答案】不变 引流 BACD 11.9
19、某年苏州市初中化学实验操作考查内容为“溶液酸碱性的检验”,请根据实验回答下列问题。
(1)测得碳酸饮料的pH 7(填“<”或“=”或“>”)。
(2)下列使用pH试纸的方法中,正确的是 (填序号)。
A.将pH试纸剪成几段使用
B.将pH试纸直接插入待测液中
C.将pH试纸放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸湿润后放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
E.读数时,在30秒内将pH试纸呈现的颜色与标准比色卡对照
(3)本次实验中滴管使用出现了如图1~图4所示的四种常见错误操作。请你从这四幅图中任意选择一幅(请写明所选图的序号),具体说明改正错误的方法 。
(4)使用白色点滴板完成实验有显色明显、便于对比、 (填一项)等优点。
【答案】(1)< (2)ACE
(3)图3滴瓶上的滴管不用清洗直接放回原瓶(合理即可)
(4)节约药品
20、根据图示回答下列问题:
(1)盐酸中含有的离子有 (填离子符号)。
(2)氢氧化钠溶液显碱性的原因是因为该溶液中含有 ;
(3)从粒子角度具体分析该反应发生的原因是 。
【答案】H+、Cl-; OH-; H++OH-=H2O
21、化学与生产生活联系紧密,请用所学知识回答问题。
(1)“自热米饭”加热原理是生石灰与水接触放热,该反应的化学方程式为______ 。
(2)使用硬水会给生活带来许多麻烦,生活中可以用______区分软水和硬水。
(3)铝的化学性质很活泼,但家里用了很久的铝壶很少出现腐蚀,原因是______。
(4)“火立熄”是一种新型的家用灭火用品,“火立熄”接触到火焰3-5秒后炸开,释放的粉末覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭,“火立熄”的灭火原理是______ 。
(5)若不小心被蚊虫叮咬(蚊虫能分泌出蚊酸),可用下列物质之一涂抹以减轻疼痛,该物质是______(填字母)。
A.食醋(pH<7) B.食盐水(pH=7) C.肥皂水(pH>7)
【答案】(1) CaO+H2O=Ca(OH)2 (2) 肥皂水
(3) 铝的表面形成一层致密的氧化物薄膜 (4) 使可燃物与氧气隔绝 (5)C
22、用化学式填空:
①小苏打 ②熟石灰 ③氨气 ④硫酸铜
⑤硫酸 ⑥氢氧化钠 ⑦食盐 ⑧硝酸钾
(1)清除金属表面铁锈
(2)使饼干松脆可口
(3)改良酸性土壤
(4)配制波尔多液的盐
(5)一种复合肥料
(6)腌制食品
(7)用于造纸的碱
(8)可作氮肥的气体 。
【答案】(1)H2SO4; (2)Na2CO3; (3)Ca(OH)2; (4)CuSO4;
(5)KNO3; (6)NaCl; (7)NaOH; (8)NH3。
23、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3)________,硫酸钾(K2SO4)________,
碳酸钾(K2CO3)________。 (2)碳酸钙(CaCO3)________,
碳酸钡(BaCO3)________,碳酸铜(CuCO3)________。
(3)氯化铵(NH4Cl)________,硝酸铵(NH4NO3)________,
碳酸铵〔(NH4)2CO3〕________。
【答案】溶 溶 溶 不溶 不溶 不溶 溶 溶 溶
三、实验题。
24、进行如下实验,研究物质的性质。
(1)D中溶液变为红色,说明硫酸锌溶液显_____ (填“酸性”或“碱性”)。
(2)溶液变为蓝色的有_____ (填字母序号,下同)。
(3)作为空白对照实验的是_____ 。
(4)再向B烧杯中加入适量石灰水,溶液变为紫色,用化学方程式解释其原因 _____ 。
【答案】 (1) 酸性 (2)CE (3)A
(4)Ca(OH)2+2HCl=CaCl2+H2O
四、综合应用题。
25、酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________ (写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
【答案】(1)H+ 稀盐酸(或者稀硫酸、BaCl2溶液,CaCl2溶液等)
(3)HCl、NaCl 红
(4)①玻璃棒 ②Ba(OH)2 +MgSO4=BaSO4↓+Mg(OH)2↓
【或者Ba(OH)2 +Na2CO3=BaCO3↓+2NaOH
或者CaCl2 +Na2CO3= CaCO3↓+2NaCl】
③Na2CO3和NaOH在溶液乙中加入适量稀盐酸 (5)9.8g
五、计算题。
26、石灰石是生产玻璃、氯化钙等多种化工产品的原料.某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实 验 1 2 3 4
加入样品质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
(1)第 次反应中矿石有剩余;
(2)表中m值是 ;
(3)试计算这种石灰石中碳酸钙的质量分数。
【答案】(1)3、4两次; (2)4.4; (3)80%;
沪教版(全国)第七章 应用广泛的酸、碱、盐
一、选择题。
1、“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是( )
A.先变蓝后变紫 B.变红后颜色不再改变
C.先变无色后变红 D.先变红后变紫
2、下列物质中,易溶于水其水溶液显碱性的物质是( )
A.氢氧化钾 B.石灰石 C.氢氧化铁 D.消石灰
3、下列说法中正确的是( )
A.凡是盐都可以食用 B.凡是碱都可溶于水
C.凡是酸溶液都含有氢离子 D.凡是生成盐和水的反应都是中和反应
4、下列关于物质的性质与其用途的对应关系正确的是( )
A.氯化钠有咸味,可作调味品
B.一氧化碳可燃,可用于冶炼金属
C.活性炭具有吸附性,可降低水的硬度
D.洗涤剂有乳化作用,可用于除去水垢
5、实验操作是否规范直接影响实验能否成功,下列操作正确的是( )
A.测定溶液pH时,用玻璃棒蘸取待测液滴在放于白色瓷板或玻璃片上的试纸上,把试纸显示的颜色与标准比色卡对照
B.为防止液体溅到试管外,应将胶头滴管伸入试管内滴加液体
C.点燃可燃性气体之前,一定要检验可燃性气体的纯度
D.稀释浓硫酸时,应将水慢慢的沿烧杯内壁倒入浓硫酸中,并不断搅拌
6、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
7、下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
8、下列盐中不能由金属与酸发生置换反应直接得到的是( )
A.ZnCl2 B.FeSO4 C.MgCl2 D.CuSO4
9、下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
10、根据下列实验现象,可以判断其溶液一定呈酸性的是( )
A.滴加酚酞试液显红色的溶液 B.滴加石蕊试液显蓝色的溶液
C.能够与碱发生反应的溶液 D.常温下,pH<7的溶液
11、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
12、如图所示,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
①试管内液面上升 ②试管内溶液变红
③试管内液面不上升 ④试管内溶液变蓝 ⑤试管内溶液不变色
A.①② B.①④ C.②③ D.③⑤
13、由于我国北方某些城市在严冬时节曾用食盐融雪,造成土壤中含盐浓度偏高,使路旁的树木死亡。目前专家已研究出一种新型的融雪剂,既能融化冰雪,又能起施肥养护树木的作用,具有上述作用的新型融雪剂的是( )
A.氯化钠 氯化钙 B.氯化钠 氯化镁
C.氯化钠 醋酸钙 醋酸镁 D.尿素 硝酸钙 硝酸镁
*14、欲将含有盐酸的氯化钙溶液调至中性,得到氯化钙溶液,在没有指示剂的情况下,应加入的试剂是( )
A.Na2CO3 B.CaO C.Ca(OH)2 D.CaCO3
15、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
二、填空题。
16、用下图装置研究酸、碱的性质。
(1)向1中滴加Na2CO3溶液,观察到的现象是______。
(2)向2、3中滴加无色酚酞溶液,溶液变红的是______(填序号);再向3中滴加NaOH溶液,NaOH与盐酸反应的化学方程式为______ 。
17、除去NaCl中的少量CuSO4(用一个化学方程式表示):
。
18、利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
19、某年苏州市初中化学实验操作考查内容为“溶液酸碱性的检验”,请根据实验回答下列问题。
(1)测得碳酸饮料的pH 7(填“<”或“=”或“>”)。
(2)下列使用pH试纸的方法中,正确的是 (填序号)。
A.将pH试纸剪成几段使用
B.将pH试纸直接插入待测液中
C.将pH试纸放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸湿润后放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
E.读数时,在30秒内将pH试纸呈现的颜色与标准比色卡对照
(3)本次实验中滴管使用出现了如图1~图4所示的四种常见错误操作。请你从这四幅图中任意选择一幅(请写明所选图的序号),具体说明改正错误的方法 。
(4)使用白色点滴板完成实验有显色明显、便于对比、 (填一项)等优点。
20、根据图示回答下列问题:
(1)盐酸中含有的离子有 (填离子符号)。
(2)氢氧化钠溶液显碱性的原因是因为该溶液中含有 ;
(3)从粒子角度具体分析该反应发生的原因是 。
21、化学与生产生活联系紧密,请用所学知识回答问题。
(1)“自热米饭”加热原理是生石灰与水接触放热,该反应的化学方程式为______ 。
(2)使用硬水会给生活带来许多麻烦,生活中可以用______区分软水和硬水。
(3)铝的化学性质很活泼,但家里用了很久的铝壶很少出现腐蚀,原因是______。
(4)“火立熄”是一种新型的家用灭火用品,“火立熄”接触到火焰3-5秒后炸开,释放的粉末覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭,“火立熄”的灭火原理是______ 。
(5)若不小心被蚊虫叮咬(蚊虫能分泌出蚊酸),可用下列物质之一涂抹以减轻疼痛,该物质是______(填字母)。
A.食醋(pH<7) B.食盐水(pH=7) C.肥皂水(pH>7)
22、用化学式填空:
①小苏打 ②熟石灰 ③氨气 ④硫酸铜
⑤硫酸 ⑥氢氧化钠 ⑦食盐 ⑧硝酸钾
(1)清除金属表面铁锈
(2)使饼干松脆可口
(3)改良酸性土壤
(4)配制波尔多液的盐
(5)一种复合肥料
(6)腌制食品
(7)用于造纸的碱
(8)可作氮肥的气体 。
23、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3)________,硫酸钾(K2SO4)________,
碳酸钾(K2CO3)________。 (2)碳酸钙(CaCO3)________,
碳酸钡(BaCO3)________,碳酸铜(CuCO3)________。
(3)氯化铵(NH4Cl)________,硝酸铵(NH4NO3)________,
碳酸铵〔(NH4)2CO3〕________。
三、实验题。
24、进行如下实验,研究物质的性质。
(1)D中溶液变为红色,说明硫酸锌溶液显_____ (填“酸性”或“碱性”)。
(2)溶液变为蓝色的有_____ (填字母序号,下同)。
(3)作为空白对照实验的是_____ 。
(4)再向B烧杯中加入适量石灰水,溶液变为紫色,用化学方程式解释其原因 _____ 。
四、综合应用题。
25、酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________ (写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
五、计算题。
26、石灰石是生产玻璃、氯化钙等多种化工产品的原料.某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实 验 1 2 3 4
加入样品质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
(1)第 次反应中矿石有剩余;
(2)表中m值是 ;
(3)试计算这种石灰石中碳酸钙的质量分数。
2022—2023学年化学沪教版(全国)九年级下册第七章 应用广泛的酸、碱、盐 课后选练题
沪教版(全国)第七章 应用广泛的酸、碱、盐
一、选择题。
1、“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是( )
A.先变蓝后变紫 B.变红后颜色不再改变
C.先变无色后变红 D.先变红后变紫
【答案】D
2、下列物质中,易溶于水其水溶液显碱性的物质是( )
A.氢氧化钾 B.石灰石 C.氢氧化铁 D.消石灰
【答案】A
3、下列说法中正确的是( )
A.凡是盐都可以食用 B.凡是碱都可溶于水
C.凡是酸溶液都含有氢离子 D.凡是生成盐和水的反应都是中和反应
【答案】C
4、下列关于物质的性质与其用途的对应关系正确的是( )
A.氯化钠有咸味,可作调味品
B.一氧化碳可燃,可用于冶炼金属
C.活性炭具有吸附性,可降低水的硬度
D.洗涤剂有乳化作用,可用于除去水垢
【答案】A
5、实验操作是否规范直接影响实验能否成功,下列操作正确的是( )
A.测定溶液pH时,用玻璃棒蘸取待测液滴在放于白色瓷板或玻璃片上的试纸上,把试纸显示的颜色与标准比色卡对照
B.为防止液体溅到试管外,应将胶头滴管伸入试管内滴加液体
C.点燃可燃性气体之前,一定要检验可燃性气体的纯度
D.稀释浓硫酸时,应将水慢慢的沿烧杯内壁倒入浓硫酸中,并不断搅拌
【答案】AC
6、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
【答案】C
7、下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
【答案】C
8、下列盐中不能由金属与酸发生置换反应直接得到的是( )
A.ZnCl2 B.FeSO4 C.MgCl2 D.CuSO4
【答案】D
9、下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
【答案】C
10、根据下列实验现象,可以判断其溶液一定呈酸性的是( )
A.滴加酚酞试液显红色的溶液 B.滴加石蕊试液显蓝色的溶液
C.能够与碱发生反应的溶液 D.常温下,pH<7的溶液
【答案】D
11、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
【答案】C
12、如图所示,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
①试管内液面上升 ②试管内溶液变红
③试管内液面不上升 ④试管内溶液变蓝 ⑤试管内溶液不变色
A.①② B.①④ C.②③ D.③⑤
【答案】A
13、由于我国北方某些城市在严冬时节曾用食盐融雪,造成土壤中含盐浓度偏高,使路旁的树木死亡。目前专家已研究出一种新型的融雪剂,既能融化冰雪,又能起施肥养护树木的作用,具有上述作用的新型融雪剂的是( )
A.氯化钠 氯化钙 B.氯化钠 氯化镁
C.氯化钠 醋酸钙 醋酸镁 D.尿素 硝酸钙 硝酸镁
【答案】D
*14、欲将含有盐酸的氯化钙溶液调至中性,得到氯化钙溶液,在没有指示剂的情况下,应加入的试剂是( )
A.Na2CO3 B.CaO C.Ca(OH)2 D.CaCO3
【答案】D
15、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
【答案】B
二、填空题。
16、用下图装置研究酸、碱的性质。
(1)向1中滴加Na2CO3溶液,观察到的现象是______。
(2)向2、3中滴加无色酚酞溶液,溶液变红的是______(填序号);再向3中滴加NaOH溶液,NaOH与盐酸反应的化学方程式为______ 。
【答案】(1) 澄清石灰水变浑浊 (2) 2 NaOH+HCl=NaCl+H2O
17、除去NaCl中的少量CuSO4(用一个化学方程式表示):
。
【答案】CuSO4 + Ba(OH)2 = BaSO4↓+ Cu(OH)2↓
18、利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
【答案】不变 引流 BACD 11.9
19、某年苏州市初中化学实验操作考查内容为“溶液酸碱性的检验”,请根据实验回答下列问题。
(1)测得碳酸饮料的pH 7(填“<”或“=”或“>”)。
(2)下列使用pH试纸的方法中,正确的是 (填序号)。
A.将pH试纸剪成几段使用
B.将pH试纸直接插入待测液中
C.将pH试纸放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸湿润后放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
E.读数时,在30秒内将pH试纸呈现的颜色与标准比色卡对照
(3)本次实验中滴管使用出现了如图1~图4所示的四种常见错误操作。请你从这四幅图中任意选择一幅(请写明所选图的序号),具体说明改正错误的方法 。
(4)使用白色点滴板完成实验有显色明显、便于对比、 (填一项)等优点。
【答案】(1)< (2)ACE
(3)图3滴瓶上的滴管不用清洗直接放回原瓶(合理即可)
(4)节约药品
20、根据图示回答下列问题:
(1)盐酸中含有的离子有 (填离子符号)。
(2)氢氧化钠溶液显碱性的原因是因为该溶液中含有 ;
(3)从粒子角度具体分析该反应发生的原因是 。
【答案】H+、Cl-; OH-; H++OH-=H2O
21、化学与生产生活联系紧密,请用所学知识回答问题。
(1)“自热米饭”加热原理是生石灰与水接触放热,该反应的化学方程式为______ 。
(2)使用硬水会给生活带来许多麻烦,生活中可以用______区分软水和硬水。
(3)铝的化学性质很活泼,但家里用了很久的铝壶很少出现腐蚀,原因是______。
(4)“火立熄”是一种新型的家用灭火用品,“火立熄”接触到火焰3-5秒后炸开,释放的粉末覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭,“火立熄”的灭火原理是______ 。
(5)若不小心被蚊虫叮咬(蚊虫能分泌出蚊酸),可用下列物质之一涂抹以减轻疼痛,该物质是______(填字母)。
A.食醋(pH<7) B.食盐水(pH=7) C.肥皂水(pH>7)
【答案】(1) CaO+H2O=Ca(OH)2 (2) 肥皂水
(3) 铝的表面形成一层致密的氧化物薄膜 (4) 使可燃物与氧气隔绝 (5)C
22、用化学式填空:
①小苏打 ②熟石灰 ③氨气 ④硫酸铜
⑤硫酸 ⑥氢氧化钠 ⑦食盐 ⑧硝酸钾
(1)清除金属表面铁锈
(2)使饼干松脆可口
(3)改良酸性土壤
(4)配制波尔多液的盐
(5)一种复合肥料
(6)腌制食品
(7)用于造纸的碱
(8)可作氮肥的气体 。
【答案】(1)H2SO4; (2)Na2CO3; (3)Ca(OH)2; (4)CuSO4;
(5)KNO3; (6)NaCl; (7)NaOH; (8)NH3。
23、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3)________,硫酸钾(K2SO4)________,
碳酸钾(K2CO3)________。 (2)碳酸钙(CaCO3)________,
碳酸钡(BaCO3)________,碳酸铜(CuCO3)________。
(3)氯化铵(NH4Cl)________,硝酸铵(NH4NO3)________,
碳酸铵〔(NH4)2CO3〕________。
【答案】溶 溶 溶 不溶 不溶 不溶 溶 溶 溶
三、实验题。
24、进行如下实验,研究物质的性质。
(1)D中溶液变为红色,说明硫酸锌溶液显_____ (填“酸性”或“碱性”)。
(2)溶液变为蓝色的有_____ (填字母序号,下同)。
(3)作为空白对照实验的是_____ 。
(4)再向B烧杯中加入适量石灰水,溶液变为紫色,用化学方程式解释其原因 _____ 。
【答案】 (1) 酸性 (2)CE (3)A
(4)Ca(OH)2+2HCl=CaCl2+H2O
四、综合应用题。
25、酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________ (写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
【答案】(1)H+ 稀盐酸(或者稀硫酸、BaCl2溶液,CaCl2溶液等)
(3)HCl、NaCl 红
(4)①玻璃棒 ②Ba(OH)2 +MgSO4=BaSO4↓+Mg(OH)2↓
【或者Ba(OH)2 +Na2CO3=BaCO3↓+2NaOH
或者CaCl2 +Na2CO3= CaCO3↓+2NaCl】
③Na2CO3和NaOH在溶液乙中加入适量稀盐酸 (5)9.8g
五、计算题。
26、石灰石是生产玻璃、氯化钙等多种化工产品的原料.某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实 验 1 2 3 4
加入样品质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
(1)第 次反应中矿石有剩余;
(2)表中m值是 ;
(3)试计算这种石灰石中碳酸钙的质量分数。
【答案】(1)3、4两次; (2)4.4; (3)80%;
