2022—2023学年化学沪教版(全国)九年级下册第七章:应用广泛的酸、碱、盐 习题(含答案)
文档属性
| 名称 | 2022—2023学年化学沪教版(全国)九年级下册第七章:应用广泛的酸、碱、盐 习题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 487.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-02 20:11:28 | ||
图片预览



文档简介
2022—2023学年化学沪教版(全国)九年级下册第七章:应用广泛的酸、碱、盐 习题含答案
沪教版(全国)第七章:应用广泛的酸、碱、盐
一、选择题。
1、如图所示,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是:①试管内液面上升;②试管内液面不上升;③试管内溶液变红;④试管内溶液变蓝
A.①② B.①③ C.②③ D.②④
2、不可能由两种元素组成的化合物是( )
A.氧化物 B.酸 C.碱 D.盐
3、某化工厂以石灰石、纯碱和水为主要原料制取烧碱.在制取过程中的变化关系可表示:CaCO3CaOCa(OH)2NaOH.上述变化过程中没有涉及到的化学反应类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
4、下列物质名称与化学式对应关系错误的是( )
A.烧碱—NaOH B.纯碱—Na2CO3
C.小苏打—NaHCO3 D.熟石灰—CaO
5、下列对有关实验操作或现象的描述中,错误的是( )
A.用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出pH
B.收集二氧化碳时,将燃着的木条伸到集气瓶口,如果木条立即熄灭,证明瓶内已集满二氧化碳
C.向鸡蛋清中滴加几滴浓硝酸,微热,出现黄色
D.将碘水滴加在馒头片上,出现蓝色
6、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
7、进行化学实验操作考核时,下列四位同学的操作中正确的是( )
A.倾倒液体 B.点燃酒精灯
C.检验溶液酸碱性 D.称取一定质量的氯化钠
8、某同学想用实验证明FeCl3溶液显黄色不是Cl﹣离子造成的,下列实验无意义的是( )
A.观察KCl溶液没有颜色
B.加水稀释后FeCl3溶液黄色变浅
C.FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失
D.向FeCl3溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液黄色消失
9、工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
10、下列四个图像能正确反映其对应实验过程的是( )
A.
等质量的两份固体加热制取氧气
B.
分别向等质量的铝和铁中加入溶质质量分数相等的稀盐酸至过量
C.
向氢氧化钾和氢氧化钡的混合溶液中逐滴加入稀硫酸
D.
向一定量的氢氧化钠溶液中逐滴滴加pH=3的稀硫酸
11、下列物质不能与NaOH溶液反应的是( )
A.二氧化碳 B.硝酸 C.硫酸铜 D.氢氧化铁
12、能使紫色石蕊试液变红的是( )
A.蒸馏水 B.盐酸 C.食盐水 D.石灰水
13、工业用反应来制备纯碱,该反应属于( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
14、t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
*15、化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是( )
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
二、填空题。
16、在酸溶液中滴入紫色石蕊呈______色,在碱溶液中滴入无色酚酞呈______色。
17、实验室检验二氧化碳的物质是 ,反应方程式为:
;实验室吸收二氧化碳的物质是 ,反应的方程式为 。
实验室为何用不同的物质检验和吸收二氧化碳?原因是:
。
18、某同学向盛有Ca(OH)2溶液的烧杯中加入K2CO3溶液到一定量时停止了实验,烧杯中产生了白色沉淀,发生的化学反应方程式为:
。为了探究反应后液体的成分,用两支试管各取少量过滤后的滤液,继续做以下实验:
(1)向第一支试管的滤液中加入稀盐酸,有气泡产生,则滤液中的溶质是: (填化学式)。
(2)向第二支试管的滤液中通入足量的CO2气体后,再蒸干滤液,得到白色固体,该物质在农业生产中的用途: (写一点即可)。
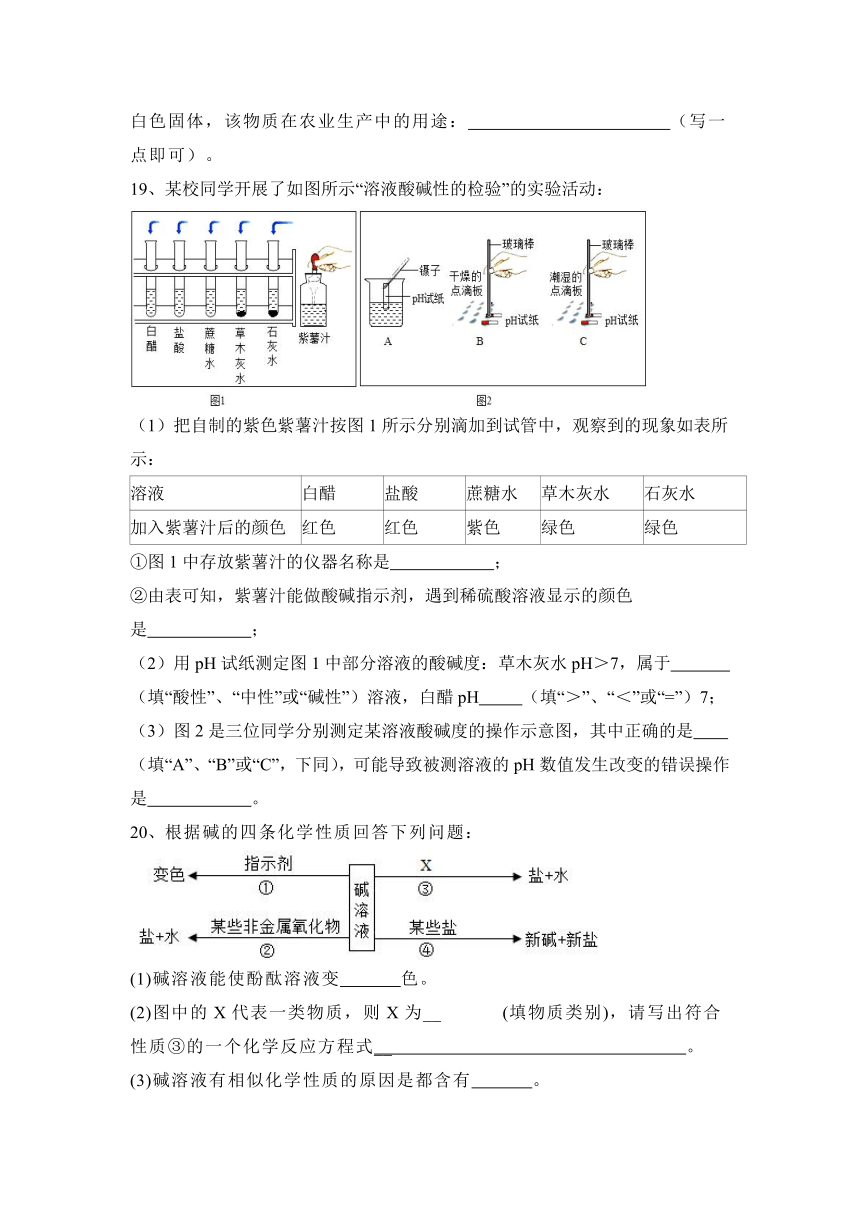
19、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 ;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是 ;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”、“<”或“=”)7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是
(填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
20、根据碱的四条化学性质回答下列问题:
(1)碱溶液能使酚酞溶液变 色。
(2)图中的X代表一类物质,则X为__ (填物质类别),请写出符合性质③的一个化学反应方程式__ 。
(3)碱溶液有相似化学性质的原因是都含有 。
21、用pH试纸测定某溶液的pH时,应先将pH试纸放在_______上。用_______蘸取1滴待测液置于pH试纸上,然后将pH试纸的颜色与__________对照可以测得pH。
22、氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂.古人将贝壳(主要成分是碳酸钙)高温煅烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用就可制得氢氧化钾.写出与制氢氧化钾有关的化学方程式,并注明反应类型.
(1) ( )反应
(2) ( )反应
(3) ( )反应
23、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3) ,硫酸钾(K2SO4) ,碳酸钾(K2CO3) 。
(2)碳酸钙(CaCO3) ,碳酸钡(BaCO3) ,碳酸铜(CuCO3) 。
(3)氯化铵(NH4Cl) ,硝酸铵(NH4NO3) ,
碳酸铵〔(NH4)2CO3〕 。
三、实验题。
24、)某校同学开展了如下“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称__________;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是___________,该汁液_______(填“能”或“不能”)做酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于_______(填“酸性”、“中性”或“碱性”)溶液,白醋pH_________(填“>”、”<”或”=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是____________(填“A”、“B”或“C”,下同),可能导致所测溶液pH数值发生改变的错误操作是________。
四、综合应用题。
25、食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和____。
②在蒸发过程中,待___时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是____ (用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有____(用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是____。已知:20 ℃时氯化钠的溶解度为36g。
五、计算题。
26、某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量的稀盐酸后,发现忘记滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。取10g烧杯中的溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。
(1)通过如图所示可知,当碳酸钠溶液质量加到_____时,溶液中盐酸恰好处理完。
(2)请计算原烧杯溶液中氯化钡的质量分数。(要有必要的解题过程)
2022—2023学年化学沪教版(全国)九年级下册第七章:应用广泛的酸、碱、盐 习题含答案
沪教版(全国)第七章:应用广泛的酸、碱、盐
一、选择题。
1、如图所示,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是:①试管内液面上升;②试管内液面不上升;③试管内溶液变红;④试管内溶液变蓝
A.①② B.①③ C.②③ D.②④
【答案】B
2、不可能由两种元素组成的化合物是( )
A.氧化物 B.酸 C.碱 D.盐
【答案】C
3、某化工厂以石灰石、纯碱和水为主要原料制取烧碱.在制取过程中的变化关系可表示:CaCO3CaOCa(OH)2NaOH.上述变化过程中没有涉及到的化学反应类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
【答案】C
4、下列物质名称与化学式对应关系错误的是( )
A.烧碱—NaOH B.纯碱—Na2CO3
C.小苏打—NaHCO3 D.熟石灰—CaO
【答案】D
5、下列对有关实验操作或现象的描述中,错误的是( )
A.用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出pH
B.收集二氧化碳时,将燃着的木条伸到集气瓶口,如果木条立即熄灭,证明瓶内已集满二氧化碳
C.向鸡蛋清中滴加几滴浓硝酸,微热,出现黄色
D.将碘水滴加在馒头片上,出现蓝色
【答案】A
6、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
【答案】B
7、进行化学实验操作考核时,下列四位同学的操作中正确的是( )
A.倾倒液体 B.点燃酒精灯
C.检验溶液酸碱性 D.称取一定质量的氯化钠
【答案】D
8、某同学想用实验证明FeCl3溶液显黄色不是Cl﹣离子造成的,下列实验无意义的是( )
A.观察KCl溶液没有颜色
B.加水稀释后FeCl3溶液黄色变浅
C.FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失
D.向FeCl3溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液黄色消失
【答案】B
9、工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
【答案】A
10、下列四个图像能正确反映其对应实验过程的是( )
A.
等质量的两份固体加热制取氧气
B.
分别向等质量的铝和铁中加入溶质质量分数相等的稀盐酸至过量
C.
向氢氧化钾和氢氧化钡的混合溶液中逐滴加入稀硫酸
D.
向一定量的氢氧化钠溶液中逐滴滴加pH=3的稀硫酸
【答案】B
11、下列物质不能与NaOH溶液反应的是( )
A.二氧化碳 B.硝酸 C.硫酸铜 D.氢氧化铁
【答案】D
12、能使紫色石蕊试液变红的是( )
A.蒸馏水 B.盐酸 C.食盐水 D.石灰水
【答案】B
13、工业用反应来制备纯碱,该反应属于( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
【答案】A
14、t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
【答案】C
*15、化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是( )
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
【答案】C
二、填空题。
16、在酸溶液中滴入紫色石蕊呈______色,在碱溶液中滴入无色酚酞呈______色。
【答案】红 红
17、实验室检验二氧化碳的物质是 ,反应方程式为:
;实验室吸收二氧化碳的物质是 ,反应的方程式为 。
实验室为何用不同的物质检验和吸收二氧化碳?原因是:
。
【答案】澄清石灰水,CO2+Ca(OH)2═CaCO3↓+H2O;
氢氧化钠溶液,2NaOH+CO2═Na2CO3+H2O;
氢氧化钙在水中的溶解度比氢氧化钠的溶解度小,吸收效果没有氢氧化钠好。
18、某同学向盛有Ca(OH)2溶液的烧杯中加入K2CO3溶液到一定量时停止了实验,烧杯中产生了白色沉淀,发生的化学反应方程式为:
。为了探究反应后液体的成分,用两支试管各取少量过滤后的滤液,继续做以下实验:
(1)向第一支试管的滤液中加入稀盐酸,有气泡产生,则滤液中的溶质是: (填化学式)。
(2)向第二支试管的滤液中通入足量的CO2气体后,再蒸干滤液,得到白色固体,该物质在农业生产中的用途: (写一点即可)。
【答案】; KOH、K2CO3; 作钾肥
19、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 ;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是 ;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”、“<”或“=”)7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是
(填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
【答案】(1)①滴瓶 ②红色 (2)碱性 < (3)B C
20、根据碱的四条化学性质回答下列问题:
(1)碱溶液能使酚酞溶液变 色。
(2)图中的X代表一类物质,则X为__ (填物质类别),请写出符合性质③的一个化学反应方程式__ 。
(3)碱溶液有相似化学性质的原因是都含有 。
【答案】红; 酸; NaOH+HCl=NaCl+H2O(合理即可); OH-(或氢氧根离子)
21、用pH试纸测定某溶液的pH时,应先将pH试纸放在_______上。用_______蘸取1滴待测液置于pH试纸上,然后将pH试纸的颜色与__________对照可以测得pH。
【答案】表面皿 玻璃棒 比色卡
22、氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂.古人将贝壳(主要成分是碳酸钙)高温煅烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用就可制得氢氧化钾.写出与制氢氧化钾有关的化学方程式,并注明反应类型.
(1) ( )反应
(2) ( )反应
(3) ( )反应
【答案】(1)CaCO3CaO+CO2↑;分解.
(2)CaO+H2O=Ca(OH)2;化合.
(3)Ca(OH)2+K2CO3=CaCO3↓+2KOH;复分解
23、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3) ,硫酸钾(K2SO4) ,碳酸钾(K2CO3) 。
(2)碳酸钙(CaCO3) ,碳酸钡(BaCO3) ,碳酸铜(CuCO3) 。
(3)氯化铵(NH4Cl) ,硝酸铵(NH4NO3) ,
碳酸铵〔(NH4)2CO3〕 。
【答案】溶; 溶; 溶; 不溶; 不溶; 不溶; 溶; 溶; 溶
三、实验题。
24、)某校同学开展了如下“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称__________;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是___________,该汁液_______(填“能”或“不能”)做酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于_______(填“酸性”、“中性”或“碱性”)溶液,白醋pH_________(填“>”、”<”或”=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是____________(填“A”、“B”或“C”,下同),可能导致所测溶液pH数值发生改变的错误操作是________。
【答案】滴瓶 红色 能 碱性 < B C
四、综合应用题。
25、食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和____。
②在蒸发过程中,待___时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是____ (用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有____(用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是____。已知:20 ℃时氯化钠的溶解度为36g。
【答案】漏斗 蒸发皿中出现较多固体时 BaCl2 + Na2CO3 = BaCO3↓+ 2NaCl Na2CO3、NaCl 、NaOH 加入22.4kg氯化钠固体
五、计算题。
26、某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量的稀盐酸后,发现忘记滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。取10g烧杯中的溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。
(1)通过如图所示可知,当碳酸钠溶液质量加到_____时,溶液中盐酸恰好处理完。
(2)请计算原烧杯溶液中氯化钡的质量分数。(要有必要的解题过程)
【答案】(1)2
(2)结合以上分析和图形中pH值的变化,反应氯化钡消耗的碳酸碳溶液的质量为6g-2g=4g;设原烧杯溶液中的质量为x,
208 106
x
解得x=1.04g
原烧杯溶液中氯化钡的质量分数:。
沪教版(全国)第七章:应用广泛的酸、碱、盐
一、选择题。
1、如图所示,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是:①试管内液面上升;②试管内液面不上升;③试管内溶液变红;④试管内溶液变蓝
A.①② B.①③ C.②③ D.②④
2、不可能由两种元素组成的化合物是( )
A.氧化物 B.酸 C.碱 D.盐
3、某化工厂以石灰石、纯碱和水为主要原料制取烧碱.在制取过程中的变化关系可表示:CaCO3CaOCa(OH)2NaOH.上述变化过程中没有涉及到的化学反应类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
4、下列物质名称与化学式对应关系错误的是( )
A.烧碱—NaOH B.纯碱—Na2CO3
C.小苏打—NaHCO3 D.熟石灰—CaO
5、下列对有关实验操作或现象的描述中,错误的是( )
A.用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出pH
B.收集二氧化碳时,将燃着的木条伸到集气瓶口,如果木条立即熄灭,证明瓶内已集满二氧化碳
C.向鸡蛋清中滴加几滴浓硝酸,微热,出现黄色
D.将碘水滴加在馒头片上,出现蓝色
6、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
7、进行化学实验操作考核时,下列四位同学的操作中正确的是( )
A.倾倒液体 B.点燃酒精灯
C.检验溶液酸碱性 D.称取一定质量的氯化钠
8、某同学想用实验证明FeCl3溶液显黄色不是Cl﹣离子造成的,下列实验无意义的是( )
A.观察KCl溶液没有颜色
B.加水稀释后FeCl3溶液黄色变浅
C.FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失
D.向FeCl3溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液黄色消失
9、工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
10、下列四个图像能正确反映其对应实验过程的是( )
A.
等质量的两份固体加热制取氧气
B.
分别向等质量的铝和铁中加入溶质质量分数相等的稀盐酸至过量
C.
向氢氧化钾和氢氧化钡的混合溶液中逐滴加入稀硫酸
D.
向一定量的氢氧化钠溶液中逐滴滴加pH=3的稀硫酸
11、下列物质不能与NaOH溶液反应的是( )
A.二氧化碳 B.硝酸 C.硫酸铜 D.氢氧化铁
12、能使紫色石蕊试液变红的是( )
A.蒸馏水 B.盐酸 C.食盐水 D.石灰水
13、工业用反应来制备纯碱,该反应属于( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
14、t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
*15、化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是( )
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
二、填空题。
16、在酸溶液中滴入紫色石蕊呈______色,在碱溶液中滴入无色酚酞呈______色。
17、实验室检验二氧化碳的物质是 ,反应方程式为:
;实验室吸收二氧化碳的物质是 ,反应的方程式为 。
实验室为何用不同的物质检验和吸收二氧化碳?原因是:
。
18、某同学向盛有Ca(OH)2溶液的烧杯中加入K2CO3溶液到一定量时停止了实验,烧杯中产生了白色沉淀,发生的化学反应方程式为:
。为了探究反应后液体的成分,用两支试管各取少量过滤后的滤液,继续做以下实验:
(1)向第一支试管的滤液中加入稀盐酸,有气泡产生,则滤液中的溶质是: (填化学式)。
(2)向第二支试管的滤液中通入足量的CO2气体后,再蒸干滤液,得到白色固体,该物质在农业生产中的用途: (写一点即可)。
19、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 ;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是 ;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”、“<”或“=”)7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是
(填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
20、根据碱的四条化学性质回答下列问题:
(1)碱溶液能使酚酞溶液变 色。
(2)图中的X代表一类物质,则X为__ (填物质类别),请写出符合性质③的一个化学反应方程式__ 。
(3)碱溶液有相似化学性质的原因是都含有 。
21、用pH试纸测定某溶液的pH时,应先将pH试纸放在_______上。用_______蘸取1滴待测液置于pH试纸上,然后将pH试纸的颜色与__________对照可以测得pH。
22、氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂.古人将贝壳(主要成分是碳酸钙)高温煅烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用就可制得氢氧化钾.写出与制氢氧化钾有关的化学方程式,并注明反应类型.
(1) ( )反应
(2) ( )反应
(3) ( )反应
23、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3) ,硫酸钾(K2SO4) ,碳酸钾(K2CO3) 。
(2)碳酸钙(CaCO3) ,碳酸钡(BaCO3) ,碳酸铜(CuCO3) 。
(3)氯化铵(NH4Cl) ,硝酸铵(NH4NO3) ,
碳酸铵〔(NH4)2CO3〕 。
三、实验题。
24、)某校同学开展了如下“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称__________;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是___________,该汁液_______(填“能”或“不能”)做酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于_______(填“酸性”、“中性”或“碱性”)溶液,白醋pH_________(填“>”、”<”或”=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是____________(填“A”、“B”或“C”,下同),可能导致所测溶液pH数值发生改变的错误操作是________。
四、综合应用题。
25、食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和____。
②在蒸发过程中,待___时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是____ (用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有____(用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是____。已知:20 ℃时氯化钠的溶解度为36g。
五、计算题。
26、某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量的稀盐酸后,发现忘记滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。取10g烧杯中的溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。
(1)通过如图所示可知,当碳酸钠溶液质量加到_____时,溶液中盐酸恰好处理完。
(2)请计算原烧杯溶液中氯化钡的质量分数。(要有必要的解题过程)
2022—2023学年化学沪教版(全国)九年级下册第七章:应用广泛的酸、碱、盐 习题含答案
沪教版(全国)第七章:应用广泛的酸、碱、盐
一、选择题。
1、如图所示,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是:①试管内液面上升;②试管内液面不上升;③试管内溶液变红;④试管内溶液变蓝
A.①② B.①③ C.②③ D.②④
【答案】B
2、不可能由两种元素组成的化合物是( )
A.氧化物 B.酸 C.碱 D.盐
【答案】C
3、某化工厂以石灰石、纯碱和水为主要原料制取烧碱.在制取过程中的变化关系可表示:CaCO3CaOCa(OH)2NaOH.上述变化过程中没有涉及到的化学反应类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
【答案】C
4、下列物质名称与化学式对应关系错误的是( )
A.烧碱—NaOH B.纯碱—Na2CO3
C.小苏打—NaHCO3 D.熟石灰—CaO
【答案】D
5、下列对有关实验操作或现象的描述中,错误的是( )
A.用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出pH
B.收集二氧化碳时,将燃着的木条伸到集气瓶口,如果木条立即熄灭,证明瓶内已集满二氧化碳
C.向鸡蛋清中滴加几滴浓硝酸,微热,出现黄色
D.将碘水滴加在馒头片上,出现蓝色
【答案】A
6、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
【答案】B
7、进行化学实验操作考核时,下列四位同学的操作中正确的是( )
A.倾倒液体 B.点燃酒精灯
C.检验溶液酸碱性 D.称取一定质量的氯化钠
【答案】D
8、某同学想用实验证明FeCl3溶液显黄色不是Cl﹣离子造成的,下列实验无意义的是( )
A.观察KCl溶液没有颜色
B.加水稀释后FeCl3溶液黄色变浅
C.FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失
D.向FeCl3溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液黄色消失
【答案】B
9、工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
【答案】A
10、下列四个图像能正确反映其对应实验过程的是( )
A.
等质量的两份固体加热制取氧气
B.
分别向等质量的铝和铁中加入溶质质量分数相等的稀盐酸至过量
C.
向氢氧化钾和氢氧化钡的混合溶液中逐滴加入稀硫酸
D.
向一定量的氢氧化钠溶液中逐滴滴加pH=3的稀硫酸
【答案】B
11、下列物质不能与NaOH溶液反应的是( )
A.二氧化碳 B.硝酸 C.硫酸铜 D.氢氧化铁
【答案】D
12、能使紫色石蕊试液变红的是( )
A.蒸馏水 B.盐酸 C.食盐水 D.石灰水
【答案】B
13、工业用反应来制备纯碱,该反应属于( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
【答案】A
14、t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
【答案】C
*15、化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是( )
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
【答案】C
二、填空题。
16、在酸溶液中滴入紫色石蕊呈______色,在碱溶液中滴入无色酚酞呈______色。
【答案】红 红
17、实验室检验二氧化碳的物质是 ,反应方程式为:
;实验室吸收二氧化碳的物质是 ,反应的方程式为 。
实验室为何用不同的物质检验和吸收二氧化碳?原因是:
。
【答案】澄清石灰水,CO2+Ca(OH)2═CaCO3↓+H2O;
氢氧化钠溶液,2NaOH+CO2═Na2CO3+H2O;
氢氧化钙在水中的溶解度比氢氧化钠的溶解度小,吸收效果没有氢氧化钠好。
18、某同学向盛有Ca(OH)2溶液的烧杯中加入K2CO3溶液到一定量时停止了实验,烧杯中产生了白色沉淀,发生的化学反应方程式为:
。为了探究反应后液体的成分,用两支试管各取少量过滤后的滤液,继续做以下实验:
(1)向第一支试管的滤液中加入稀盐酸,有气泡产生,则滤液中的溶质是: (填化学式)。
(2)向第二支试管的滤液中通入足量的CO2气体后,再蒸干滤液,得到白色固体,该物质在农业生产中的用途: (写一点即可)。
【答案】; KOH、K2CO3; 作钾肥
19、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 ;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是 ;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”、“<”或“=”)7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是
(填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
【答案】(1)①滴瓶 ②红色 (2)碱性 < (3)B C
20、根据碱的四条化学性质回答下列问题:
(1)碱溶液能使酚酞溶液变 色。
(2)图中的X代表一类物质,则X为__ (填物质类别),请写出符合性质③的一个化学反应方程式__ 。
(3)碱溶液有相似化学性质的原因是都含有 。
【答案】红; 酸; NaOH+HCl=NaCl+H2O(合理即可); OH-(或氢氧根离子)
21、用pH试纸测定某溶液的pH时,应先将pH试纸放在_______上。用_______蘸取1滴待测液置于pH试纸上,然后将pH试纸的颜色与__________对照可以测得pH。
【答案】表面皿 玻璃棒 比色卡
22、氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂.古人将贝壳(主要成分是碳酸钙)高温煅烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用就可制得氢氧化钾.写出与制氢氧化钾有关的化学方程式,并注明反应类型.
(1) ( )反应
(2) ( )反应
(3) ( )反应
【答案】(1)CaCO3CaO+CO2↑;分解.
(2)CaO+H2O=Ca(OH)2;化合.
(3)Ca(OH)2+K2CO3=CaCO3↓+2KOH;复分解
23、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3) ,硫酸钾(K2SO4) ,碳酸钾(K2CO3) 。
(2)碳酸钙(CaCO3) ,碳酸钡(BaCO3) ,碳酸铜(CuCO3) 。
(3)氯化铵(NH4Cl) ,硝酸铵(NH4NO3) ,
碳酸铵〔(NH4)2CO3〕 。
【答案】溶; 溶; 溶; 不溶; 不溶; 不溶; 溶; 溶; 溶
三、实验题。
24、)某校同学开展了如下“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称__________;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是___________,该汁液_______(填“能”或“不能”)做酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于_______(填“酸性”、“中性”或“碱性”)溶液,白醋pH_________(填“>”、”<”或”=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是____________(填“A”、“B”或“C”,下同),可能导致所测溶液pH数值发生改变的错误操作是________。
【答案】滴瓶 红色 能 碱性 < B C
四、综合应用题。
25、食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和____。
②在蒸发过程中,待___时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是____ (用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有____(用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是____。已知:20 ℃时氯化钠的溶解度为36g。
【答案】漏斗 蒸发皿中出现较多固体时 BaCl2 + Na2CO3 = BaCO3↓+ 2NaCl Na2CO3、NaCl 、NaOH 加入22.4kg氯化钠固体
五、计算题。
26、某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量的稀盐酸后,发现忘记滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。取10g烧杯中的溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。
(1)通过如图所示可知,当碳酸钠溶液质量加到_____时,溶液中盐酸恰好处理完。
(2)请计算原烧杯溶液中氯化钡的质量分数。(要有必要的解题过程)
【答案】(1)2
(2)结合以上分析和图形中pH值的变化,反应氯化钡消耗的碳酸碳溶液的质量为6g-2g=4g;设原烧杯溶液中的质量为x,
208 106
x
解得x=1.04g
原烧杯溶液中氯化钡的质量分数:。
