第3节 原子结构的模型 同步练习(44张ppt)
文档属性
| 名称 | 第3节 原子结构的模型 同步练习(44张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-03 18:32:06 | ||
图片预览








文档简介
第2章 微粒的模型与符号
第3节 原子结构的模型
学习目标
1.了解原子结构模型及其发展过程,体验建立模型的思想。
2.认识原子的结构,知道核电荷数、质子数和核外电子数之间的关系。
3.理解元素、同位素的概念,认识原子、元素和同位素的关系。
4.知道物质也可由离子构成,认识原子与离子之间的关系。
知识点1 原子结构模型的建立
1.原子结构模型的建立历程
时间
1803年
1897年
1911年
1913年
1926年
科学家
道尔顿
(英国)
汤姆生(英国)
卢瑟福(英国)
玻尔(丹麦)
薛定谔(奥地利)
模型
类型
实心
球模
型
枣糕模型(又
叫西瓜模型)
核式结构模型(又
叫行星模型)
分层模型
电子云模型
模型图
. .
. .
. .
. .
. .
模型
说明
认为原子是一
个实心球体
原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡
萄干那样镶嵌其中
(1)原子内部大部
分是空的;(2)在
原子的中心有一个
很小的原子核;(3)
原子的全部正电荷
和几乎全部的质量
都集中在原子核里,
带负电的电子在核
外空间绕核运动
电子在原子
核外空间的
一定轨道上
分层绕核做
高速运动
电子在原子核外
很小的空间内做
高速运动,其在
各处出现的概率
是不同的,若用
疏密不同的点表
示电子出现在各
处的概率,画出
图形,就像云雾
一样
续表
建模
依据
猜测
汤姆生发现了电子,且测得电子带负电,而原子显电中性
???? 粒子轰击金属箔实验
带负电的电
子只能在原
子内的一些
特定的稳定
轨道上运动
单位体积内电子
出现的几率高低
总结
建立模型往往需要一个不断完善、不断修正的过程,以使模型更接近事物
的本质
建模
依据
猜测
汤姆生发现了电子,且测得电子带负电,而原子显电中性
带负电的电
子只能在原
子内的一些
特定的稳定
轨道上运动
单位体积内电子
出现的几率高低
总结
建立模型往往需要一个不断完善、不断修正的过程,以使模型更接近事物
的本质
续表
教材深挖
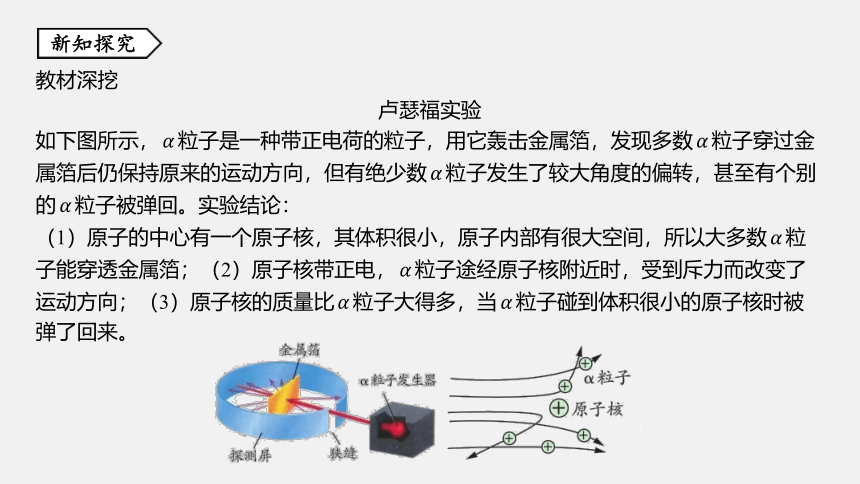
卢瑟福实验
如下图所示,???? 粒子是一种带正电荷的粒子,用它轰击金属箔,发现多数 ???? 粒子穿过金
属箔后仍保持原来的运动方向,但有绝少数???? 粒子发生了较大角度的偏转,甚至有个别
的???? 粒子被弹回。实验结论:
(1)原子的中心有一个原子核,其体积很小,原子内部有很大空间,所以大多数???? 粒
子能穿透金属箔;(2)原子核带正电,???? 粒子途经原子核附近时,受到斥力而改变了
运动方向;(3)原子核的质量比???? 粒子大得多,当 ???? 粒子碰到体积很小的原子核时被
弹了回来。
?
.&1& &2& .
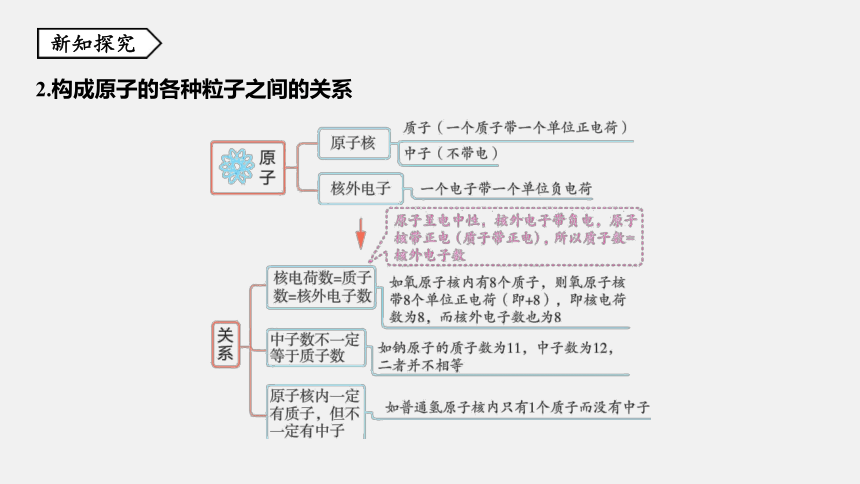
2.原子的构成
说明 因为原子核和核外电子所带电量相等,电性相反,所以整个原子显电中性。
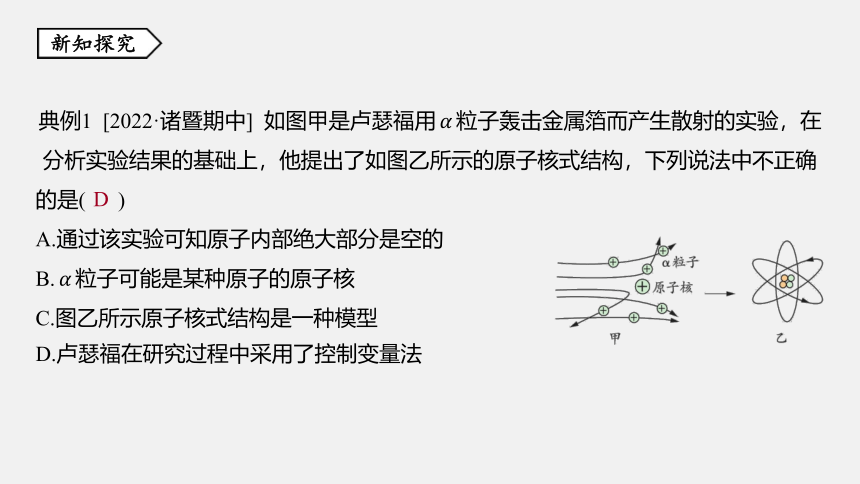
典例1 [2022·诸暨期中] 如图甲是卢瑟福用???? 粒子轰击金属箔而产生散射的实验,在
分析实验结果的基础上,他提出了如图乙所示的原子核式结构,下列说法中不正确
的是( )
A.通过该实验可知原子内部绝大部分是空的
B.???? 粒子可能是某种原子的原子核
C.图乙所示原子核式结构是一种模型
D.卢瑟福在研究过程中采用了控制变量法
?
D
[解析] 由图甲知,大多数???? 粒子的运动轨迹变化较小,即受到原子核的排斥力小,
这说明原子核很小,即原子内部绝大部分是空的,A不合题意;???? 粒子与原子核互相
排斥,而原子核带正电,说明???? 粒子带正电,所以 ???? 粒子可能是某种原子的原子核,
B不合题意;图乙是表示原子结构的一种模型,C不合题意;卢瑟福在研究过程中采
用的是模型法,D符合题意。
?
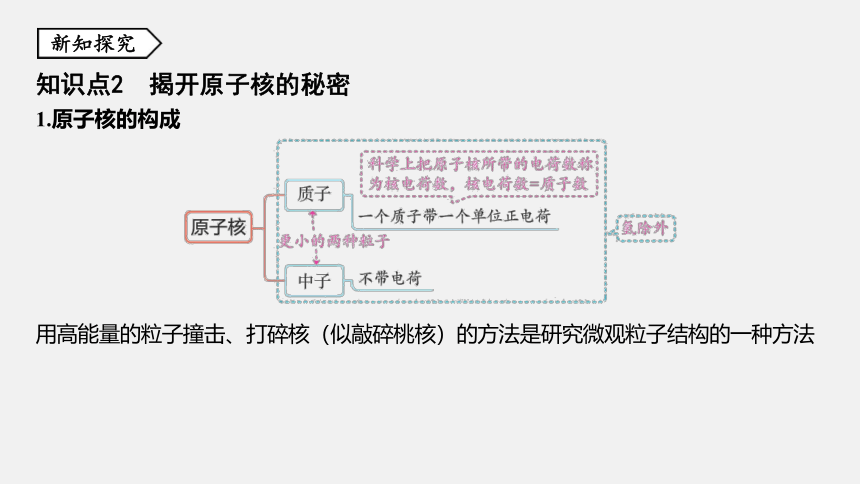
知识点2 揭开原子核的秘密
1.原子核的构成
用高能量的粒子撞击、打碎核(似敲碎桃核)的方法是研究微观粒子结构的一种方法
2.构成原子的各种粒子之间的关系
3.构成原子的各种微粒的质量比较
4.构成质子和中子的粒子
科学家又对质子和中子的构成进行了研究,发现质子和中子都是由更微小的基本粒子——夸
克构成的。夸克还可以再分。有关夸克的结构和性质还在研究中。
原子是由原子核和核外电子构成的,原子核又是由质子和中子构成的,质子和中子又是由更
小的微粒——夸克构成的,这体现了物质微观上的结构层次。其实人体、植物体乃至整个宇
宙也都是有一定的结构层次的
典例2 [杭州期末] 如图为某原子结构模型的示意图,其中a 、 b 、 c 是构成该原子
的三种不同粒子,下列说法正确的是( )
?
A.b 是最小的粒子,不可再分
B.原子中b 与 c 的数目一定相同
C.原子中a 与 c 的数目一定相同
D.原子的质量集中在a 和 c 上
?
C
[解析]
读图
分析
. .
b 是中子,由更小的微粒——夸克构成;原子中质子数和中子
数不一定相等;原子呈电中性,原子中质子数等于电子数;原
子的质量主要集中在原子核上,而原子核由质子和中子构成
读图
分析
. .
知识点3 带电的原子——离子
1.教材第46页活动:钠在氯气中燃烧形成氯化钠的过程
实验
步骤
取一瓶氯气,用镊子夹一小块钠放入玻璃燃烧匙中,点燃钠,将玻璃燃烧
匙迅速伸入氯气瓶中,反应结束后观察瓶内的物质
图示
. .
实验
现象
产生光亮的黄色火焰,伴有白烟生成,冷却后得到白色固体
微观
解释
金属钠在氯气中燃烧时,钠原子失去了电子形成带正电荷的钠离子(阳离
子),氯原子得到了电子形成带负电荷的氯离子(阴离子)。带有相反电
荷的钠离子和氯离子之间相互吸引,构成了电中性的氯化钠
. .
结论
与分子、原子一样,离子也是构成物质的基本粒子
续表
2.离子的概况
定义
离子是带电的原子或原子团(原子团是由两种或两种以上元素的原子结合而成的,常作为一个整体参与化学反应,如氢氧根离子、硫酸根离子)
分类
阳离子
带正电荷的原子或原子团,如钠离子、铵根离子
阴离子
带负电荷的原子或原子团,如氯离子、硫酸根离子
形成
一般来说,金属原子容易失去最外层电子变成阳离子,非金属原子容易得到电子变成阴离子
3.原子与离子的比较
项目
原子
离子
阳离子
阴离子
结构关系
质子数=电子数
质子数>电子数
质子数<电子数
电性
呈电中性
带正电
带负电
相互转化
同种元素的原子和离子的原子核相同,原子得、失电子后形成阴、阳
离子
阳离子?得电子失电子? 原子 ?得电子失电子? 阴离子
项目
原子
离子
阳离子
阴离子
结构关系
质子数=电子数
质子数>电子数
质子数<电子数
电性
呈电中性
带正电
带负电
相互转化
归纳总结
构成物质的粒子
分子、原子、离子都是构成物质的粒子,物质由哪种粒子构成,其化学性质就由哪
种粒子保持。
示
例
水由水分子构成,保持水化学性质的最小粒子是水分子;金刚石由碳原子构成,
碳原子是保持金刚石的化学性质的最小粒子;氯化钠由钠离子和氯离子构成,
保持氯化钠化学性质的最小粒子是钠离子和氯离子。
典例3 下图形象地表示了氯化钠的形成过程。下列相关叙述中不正确的是( )
A.钠原子易失去一个电子,氯原子易得到一个电子
B.钠跟氯气反应生成氯化钠
C.氯化钠是由离子构成的物质
D.钠离子与钠原子有相似的化学性质
[解析] 钠离子结构稳定,化学性质稳定,而钠原子的化学性质活泼,二者保持化学
性质的基本粒子不同,所以它们的化学性质不同。
D
知识点4 同位素——原子的“孪生兄弟”
1.元素的定义:科学上把具有相同核电荷数(即质子数)的一类原子总称为元素,
如氧元素就是所有核电荷数为8的原子的总称,氢元素就是所有核电荷数为1的原子
的总称。
特别提醒
对元素的理解
(1)元素概念中必须强调的微粒是原子或单核离子,因为具有相同质子数的微粒不一定是
同种元素。常见的微粒有分子、原子和离子,有些分子、原子和离子的质子数相同,如水分
子中有10个质子,氖原子中有10个质子,但它们不是同种元素。
(2)原子与该原子得失电子后形成的离子属于同一种元素。如钠原子和钠离子都属于钠元
素,氯原子和氯离子都属于氯元素。
2.同位素的定义与表示方法
定义
原子核内的质子数相同、中子数不相同的同类原子互为同位素原子
表示
方法
. .
如含6个质子、7个中子的碳原子可以表示为?613???? 或 ?????13
定义
原子核内的质子数相同、中子数不相同的同类原子互为同位素原子
表示
方法
说明 (1)元素是互为同位素的原子的总称,同位素原子是一种元素的不同种原子。
(2)大多数元素都有同位素原子,如氢有三种同位素原子,氧也有三种同位素原子。
3.同位素原子的应用
应用同位素原子可以测定年代,如应用碳?14 测出长沙马王堆出土的女尸墓葬距今
(2?130±95) 年
?
4.元素与原子的区别和联系
元素
原子
概念
核电荷数(即质子数)相同的一类原
子的总称
化学变化中的最小粒子
区别
宏观概念,只讲种类,不讲个数
微观概念,既讲种类,又讲个数
适用
范围
描述物质的宏观组成,如水是由氢、
氧两种元素组成的
描述物质的微观构成,如1个水分子
是由2个氢原子和1个氧原子构成的
联系
元素是核电荷数(即质子数)相同的一类原子的总称,原子是元素的个体
(即最小单位),元素则是原子的一个归类“集体”,即元素和原子是总体
和个体的关系
特别提醒
元素和同位素的关系
典例4 [2022·诸暨期中] 下表是小科收集的一些关于微粒的资料,请根据表格数据,
回答下列问题。
粒子名称
质子数
中子数
电子数
A
14
14
14
B
26
30
24
C
14
14
18
D
14
18
14
例题点拨
解决本题第(3)问可根据同位素原子的定义进行判断,也可根据“原子的质子数等于电子数”判断,即同位素原子是针对“不带电的原子”而言的,D是不带电的原子,B、C均不是不带电的原子。
(1)表中的元素共有___种。
[解析] 元素是具有相同核电荷数(即质子数)的同一类原子的总称,即元素的本质
区别是核电荷数(质子数)不同,根据表格知,质子数只有2种,故共有2种元素。
(2)属于阳离子的是___(选填字母)。
[解析] 质子带正电核,电子带负电荷,若质子数大于电子数,则带正电,为阳离子。
由表格知,B的质子数大于电子数,为阳离子。
(3)与A互为同位素原子的是___(选填字母)。
[解析] 根据表格知,A和D质子数相同,而中子数不同,所以它们互为同位素原子。
2
?
B
D
题型1 原子的结构
角度1 结合史料探究原子的结构★★★★
?
典例5 [2022·金华期中] 1911年英国科学家卢瑟福进行了著名的???? 粒子(带正电)轰击金属箔实验。结果发现:绝大多数 ???? 粒子穿过金属箔后仍沿原方向前进,但是有少数 ???? 粒子却发生了较大角度的偏转,并且有少数 ???? 粒子的偏转角度超过 90? ,有的几乎达到 180? ,像是被金属箔弹了回去。
?
(1)通过上述实验,可推出的原子结构模型为___(选填字母)。
A.&3& B.&4& C.&5&
C
[解析] 由题意知,大多数???? 粒子都沿原来的方向前进,即没有受到原子核的排斥力,
说明原子核作用力的范围很小,即原子核本身很小,原子内部大部分都是空的,C符
合题意。
?
(2)当???? 粒子轰击金属箔时,如图所示的运动轨迹不可能
的是_____(选填字母)。
?
BC
[解析]???? 粒子带正电荷,原子核也带正电荷,因此 ???? 粒子会
受到排斥力而使运动轨迹向外弯曲,而不是向内弯曲,故不
可能是B,C。
?
审题技巧
“绝大多数???? 粒子穿过金属箔后仍沿原方向前进”说明绝大多数 ???? 粒子没有受到力的
作用,可得原子内部有很大的空间;“少数???? 粒子却发生了较大角度的偏转”说明少
数???? 粒子受到了力的作用,可知原子核体积小且带正电,对 ???? 粒子产生了斥力;“少
数???? 粒子像是被金属箔弹了回去”说明 ???? 粒子撞击了原子核,原子核的质量比 ???? 粒子
的质量大得多。
?
角度2 构建原子的结构示意图 ★★★
?
典例6 [兰溪期中] 氚是氢的一种同位素,氚原子含有一个质子和两个中子。下列示意图能正确表示氚原子结构
的是( )
A
A.&6& B.&7& C.&8& D.&9&
[解析] &10&
审题技巧
由“氚原子含有一个质子和两个中子”可知原子核的具体情况,再结合原子是由原子
核和核外电子构成的,可知需确定核外电子的数量,而由“核外电子的数量与质子的
数量相等”即可确定核外电子数。
角度3 构成原子的各种粒子之间的关系★★
?
典例7 [2022·金华期中] 医学上用碘的同位素治疗甲亢已非常普遍,从1942年第一例
放射性元素碘?131 治疗甲亢以来,有效性和安全性就得到了充分的证实。已知碘
?131 原子的核电荷数为53,中子数为78,则该原子核外电子数为( )
A.25 B. 53 C. 78 D. 131
?
B
[解析] 在原子中,核外电子数=核电荷数,因此该原子的核外电子数为53。
归纳总结
解决此类问题的关键是掌握核电荷数的定义,明确原子中,核外电子数=质子数=核
电荷数。
题型2 原子和离子的比较★★★
?
典例8 [桐乡期中] 下图形象地表示了氯化钠的形
成过程。下列相关叙述中正确的是( )
A
A.钠原子失去一个电子形成阳离子,氯原子得到
一个电子形成阴离子
B.钠原子与钠离子都不显电性
C.氯化钠分子由氯原子和钠原子构成
D.钠原子与钠离子的微观结构相同
[解析] 钠原子失去一个电子形成钠离子,钠离子带一个单位的正电荷,钠原子与钠
离子的微观结构不同,B、D均错误;氯化钠是由离子构成的,C错误。
题型3 同位素
角度1 同位素原子的判断★★
?
典例9 [2022·舟山期中] 下图为原子核聚变(原理是
让几个原子核发生聚合作用,生成质量更大的新原子
核)的示意图,①②③表示三种原子(③的原子核未画出),&11&
分别表示原子中的不同微粒,聚变前后的微粒种类不变,各微粒总数也不变。
(1)仿照①②,在图中的③中画出其原子核;
[答案] &12&
[解析] 由题图知,聚变前,共有2个&13& 、3个&14& 和2个&15& ,聚变后,已出
现2个&16& 和1个&17& ,那么③中原子核应该包括2个&18& 和2个&19& 。
(2)①②③中属于同种元素的原子是______。
①②
[解析] 由质子数=核外电子数,并结合②可知,&20& 为质子。因为①和②的质
子数相同,所以①和②属于同种元素的原子。
审题技巧
抓住“聚变前后的微粒种类不变,各微粒总数也不变”,数出聚变前后各个微粒的数
量,分析出差异,即可画出③中的原子核。
易错警示
审题不清致误
许多同学看到“三种原子”而直接考虑质子数不同,没有考虑到同位素原子,或错误
地认为&21& 表示质子,从而得到②③为同种元素的原子。
角度2 同位素原子表示方法的应用★★
?
典例10 [2022·临海期中] 据报道钬元素的原子?67166Ho 可有效治疗肝癌,该原子中的
中子数与核外电子数之差是____。现有?67166X 和 ?67168Y 两种原子,则 X 和 Y ____(选填
“是”或“不是”)同种元素,理由是____________,我们把X 和 Y 原子称为________原
子。
?
32
是
质子数相同
同位素
[解析] 由?67166Ho 知,其质子数为67,质子数+中子数 =166 ,所以中子数
=166?67=99 ,因为核外电子数=质子数 =67 ,所以该原子中的中子数与核外电
子数之差是99?67=32 。因为 ?67166X 和 ?67168Y 的质子数都为67,即相同,所以 X 和 Y
是同种元素,但它们中子数不同,所以把X 和 Y 原子称为同位素原子。
?
归纳总结
解决此类问题的关键是掌握同位素原子的表示方法,即
第3节 原子结构的模型
学习目标
1.了解原子结构模型及其发展过程,体验建立模型的思想。
2.认识原子的结构,知道核电荷数、质子数和核外电子数之间的关系。
3.理解元素、同位素的概念,认识原子、元素和同位素的关系。
4.知道物质也可由离子构成,认识原子与离子之间的关系。
知识点1 原子结构模型的建立
1.原子结构模型的建立历程
时间
1803年
1897年
1911年
1913年
1926年
科学家
道尔顿
(英国)
汤姆生(英国)
卢瑟福(英国)
玻尔(丹麦)
薛定谔(奥地利)
模型
类型
实心
球模
型
枣糕模型(又
叫西瓜模型)
核式结构模型(又
叫行星模型)
分层模型
电子云模型
模型图
. .
. .
. .
. .
. .
模型
说明
认为原子是一
个实心球体
原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡
萄干那样镶嵌其中
(1)原子内部大部
分是空的;(2)在
原子的中心有一个
很小的原子核;(3)
原子的全部正电荷
和几乎全部的质量
都集中在原子核里,
带负电的电子在核
外空间绕核运动
电子在原子
核外空间的
一定轨道上
分层绕核做
高速运动
电子在原子核外
很小的空间内做
高速运动,其在
各处出现的概率
是不同的,若用
疏密不同的点表
示电子出现在各
处的概率,画出
图形,就像云雾
一样
续表
建模
依据
猜测
汤姆生发现了电子,且测得电子带负电,而原子显电中性
带负电的电
子只能在原
子内的一些
特定的稳定
轨道上运动
单位体积内电子
出现的几率高低
总结
建立模型往往需要一个不断完善、不断修正的过程,以使模型更接近事物
的本质
建模
依据
猜测
汤姆生发现了电子,且测得电子带负电,而原子显电中性
带负电的电
子只能在原
子内的一些
特定的稳定
轨道上运动
单位体积内电子
出现的几率高低
总结
建立模型往往需要一个不断完善、不断修正的过程,以使模型更接近事物
的本质
续表
教材深挖
卢瑟福实验
如下图所示,
属箔后仍保持原来的运动方向,但有绝少数
的
(1)原子的中心有一个原子核,其体积很小,原子内部有很大空间,所以大多数
子能穿透金属箔;(2)原子核带正电,
运动方向;(3)原子核的质量比
弹了回来。
?
.&1& &2& .
2.原子的构成
说明 因为原子核和核外电子所带电量相等,电性相反,所以整个原子显电中性。
典例1 [2022·诸暨期中] 如图甲是卢瑟福用
分析实验结果的基础上,他提出了如图乙所示的原子核式结构,下列说法中不正确
的是( )
A.通过该实验可知原子内部绝大部分是空的
B.
C.图乙所示原子核式结构是一种模型
D.卢瑟福在研究过程中采用了控制变量法
?
D
[解析] 由图甲知,大多数
这说明原子核很小,即原子内部绝大部分是空的,A不合题意;
排斥,而原子核带正电,说明
B不合题意;图乙是表示原子结构的一种模型,C不合题意;卢瑟福在研究过程中采
用的是模型法,D符合题意。
?
知识点2 揭开原子核的秘密
1.原子核的构成
用高能量的粒子撞击、打碎核(似敲碎桃核)的方法是研究微观粒子结构的一种方法
2.构成原子的各种粒子之间的关系
3.构成原子的各种微粒的质量比较
4.构成质子和中子的粒子
科学家又对质子和中子的构成进行了研究,发现质子和中子都是由更微小的基本粒子——夸
克构成的。夸克还可以再分。有关夸克的结构和性质还在研究中。
原子是由原子核和核外电子构成的,原子核又是由质子和中子构成的,质子和中子又是由更
小的微粒——夸克构成的,这体现了物质微观上的结构层次。其实人体、植物体乃至整个宇
宙也都是有一定的结构层次的
典例2 [杭州期末] 如图为某原子结构模型的示意图,其中
的三种不同粒子,下列说法正确的是( )
?
A.
B.原子中
C.原子中
D.原子的质量集中在
?
C
[解析]
读图
分析
. .
数不一定相等;原子呈电中性,原子中质子数等于电子数;原
子的质量主要集中在原子核上,而原子核由质子和中子构成
读图
分析
. .
知识点3 带电的原子——离子
1.教材第46页活动:钠在氯气中燃烧形成氯化钠的过程
实验
步骤
取一瓶氯气,用镊子夹一小块钠放入玻璃燃烧匙中,点燃钠,将玻璃燃烧
匙迅速伸入氯气瓶中,反应结束后观察瓶内的物质
图示
. .
实验
现象
产生光亮的黄色火焰,伴有白烟生成,冷却后得到白色固体
微观
解释
金属钠在氯气中燃烧时,钠原子失去了电子形成带正电荷的钠离子(阳离
子),氯原子得到了电子形成带负电荷的氯离子(阴离子)。带有相反电
荷的钠离子和氯离子之间相互吸引,构成了电中性的氯化钠
. .
结论
与分子、原子一样,离子也是构成物质的基本粒子
续表
2.离子的概况
定义
离子是带电的原子或原子团(原子团是由两种或两种以上元素的原子结合而成的,常作为一个整体参与化学反应,如氢氧根离子、硫酸根离子)
分类
阳离子
带正电荷的原子或原子团,如钠离子、铵根离子
阴离子
带负电荷的原子或原子团,如氯离子、硫酸根离子
形成
一般来说,金属原子容易失去最外层电子变成阳离子,非金属原子容易得到电子变成阴离子
3.原子与离子的比较
项目
原子
离子
阳离子
阴离子
结构关系
质子数=电子数
质子数>电子数
质子数<电子数
电性
呈电中性
带正电
带负电
相互转化
同种元素的原子和离子的原子核相同,原子得、失电子后形成阴、阳
离子
阳离子
项目
原子
离子
阳离子
阴离子
结构关系
质子数=电子数
质子数>电子数
质子数<电子数
电性
呈电中性
带正电
带负电
相互转化
归纳总结
构成物质的粒子
分子、原子、离子都是构成物质的粒子,物质由哪种粒子构成,其化学性质就由哪
种粒子保持。
示
例
水由水分子构成,保持水化学性质的最小粒子是水分子;金刚石由碳原子构成,
碳原子是保持金刚石的化学性质的最小粒子;氯化钠由钠离子和氯离子构成,
保持氯化钠化学性质的最小粒子是钠离子和氯离子。
典例3 下图形象地表示了氯化钠的形成过程。下列相关叙述中不正确的是( )
A.钠原子易失去一个电子,氯原子易得到一个电子
B.钠跟氯气反应生成氯化钠
C.氯化钠是由离子构成的物质
D.钠离子与钠原子有相似的化学性质
[解析] 钠离子结构稳定,化学性质稳定,而钠原子的化学性质活泼,二者保持化学
性质的基本粒子不同,所以它们的化学性质不同。
D
知识点4 同位素——原子的“孪生兄弟”
1.元素的定义:科学上把具有相同核电荷数(即质子数)的一类原子总称为元素,
如氧元素就是所有核电荷数为8的原子的总称,氢元素就是所有核电荷数为1的原子
的总称。
特别提醒
对元素的理解
(1)元素概念中必须强调的微粒是原子或单核离子,因为具有相同质子数的微粒不一定是
同种元素。常见的微粒有分子、原子和离子,有些分子、原子和离子的质子数相同,如水分
子中有10个质子,氖原子中有10个质子,但它们不是同种元素。
(2)原子与该原子得失电子后形成的离子属于同一种元素。如钠原子和钠离子都属于钠元
素,氯原子和氯离子都属于氯元素。
2.同位素的定义与表示方法
定义
原子核内的质子数相同、中子数不相同的同类原子互为同位素原子
表示
方法
. .
如含6个质子、7个中子的碳原子可以表示为
定义
原子核内的质子数相同、中子数不相同的同类原子互为同位素原子
表示
方法
说明 (1)元素是互为同位素的原子的总称,同位素原子是一种元素的不同种原子。
(2)大多数元素都有同位素原子,如氢有三种同位素原子,氧也有三种同位素原子。
3.同位素原子的应用
应用同位素原子可以测定年代,如应用碳
?
4.元素与原子的区别和联系
元素
原子
概念
核电荷数(即质子数)相同的一类原
子的总称
化学变化中的最小粒子
区别
宏观概念,只讲种类,不讲个数
微观概念,既讲种类,又讲个数
适用
范围
描述物质的宏观组成,如水是由氢、
氧两种元素组成的
描述物质的微观构成,如1个水分子
是由2个氢原子和1个氧原子构成的
联系
元素是核电荷数(即质子数)相同的一类原子的总称,原子是元素的个体
(即最小单位),元素则是原子的一个归类“集体”,即元素和原子是总体
和个体的关系
特别提醒
元素和同位素的关系
典例4 [2022·诸暨期中] 下表是小科收集的一些关于微粒的资料,请根据表格数据,
回答下列问题。
粒子名称
质子数
中子数
电子数
A
14
14
14
B
26
30
24
C
14
14
18
D
14
18
14
例题点拨
解决本题第(3)问可根据同位素原子的定义进行判断,也可根据“原子的质子数等于电子数”判断,即同位素原子是针对“不带电的原子”而言的,D是不带电的原子,B、C均不是不带电的原子。
(1)表中的元素共有___种。
[解析] 元素是具有相同核电荷数(即质子数)的同一类原子的总称,即元素的本质
区别是核电荷数(质子数)不同,根据表格知,质子数只有2种,故共有2种元素。
(2)属于阳离子的是___(选填字母)。
[解析] 质子带正电核,电子带负电荷,若质子数大于电子数,则带正电,为阳离子。
由表格知,B的质子数大于电子数,为阳离子。
(3)与A互为同位素原子的是___(选填字母)。
[解析] 根据表格知,A和D质子数相同,而中子数不同,所以它们互为同位素原子。
?
B
D
题型1 原子的结构
角度1 结合史料探究原子的结构
?
典例5 [2022·金华期中] 1911年英国科学家卢瑟福进行了著名的
?
(1)通过上述实验,可推出的原子结构模型为___(选填字母)。
A.&3& B.&4& C.&5&
C
[解析] 由题意知,大多数
说明原子核作用力的范围很小,即原子核本身很小,原子内部大部分都是空的,C符
合题意。
?
(2)当
的是_____(选填字母)。
?
BC
[解析]
受到排斥力而使运动轨迹向外弯曲,而不是向内弯曲,故不
可能是B,C。
?
审题技巧
“绝大多数
作用,可得原子内部有很大的空间;“少数
数
数
的质量大得多。
?
角度2 构建原子的结构示意图
?
典例6 [兰溪期中] 氚是氢的一种同位素,氚原子含有一个质子和两个中子。下列示意图能正确表示氚原子结构
的是( )
A
A.&6& B.&7& C.&8& D.&9&
[解析] &10&
审题技巧
由“氚原子含有一个质子和两个中子”可知原子核的具体情况,再结合原子是由原子
核和核外电子构成的,可知需确定核外电子的数量,而由“核外电子的数量与质子的
数量相等”即可确定核外电子数。
角度3 构成原子的各种粒子之间的关系
?
典例7 [2022·金华期中] 医学上用碘的同位素治疗甲亢已非常普遍,从1942年第一例
放射性元素碘
A.
?
B
[解析] 在原子中,核外电子数=核电荷数,因此该原子的核外电子数为53。
归纳总结
解决此类问题的关键是掌握核电荷数的定义,明确原子中,核外电子数=质子数=核
电荷数。
题型2 原子和离子的比较
?
典例8 [桐乡期中] 下图形象地表示了氯化钠的形
成过程。下列相关叙述中正确的是( )
A
A.钠原子失去一个电子形成阳离子,氯原子得到
一个电子形成阴离子
B.钠原子与钠离子都不显电性
C.氯化钠分子由氯原子和钠原子构成
D.钠原子与钠离子的微观结构相同
[解析] 钠原子失去一个电子形成钠离子,钠离子带一个单位的正电荷,钠原子与钠
离子的微观结构不同,B、D均错误;氯化钠是由离子构成的,C错误。
题型3 同位素
角度1 同位素原子的判断
?
典例9 [2022·舟山期中] 下图为原子核聚变(原理是
让几个原子核发生聚合作用,生成质量更大的新原子
核)的示意图,①②③表示三种原子(③的原子核未画出),&11&
分别表示原子中的不同微粒,聚变前后的微粒种类不变,各微粒总数也不变。
(1)仿照①②,在图中的③中画出其原子核;
[答案] &12&
[解析] 由题图知,聚变前,共有2个&13& 、3个&14& 和2个&15& ,聚变后,已出
现2个&16& 和1个&17& ,那么③中原子核应该包括2个&18& 和2个&19& 。
(2)①②③中属于同种元素的原子是______。
①②
[解析] 由质子数=核外电子数,并结合②可知,&20& 为质子。因为①和②的质
子数相同,所以①和②属于同种元素的原子。
审题技巧
抓住“聚变前后的微粒种类不变,各微粒总数也不变”,数出聚变前后各个微粒的数
量,分析出差异,即可画出③中的原子核。
易错警示
审题不清致误
许多同学看到“三种原子”而直接考虑质子数不同,没有考虑到同位素原子,或错误
地认为&21& 表示质子,从而得到②③为同种元素的原子。
角度2 同位素原子表示方法的应用
?
典例10 [2022·临海期中] 据报道钬元素的原子
中子数与核外电子数之差是____。现有
“是”或“不是”)同种元素,理由是____________,我们把
子。
?
32
是
质子数相同
同位素
[解析] 由
子数之差是
是同种元素,但它们中子数不同,所以把
?
归纳总结
解决此类问题的关键是掌握同位素原子的表示方法,即
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
