第3节 化学方程式 同步练习(49张ppt)
文档属性
| 名称 | 第3节 化学方程式 同步练习(49张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-03 18:33:45 | ||
图片预览







文档简介
(共49张PPT)
第3章 空气与生命
第3节 化学方程式
学习目标
1.通过对化学反应中反应物和生成物质量的测定实验,了解质量守恒定律。
2.通过对化学反应的实质分析,理解质量守恒定律,能用原子、分子等粒子观点解
释质量守恒定律。
3.了解化学方程式表示的意义,掌握化学方程式书写的方法,学化学方程式。
4.在了解化学方程式意义的基础上,能依据化学方程式进行反应物质量和生成物质
量之间的计算。通过有关化学方程式的计算练习,规范解题格式。
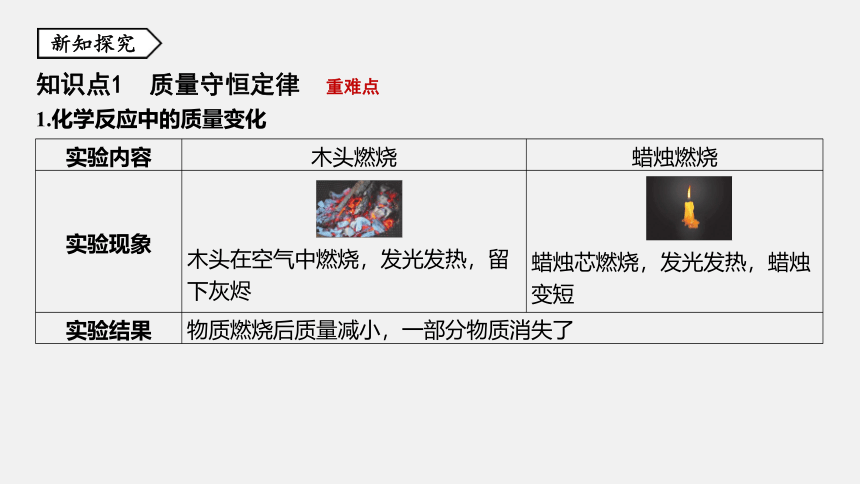
知识点1 质量守恒定律 重难点
1.化学反应中的质量变化
实验内容 木头燃烧 蜡烛燃烧
实验现象 . . 木头在空气中燃烧,发光发热,留 下灰烬 . .
蜡烛芯燃烧,发光发热,蜡烛
变短
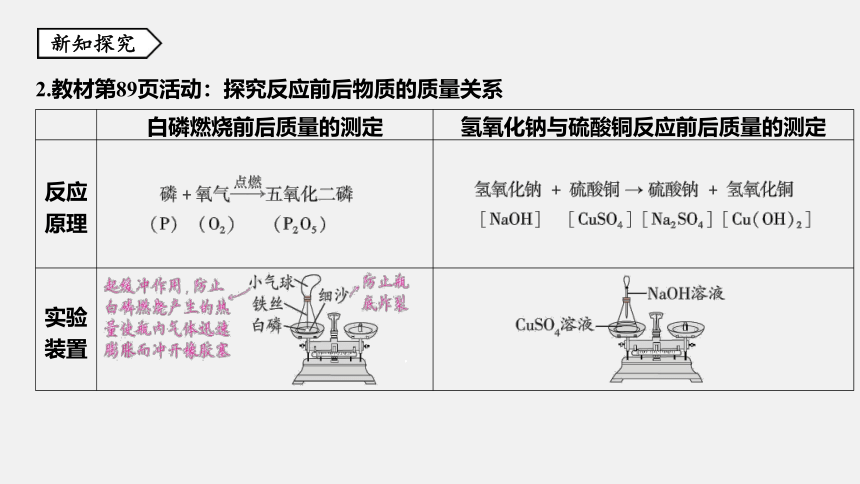
实验结果 物质燃烧后质量减小,一部分物质消失了 2.教材第89页活动:探究反应前后物质的质量关系
白磷燃烧前后质量的测定 氢氧化钠与硫酸铜反应前后质量的测定
反应 原理
实验 装置 . . . .
白磷燃烧前后质量的测定 氢氧化钠与硫酸铜反应前后质量的测定
实验 步骤 将锥形瓶放在天平托盘上,调节平 衡。然后取下锥形瓶,将瓶塞上的 铁丝在酒精灯上烧红后,接触引燃 白磷,并立即塞紧瓶塞。待反应结 束冷却后,重新放在天平托盘上, 观察天平是否平衡 将锥形瓶置于天平托盘上,调节平衡。然后
取下锥形瓶,把滴管内的溶液滴入瓶内,使
两种溶液混合。再将锥形瓶放回天平托盘上,
观察是否平衡
实验 现象 白磷燃烧,产生大量白烟;开始时 气球胀大,冷却后缩小;白磷燃烧 前后天平平衡 反应生成蓝色沉淀;反应前后天平平衡
实验 结论 参加反应的白磷和氧气的质量总和 等于反应生成的五氧化二磷的质量 参加反应的氢氧化钠和硫酸铜的质量总和等
于反应后生成硫酸钠和氢氧化铜的质量总和
续表
3.质量守恒定律的内容
在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律叫做质
量守恒定律。
对质量守恒定律的理解
适用范围 适用于所有的化学反应,不适用于物理变化
研究的量 是质量的守恒,不包括体积等其他方面的守恒
研究对象 “参加化学反应的”各物质的质量,不是反应物质量的简单相加,不包括没有参与反应的
那部分质量;“反应后生成的”各物质的质量,不包括反应前就已经存在的物质的质量
各物质 指所有参与反应的反应物和生成物,包括固态、液态、气态
4.质量守恒的原因
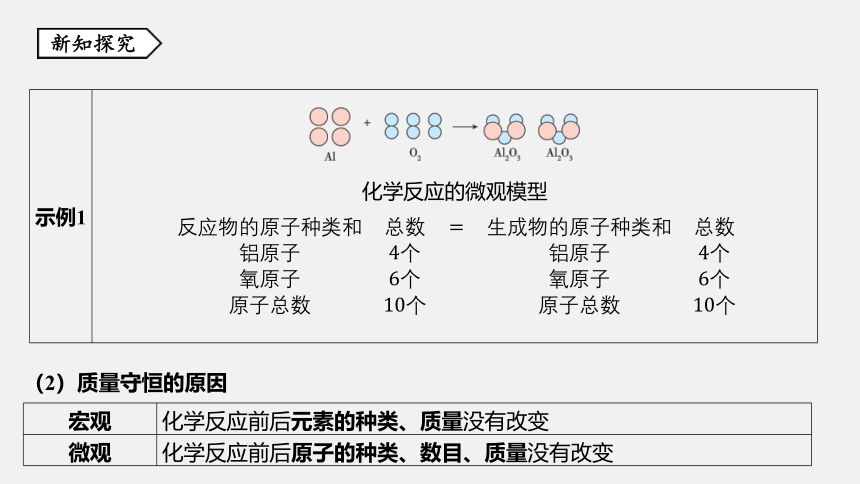
(1)化学反应的实质
化学反应的过程就是组成反应物分子的原子重新组合成生成物分子的过程。该过程
可表示为:
分子
示例1 . .
化学反应的微观模型
(2)质量守恒的原因
宏观 化学反应前后元素的种类、质量没有改变
微观 化学反应前后原子的种类、数目、质量没有改变
辨析比较
化学反应前后的变和不变
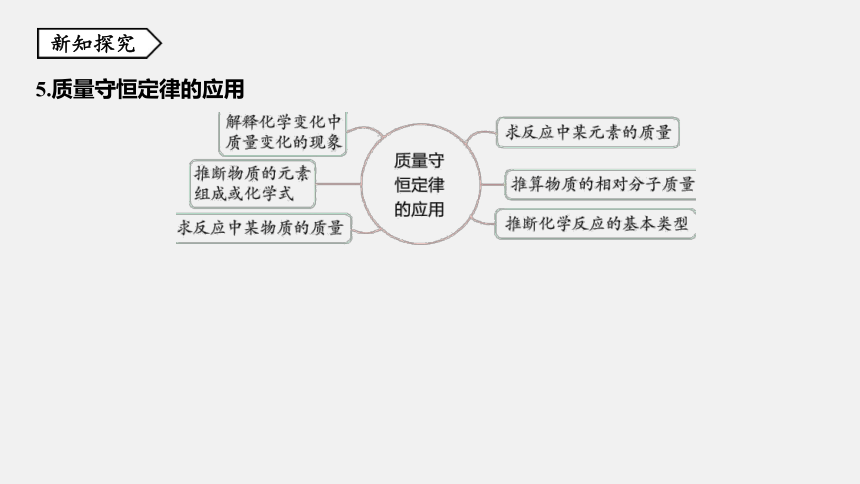
5.质量守恒定律的应用
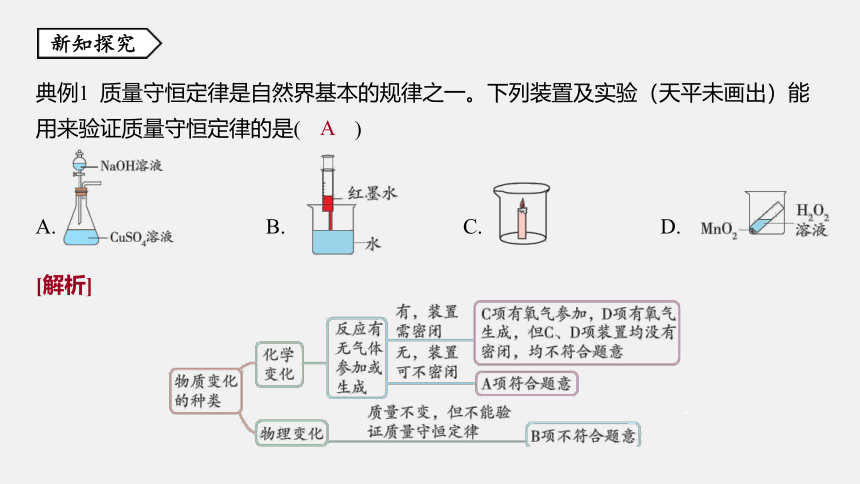
典例1 质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能
用来验证质量守恒定律的是( )
A.&1& B.&2& C.&3& D.&4&
A
[解析]
.&5& .
例题点拨
设计实验验证质量守恒定律时,应注意两点:
1.实验中必须发生化学变化,而非物理变化;
2.若反应中有气体参加或生成,必须在密闭容器中进行实验。
知识点2化学方程式的定义、读法及意义重点
1.化学方程式的定义
示例2 木炭在氧气中燃烧的化学方程式为
2.化学方程式的读法及意义
以
意义 示例 读法
宏观 角度 表示反应物、生成物 以及反应条件 ①反应物是碳和氧气,生成物是二氧化碳;②反应条 件是点燃 碳和氧气在点燃的条件下反应生成二氧化碳
质量 角度 表示反应物、生成物 各物质间的质量比, 各物质间质量比=相 对分子质量与化学计 量数的乘积比 指化学方程式中物质 前的数字
微观 角度 表示各物质间分子或 原子的个数比,即化 学计量数之比
典例2 关于化学方程式
其中错误的是( )
A.&6& B.&7& C.&8& D.&9&
A
[解析] 反应中各物质之间的质量比为
体,反应后生成的五氧化二磷固体的质量为参加反应的磷和氧气的质量总和,所以
反应后固体质量增加。
知识点3 化学方程式的书写
1.书写原则
2.书写步骤
一写 根据反应事实,左边写反应物化学式,右边写生成物化学式,中间用短线连接。如果反应物或生成物不止一种,就分别用“+”号连接起来
二配 配平,使左右两边各原子的种类与数目相等
三注 注明反应条件,如点燃、加热(常用
四查 检查化学式是否正确,化学方程式是否配平,反应条件是否标注正确,生成 物状态是否漏标或多标 配平时,化学式右下角的数字不能更改,化学计量数之比应取最简整数比
巧学妙记
左反应、右生成;
化学式、须正确;
系数平、原子等;
等号连、条件清;
生成气体和沉淀,
上下箭头来注明。
特别提醒
书写化学方程式的注意事项
(1)正确区分反应条件与反应过程:如“点燃”与“燃烧”不同,“点燃”是反应条件,而
“燃烧”是反应过程。如
(2)“
无气体,而生成物中有气体,则在气体的化学式右边注“
反应,反应物中无固体,而生成物中有固体,则在固体的化学式右边注“
3.化学方程式的配平方法
(1)最小公倍数法
①适用范围:适用于左右两边原子个数差异较大的化学方程式。
②步骤(以
步骤 示例
最小公倍数:
(2)奇数配偶法
①适用范围:适用于左右两边某一元素的原子数目为一奇一偶的化学方程式。
②步骤(以
步骤 示例
典例3 下列化学方程式书写正确的是( )
A.
B.
C.
D.
D
[解析] A选项反应物是液体,生成的气体化学式右边应标注气体符号“
式应为
知识点4 依据化学方程式进行计算 重难点
1.计算依据
示例3 碳在空气中燃烧,利用化学方程式可表示反应物、生成各物质间的质量比。
2.根据化学方程式计算的一般步骤
示 例 4 2022年1月17日,长征二号丁遥七十运载火箭成功将试验十三号卫星送入预定
轨道,发射任务取得圆满成功。氢氧发动机是火箭常用推进装置之一,假如火
箭将卫星送入预定轨道需要
巧学妙记
一解二设最后答,
写方程式不能差,
准确找到质量比,
纯量代入不掺假,
所有单位要一致,
列式计算解决它。
典例4 小明取
应。
(1)
解:设
答:
(2)样品中
[答案] 样品中碳酸钠的含量(质量分数)
此该样品中
答:样品中
例题点拨
物质纯度的计算公式
物质的纯度(质量分数)
题型1 从微观角度认识质量守恒定律
典例5 工业生产硫酸中的某一步反应用微观模型图表示如下,下列说法正确的是
( )
D
A.反应前后硫元素的化合价从
B.参加反应的反应物间分子个数比是
C.反应前后分子数目不变
D.该反应属于化合反应
[解析] 根据微观模型图可知,反应物为二氧化硫和氧气,生成物为三氧化硫,硫元
素的化合价从
物分子总数为2,参加反应的反应物(二氧化硫和氧气)间分子个数比是
后分子数目减少,B、C均错;该反应符合“多变一”的特点,属于化合反应,D正确。
方法点拨
根据化学反应前后原子的种类和数目不变、分子的种类一定改变以及化合反应“多变一”的特点分析解答。
题型2 质量守恒定律的应用
角度1 推断物质的化学式★★★
典例6 防控新冠肺炎疫情常需要用“84”消毒液进行消毒。“84”消毒液的主要成分是
次氯酸钠
的化学式:______。
[解析]
原子种类 钠原子 氯原子 氧原子 碳原子 氢原子
反应前原子总数 2个 2个 5个 1个 2个
反应后已知的原子总数 2个 3个 1个
由表可知,
方法点拨
化学方程式中物质化学式的推断方法
根据化学反应前后原子的种类和数目不变,计算反应前后各种原子的个数,根据差值得出待求物质的化学式。
角度2 分析反应体系中的变化★★★
典例7 一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量
如下表:
物质 A B C D
反应前质量
反应后质量
则反应后A的质量为______;该反应所属的反应类型是__________;该反应中B和D
两种物质的质量比为______。
分解反应
[解析]
.&10& .
该反应的特点为“一变多”,属于分解反应;反应过程中B和D的质量比为
方法点拨
表格类数据分析题的解法
1.根据反应前物质的质量总和
2.分析各种物质质量的变化,根据变化情况得出结论:
质量增加 为生成物
质量减少 为反应物
质量不变 可能是催化剂或未参与反应的杂质
3.表示反应过程,进而判断基本反应类型等其他信息。
角度3 推断物质的组成★★★★
典例8 化学上常用燃烧法测定物质的组成。现取
成
B
A.该物质中只含有碳、氢两种元素
B.该实验消耗氧气的质量为
C.该物质中碳、氢元素的质量比为
D.该物质中可能含有氧元素
[解析] 根据题干信息表示出该反应过程,如右所示:
根据反应前后元素的种类和质量不变可知,
碳元素
元素的质量
C错误;根据反应前后物质的总质量不变,可知该实验消耗氧气的质量为
方法点拨
根据质量守恒定律推断物质元素组成的方法
已知条件:某物质在氧气中燃烧,生成二氧化碳和水。
1.根据化学反应前后元素的种类不变,可以推知该物质中一定含有碳、氢元素,可能含有氧元素。
2.根据反应前后碳、氢元素的质量不变,可将二氧化碳和水中碳、氢元素的总质量与该物质的质量比较,若相等,说明该物质中不含氧元素;若该物质的质量大于碳、氢元素质量之和,说明该物质中含有氧元素。
3.根据元素的质量之比等于相对原子质量与原子个数的乘积之比,推断物质的化学式。
题型3 根据微观模型写化学方程式
典例9 我国科学家成功合成新型催化剂,能将二氧化碳高效转化为甲醇,其反应的
微观过程如图所示。
(1)该反应的化学方程式是_ _________________________。
(2)甲、乙、丙、丁四种物质中属于单质的是____(填化学式)。
方法点拨
先分析微观示意图,找出反应物、生成物、反应条件,然后书写化学方程式,并配平。
[解析]
.&11& .
题型4 依据化学方程式进行计算
角度1 计算相对分子质量★★★
典例10 在反应
已知D的相对分子质量为18,则A的相对分子质量是( )
A.
C
[解析] &12&
角度2 分析图像进行计算★★★
典例11 实验室用
实验的相关数据如图所示。请回答下列问题。
(1)反应中二氧化锰起______作用,在化学反应前后本身的________________都没
有发生变化。
催化
质量和化学性质
(2)反应生成氧气的质量为____
1.6
[解析] 由图像可知生成氧气的质量为
(3)计算用过氧化氢制取氧气的反应中生成水的质量(要求写出完整计算过程)。
解:设反应中生成水的质量为
答:反应中生成水的质量为
方法点拨
读图指导
角度3 分析表格进行计算(培优)★★★★
典例12 某兴趣小组在实验室加热氯酸钾和二氧化锰的混合物制取氧气,试管中固体
的质量随时间变化的数据见下表。实验结束后,将剩余固体溶解、过滤、烘干,回
收二氧化锰。请计算下列问题。
加热时间
固体的质量
(1)共制得氧气____
9.6
[解析] 根据质量守恒定律,反应前后固体的质量差即为反应生成的氧气的质量,反
应生成的氧气的质量为
(2)理论上可回收的二氧化锰的质量。
解:设混合物中氯酸钾的质量为
则反应前混合物中二氧化锰的质量为
由于二氧化锰作催化剂,反应前后质量不变,因此理论上可回收的二氧化锰的质量
为
答:理论上可回收的二氧化锰的质量为
[解析] 根据化学方程式,由氧气的质量可以计算出氯酸钾的质量,结合反应前混合
物的总质量,可以进一步计算出二氧化锰的质量。
审题技巧
氯酸钾受热分解生成氯化钾和氧气,分析表中数据,
相同,都是
生成物氧气的质量,再利用化学方程式计算反应物氯酸钾的质量,进而可得混合物
中催化剂二氧化锰的质量。
第3章 空气与生命
第3节 化学方程式
学习目标
1.通过对化学反应中反应物和生成物质量的测定实验,了解质量守恒定律。
2.通过对化学反应的实质分析,理解质量守恒定律,能用原子、分子等粒子观点解
释质量守恒定律。
3.了解化学方程式表示的意义,掌握化学方程式书写的方法,学化学方程式。
4.在了解化学方程式意义的基础上,能依据化学方程式进行反应物质量和生成物质
量之间的计算。通过有关化学方程式的计算练习,规范解题格式。
知识点1 质量守恒定律 重难点
1.化学反应中的质量变化
实验内容 木头燃烧 蜡烛燃烧
实验现象 . . 木头在空气中燃烧,发光发热,留 下灰烬 . .
蜡烛芯燃烧,发光发热,蜡烛
变短
实验结果 物质燃烧后质量减小,一部分物质消失了 2.教材第89页活动:探究反应前后物质的质量关系
白磷燃烧前后质量的测定 氢氧化钠与硫酸铜反应前后质量的测定
反应 原理
实验 装置 . . . .
白磷燃烧前后质量的测定 氢氧化钠与硫酸铜反应前后质量的测定
实验 步骤 将锥形瓶放在天平托盘上,调节平 衡。然后取下锥形瓶,将瓶塞上的 铁丝在酒精灯上烧红后,接触引燃 白磷,并立即塞紧瓶塞。待反应结 束冷却后,重新放在天平托盘上, 观察天平是否平衡 将锥形瓶置于天平托盘上,调节平衡。然后
取下锥形瓶,把滴管内的溶液滴入瓶内,使
两种溶液混合。再将锥形瓶放回天平托盘上,
观察是否平衡
实验 现象 白磷燃烧,产生大量白烟;开始时 气球胀大,冷却后缩小;白磷燃烧 前后天平平衡 反应生成蓝色沉淀;反应前后天平平衡
实验 结论 参加反应的白磷和氧气的质量总和 等于反应生成的五氧化二磷的质量 参加反应的氢氧化钠和硫酸铜的质量总和等
于反应后生成硫酸钠和氢氧化铜的质量总和
续表
3.质量守恒定律的内容
在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律叫做质
量守恒定律。
对质量守恒定律的理解
适用范围 适用于所有的化学反应,不适用于物理变化
研究的量 是质量的守恒,不包括体积等其他方面的守恒
研究对象 “参加化学反应的”各物质的质量,不是反应物质量的简单相加,不包括没有参与反应的
那部分质量;“反应后生成的”各物质的质量,不包括反应前就已经存在的物质的质量
各物质 指所有参与反应的反应物和生成物,包括固态、液态、气态
4.质量守恒的原因
(1)化学反应的实质
化学反应的过程就是组成反应物分子的原子重新组合成生成物分子的过程。该过程
可表示为:
分子
示例1 . .
化学反应的微观模型
(2)质量守恒的原因
宏观 化学反应前后元素的种类、质量没有改变
微观 化学反应前后原子的种类、数目、质量没有改变
辨析比较
化学反应前后的变和不变
5.质量守恒定律的应用
典例1 质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能
用来验证质量守恒定律的是( )
A.&1& B.&2& C.&3& D.&4&
A
[解析]
.&5& .
例题点拨
设计实验验证质量守恒定律时,应注意两点:
1.实验中必须发生化学变化,而非物理变化;
2.若反应中有气体参加或生成,必须在密闭容器中进行实验。
知识点2化学方程式的定义、读法及意义重点
1.化学方程式的定义
示例2 木炭在氧气中燃烧的化学方程式为
2.化学方程式的读法及意义
以
意义 示例 读法
宏观 角度 表示反应物、生成物 以及反应条件 ①反应物是碳和氧气,生成物是二氧化碳;②反应条 件是点燃 碳和氧气在点燃的条件下反应生成二氧化碳
质量 角度 表示反应物、生成物 各物质间的质量比, 各物质间质量比=相 对分子质量与化学计 量数的乘积比 指化学方程式中物质 前的数字
微观 角度 表示各物质间分子或 原子的个数比,即化 学计量数之比
典例2 关于化学方程式
其中错误的是( )
A.&6& B.&7& C.&8& D.&9&
A
[解析] 反应中各物质之间的质量比为
体,反应后生成的五氧化二磷固体的质量为参加反应的磷和氧气的质量总和,所以
反应后固体质量增加。
知识点3 化学方程式的书写
1.书写原则
2.书写步骤
一写 根据反应事实,左边写反应物化学式,右边写生成物化学式,中间用短线连接。如果反应物或生成物不止一种,就分别用“+”号连接起来
二配 配平,使左右两边各原子的种类与数目相等
三注 注明反应条件,如点燃、加热(常用
四查 检查化学式是否正确,化学方程式是否配平,反应条件是否标注正确,生成 物状态是否漏标或多标 配平时,化学式右下角的数字不能更改,化学计量数之比应取最简整数比
巧学妙记
左反应、右生成;
化学式、须正确;
系数平、原子等;
等号连、条件清;
生成气体和沉淀,
上下箭头来注明。
特别提醒
书写化学方程式的注意事项
(1)正确区分反应条件与反应过程:如“点燃”与“燃烧”不同,“点燃”是反应条件,而
“燃烧”是反应过程。如
(2)“
无气体,而生成物中有气体,则在气体的化学式右边注“
反应,反应物中无固体,而生成物中有固体,则在固体的化学式右边注“
3.化学方程式的配平方法
(1)最小公倍数法
①适用范围:适用于左右两边原子个数差异较大的化学方程式。
②步骤(以
步骤 示例
最小公倍数:
(2)奇数配偶法
①适用范围:适用于左右两边某一元素的原子数目为一奇一偶的化学方程式。
②步骤(以
步骤 示例
典例3 下列化学方程式书写正确的是( )
A.
B.
C.
D.
D
[解析] A选项反应物是液体,生成的气体化学式右边应标注气体符号“
式应为
知识点4 依据化学方程式进行计算 重难点
1.计算依据
示例3 碳在空气中燃烧,利用化学方程式可表示反应物、生成各物质间的质量比。
2.根据化学方程式计算的一般步骤
示 例 4 2022年1月17日,长征二号丁遥七十运载火箭成功将试验十三号卫星送入预定
轨道,发射任务取得圆满成功。氢氧发动机是火箭常用推进装置之一,假如火
箭将卫星送入预定轨道需要
巧学妙记
一解二设最后答,
写方程式不能差,
准确找到质量比,
纯量代入不掺假,
所有单位要一致,
列式计算解决它。
典例4 小明取
应。
(1)
解:设
答:
(2)样品中
[答案] 样品中碳酸钠的含量(质量分数)
此该样品中
答:样品中
例题点拨
物质纯度的计算公式
物质的纯度(质量分数)
题型1 从微观角度认识质量守恒定律
典例5 工业生产硫酸中的某一步反应用微观模型图表示如下,下列说法正确的是
( )
D
A.反应前后硫元素的化合价从
B.参加反应的反应物间分子个数比是
C.反应前后分子数目不变
D.该反应属于化合反应
[解析] 根据微观模型图可知,反应物为二氧化硫和氧气,生成物为三氧化硫,硫元
素的化合价从
物分子总数为2,参加反应的反应物(二氧化硫和氧气)间分子个数比是
后分子数目减少,B、C均错;该反应符合“多变一”的特点,属于化合反应,D正确。
方法点拨
根据化学反应前后原子的种类和数目不变、分子的种类一定改变以及化合反应“多变一”的特点分析解答。
题型2 质量守恒定律的应用
角度1 推断物质的化学式★★★
典例6 防控新冠肺炎疫情常需要用“84”消毒液进行消毒。“84”消毒液的主要成分是
次氯酸钠
的化学式:______。
[解析]
原子种类 钠原子 氯原子 氧原子 碳原子 氢原子
反应前原子总数 2个 2个 5个 1个 2个
反应后已知的原子总数 2个 3个 1个
由表可知,
方法点拨
化学方程式中物质化学式的推断方法
根据化学反应前后原子的种类和数目不变,计算反应前后各种原子的个数,根据差值得出待求物质的化学式。
角度2 分析反应体系中的变化★★★
典例7 一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量
如下表:
物质 A B C D
反应前质量
反应后质量
则反应后A的质量为______;该反应所属的反应类型是__________;该反应中B和D
两种物质的质量比为______。
分解反应
[解析]
.&10& .
该反应的特点为“一变多”,属于分解反应;反应过程中B和D的质量比为
方法点拨
表格类数据分析题的解法
1.根据反应前物质的质量总和
2.分析各种物质质量的变化,根据变化情况得出结论:
质量增加 为生成物
质量减少 为反应物
质量不变 可能是催化剂或未参与反应的杂质
3.表示反应过程,进而判断基本反应类型等其他信息。
角度3 推断物质的组成★★★★
典例8 化学上常用燃烧法测定物质的组成。现取
成
B
A.该物质中只含有碳、氢两种元素
B.该实验消耗氧气的质量为
C.该物质中碳、氢元素的质量比为
D.该物质中可能含有氧元素
[解析] 根据题干信息表示出该反应过程,如右所示:
根据反应前后元素的种类和质量不变可知,
碳元素
元素的质量
C错误;根据反应前后物质的总质量不变,可知该实验消耗氧气的质量为
方法点拨
根据质量守恒定律推断物质元素组成的方法
已知条件:某物质在氧气中燃烧,生成二氧化碳和水。
1.根据化学反应前后元素的种类不变,可以推知该物质中一定含有碳、氢元素,可能含有氧元素。
2.根据反应前后碳、氢元素的质量不变,可将二氧化碳和水中碳、氢元素的总质量与该物质的质量比较,若相等,说明该物质中不含氧元素;若该物质的质量大于碳、氢元素质量之和,说明该物质中含有氧元素。
3.根据元素的质量之比等于相对原子质量与原子个数的乘积之比,推断物质的化学式。
题型3 根据微观模型写化学方程式
典例9 我国科学家成功合成新型催化剂,能将二氧化碳高效转化为甲醇,其反应的
微观过程如图所示。
(1)该反应的化学方程式是_ _________________________。
(2)甲、乙、丙、丁四种物质中属于单质的是____(填化学式)。
方法点拨
先分析微观示意图,找出反应物、生成物、反应条件,然后书写化学方程式,并配平。
[解析]
.&11& .
题型4 依据化学方程式进行计算
角度1 计算相对分子质量★★★
典例10 在反应
已知D的相对分子质量为18,则A的相对分子质量是( )
A.
C
[解析] &12&
角度2 分析图像进行计算★★★
典例11 实验室用
实验的相关数据如图所示。请回答下列问题。
(1)反应中二氧化锰起______作用,在化学反应前后本身的________________都没
有发生变化。
催化
质量和化学性质
(2)反应生成氧气的质量为____
1.6
[解析] 由图像可知生成氧气的质量为
(3)计算用过氧化氢制取氧气的反应中生成水的质量(要求写出完整计算过程)。
解:设反应中生成水的质量为
答:反应中生成水的质量为
方法点拨
读图指导
角度3 分析表格进行计算(培优)★★★★
典例12 某兴趣小组在实验室加热氯酸钾和二氧化锰的混合物制取氧气,试管中固体
的质量随时间变化的数据见下表。实验结束后,将剩余固体溶解、过滤、烘干,回
收二氧化锰。请计算下列问题。
加热时间
固体的质量
(1)共制得氧气____
9.6
[解析] 根据质量守恒定律,反应前后固体的质量差即为反应生成的氧气的质量,反
应生成的氧气的质量为
(2)理论上可回收的二氧化锰的质量。
解:设混合物中氯酸钾的质量为
则反应前混合物中二氧化锰的质量为
由于二氧化锰作催化剂,反应前后质量不变,因此理论上可回收的二氧化锰的质量
为
答:理论上可回收的二氧化锰的质量为
[解析] 根据化学方程式,由氧气的质量可以计算出氯酸钾的质量,结合反应前混合
物的总质量,可以进一步计算出二氧化锰的质量。
审题技巧
氯酸钾受热分解生成氯化钾和氧气,分析表中数据,
相同,都是
生成物氧气的质量,再利用化学方程式计算反应物氯酸钾的质量,进而可得混合物
中催化剂二氧化锰的质量。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
