第2节 氧化和燃烧 同步练习(33张ppt)
文档属性
| 名称 | 第2节 氧化和燃烧 同步练习(33张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-03 19:00:47 | ||
图片预览










文档简介
第3章 空气与生命
第2节 氧化和燃烧
学习目标
1.了解氧化反应的概念,知道剧烈氧化和缓慢氧化的过程。
2.了解燃烧的概念,知道燃烧的条件,了解灭火的原理和防火的措施。
3.知道爆炸、缓慢氧化、自燃、燃烧的区别和联系。
4.知道在化学反应过程中伴随能量的变化。
知识点1 氧化反应
1.概念:物质跟氧发生的反应叫做氧化反应。
注意 (1)氧化反应不属于化学反应的基本类型。
(2)氧化反应中的“氧”并不只是氧气,还可以是含氧化合物中的氧。
苹果切开后放一会儿会变色
锈迹斑斑的铁
2.分类???? 依据:氧化过程进行的剧烈程度
?
缓慢氧化
剧烈氧化
概念
进行得很慢,甚至在短期内不易察觉的
氧化反应
像燃烧那样反应剧烈的氧化反应
举例
塑料和橡胶制品的老化、苹果变色、呼
吸作用、金属的锈蚀
硫、铁等物质的燃烧、爆炸
区别
现象不同,反应的剧烈程度不同,反应条件不同
联系
都是氧化反应;都放出热量
典例1 生活中发生缓慢氧化的事例很多,下列过程不涉及缓慢氧化的是( )
A.酒和醋的酿造 B.人在长跑时急促呼吸
C.农家肥的腐熟 D.酒精灯安静地燃烧
D
[解析] 酒和醋的酿造、农家肥的腐熟、人的呼吸作用都属于进行得比较缓慢的氧化
反应;燃烧属于剧烈的氧化反应。
知识点2 燃烧的条件 重点
拓展培优
燃烧不一定有氧气参加
广义的燃烧指的是所有的发光、放热的剧烈的化学反应。如镁条可以在二氧化碳中燃烧,氢
气可以在氯气中燃烧等。
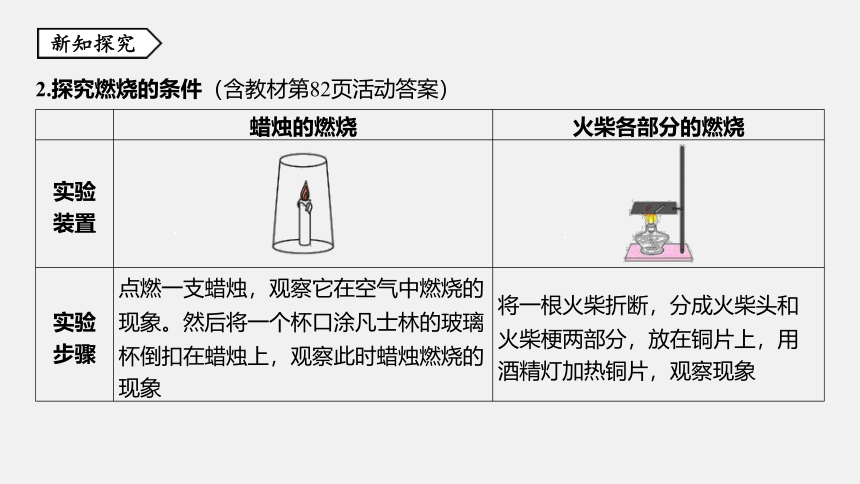
2.探究燃烧的条件(含教材第82页活动答案)
蜡烛的燃烧
火柴各部分的燃烧
实验
装置
. .
. .
实验
步骤
点燃一支蜡烛,观察它在空气中燃烧的
现象。然后将一个杯口涂凡士林的玻璃
杯倒扣在蜡烛上,观察此时蜡烛燃烧的
现象
将一根火柴折断,分成火柴头和
火柴梗两部分,放在铜片上,用
酒精灯加热铜片,观察现象
蜡烛的燃烧
火柴各部分的燃烧
实验
现象
蜡烛在空气中安静燃烧,在倒扣的玻璃
杯内燃烧一会儿后熄灭
火柴头加热一会儿后就开始燃烧,
火柴梗加热较长时间后才开始燃烧
现象
分析
空气中有充足的氧气,蜡烛能持续燃烧;
玻璃杯内氧气逐渐被消耗,蜡烛因为没
有氧气而熄灭
燃烧需要一定的温度,火柴头燃
烧需要的温度较低,火柴梗燃烧
需要的温度较高
实验
结论
燃烧的条件之一是需要充足的氧气(或
助燃剂)
燃烧的条件之一是温度达到可燃
物燃烧需要的最低温度
续表
3.着火点:物质燃烧所需达到的最低温度叫着火点。
通常状况下一些常见物质的着火点
物质
白磷
红磷
木材
木炭
无烟煤
着火点/℃40
240
250?330
320?370
700?750
物质
白磷
红磷
木材
木炭
无烟煤
40
240
着火点低,保存在水中
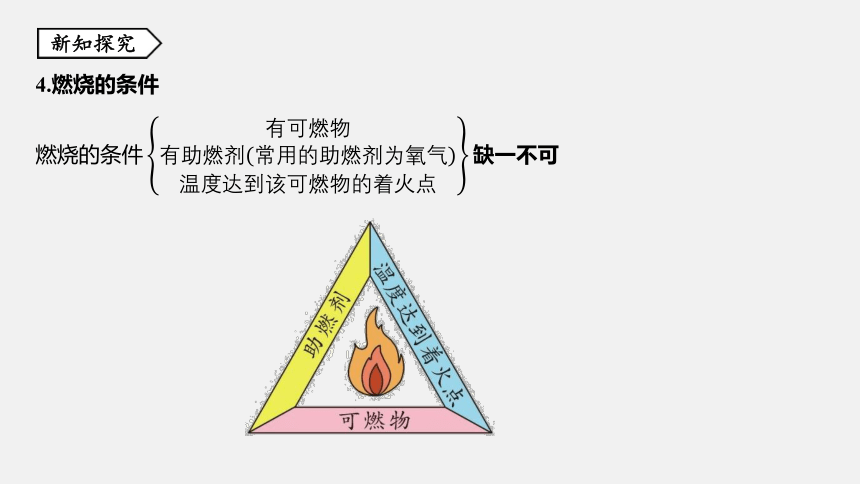
4.燃烧的条件
燃烧的条件&有可燃物&有助燃剂(常用的助燃剂为氧气)&温度达到该可燃物的着火点 缺一不可&1&
?
拓展培优
使可燃物燃烧更旺的措施
(1)增大氧气的浓度。如铁丝在空气中不能燃烧,在氧气中剧烈燃烧;烧锅炉时向
炉膛中鼓气等。
(2)增大可燃物与空气(或氧气)的接触面积。如将煤块粉碎或将“煤球”制成“蜂
窝煤”等。
5.自燃
(1)概念:物质在缓慢氧化过程中产生的热量如果不能及时散失,就会使温度逐渐
升高,达到着火点时,如果同时有足量的空气,不经点火,物质也会自发地燃烧起
来。这种由缓慢氧化而引起的自发燃烧叫自燃。
(2)常见的自燃:一些着火点较低的可燃物,如粮食、麦秆、煤炭、擦拭机器的棉
纱等,如果堆放不合理、空气不流通,就会引起自燃,引发火灾。
6.爆炸
(1)概念:如果燃烧以极快的速度在有限的空间里发生,瞬间累积大量的热,使气
体体积急剧地膨胀,就会引起爆炸。
(2)分类
化学爆炸
有新物质生成,属于化学变化,如矿井中的瓦斯爆炸,氢气和氧气
混合后点燃爆炸
物理爆炸
没有新物质生成,属于物理变化,如车胎爆炸、高压锅爆炸
(3)危害与利用:爆炸会给人类造成严重的生命和财产损失,但合理利用也能为人
类服务,如利用爆炸产生的巨大能量开矿采煤、开山炸石、拆除危旧建筑物等。
归纳总结
燃烧、爆炸、缓慢氧化和自燃的关系
典例2 为了研究可燃物的燃烧条件,某兴趣小组用如图所示的装置进行了实验(白
磷、红磷均不超过绿豆大小,锥形瓶中的白磷A与红磷C尽量拉开距离)。已知白磷
的着火点为40℃ ,红磷的着火点为 240℃ 。
?
(1)锥形瓶中发生的实验现象有________________________
_________________________。
白磷A燃烧,产生白烟,放出热量,温度计的示数上升
(2)通过比较_______和_______能说明物质的燃烧需要氧气。
白磷A
白磷B
(3)烧杯中70℃ 热水的作用是_________________、______
___________________。
?
使白磷B隔绝氧气
使白磷A的温度达到着火点
[解析]
.&2& .
知识点3 灭火与火灾自救 重点
1.灭火原理:破坏燃烧的条件之一
2.灭火的方法
方法
举例
原理
冷却法
用水灭火;吹灭蜡烛;油锅着火倒入大量青菜
降低温度
“窒息”法
用灯帽盖灭酒精灯;油锅着火,盖上锅盖或用湿
棉被盖灭;实验台上酒精灯着火用湿抹布盖灭
隔绝氧气(或
空气)
隔离法
森林着火开辟隔离带;关闭煤气灶阀门
移走可燃物
注意:
(1)一般火灾可用水扑灭,是利用水降低温度,从而使温度达不到可燃物的着火点。
(2)油库着火时不能用水灭火,因为油的密度比水的小,油会浮在水面上造成火势
蔓延,应用干粉灭火器灭火或用沙土盖灭。
(3)当电器或电线着火时,应先切断电源,再用干粉灭火器或沙子灭火,不能用水灭火。
3.几种常见的灭火器(含教材第84页思考与讨论(下)答案)
灭火器
使用方法
灭火原理
适用范围
泡沫灭
火器
(1)取下喷射软管,拔掉保险销;
(2)压下压把,对准火焰根部喷射
产生的泡沫喷射到燃料表面,
泡沫层析出的水在燃料表面
形成一层水膜,隔绝氧气
(或空气)
扑灭非水溶性可燃性
液体,如汽油、柴油
等,以及固体材料,
如木材、棉布等引起
的失火
干粉灭
火器
(1)上下摇动灭火器几次,拔出保险销;
(2)距火约3米处,对准火焰根部;
(3)压下压把,扫射
利用压缩的二氧化碳吹出干粉
(主要含有碳酸氢钠或磷酸铵
盐),隔绝氧气(或空气)
扑灭一般失火以及油、
气等燃烧引起的失火
二氧化碳灭火器
(1)拉出保险销;
(2)按下压把(注意:手一定要先握在钢瓶的木柄上,防止冻伤)
灭火时将瓶内的液态二氧化
碳喷出,有降温和隔绝氧气
(或空气)的作用
扑灭图书、档案、贵
重设备、精密仪器等
物品的失火
干粉灭火器
4.火灾自救的措施
在自然界里,剧烈氧化和缓慢氧化都可能导致火灾。
(1)发生火灾时,要保持镇定,先了解火源的准确位置,然后拨打“119”报警求助。如
果火势扩散,应尽快通知家人和邻居设法离开现场,沿途要关上大门,以减低火势及烟
雾蔓延的速度,同时切勿乘电梯或升降机,以免停电被困。
(2)如果无法离开火灾现场,应采取下列措施:室内浓烟密布时,应俯伏在地上爬行
并用湿毛巾掩盖口鼻;用湿毛巾等物品塞住门和窗户的缝隙,以免浓烟渗入;或打开窗
户,在窗前呼救等。
科学与文学
成语中蕴藏的科学知识
煽风点火、风助火威:为可燃物提供充足的氧气(或空气)。
火上浇油、抱薪救火:增加可燃物。
钻木取火:使温度达到可燃物的着火点。
釜底抽薪:清除可燃物灭火。
杯水车薪:水太少了,不能使温度降至可燃物的着火点以下,无法灭火。
典例3 阻燃剂氢氧化铝受热分解时吸收热量,同时生成耐高温的氧化铝和水蒸气,
起到防火作用。下列关于该阻燃剂防火原因的叙述错误的是( )
A.反应吸热,降低了可燃物的着火点
B.生成的氧化铝覆盖在可燃物表面,隔绝空气
C.生成大量水蒸气,降低可燃物周围氧气浓度
D.反应吸热,使周围环境温度降低
A
[解析] 着火点是可燃物的固有属性,外界条件不会改变可燃物的着火点,但能改变
周围环境的温度,使温度降低到可燃物的着火点以下,A错误。
知识点4 化学反应中能量的变化
1.教材第85页活动:探究两种化学反应的能量变化
镁条与稀盐酸反应
氢氧化钡与氯化铵反应
实验步骤
将一段镁条放入试管中,
加入少量稀盐酸,用手触摸试管外壁
用研钵将约20?g 氢氧化钡晶体磨成粉末,倒入一小烧杯中。在一玻璃片上洒上少量水,并将小烧杯放在玻璃片上。再向小烧杯中加入约 10?g 氯化铵晶体,用玻璃棒迅速搅拌后静止片刻,提起小烧杯,观察现象
实验现象
试管内有气泡生成,用手触摸试管外壁感觉发烫
玻璃片粘在小烧杯底部
现象分析
镁与稀盐酸反应放热,反应后容器温度升高
氢氧化钡晶体与氯化铵晶体反应吸热,反应后容器温度下降,水凝固成冰
镁条与稀盐酸反应
氢氧化钡与氯化铵反应
实验步骤
将一段镁条放入试管中,
加入少量稀盐酸,用手触摸试管外壁
实验现象
试管内有气泡生成,用手触摸试管外壁感觉发烫
玻璃片粘在小烧杯底部
现象分析
镁与稀盐酸反应放热,反应后容器温度升高
氢氧化钡晶体与氯化铵晶体反应吸热,反应后容器温度下降,水凝固成冰
镁条与稀盐酸反应
氢氧化钡与氯化铵反应
2.化学反应类型
化学反应在生成新物质的同时,伴有能量的变化,而能量的变化通常表现为吸收或
放出热量。
放热反应
燃料的燃烧,生石灰与水结合生成氢氧化钙,镁与稀盐酸反应等
吸热反应
氢氧化钡晶体与氯化铵晶体反应,碳与二氧化碳在高温条件下生成
一氧化碳等
3.化学能与其他形式的能量之间的相互转化
化学反应中的能量通常表现为热、光、电等。不同的化学反应能量变化的大小是不
同的,有些化学反应的能量变化非常细微,只有用灵敏的仪器才能检测到,有的能
量变化则非常明显。
现象
. .
天然气燃烧喷出火焰
.
.
烟花燃放
. .
用铜片和锌片制作原电池
. .
蓄电池放电
能量转化
化学能→热能
化学能→光能
化学能→电能
化学能→电能
典例4 伏打电堆的结构如图所示,它用圆形的锌板、铜板间隔堆积而
成,所有的圆板之间夹放几层盐水泡过的布。关于伏打电堆中能量的
转化形式,下列说法正确的是( )
A
A.化学能转化为电能 B.电能转化为热能
C.电能转化为化学能 D.太阳能转化为电能
[解析] 伏打电池工作时,将化学能转化为电能。
题型1 对氧化反应的理解★★★
?
典例5 下列关于氧化反应的叙述正确的是( )
A.只有物质跟氧气的反应才属于氧化反应
B.氧化反应的反应物中一定有氧气
C.有氧气参加的化合反应一定是氧化反应
D.氧化反应一定有发光、发热的现象发生
C
[解析] 氧化反应是指物质与氧发生的化学反应,其中的“氧”不单指氧气,还可以是
含氧化合物中的氧,故A、B均错误;有些氧化反应比较缓慢,没有发光现象,如铁
生锈,故D错误。
易错警示
氧化反应≠氧气跟物质的反应
氧气与物质的反应只是氧化反应中的一种形式,化合物里的氧跟物质所起的一些化
学反应也是氧化反应。
题型2 燃烧条件的应用★★★
?
典例6 科学老师在课堂上演示了一个有趣的实验——烧不坏的手帕。将一块棉布手
帕浸泡在质量分数约为70% 的酒精中,将手帕取出后稍微拧一下,舒展开,用坩埚
钳夹住一角,在酒精灯上点燃,再挥动手帕,可以看到手帕上的火焰熄灭后,手帕
完好无损。同学们对此进行了热烈的讨论,下列对这一现象的解释正确的是( )
A.这是魔术,你所看到的是一种假象
B.火焰的温度低于棉布的着火点
C.酒精燃烧后使棉布的着火点升高
D.手帕上的水和酒精汽化吸热,使手帕的温度低于棉布的着火点
?
D
[解析] 可燃物的着火点一般是不变的,火焰的温度要高于棉布的着火点,故B、C均
错误。
审题技巧
手帕不燃烧说明手帕没有完全满足燃烧的三个条件,从条件入手分析即可。
第2节 氧化和燃烧
学习目标
1.了解氧化反应的概念,知道剧烈氧化和缓慢氧化的过程。
2.了解燃烧的概念,知道燃烧的条件,了解灭火的原理和防火的措施。
3.知道爆炸、缓慢氧化、自燃、燃烧的区别和联系。
4.知道在化学反应过程中伴随能量的变化。
知识点1 氧化反应
1.概念:物质跟氧发生的反应叫做氧化反应。
注意 (1)氧化反应不属于化学反应的基本类型。
(2)氧化反应中的“氧”并不只是氧气,还可以是含氧化合物中的氧。
苹果切开后放一会儿会变色
锈迹斑斑的铁
2.分类
?
缓慢氧化
剧烈氧化
概念
进行得很慢,甚至在短期内不易察觉的
氧化反应
像燃烧那样反应剧烈的氧化反应
举例
塑料和橡胶制品的老化、苹果变色、呼
吸作用、金属的锈蚀
硫、铁等物质的燃烧、爆炸
区别
现象不同,反应的剧烈程度不同,反应条件不同
联系
都是氧化反应;都放出热量
典例1 生活中发生缓慢氧化的事例很多,下列过程不涉及缓慢氧化的是( )
A.酒和醋的酿造 B.人在长跑时急促呼吸
C.农家肥的腐熟 D.酒精灯安静地燃烧
D
[解析] 酒和醋的酿造、农家肥的腐熟、人的呼吸作用都属于进行得比较缓慢的氧化
反应;燃烧属于剧烈的氧化反应。
知识点2 燃烧的条件 重点
拓展培优
燃烧不一定有氧气参加
广义的燃烧指的是所有的发光、放热的剧烈的化学反应。如镁条可以在二氧化碳中燃烧,氢
气可以在氯气中燃烧等。
2.探究燃烧的条件(含教材第82页活动答案)
蜡烛的燃烧
火柴各部分的燃烧
实验
装置
. .
. .
实验
步骤
点燃一支蜡烛,观察它在空气中燃烧的
现象。然后将一个杯口涂凡士林的玻璃
杯倒扣在蜡烛上,观察此时蜡烛燃烧的
现象
将一根火柴折断,分成火柴头和
火柴梗两部分,放在铜片上,用
酒精灯加热铜片,观察现象
蜡烛的燃烧
火柴各部分的燃烧
实验
现象
蜡烛在空气中安静燃烧,在倒扣的玻璃
杯内燃烧一会儿后熄灭
火柴头加热一会儿后就开始燃烧,
火柴梗加热较长时间后才开始燃烧
现象
分析
空气中有充足的氧气,蜡烛能持续燃烧;
玻璃杯内氧气逐渐被消耗,蜡烛因为没
有氧气而熄灭
燃烧需要一定的温度,火柴头燃
烧需要的温度较低,火柴梗燃烧
需要的温度较高
实验
结论
燃烧的条件之一是需要充足的氧气(或
助燃剂)
燃烧的条件之一是温度达到可燃
物燃烧需要的最低温度
续表
3.着火点:物质燃烧所需达到的最低温度叫着火点。
通常状况下一些常见物质的着火点
物质
白磷
红磷
木材
木炭
无烟煤
着火点/℃40
240
物质
白磷
红磷
木材
木炭
无烟煤
40
240
着火点低,保存在水中
4.燃烧的条件
燃烧的条件
?
拓展培优
使可燃物燃烧更旺的措施
(1)增大氧气的浓度。如铁丝在空气中不能燃烧,在氧气中剧烈燃烧;烧锅炉时向
炉膛中鼓气等。
(2)增大可燃物与空气(或氧气)的接触面积。如将煤块粉碎或将“煤球”制成“蜂
窝煤”等。
5.自燃
(1)概念:物质在缓慢氧化过程中产生的热量如果不能及时散失,就会使温度逐渐
升高,达到着火点时,如果同时有足量的空气,不经点火,物质也会自发地燃烧起
来。这种由缓慢氧化而引起的自发燃烧叫自燃。
(2)常见的自燃:一些着火点较低的可燃物,如粮食、麦秆、煤炭、擦拭机器的棉
纱等,如果堆放不合理、空气不流通,就会引起自燃,引发火灾。
6.爆炸
(1)概念:如果燃烧以极快的速度在有限的空间里发生,瞬间累积大量的热,使气
体体积急剧地膨胀,就会引起爆炸。
(2)分类
化学爆炸
有新物质生成,属于化学变化,如矿井中的瓦斯爆炸,氢气和氧气
混合后点燃爆炸
物理爆炸
没有新物质生成,属于物理变化,如车胎爆炸、高压锅爆炸
(3)危害与利用:爆炸会给人类造成严重的生命和财产损失,但合理利用也能为人
类服务,如利用爆炸产生的巨大能量开矿采煤、开山炸石、拆除危旧建筑物等。
归纳总结
燃烧、爆炸、缓慢氧化和自燃的关系
典例2 为了研究可燃物的燃烧条件,某兴趣小组用如图所示的装置进行了实验(白
磷、红磷均不超过绿豆大小,锥形瓶中的白磷A与红磷C尽量拉开距离)。已知白磷
的着火点为
?
(1)锥形瓶中发生的实验现象有________________________
_________________________。
白磷A燃烧,产生白烟,放出热量,温度计的示数上升
(2)通过比较_______和_______能说明物质的燃烧需要氧气。
白磷A
白磷B
(3)烧杯中
___________________。
?
使白磷B隔绝氧气
使白磷A的温度达到着火点
[解析]
.&2& .
知识点3 灭火与火灾自救 重点
1.灭火原理:破坏燃烧的条件之一
2.灭火的方法
方法
举例
原理
冷却法
用水灭火;吹灭蜡烛;油锅着火倒入大量青菜
降低温度
“窒息”法
用灯帽盖灭酒精灯;油锅着火,盖上锅盖或用湿
棉被盖灭;实验台上酒精灯着火用湿抹布盖灭
隔绝氧气(或
空气)
隔离法
森林着火开辟隔离带;关闭煤气灶阀门
移走可燃物
注意:
(1)一般火灾可用水扑灭,是利用水降低温度,从而使温度达不到可燃物的着火点。
(2)油库着火时不能用水灭火,因为油的密度比水的小,油会浮在水面上造成火势
蔓延,应用干粉灭火器灭火或用沙土盖灭。
(3)当电器或电线着火时,应先切断电源,再用干粉灭火器或沙子灭火,不能用水灭火。
3.几种常见的灭火器(含教材第84页思考与讨论(下)答案)
灭火器
使用方法
灭火原理
适用范围
泡沫灭
火器
(1)取下喷射软管,拔掉保险销;
(2)压下压把,对准火焰根部喷射
产生的泡沫喷射到燃料表面,
泡沫层析出的水在燃料表面
形成一层水膜,隔绝氧气
(或空气)
扑灭非水溶性可燃性
液体,如汽油、柴油
等,以及固体材料,
如木材、棉布等引起
的失火
干粉灭
火器
(1)上下摇动灭火器几次,拔出保险销;
(2)距火约3米处,对准火焰根部;
(3)压下压把,扫射
利用压缩的二氧化碳吹出干粉
(主要含有碳酸氢钠或磷酸铵
盐),隔绝氧气(或空气)
扑灭一般失火以及油、
气等燃烧引起的失火
二氧化碳灭火器
(1)拉出保险销;
(2)按下压把(注意:手一定要先握在钢瓶的木柄上,防止冻伤)
灭火时将瓶内的液态二氧化
碳喷出,有降温和隔绝氧气
(或空气)的作用
扑灭图书、档案、贵
重设备、精密仪器等
物品的失火
干粉灭火器
4.火灾自救的措施
在自然界里,剧烈氧化和缓慢氧化都可能导致火灾。
(1)发生火灾时,要保持镇定,先了解火源的准确位置,然后拨打“119”报警求助。如
果火势扩散,应尽快通知家人和邻居设法离开现场,沿途要关上大门,以减低火势及烟
雾蔓延的速度,同时切勿乘电梯或升降机,以免停电被困。
(2)如果无法离开火灾现场,应采取下列措施:室内浓烟密布时,应俯伏在地上爬行
并用湿毛巾掩盖口鼻;用湿毛巾等物品塞住门和窗户的缝隙,以免浓烟渗入;或打开窗
户,在窗前呼救等。
科学与文学
成语中蕴藏的科学知识
煽风点火、风助火威:为可燃物提供充足的氧气(或空气)。
火上浇油、抱薪救火:增加可燃物。
钻木取火:使温度达到可燃物的着火点。
釜底抽薪:清除可燃物灭火。
杯水车薪:水太少了,不能使温度降至可燃物的着火点以下,无法灭火。
典例3 阻燃剂氢氧化铝受热分解时吸收热量,同时生成耐高温的氧化铝和水蒸气,
起到防火作用。下列关于该阻燃剂防火原因的叙述错误的是( )
A.反应吸热,降低了可燃物的着火点
B.生成的氧化铝覆盖在可燃物表面,隔绝空气
C.生成大量水蒸气,降低可燃物周围氧气浓度
D.反应吸热,使周围环境温度降低
A
[解析] 着火点是可燃物的固有属性,外界条件不会改变可燃物的着火点,但能改变
周围环境的温度,使温度降低到可燃物的着火点以下,A错误。
知识点4 化学反应中能量的变化
1.教材第85页活动:探究两种化学反应的能量变化
镁条与稀盐酸反应
氢氧化钡与氯化铵反应
实验步骤
将一段镁条放入试管中,
加入少量稀盐酸,用手触摸试管外壁
用研钵将约
实验现象
试管内有气泡生成,用手触摸试管外壁感觉发烫
玻璃片粘在小烧杯底部
现象分析
镁与稀盐酸反应放热,反应后容器温度升高
氢氧化钡晶体与氯化铵晶体反应吸热,反应后容器温度下降,水凝固成冰
镁条与稀盐酸反应
氢氧化钡与氯化铵反应
实验步骤
将一段镁条放入试管中,
加入少量稀盐酸,用手触摸试管外壁
实验现象
试管内有气泡生成,用手触摸试管外壁感觉发烫
玻璃片粘在小烧杯底部
现象分析
镁与稀盐酸反应放热,反应后容器温度升高
氢氧化钡晶体与氯化铵晶体反应吸热,反应后容器温度下降,水凝固成冰
镁条与稀盐酸反应
氢氧化钡与氯化铵反应
2.化学反应类型
化学反应在生成新物质的同时,伴有能量的变化,而能量的变化通常表现为吸收或
放出热量。
放热反应
燃料的燃烧,生石灰与水结合生成氢氧化钙,镁与稀盐酸反应等
吸热反应
氢氧化钡晶体与氯化铵晶体反应,碳与二氧化碳在高温条件下生成
一氧化碳等
3.化学能与其他形式的能量之间的相互转化
化学反应中的能量通常表现为热、光、电等。不同的化学反应能量变化的大小是不
同的,有些化学反应的能量变化非常细微,只有用灵敏的仪器才能检测到,有的能
量变化则非常明显。
现象
. .
天然气燃烧喷出火焰
.
.
烟花燃放
. .
用铜片和锌片制作原电池
. .
蓄电池放电
能量转化
化学能→热能
化学能→光能
化学能→电能
化学能→电能
典例4 伏打电堆的结构如图所示,它用圆形的锌板、铜板间隔堆积而
成,所有的圆板之间夹放几层盐水泡过的布。关于伏打电堆中能量的
转化形式,下列说法正确的是( )
A
A.化学能转化为电能 B.电能转化为热能
C.电能转化为化学能 D.太阳能转化为电能
[解析] 伏打电池工作时,将化学能转化为电能。
题型1 对氧化反应的理解
?
典例5 下列关于氧化反应的叙述正确的是( )
A.只有物质跟氧气的反应才属于氧化反应
B.氧化反应的反应物中一定有氧气
C.有氧气参加的化合反应一定是氧化反应
D.氧化反应一定有发光、发热的现象发生
C
[解析] 氧化反应是指物质与氧发生的化学反应,其中的“氧”不单指氧气,还可以是
含氧化合物中的氧,故A、B均错误;有些氧化反应比较缓慢,没有发光现象,如铁
生锈,故D错误。
易错警示
氧化反应≠氧气跟物质的反应
氧气与物质的反应只是氧化反应中的一种形式,化合物里的氧跟物质所起的一些化
学反应也是氧化反应。
题型2 燃烧条件的应用
?
典例6 科学老师在课堂上演示了一个有趣的实验——烧不坏的手帕。将一块棉布手
帕浸泡在质量分数约为
钳夹住一角,在酒精灯上点燃,再挥动手帕,可以看到手帕上的火焰熄灭后,手帕
完好无损。同学们对此进行了热烈的讨论,下列对这一现象的解释正确的是( )
A.这是魔术,你所看到的是一种假象
B.火焰的温度低于棉布的着火点
C.酒精燃烧后使棉布的着火点升高
D.手帕上的水和酒精汽化吸热,使手帕的温度低于棉布的着火点
?
D
[解析] 可燃物的着火点一般是不变的,火焰的温度要高于棉布的着火点,故B、C均
错误。
审题技巧
手帕不燃烧说明手帕没有完全满足燃烧的三个条件,从条件入手分析即可。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
