第4节 二氧化碳 同步练习(34张ppt)
文档属性
| 名称 | 第4节 二氧化碳 同步练习(34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-03 18:48:16 | ||
图片预览









文档简介
第3章 空气与生命
第4节 二氧化碳
学习目标
1.认识二氧化碳的主要物理性质和化学性质,能通过二氧化碳的性质理解二氧化碳
的用途。
2.进一步学习用实验来探究物质性质及其变化的科
学方法。通过观察和分析实验现象,培养观察能力和综合分析能力。
3.初步学习在实验室制取二氧化碳。
知识点1 自然界中的二氧化碳
1.二氧化碳的构成和组成
(1)二氧化碳气体是由大量二氧化碳分子构成的,其化学式为CO2 。
?
(2)每个二氧化碳分子由1个碳原子和2个氧原子构成。
(3)二氧化碳由碳元素和氧元素组成,其中碳元素的化合价为+4 价。
?
CO?分子结构模型
2.二氧化碳对人体健康的影响
CO2 本身没有毒性,但 CO2 不能供给呼吸,当空气中的 CO2 含量超过正常含量时,
会对人体产生危害。
?
???????????? 对人体健康的影响
?
空气中???????????? 的体积分数
对人体的影响
1%
感到气闷、头晕、心悸
4%?5%
感到气闷、头痛、眩晕
10% 以上
使人神志不清、呼吸停止,以致死亡
对人体的影响
感到气闷、头晕、心悸
感到气闷、头痛、眩晕
使人神志不清、呼吸停止,以致死亡
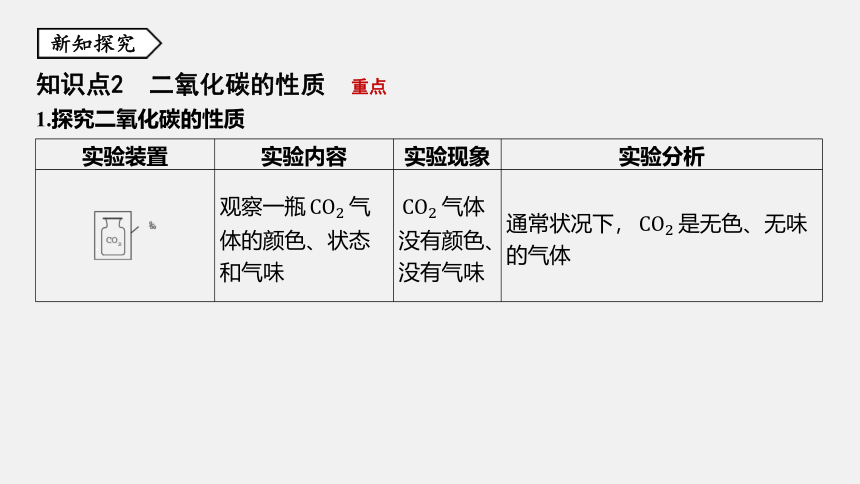
知识点2 二氧化碳的性质 重点
1.探究二氧化碳的性质
实验装置
实验内容
实验现象
实验分析
. .
观察一瓶CO2 气
体的颜色、状态
和气味
CO2 气体
没有颜色、
没有气味
通常状况下,CO2 是无色、无味
的气体
实验装置
实验内容
实验现象
实验分析
. .
实验装置
实验内容
实验现象
实验分析
. .
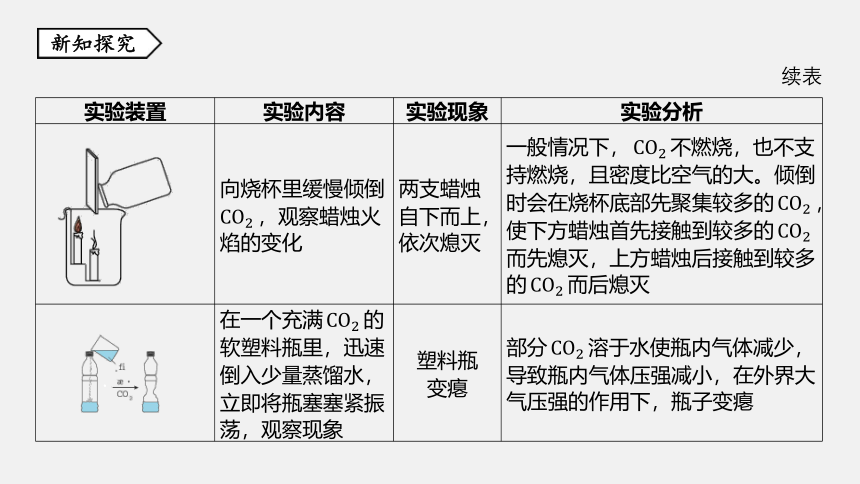
向烧杯里缓慢倾倒
CO2 ,观察蜡烛火
焰的变化
两支蜡烛
自下而上,
依次熄灭
一般情况下,CO2 不燃烧,也不支
持燃烧,且密度比空气的大。倾倒
时会在烧杯底部先聚集较多的CO2 ,
使下方蜡烛首先接触到较多的CO2
而先熄灭,上方蜡烛后接触到较多
的CO2 而后熄灭
. .
在一个充满CO2 的
软塑料瓶里,迅速
倒入少量蒸馏水,
立即将瓶塞塞紧振
荡,观察现象
塑料瓶
变瘪
部分CO2 溶于水使瓶内气体减少,
导致瓶内气体压强减小,在外界大
气压强的作用下,瓶子变瘪
实验装置
实验内容
实验现象
实验分析
. .
两支蜡烛
自下而上,
依次熄灭
. .
塑料瓶
变瘪
续表
2.二氧化碳的物理性质
(1)通常状况下,CO2 有如下物理性质:
?
状态
颜色
气味
密度(与空气相比)
溶解性
气态
无色
无味
比空气的大
能溶于水
说明 ①CO2 的密度大约是空气密度的1.5倍,因此能像倒液体那样从一个容器向另一个
容器倾倒。②通常1体积水中能溶解1体积的CO2 ,增大压强可使其溶解得更多。
?
(2)在加压降温的情况下,CO2 能变成无色液体,甚至变成雪状固体。通常把固体
CO2 叫做“干冰”,干冰易升华吸热。
?
3.二氧化碳的化学性质
实验1
实验2
实验步骤
. .
用酒精灯加热颜色呈红色
的那支试管,观察液体颜
色的变化
实验现象
滴入蒸馏水中的紫色石蕊试液不变色,滴入
变扁瓶中液体的紫色石蕊试液变红色
红色的石蕊试液重新变为
紫色
现象解释
CO2 与水反应生成了一种酸性物质——碳酸,
碳酸能使紫色石蕊试液变成红色
碳酸很不稳定,受热易分解
化学方
程式
CO2+H2O????????????H2CO3
H2CO3????△?????H2O+CO2↑
实验1
实验2
实验步骤
. .
用酒精灯加热颜色呈红色
的那支试管,观察液体颜
色的变化
实验现象
滴入蒸馏水中的紫色石蕊试液不变色,滴入
变扁瓶中液体的紫色石蕊试液变红色
红色的石蕊试液重新变为
紫色
现象解释
碳酸很不稳定,受热易分解
化学方
程式
(1)二氧化碳与水的反应
(2)二氧化碳与澄清石灰水反应
实验操作
把CO2 通入澄清石灰水[ Ca(OH)2 水溶液]中
实验现象
生成白色沉淀,澄清石灰水变浑浊
现象分析
. .
化学方程式
CO2+Ca(OH)2????????????CaCO3↓+H2O
实验操作
实验现象
生成白色沉淀,澄清石灰水变浑浊
现象分析
. .
化学方程式
示例
用熟石灰[Ca(OH)2] 抹墙,墙璧会变白变硬;长期存放石灰水的试剂瓶、瓶壁有白
色固休、石灰水表面有一层白膜;鸡蛋放入石灰水中可以保存较长时间,这些都
是因为Ca(OH)2 ,与 CO2 ,反应生成了 CaCO3 ,沉淀
示例
归纳总结
二氧化碳的化学性质
(1)一般情况下,二氧化碳不燃烧,也不支持燃烧,不能供给呼吸。
(2)二氧化碳能与水反应生成碳酸:????????????+???????????????????????????????????????????? 。
?
(3)二氧化碳能使澄清石灰水变浑浊:????????????+????????(????????)????????????????????????????????????↓+ ???????????? 。
?
二氧化碳能使澄清石灰水变浑浊,故可用澄清石灰水检验二氧化碳
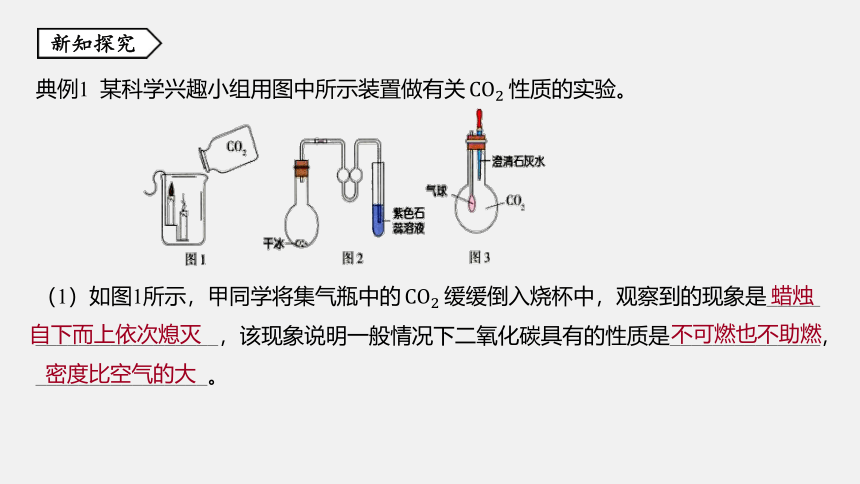
典例1 某科学兴趣小组用图中所示装置做有关CO2 性质的实验。
?
(1)如图1所示,甲同学将集气瓶中的CO2 缓缓倒入烧杯中,观察到的现象是_____
_________________,该现象说明一般情况下二氧化碳具有的性质是______________,________________。
?
蜡烛自下而上依次熄灭
不可燃也不助燃
密度比空气的大
(2)乙同学在常温下进行如图2所示的实验时,观察到烧瓶中固体逐渐减少,此过
程发生的是______ (选填“物理”或“化学”)变化;试管中有气泡产生,溶液颜色由
紫色变为______。
物理
红色
[解析] 烧瓶中固体逐渐减少是因为干冰升华了,此过程中没有新物质生成,属于物
理变化;试管中二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊试液变红。
(3)丙同学挤压图3装置中滴管的胶头,使其中液体滴入烧瓶,振荡烧瓶,可以观
察到的现象是____________________________,产生这一现象的原因是___________
_________________________________________________________________________
_____________________________。
烧瓶内溶液变浑浊,气球胀大
CO2 与 Ca
(OH)2 反应生成难溶于水的 CaCO3 ,使澄清石灰水变浑浊,同时烧瓶内气压减小,在外界大气压的作用下,气球胀大
?
知识点3 二氧化碳的制取 重难点
1.药品的选择
药品
现象
稀盐酸与块状大理石
反应速率适中,便于气体收集,且原料廉
价易得
产生气泡,速率适中
浓盐酸与块状大理石
剧烈反应,迅速产生大量气泡,并伴有白雾
稀硫酸与块状大理石
刚开始时产生气泡,后来速率减慢并逐渐
停止
稀盐酸与碳酸钠粉末(或纯碳酸钙)
剧烈反应,迅速产生大量气泡
通过上述对比分析可知,实验室制取二氧化碳的药品宜选用稀盐酸和大理石(或石灰石,
主要成分都是碳酸钙)。
稀硫酸与碳酸钙反应生成微溶于水的硫酸钙,覆盖在大理石的表面,阻止反应继续进行,不适合用来制取CO2
?
碳酸钠粉末与稀盐酸反应速率过快,产生的气体不便于收集,不适合用于实验室制取CO2
?
浓盐酸与大理石反应速率过快,且浓盐酸有挥发性,会使制得的CO2 中混有 HCl 气体,不适合用来制取 CO2
?
3.实验装置
发生装置
收集装置
选择依据
固体和液体反应,不需要加热
CO2 密度比空气的大,能溶于水
装置类型
. .
固液常温型
. .
向上排空气法
发生装置
收集装置
选择依据
固体和液体反应,不需要加热
装置类型
. .
固液常温型
. .
向上排空气法
2.反应原理:????????????????????+????????????????=????????????????????+????????????↑+????????????
?
4.实验步骤→ 谐音记为“茶庄莫收盐”
?
拓展培优
二氧化碳的工业制法
高温煅烧石灰石生成氧化钙(俗称生石灰)和二氧化碳,反应的化学方程式为
CaCO3?高温??CaO+CO2↑ 。
?
特别提醒
实验注意事项
5.二氧化碳的检验、验满与存放
用品或放置方法
方法或注意事项
检验
澄清石灰水
将被检验的气体通入澄清石灰水中,如果澄清石灰水变
浑浊,证明该气体为二氧化碳,否则不是
验满
燃着的木条
将燃着的木条放在收集二氧化碳的集气瓶口,如果木条
熄灭,证明已收集满,否则未满
存放
正放在桌面上
收集满二氧化碳的集气瓶要用玻璃片(毛面向下)盖住
验满二氧化碳
检验二氧化碳
拓展
???????????? 的净化
制取的CO2 中混有少量 HCl 气体(盐酸能挥发出 HCl 气体)和水蒸气,因此要除杂,
除杂时,先除HCl ,后干燥。
?
家庭小实验
食醋与碱面反应生成的气体是什么?
取一个玻璃杯,放入一些碱面,然后加入一些食醋(含醋酸),立即用蘸有澄清石
灰水(澄清石灰水可用食品包装袋内的干燥剂生石灰加水制得)的玻璃片盖住。观
察到澄清石灰水变浑浊,说明有二氧化碳生成。
典例2 如图是实验室制取气体常用的装置图,请结合下列装置图回答问题。
(1)装置图中标号a 的仪器名称为________。
?
集气瓶
(2)实验室制取二氧化碳时,发生反应的化学方程式为___________________________________,可选
用的发生装置是___(选填字母,下同),可选用的收集装置是___。
CaCO3+2HCl????????????CaCl2+H2O+CO2↑
?
B
D
(3)下列为制取二氧化碳的操作:①检查装置气密性;②组装装置;③向分液漏斗
中注入稀盐酸;④加入小块大理石;⑤收集气体。正确的顺序是____________。
②①④③⑤
知识点4 二氧化碳的应用
???????????? 的性质
???????????? 的用途
能溶于水(物理性质)
生产汽水等碳酸饮料
干冰(固态CO2 )升华吸热(物理性质)
作为制冷剂,用于人工降雨,制造
舞台云雾效果等
一般情况下,不燃烧,也不支持燃烧(化学性质),
密度比空气的大(物理性质)
用来灭火
参与植物光合作用(化学性质),二氧化碳+水
?光叶绿体? 葡萄糖+氧气
作为气体肥料,提高光合作用的强
度和效率
能用CO2 、 H2O 、 NaCl 等生产纯碱 (Na2CO3) (化
学性质)
作为化工产品的原料
能溶于水(物理性质)
生产汽水等碳酸饮料
作为制冷剂,用于人工降雨,制造
舞台云雾效果等
一般情况下,不燃烧,也不支持燃烧(化学性质),
密度比空气的大(物理性质)
用来灭火
作为气体肥料,提高光合作用的强
度和效率
作为化工产品的原料
典例3 二氧化碳的下列用途没有利用其化学性质的是( )
A.干冰用于人工降雨
B.二氧化碳用于灭火
C.二氧化碳作为气体肥料
D.二氧化碳用于制纯碱
A
[解析] 干冰用于人工降雨,利用了干冰升华时吸热的性质,属于物理性质。
题型1 二氧化碳的性质★★★
?
典例4 以下两个实验可用于验证CO2 的某些性质。
?
(1)甲实验中观察到溶液颜色的变化是___(选填序号)。
B
H2CO3
?
[解析] 二氧化碳和水反应生成碳酸(H2CO3) ,碳酸能使紫色石蕊试液变红;碳酸不
稳定,受热易分解,加热后溶液又变为紫色。
?
A.紫色→红色→无色
B.紫色→红色→紫色
C.红色→紫色→紫色
该实验中使石蕊试液变红的物质是_______(填化学式)。
(2)乙实验中观察到②③不变红,④比①先变红,由此能得到CO2 的性质有_____
(选填序号,双选)。
A.CO2 不能供给呼吸
B.CO2 不能与石蕊试液反应
C.CO2 的密度比空气的大
D.CO2 能与 H2O 反应
?
CD
[解析] 湿润的紫色石蕊棉球中含有水,二氧化碳和水反应生成碳酸,碳酸使湿润的
紫色石蕊棉球变红,下面的棉球④先变红,是因为二氧化碳的密度比空气的大。
(3)乙装置简单改进后还可同时证明CO2 不能燃烧也不能支持燃烧,改进方法是
__________________________。
?
在支管口处放一燃着的木条
[解析] 将燃着的木条放在支管口处,观察到木条熄灭,即可证明二氧化碳不能燃烧
也不能支持燃烧。
易错警示
误认为???????????? 能使紫色石蕊试液变红
酸性物质能使紫色石蕊试液变红,将CO2 气体通入紫色石蕊试液中,石蕊试液变红,
是因为CO2 与石蕊试液中的水发生反应生成了碳酸,碳酸呈酸性,使紫色石蕊试液变红。
?
题型2 制取二氧化碳的实验装置★★★
?
典例5 如图甲是某小组同学组装的实验室制取二氧化碳气体的发生装置,该装置的优点是____________________________;为了解装置具有该优点的原因,
可随时控制反应的发生和停止
BC
A.ab 段试管中液面逐渐上升
B.bc 段石灰石与稀盐酸脱离接触
C.c 点的对应操作是打开弹簧夹
?
他们在甲装置中连接压强传感器(如图乙所示),从而测定实验过
程中试管内气体压强变化的情况(结果如图丙所示)。下列说法正确的是_____(选填
序号,双选)。
[解析] 夹紧弹簧夹时,随着反应的发生,生成的气体增多,试管内压强增大,试管
内的稀盐酸被压入长颈漏斗中,待稀盐酸和多孔塑料片上的石灰石分开,反应停止,
再打开弹簧夹,试管内气体排出,压强减小,稀盐酸重新从长颈漏斗流入试管中,
试管内液面升高,石灰石与稀盐酸接触,反应再次发生,所以该装置的优点是可随
时控制反应的发生和停止。a 点时夹紧弹簧夹,稀盐酸与石灰石依然接触,随着生
成CO2 气体的增多,试管内压强增大( ab 段),试管中的稀盐酸逐渐被压入长颈漏
斗中,试管中液面逐渐降低,直至石灰石和稀盐酸脱离接触(b 点),不再有气体
产生,试管中的压强不变(bc 段); c 点时打开弹簧夹,试管中的气体通过导管排
出,试管内压强减小,直至与a 点时压强相同。
?
题型3 实验室制取气体的综合★★★★
?
典例6 根据下列装置,结合所学科学知识回答下列问题。
(1)写出仪器①的名称:________。
锥形瓶
(2)实验室选择装置A用高锰酸钾制取氧气时,你认为装置A存在的问题是_______
_______________,选择收集装置应依据氧气的______________,该反应的化学方程
式是_ ________________________________。
试管口没有放一团棉花
密度和溶解性
2KMnO4????△?????K2MnO4+MnO2+O2↑
?
[解析] 加热高锰酸钾时,为了防止加热时试管内的粉末状物质进入导管,试管口要
放一团棉花;选择收集装置应依据氧气的密度和溶解性。
(3)实验室可以选择装置______________(选填序号)制取并收集CO2 ,发生反应
的化学方程式是___________________________________,验满的方法是__________
_________________________________________________________________________
_______________________________________。
?
BC (或 BF )
?
CaCO3+2HCl????????????CaCl2+H2O+CO2↑
?
将燃着的木条放在装置C的集气瓶口,若木条熄灭,证明已收集满(或将燃着的木条放在装置F 的 b 口,若木条熄灭,证明已收集满)
?
[解析] 实验室用大理石(或石灰石)和稀盐酸在常温下反应制取CO2 ,应选择装置
B作为气体发生装置;二氧化碳能溶于水,密度比空气的大,应用向上排空气法收集,
即选择装置C(或装置F )收集。
?
(4)通常情况下,SO2 是一种无色、有刺激性气味的气体,密度比空气的大,易溶
于水。实验室里,用亚硫酸钠固体和较浓的硫酸溶液在常温下反应制取SO2 。实验
室制取SO2 选择的发生装置是___(选填序号),若选择装置 F 收集 SO2 ,气体应该
从__(选填“a ”或“ b ”)口进入。
?
B
a
?
[解析] 实验室用亚硫酸钠固体和较浓的硫酸溶液在常温下反应制取SO2 时,反应物
为固体和液体,不需要加热,应选择装置B作为气体发生装置;因为二氧化硫的密度
比空气的大,若选择装置F 收集 SO2 ,进气导管应接近集气瓶底部,以便排尽瓶内
空气,即从a 口进入。
第4节 二氧化碳
学习目标
1.认识二氧化碳的主要物理性质和化学性质,能通过二氧化碳的性质理解二氧化碳
的用途。
2.进一步学习用实验来探究物质性质及其变化的科
学方法。通过观察和分析实验现象,培养观察能力和综合分析能力。
3.初步学习在实验室制取二氧化碳。
知识点1 自然界中的二氧化碳
1.二氧化碳的构成和组成
(1)二氧化碳气体是由大量二氧化碳分子构成的,其化学式为
?
(2)每个二氧化碳分子由1个碳原子和2个氧原子构成。
(3)二氧化碳由碳元素和氧元素组成,其中碳元素的化合价为
?
CO?分子结构模型
2.二氧化碳对人体健康的影响
会对人体产生危害。
?
?
空气中
对人体的影响
感到气闷、头晕、心悸
感到气闷、头痛、眩晕
使人神志不清、呼吸停止,以致死亡
对人体的影响
感到气闷、头晕、心悸
感到气闷、头痛、眩晕
使人神志不清、呼吸停止,以致死亡
知识点2 二氧化碳的性质 重点
1.探究二氧化碳的性质
实验装置
实验内容
实验现象
实验分析
. .
观察一瓶
体的颜色、状态
和气味
没有颜色、
没有气味
通常状况下,
的气体
实验装置
实验内容
实验现象
实验分析
. .
实验装置
实验内容
实验现象
实验分析
. .
向烧杯里缓慢倾倒
焰的变化
两支蜡烛
自下而上,
依次熄灭
一般情况下,
持燃烧,且密度比空气的大。倾倒
时会在烧杯底部先聚集较多的
使下方蜡烛首先接触到较多的
而先熄灭,上方蜡烛后接触到较多
的
. .
在一个充满
软塑料瓶里,迅速
倒入少量蒸馏水,
立即将瓶塞塞紧振
荡,观察现象
塑料瓶
变瘪
部分
导致瓶内气体压强减小,在外界大
气压强的作用下,瓶子变瘪
实验装置
实验内容
实验现象
实验分析
. .
两支蜡烛
自下而上,
依次熄灭
. .
塑料瓶
变瘪
续表
2.二氧化碳的物理性质
(1)通常状况下,
?
状态
颜色
气味
密度(与空气相比)
溶解性
气态
无色
无味
比空气的大
能溶于水
说明 ①
容器倾倒。②通常1体积水中能溶解1体积的
?
(2)在加压降温的情况下,
?
3.二氧化碳的化学性质
实验1
实验2
实验步骤
. .
用酒精灯加热颜色呈红色
的那支试管,观察液体颜
色的变化
实验现象
滴入蒸馏水中的紫色石蕊试液不变色,滴入
变扁瓶中液体的紫色石蕊试液变红色
红色的石蕊试液重新变为
紫色
现象解释
碳酸能使紫色石蕊试液变成红色
碳酸很不稳定,受热易分解
化学方
程式
实验1
实验2
实验步骤
. .
用酒精灯加热颜色呈红色
的那支试管,观察液体颜
色的变化
实验现象
滴入蒸馏水中的紫色石蕊试液不变色,滴入
变扁瓶中液体的紫色石蕊试液变红色
红色的石蕊试液重新变为
紫色
现象解释
碳酸很不稳定,受热易分解
化学方
程式
(1)二氧化碳与水的反应
(2)二氧化碳与澄清石灰水反应
实验操作
把
实验现象
生成白色沉淀,澄清石灰水变浑浊
现象分析
. .
化学方程式
实验操作
实验现象
生成白色沉淀,澄清石灰水变浑浊
现象分析
. .
化学方程式
示例
用熟石灰
色固休、石灰水表面有一层白膜;鸡蛋放入石灰水中可以保存较长时间,这些都
是因为
示例
归纳总结
二氧化碳的化学性质
(1)一般情况下,二氧化碳不燃烧,也不支持燃烧,不能供给呼吸。
(2)二氧化碳能与水反应生成碳酸:
?
(3)二氧化碳能使澄清石灰水变浑浊:
?
二氧化碳能使澄清石灰水变浑浊,故可用澄清石灰水检验二氧化碳
典例1 某科学兴趣小组用图中所示装置做有关
?
(1)如图1所示,甲同学将集气瓶中的
_________________,该现象说明一般情况下二氧化碳具有的性质是______________,________________。
?
蜡烛自下而上依次熄灭
不可燃也不助燃
密度比空气的大
(2)乙同学在常温下进行如图2所示的实验时,观察到烧瓶中固体逐渐减少,此过
程发生的是______ (选填“物理”或“化学”)变化;试管中有气泡产生,溶液颜色由
紫色变为______。
物理
红色
[解析] 烧瓶中固体逐渐减少是因为干冰升华了,此过程中没有新物质生成,属于物
理变化;试管中二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊试液变红。
(3)丙同学挤压图3装置中滴管的胶头,使其中液体滴入烧瓶,振荡烧瓶,可以观
察到的现象是____________________________,产生这一现象的原因是___________
_________________________________________________________________________
_____________________________。
烧瓶内溶液变浑浊,气球胀大
(OH)2
?
知识点3 二氧化碳的制取 重难点
1.药品的选择
药品
现象
稀盐酸与块状大理石
反应速率适中,便于气体收集,且原料廉
价易得
产生气泡,速率适中
浓盐酸与块状大理石
剧烈反应,迅速产生大量气泡,并伴有白雾
稀硫酸与块状大理石
刚开始时产生气泡,后来速率减慢并逐渐
停止
稀盐酸与碳酸钠粉末(或纯碳酸钙)
剧烈反应,迅速产生大量气泡
通过上述对比分析可知,实验室制取二氧化碳的药品宜选用稀盐酸和大理石(或石灰石,
主要成分都是碳酸钙)。
稀硫酸与碳酸钙反应生成微溶于水的硫酸钙,覆盖在大理石的表面,阻止反应继续进行,不适合用来制取
?
碳酸钠粉末与稀盐酸反应速率过快,产生的气体不便于收集,不适合用于实验室制取
?
浓盐酸与大理石反应速率过快,且浓盐酸有挥发性,会使制得的
?
3.实验装置
发生装置
收集装置
选择依据
固体和液体反应,不需要加热
装置类型
. .
固液常温型
. .
向上排空气法
发生装置
收集装置
选择依据
固体和液体反应,不需要加热
装置类型
. .
固液常温型
. .
向上排空气法
2.反应原理:
?
4.实验步骤
?
拓展培优
二氧化碳的工业制法
高温煅烧石灰石生成氧化钙(俗称生石灰)和二氧化碳,反应的化学方程式为
?
特别提醒
实验注意事项
5.二氧化碳的检验、验满与存放
用品或放置方法
方法或注意事项
检验
澄清石灰水
将被检验的气体通入澄清石灰水中,如果澄清石灰水变
浑浊,证明该气体为二氧化碳,否则不是
验满
燃着的木条
将燃着的木条放在收集二氧化碳的集气瓶口,如果木条
熄灭,证明已收集满,否则未满
存放
正放在桌面上
收集满二氧化碳的集气瓶要用玻璃片(毛面向下)盖住
验满二氧化碳
检验二氧化碳
拓展
制取的
除杂时,先除
?
家庭小实验
食醋与碱面反应生成的气体是什么?
取一个玻璃杯,放入一些碱面,然后加入一些食醋(含醋酸),立即用蘸有澄清石
灰水(澄清石灰水可用食品包装袋内的干燥剂生石灰加水制得)的玻璃片盖住。观
察到澄清石灰水变浑浊,说明有二氧化碳生成。
典例2 如图是实验室制取气体常用的装置图,请结合下列装置图回答问题。
(1)装置图中标号
?
集气瓶
(2)实验室制取二氧化碳时,发生反应的化学方程式为___________________________________,可选
用的发生装置是___(选填字母,下同),可选用的收集装置是___。
?
B
D
(3)下列为制取二氧化碳的操作:①检查装置气密性;②组装装置;③向分液漏斗
中注入稀盐酸;④加入小块大理石;⑤收集气体。正确的顺序是____________。
②①④③⑤
知识点4 二氧化碳的应用
能溶于水(物理性质)
生产汽水等碳酸饮料
干冰(固态
作为制冷剂,用于人工降雨,制造
舞台云雾效果等
一般情况下,不燃烧,也不支持燃烧(化学性质),
密度比空气的大(物理性质)
用来灭火
参与植物光合作用(化学性质),二氧化碳+水
作为气体肥料,提高光合作用的强
度和效率
能用
学性质)
作为化工产品的原料
能溶于水(物理性质)
生产汽水等碳酸饮料
作为制冷剂,用于人工降雨,制造
舞台云雾效果等
一般情况下,不燃烧,也不支持燃烧(化学性质),
密度比空气的大(物理性质)
用来灭火
作为气体肥料,提高光合作用的强
度和效率
作为化工产品的原料
典例3 二氧化碳的下列用途没有利用其化学性质的是( )
A.干冰用于人工降雨
B.二氧化碳用于灭火
C.二氧化碳作为气体肥料
D.二氧化碳用于制纯碱
A
[解析] 干冰用于人工降雨,利用了干冰升华时吸热的性质,属于物理性质。
题型1 二氧化碳的性质
?
典例4 以下两个实验可用于验证
?
(1)甲实验中观察到溶液颜色的变化是___(选填序号)。
B
?
[解析] 二氧化碳和水反应生成碳酸
稳定,受热易分解,加热后溶液又变为紫色。
?
A.紫色→红色→无色
B.紫色→红色→紫色
C.红色→紫色→紫色
该实验中使石蕊试液变红的物质是_______(填化学式)。
(2)乙实验中观察到②③不变红,④比①先变红,由此能得到
(选填序号,双选)。
A.
B.
C.
D.
?
CD
[解析] 湿润的紫色石蕊棉球中含有水,二氧化碳和水反应生成碳酸,碳酸使湿润的
紫色石蕊棉球变红,下面的棉球④先变红,是因为二氧化碳的密度比空气的大。
(3)乙装置简单改进后还可同时证明
__________________________。
?
在支管口处放一燃着的木条
[解析] 将燃着的木条放在支管口处,观察到木条熄灭,即可证明二氧化碳不能燃烧
也不能支持燃烧。
易错警示
误认为
酸性物质能使紫色石蕊试液变红,将
是因为
?
题型2 制取二氧化碳的实验装置
?
典例5 如图甲是某小组同学组装的实验室制取二氧化碳气体的发生装置,该装置的优点是____________________________;为了解装置具有该优点的原因,
可随时控制反应的发生和停止
BC
A.
B.
C.
?
他们在甲装置中连接压强传感器(如图乙所示),从而测定实验过
程中试管内气体压强变化的情况(结果如图丙所示)。下列说法正确的是_____(选填
序号,双选)。
[解析] 夹紧弹簧夹时,随着反应的发生,生成的气体增多,试管内压强增大,试管
内的稀盐酸被压入长颈漏斗中,待稀盐酸和多孔塑料片上的石灰石分开,反应停止,
再打开弹簧夹,试管内气体排出,压强减小,稀盐酸重新从长颈漏斗流入试管中,
试管内液面升高,石灰石与稀盐酸接触,反应再次发生,所以该装置的优点是可随
时控制反应的发生和停止。
成
斗中,试管中液面逐渐降低,直至石灰石和稀盐酸脱离接触(
产生,试管中的压强不变(
出,试管内压强减小,直至与
?
题型3 实验室制取气体的综合
?
典例6 根据下列装置,结合所学科学知识回答下列问题。
(1)写出仪器①的名称:________。
锥形瓶
(2)实验室选择装置A用高锰酸钾制取氧气时,你认为装置A存在的问题是_______
_______________,选择收集装置应依据氧气的______________,该反应的化学方程
式是_ ________________________________。
试管口没有放一团棉花
密度和溶解性
?
[解析] 加热高锰酸钾时,为了防止加热时试管内的粉末状物质进入导管,试管口要
放一团棉花;选择收集装置应依据氧气的密度和溶解性。
(3)实验室可以选择装置______________(选填序号)制取并收集
的化学方程式是___________________________________,验满的方法是__________
_________________________________________________________________________
_______________________________________。
?
?
?
将燃着的木条放在装置C的集气瓶口,若木条熄灭,证明已收集满(或将燃着的木条放在装置
?
[解析] 实验室用大理石(或石灰石)和稀盐酸在常温下反应制取
B作为气体发生装置;二氧化碳能溶于水,密度比空气的大,应用向上排空气法收集,
即选择装置C(或装置
?
(4)通常情况下,
于水。实验室里,用亚硫酸钠固体和较浓的硫酸溶液在常温下反应制取
室制取
从__(选填“
?
B
?
[解析] 实验室用亚硫酸钠固体和较浓的硫酸溶液在常温下反应制取
为固体和液体,不需要加热,应选择装置B作为气体发生装置;因为二氧化硫的密度
比空气的大,若选择装置
空气,即从
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
