化学反应与能量变化课件(77页)
图片预览







文档简介
课件77张PPT。第一课时现代社会离不开能源,在影响全球经济和生活的各种因素中,能源占首位能源与人类 能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可回避的能源危机。 煤、石油、天然气的主要化学成分是烃类等有机物(煤中含有大量的碳),它们燃烧时放出热能。 不同的燃料其组成不同,燃烧后放出的热量也不相等。思考:人类文明始于火 这种能量从何而来?它与化学物质
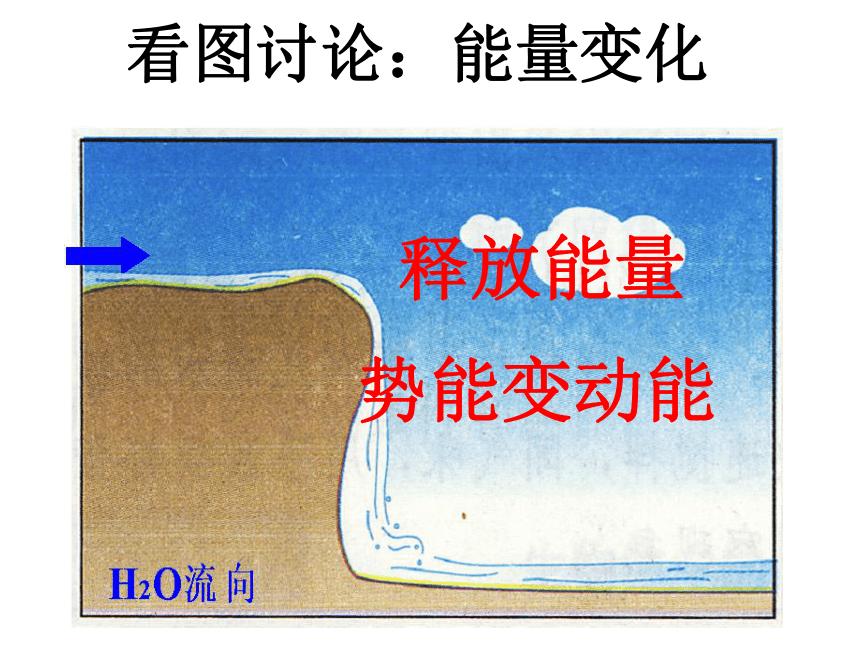
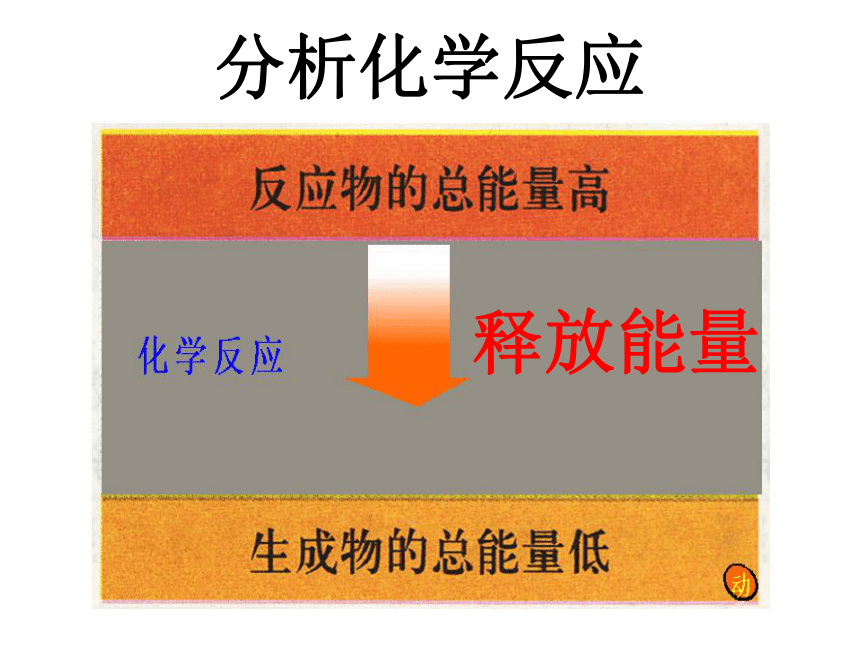
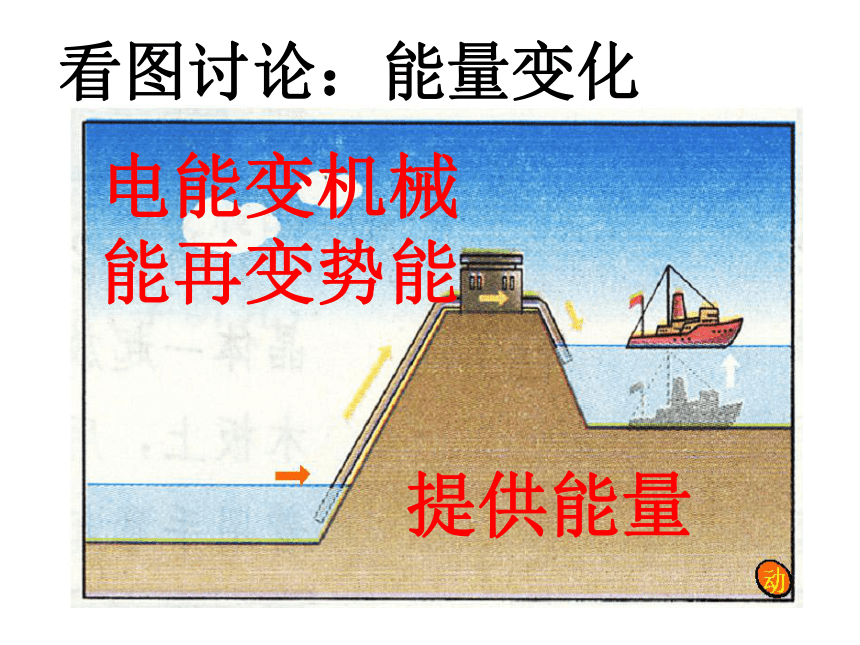
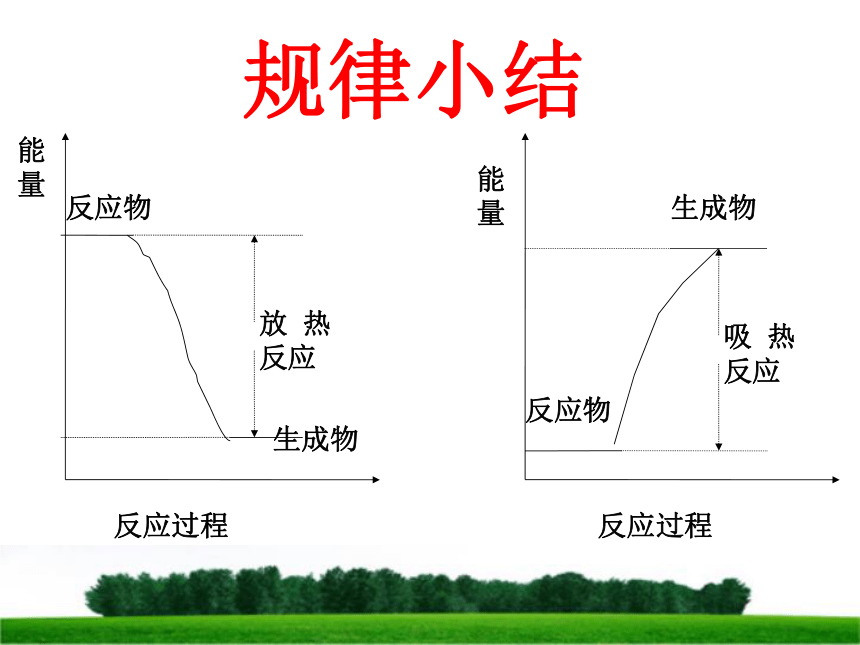
和化学反应有什么关系?为什么不同的燃料燃烧时放出的热量会不同?燃料在燃烧反应中产生的热能来自哪里?看图讨论:能量变化释放能量势能变动能分析化学反应释放能量看图讨论:能量变化电能变机械能再变势能提供能量分析化学反应吸收能量 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。一、能量与化学物质和化学反应的关系规律小结规 律1、如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
2、如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。思考:
物质具有的能量与其稳定性之间存在什么关系?
3、物质具的能量越低越稳定。一般原子间的化学键越牢固,键能越大,物质越稳定。化学反应放热反应
吸热反应二、根据能量变化 一般来说,分解反应多数为吸热反应。对于可逆反应,若正反应为放热反应,则逆反应必为吸热反应。
(4)化学反应中的能量变化,通常主要表现为热量的变化——吸热或放热,但是也有其他形式的能量变化。例如燃烧反应(发光发热的剧烈的氧化还原反应)中不仅有热量放出,而且还有光能、声能等其他形式的能量变化。两条基本的自然定律
(1)质量守恒定律:自然界的物质可以发生相互转化,但是总质量保持不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,转化的途径和能量形式可以不同,但是体系包含的能量不变。这就是“能量守恒定律”。问题小结
1.怎样判断某个反应是吸收能量还是释放能量的?
①根据经验规律,用常见吸收能量和释放能量的反应类型来判断。
②根据生成物和反应物的相对稳定性判断,由稳定性的物质生成不稳定的物质的反应为吸收能量的反应,反之为释放能量的反应。
③根据反应条件判断,凡是需持续加热才能进行的反应就是吸收能量的反应,反之,一般为释放能量的反应。
④根据得失电子情况判断,失去电子要吸收能量,得到电子要释放能量。 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子的过程。化学反应过程中为什么会有能量的变化? 旧键断裂需要吸收能量,新键形成需要放出能量。 而一般化学反应中,旧键的断裂所吸收的总能量与新键形成所放出的总能量是不相等的,而这个差值就是反应中能量的变化。所以化学反应过程中都会有能量的变化。三、化学键与化学反应中能量变化的关系1、分子或化合物里的原子之间是通过化学键相结合的,而化学键是与能量联系在一起的。当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。
2、化学键的断裂和形成正是化学反应中能量变化的主要原因。
3、各种物质都储存有化学能。不同的物质不仅组成不同、结构不同,所包含的化学能也不同想一想:通过上述学习,那么,一个化学反应吸收能量还是放出能量是由什么决定的呢?1、与物质具有的能量有关(内能)
2、与化学键键能有关四、反应热、焓变化学反应过程中所释放或吸收的能量都可以用热量(或换算成相应的热量)来表述,叫做反应热,又称为“焓变”,符号用ΔH。
单位: kJ/mol 或 kJ·mol-11、反应热看课本2页或成才之路2页注意事项:①单位为kJ/mol 或kJ·mol-1。
②反应热描述的是化学反应前后的热量变化。
③反应热描述的是一定温度下的热量变化。
④任何化学反应都有反应热。
吸收
679 kJ/mol放出862kJ/mol2、焓:
与内能有关的物理量 符号:H 反应物本身的性质
物质的状态:g > l> s
温度:T↑→H↑
压强:P↑→H↑决定因素
(了解):2、焓变:
生成物与反应物的焓值差
符号:△H
△H=H生成物-H反应物=反应热(1)、.根据质量守恒定律和能量守恒定律,特定反应的反应热数值应为生成物分子化学键形成时所释放的总能量与反应物分子化学键断裂时所吸收的总能量之差。
(2).由于反应后放出的热量使反应体系的能量降低(使环境的能量升高),故规定放热反应的ΔH为“-”,ΔH<0;而吸热反应使反应体系的能量升高(使环境的能量降低),故规定吸热反应的ΔH为“+”,ΔH>0。成才之路(3)化学变化过程中的能量变化,如图所示。 ΔH=生成物总能量-反应物总能量
(2)ΔH=反应物的键能之和-生成物的键能之和ΔH的计算【例1】 根据要求回答:
(1)下列各图中,表示反应是吸热反应的是 ( ) (2)拆开1mol H—H键,1mol N—H键,1mol N≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求1mol N2生成NH3的焓变(ΔH)。[解析] (1)反应中的能量变化=生成物总能量-反应物总能量,若大于0,则反应过程为吸热,小于0,则为放热,答案为A。
(2)ΔH=反应物的键能之和-生成物的键能之和=(1mol N≡N键键能+3mol H-H键键能)-6mol N-H键键能,代入数据即可得结论。
[答案] (1)A (2)ΔH=-92kJ/mol
[点评] 能从能量和键能的角度准确理解ΔH的概念。【例2】 某些化学键的键能如下表(kJ·mol-1)
(1)1mol H2在2mol Cl2中燃烧,放出热量________kJ。
(2)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是________。
a.Cl2>Br2>I2 b.I2>Br2>Cl2
预测1mol H2在足量F2中燃烧比在Cl2中放热________。[解析] 本题涉及键能与吸、放热的关系,考查了键能与反应热的定量关系。(1)1mol H2在2mol Cl2中燃烧,参加反应的H2和Cl2都是1mol,生成HCl 2mol。则放出热量 :431 kJ·mol-1×2mol-436kJ·mol-1×1mol-247kJ·mol-1×1mol=179kJ。
(2)由于键能Cl—Cl键>Br—Br键>I—I键,故H2在Cl2中燃烧放热最多,在I2中燃烧放热最少。推测键能F—F键>Cl—Cl键,故知H2在F2中燃烧放热多。 [答案] (1)179 (2)a (3)多
[点评] 在化学反应中,旧化学键断裂时,需要吸收能量;当原子重新组合,形成新化学键生成新物质时,又要释放能量。断裂1mol 化学键吸收的能量或形成1mol化学键释放出的能量就是该化学键的键能。小结反应热、焓变
从焓变角度看:ΔH=生成物的焓-反应物的焓从反应热角度看:ΔH=生成物总能量-反应物总能量从键能角度看:ΔH=反应物总键能-生成物总键能课堂练习+131.5 2、拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。 -92KJ/mol-30.6KJ/mol课堂练习ΔH=反应物的键能之和-生成物的键能之和=(1mol N≡N键键能+3mol H-H键键能)-6mol N-H键键能,代入数据即可得结论。 (2)ΔH=-92kJ/mol课堂练习3、下列叙述正确的是 ( )
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量A C课堂练习4、已知:H + H ═ H2;△H=-436KJ/mol,
则下列叙述正确的是( )
A.2个H原子的能量高于1个H2的能量
B.2个H原子的能量低于1个H2的能量
C. H原子比H2分子稳定
D.H2分子比H原子稳定A D课堂练习5、下列变化过程中会放出热量的是 ( )
①硝酸铵溶于水②物质的燃烧
③苛性钠溶于水
④生石灰放入水中 ⑤醋酸的电离
A.仅①⑤ B.仅②③
C.仅②④ D.②③④D课堂练习6、下列变化中,属于放热反应的是
( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化钠溶于水BTHE END第二课时化学反应过程中所释放或吸收的能量都可以用热量(或换算成相应的热量)来表述,叫做反应热,又称为“焓变”,符号用ΔH。
单位: kJ/mol 或 kJ·mol-11、什么是反应热?反应热单位是什么?复习回顾2、什么是焓?
与内能有关的物理量 符号:H 反应物本身的性质
物质的状态:g > l> s
温度:T↑→H↑
压强:P↑→H↑决定因素
(了解):焓变ΔH :
生成物与反应物的焓值差 符号:△H
△H=H生成物-H反应物=反应热
3、 物质具有的能量与其稳定性之间存在什么关系?
物质具的能量越低越稳定。物质间的化学键越牢固,键能越大,物质越稳定。小结一、反应热、焓变
从焓变角度看:ΔH=生成物的焓-反应物的焓从反应热角度看:ΔH=生成物能量-反应物能量从键能角度看:ΔH=反应物总键能-生成物总键能ΔH=生成物总能量-反应物总能量(图像难计算)
(2)ΔH=反应物的键能之和-生成物的键能之和。ΔH是如何计算的??H(反应热)=E(反应物分子化学键断裂时所吸收的总能量)- E (生成物分子化学键形成时所释放的总能量)成才之路例2 变式1 、2 我们已经认识了反应热,那如何在化学方程式中正确反映其热量的变化?二、热化学方程式什么是热化学方程式?请看以下例子,再思考!思考
交流与化学方程式相比,热化学方程式有哪些不同?H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol物质变化能量变化200℃
101kPa1、热化学方程式的定义 热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
普通化学方程式只包含物质变化一个部分。表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。正确书写热化学方程式应注意哪几点?★书写热化学方程式的注意事项1、化学方程式的右边必须写上△H,并用“空格”隔开,
△H:吸热用“+”,放热用:“-”, 单位是kJ/mol或J/mol2、热化学方程式需注明反应时的温度和压强。对于 25℃ 101kPa时进行的反应可不注明。普通化学方程式不需注明温度和压强。3、热化学方程式物质后需标聚集状态(s、l、g、aq)即注明各物质的状态。
普通化学方程式不需注明物质的状态。4、热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数。
普通化学方程式中化学计量数宏观上表示各物质的物质的量,微观上表示原子分子数目,只能为整数,不能为分数。 ?H(KJ/mol)它表示每摩尔反应所放出的热量,?H它的值与方程式中的计量系数有关,即对于相同的反应,当化学计量数不同时,其?H不同。如而这些书写也是对的!!!5、若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变3、热化学方程式表示的意义1、反应物和生成物的种类、聚集状态
2、反应中各物质的物质的量比和质量比
3、反应中放出或吸收的热量。综上所述1、当1mol气态H2与1mol气态Cl2反应
生成2mol气态HCl,放出184.6KJ的热
量,请写出该反应的热化学方程式。H2(g)+Cl2(g)=2HCl(g) ?H =-184.6KJ/mol练习:2、写出下列反应的热化学方程式
(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量
(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3KJ/mol2Cu(s)+O2(g)=2CuO(s) △H= - 314KJ/mol(3) 2.00gC2H2完全燃烧生成液态水和CO2放出的热量为99.6KJ,写出C2H2燃烧的热化学方程式。
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-2589.6KJ/mol2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol
C. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g) △H=-4b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+4b kJ/mol
E. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mol3、已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )B点拨:热化学方程式书写正误的判断可从物质的聚集状态、△H的正负号、物质的量的大小、单位等主要方面入手4、沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是A、 2CH4 ( g )+4O2 ( g ) = 2CO2 ( g ) + 4H2O ( l ) ΔH = +890 kJ/mol
B、 CH4 +2 O2 = CO2 + H2O ΔH = -890 kJ/mol
C、 CH4 ( g )+2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l ) ΔH = -890 kJ/mol
D、 1/2CH4 ( g )+O2 ( g ) = 1/2CO2 ( g ) + H2O ( l ) ΔH = -890 kJ/mol
C4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A. H2O(g)=H2(g)+1/2O2(g)
ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O
ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g)
ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g)
ΔH=+484kJ·mol-1 ATHE END再见!5、在200℃、101kP时,1molH2与碘蒸气作用生成HI反应,科学文献表示为:
H2(g)+I2(g) 2HI(g) ?
△H=-14.9kJ/mol
以上化学方程式指出了反应时的 和 ;括号中的符号表示反应物或生成物的 。
6、在25℃、101kPa时,有两个由H2和 O2 化合成1mol H2O的反应,一个生成气态水,一个液态水,化学方程式如下:
H2(g)+1/2 O2(g) = H2O(g) ?
△H=-241.8Kj/mol
H2(g)+1/2 O2(g)= H2O(I) ?
△H= - 285.8kJ/ mol
以上两个反应,产物都是 ,但产物的 不同, 温度 压强 状态 水 状态(练习与巩固)依据事实,写出下列反应的热化学方程式∶(1)1mol碳完全燃烧放出393.5KJ的热量;
(2)1克甲醇燃烧生成二氧化碳和液态水时放热22.68KJ;
(3)1mol氯气和水蒸气通过灼热的炭层反应,生成氯化氢和二氧化碳放出145KJ的热量。你写对了吗?^_^二、中和热 1、酸和碱的中和反应有热量放出,可以通过实验测得中和反应的反应热。当1L1mol/L的稀盐酸跟1L1 mol/L的NaOH溶液起中和反应时,能放出57.3kJ的热量。
NaOH(aq)+HCI(aq)=NaCl(aq)+H2O(l)
ΔH=-57.3 kJ/mol2、如果用1L1mol/L的 KOH溶液中和 1L1mol/L的HNO3溶液,也能放出57.3 kJ的热量。
KOH(aq)+HNO3(aq)=KNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol ●典例精析
【例1】 对下列化学反应的热现象的说法不正确的是 ( )
①放热反应发生时不必加热
②化学反应发生过程中一定有能量变化
③吸热反应需要加热后才能发生,放热反应不加热就会发生
④化学反应吸收或放出热量的多少与参加反应的物质的多少有关
A.①② B.②③ C.①③ D.②④反应热与物质的量的关系:
质量守恒
能量守恒
某一反应中,质量和能量成正比关系
热量用Q表示
①体系向环境做正功,Q>0,释放能量→放热反应
②体系向环境做负功,Q<0,得到能量→吸热反应3、在一定条件下,判断某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定;
4、一般反应都是在敞口容器中进行的,系统的压力等于外界压力,是在恒压条件下进行的反应,反应的热效应等于焓变。内能和焓变是否完全等同?判断一个反应是吸热反应还是放热反应的方法:Ⅰ:H反应物和H生成物的相对大小
△H= H生 - H反
△H > 0,则为吸热反应,△H为“+”, Q<0
△H < 0,则为放热反应,△H为“-”, Q>0
Ⅱ:△H=E1 - E2 > 0为吸热反应
E1不能通过实验测得,
∴没有实际的计算意义Ⅲ:反应物分子断键时吸收的总能量Σ反与生成物分子形成新化学键时释放的能量Σ生的相对大小
△H= Σ反- Σ生
△H > 0 则为吸热反应 △H为“+” , Q<0
△H < 0 则为放热反应 △H为“-” , Q>0键能:破坏1 mol 共价键吸收的能量或形成1 mol 共价键放出的能量Ⅳ:通过实验直接测得→掌握中和热的测定键能恒取正值2、焓变:
生成物与反应物的焓值差 符号:△H
△H=H生成物-H反应物?H=E(生成物的总能量)- E(反应物的总能量)?H=E(反应物分子化学键断裂时所释放的总能量)- E (生成物分子化学键形成时所吸收的总能量)常见的放热反应和吸热反应放热反应所有的燃烧
中和反应
溶液里的置换
一般的化合反应
特殊的分解吸热反应电离
强碱与铵盐
一般的分解
特殊的化合
和化学反应有什么关系?为什么不同的燃料燃烧时放出的热量会不同?燃料在燃烧反应中产生的热能来自哪里?看图讨论:能量变化释放能量势能变动能分析化学反应释放能量看图讨论:能量变化电能变机械能再变势能提供能量分析化学反应吸收能量 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。一、能量与化学物质和化学反应的关系规律小结规 律1、如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
2、如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。思考:
物质具有的能量与其稳定性之间存在什么关系?
3、物质具的能量越低越稳定。一般原子间的化学键越牢固,键能越大,物质越稳定。化学反应放热反应
吸热反应二、根据能量变化 一般来说,分解反应多数为吸热反应。对于可逆反应,若正反应为放热反应,则逆反应必为吸热反应。
(4)化学反应中的能量变化,通常主要表现为热量的变化——吸热或放热,但是也有其他形式的能量变化。例如燃烧反应(发光发热的剧烈的氧化还原反应)中不仅有热量放出,而且还有光能、声能等其他形式的能量变化。两条基本的自然定律
(1)质量守恒定律:自然界的物质可以发生相互转化,但是总质量保持不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,转化的途径和能量形式可以不同,但是体系包含的能量不变。这就是“能量守恒定律”。问题小结
1.怎样判断某个反应是吸收能量还是释放能量的?
①根据经验规律,用常见吸收能量和释放能量的反应类型来判断。
②根据生成物和反应物的相对稳定性判断,由稳定性的物质生成不稳定的物质的反应为吸收能量的反应,反之为释放能量的反应。
③根据反应条件判断,凡是需持续加热才能进行的反应就是吸收能量的反应,反之,一般为释放能量的反应。
④根据得失电子情况判断,失去电子要吸收能量,得到电子要释放能量。 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子的过程。化学反应过程中为什么会有能量的变化? 旧键断裂需要吸收能量,新键形成需要放出能量。 而一般化学反应中,旧键的断裂所吸收的总能量与新键形成所放出的总能量是不相等的,而这个差值就是反应中能量的变化。所以化学反应过程中都会有能量的变化。三、化学键与化学反应中能量变化的关系1、分子或化合物里的原子之间是通过化学键相结合的,而化学键是与能量联系在一起的。当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。
2、化学键的断裂和形成正是化学反应中能量变化的主要原因。
3、各种物质都储存有化学能。不同的物质不仅组成不同、结构不同,所包含的化学能也不同想一想:通过上述学习,那么,一个化学反应吸收能量还是放出能量是由什么决定的呢?1、与物质具有的能量有关(内能)
2、与化学键键能有关四、反应热、焓变化学反应过程中所释放或吸收的能量都可以用热量(或换算成相应的热量)来表述,叫做反应热,又称为“焓变”,符号用ΔH。
单位: kJ/mol 或 kJ·mol-11、反应热看课本2页或成才之路2页注意事项:①单位为kJ/mol 或kJ·mol-1。
②反应热描述的是化学反应前后的热量变化。
③反应热描述的是一定温度下的热量变化。
④任何化学反应都有反应热。
吸收
679 kJ/mol放出862kJ/mol2、焓:
与内能有关的物理量 符号:H 反应物本身的性质
物质的状态:g > l> s
温度:T↑→H↑
压强:P↑→H↑决定因素
(了解):2、焓变:
生成物与反应物的焓值差
符号:△H
△H=H生成物-H反应物=反应热(1)、.根据质量守恒定律和能量守恒定律,特定反应的反应热数值应为生成物分子化学键形成时所释放的总能量与反应物分子化学键断裂时所吸收的总能量之差。
(2).由于反应后放出的热量使反应体系的能量降低(使环境的能量升高),故规定放热反应的ΔH为“-”,ΔH<0;而吸热反应使反应体系的能量升高(使环境的能量降低),故规定吸热反应的ΔH为“+”,ΔH>0。成才之路(3)化学变化过程中的能量变化,如图所示。 ΔH=生成物总能量-反应物总能量
(2)ΔH=反应物的键能之和-生成物的键能之和ΔH的计算【例1】 根据要求回答:
(1)下列各图中,表示反应是吸热反应的是 ( ) (2)拆开1mol H—H键,1mol N—H键,1mol N≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求1mol N2生成NH3的焓变(ΔH)。[解析] (1)反应中的能量变化=生成物总能量-反应物总能量,若大于0,则反应过程为吸热,小于0,则为放热,答案为A。
(2)ΔH=反应物的键能之和-生成物的键能之和=(1mol N≡N键键能+3mol H-H键键能)-6mol N-H键键能,代入数据即可得结论。
[答案] (1)A (2)ΔH=-92kJ/mol
[点评] 能从能量和键能的角度准确理解ΔH的概念。【例2】 某些化学键的键能如下表(kJ·mol-1)
(1)1mol H2在2mol Cl2中燃烧,放出热量________kJ。
(2)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是________。
a.Cl2>Br2>I2 b.I2>Br2>Cl2
预测1mol H2在足量F2中燃烧比在Cl2中放热________。[解析] 本题涉及键能与吸、放热的关系,考查了键能与反应热的定量关系。(1)1mol H2在2mol Cl2中燃烧,参加反应的H2和Cl2都是1mol,生成HCl 2mol。则放出热量 :431 kJ·mol-1×2mol-436kJ·mol-1×1mol-247kJ·mol-1×1mol=179kJ。
(2)由于键能Cl—Cl键>Br—Br键>I—I键,故H2在Cl2中燃烧放热最多,在I2中燃烧放热最少。推测键能F—F键>Cl—Cl键,故知H2在F2中燃烧放热多。 [答案] (1)179 (2)a (3)多
[点评] 在化学反应中,旧化学键断裂时,需要吸收能量;当原子重新组合,形成新化学键生成新物质时,又要释放能量。断裂1mol 化学键吸收的能量或形成1mol化学键释放出的能量就是该化学键的键能。小结反应热、焓变
从焓变角度看:ΔH=生成物的焓-反应物的焓从反应热角度看:ΔH=生成物总能量-反应物总能量从键能角度看:ΔH=反应物总键能-生成物总键能课堂练习+131.5 2、拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。 -92KJ/mol-30.6KJ/mol课堂练习ΔH=反应物的键能之和-生成物的键能之和=(1mol N≡N键键能+3mol H-H键键能)-6mol N-H键键能,代入数据即可得结论。 (2)ΔH=-92kJ/mol课堂练习3、下列叙述正确的是 ( )
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量A C课堂练习4、已知:H + H ═ H2;△H=-436KJ/mol,
则下列叙述正确的是( )
A.2个H原子的能量高于1个H2的能量
B.2个H原子的能量低于1个H2的能量
C. H原子比H2分子稳定
D.H2分子比H原子稳定A D课堂练习5、下列变化过程中会放出热量的是 ( )
①硝酸铵溶于水②物质的燃烧
③苛性钠溶于水
④生石灰放入水中 ⑤醋酸的电离
A.仅①⑤ B.仅②③
C.仅②④ D.②③④D课堂练习6、下列变化中,属于放热反应的是
( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化钠溶于水BTHE END第二课时化学反应过程中所释放或吸收的能量都可以用热量(或换算成相应的热量)来表述,叫做反应热,又称为“焓变”,符号用ΔH。
单位: kJ/mol 或 kJ·mol-11、什么是反应热?反应热单位是什么?复习回顾2、什么是焓?
与内能有关的物理量 符号:H 反应物本身的性质
物质的状态:g > l> s
温度:T↑→H↑
压强:P↑→H↑决定因素
(了解):焓变ΔH :
生成物与反应物的焓值差 符号:△H
△H=H生成物-H反应物=反应热
3、 物质具有的能量与其稳定性之间存在什么关系?
物质具的能量越低越稳定。物质间的化学键越牢固,键能越大,物质越稳定。小结一、反应热、焓变
从焓变角度看:ΔH=生成物的焓-反应物的焓从反应热角度看:ΔH=生成物能量-反应物能量从键能角度看:ΔH=反应物总键能-生成物总键能ΔH=生成物总能量-反应物总能量(图像难计算)
(2)ΔH=反应物的键能之和-生成物的键能之和。ΔH是如何计算的??H(反应热)=E(反应物分子化学键断裂时所吸收的总能量)- E (生成物分子化学键形成时所释放的总能量)成才之路例2 变式1 、2 我们已经认识了反应热,那如何在化学方程式中正确反映其热量的变化?二、热化学方程式什么是热化学方程式?请看以下例子,再思考!思考
交流与化学方程式相比,热化学方程式有哪些不同?H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol物质变化能量变化200℃
101kPa1、热化学方程式的定义 热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
普通化学方程式只包含物质变化一个部分。表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。正确书写热化学方程式应注意哪几点?★书写热化学方程式的注意事项1、化学方程式的右边必须写上△H,并用“空格”隔开,
△H:吸热用“+”,放热用:“-”, 单位是kJ/mol或J/mol2、热化学方程式需注明反应时的温度和压强。对于 25℃ 101kPa时进行的反应可不注明。普通化学方程式不需注明温度和压强。3、热化学方程式物质后需标聚集状态(s、l、g、aq)即注明各物质的状态。
普通化学方程式不需注明物质的状态。4、热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数。
普通化学方程式中化学计量数宏观上表示各物质的物质的量,微观上表示原子分子数目,只能为整数,不能为分数。 ?H(KJ/mol)它表示每摩尔反应所放出的热量,?H它的值与方程式中的计量系数有关,即对于相同的反应,当化学计量数不同时,其?H不同。如而这些书写也是对的!!!5、若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变3、热化学方程式表示的意义1、反应物和生成物的种类、聚集状态
2、反应中各物质的物质的量比和质量比
3、反应中放出或吸收的热量。综上所述1、当1mol气态H2与1mol气态Cl2反应
生成2mol气态HCl,放出184.6KJ的热
量,请写出该反应的热化学方程式。H2(g)+Cl2(g)=2HCl(g) ?H =-184.6KJ/mol练习:2、写出下列反应的热化学方程式
(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量
(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3KJ/mol2Cu(s)+O2(g)=2CuO(s) △H= - 314KJ/mol(3) 2.00gC2H2完全燃烧生成液态水和CO2放出的热量为99.6KJ,写出C2H2燃烧的热化学方程式。
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-2589.6KJ/mol2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol
C. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g) △H=-4b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+4b kJ/mol
E. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mol3、已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )B点拨:热化学方程式书写正误的判断可从物质的聚集状态、△H的正负号、物质的量的大小、单位等主要方面入手4、沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是A、 2CH4 ( g )+4O2 ( g ) = 2CO2 ( g ) + 4H2O ( l ) ΔH = +890 kJ/mol
B、 CH4 +2 O2 = CO2 + H2O ΔH = -890 kJ/mol
C、 CH4 ( g )+2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l ) ΔH = -890 kJ/mol
D、 1/2CH4 ( g )+O2 ( g ) = 1/2CO2 ( g ) + H2O ( l ) ΔH = -890 kJ/mol
C4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A. H2O(g)=H2(g)+1/2O2(g)
ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O
ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g)
ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g)
ΔH=+484kJ·mol-1 ATHE END再见!5、在200℃、101kP时,1molH2与碘蒸气作用生成HI反应,科学文献表示为:
H2(g)+I2(g) 2HI(g) ?
△H=-14.9kJ/mol
以上化学方程式指出了反应时的 和 ;括号中的符号表示反应物或生成物的 。
6、在25℃、101kPa时,有两个由H2和 O2 化合成1mol H2O的反应,一个生成气态水,一个液态水,化学方程式如下:
H2(g)+1/2 O2(g) = H2O(g) ?
△H=-241.8Kj/mol
H2(g)+1/2 O2(g)= H2O(I) ?
△H= - 285.8kJ/ mol
以上两个反应,产物都是 ,但产物的 不同, 温度 压强 状态 水 状态(练习与巩固)依据事实,写出下列反应的热化学方程式∶(1)1mol碳完全燃烧放出393.5KJ的热量;
(2)1克甲醇燃烧生成二氧化碳和液态水时放热22.68KJ;
(3)1mol氯气和水蒸气通过灼热的炭层反应,生成氯化氢和二氧化碳放出145KJ的热量。你写对了吗?^_^二、中和热 1、酸和碱的中和反应有热量放出,可以通过实验测得中和反应的反应热。当1L1mol/L的稀盐酸跟1L1 mol/L的NaOH溶液起中和反应时,能放出57.3kJ的热量。
NaOH(aq)+HCI(aq)=NaCl(aq)+H2O(l)
ΔH=-57.3 kJ/mol2、如果用1L1mol/L的 KOH溶液中和 1L1mol/L的HNO3溶液,也能放出57.3 kJ的热量。
KOH(aq)+HNO3(aq)=KNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol ●典例精析
【例1】 对下列化学反应的热现象的说法不正确的是 ( )
①放热反应发生时不必加热
②化学反应发生过程中一定有能量变化
③吸热反应需要加热后才能发生,放热反应不加热就会发生
④化学反应吸收或放出热量的多少与参加反应的物质的多少有关
A.①② B.②③ C.①③ D.②④反应热与物质的量的关系:
质量守恒
能量守恒
某一反应中,质量和能量成正比关系
热量用Q表示
①体系向环境做正功,Q>0,释放能量→放热反应
②体系向环境做负功,Q<0,得到能量→吸热反应3、在一定条件下,判断某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定;
4、一般反应都是在敞口容器中进行的,系统的压力等于外界压力,是在恒压条件下进行的反应,反应的热效应等于焓变。内能和焓变是否完全等同?判断一个反应是吸热反应还是放热反应的方法:Ⅰ:H反应物和H生成物的相对大小
△H= H生 - H反
△H > 0,则为吸热反应,△H为“+”, Q<0
△H < 0,则为放热反应,△H为“-”, Q>0
Ⅱ:△H=E1 - E2 > 0为吸热反应
E1不能通过实验测得,
∴没有实际的计算意义Ⅲ:反应物分子断键时吸收的总能量Σ反与生成物分子形成新化学键时释放的能量Σ生的相对大小
△H= Σ反- Σ生
△H > 0 则为吸热反应 △H为“+” , Q<0
△H < 0 则为放热反应 △H为“-” , Q>0键能:破坏1 mol 共价键吸收的能量或形成1 mol 共价键放出的能量Ⅳ:通过实验直接测得→掌握中和热的测定键能恒取正值2、焓变:
生成物与反应物的焓值差 符号:△H
△H=H生成物-H反应物?H=E(生成物的总能量)- E(反应物的总能量)?H=E(反应物分子化学键断裂时所释放的总能量)- E (生成物分子化学键形成时所吸收的总能量)常见的放热反应和吸热反应放热反应所有的燃烧
中和反应
溶液里的置换
一般的化合反应
特殊的分解吸热反应电离
强碱与铵盐
一般的分解
特殊的化合
