浙教版八下科学第五周周末专题(2.1-2.3)含解析
文档属性
| 名称 | 浙教版八下科学第五周周末专题(2.1-2.3)含解析 |  | |
| 格式 | doc | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-09 14:09:50 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
浙教版八下科学第五周周末专题(2.1-2.3)
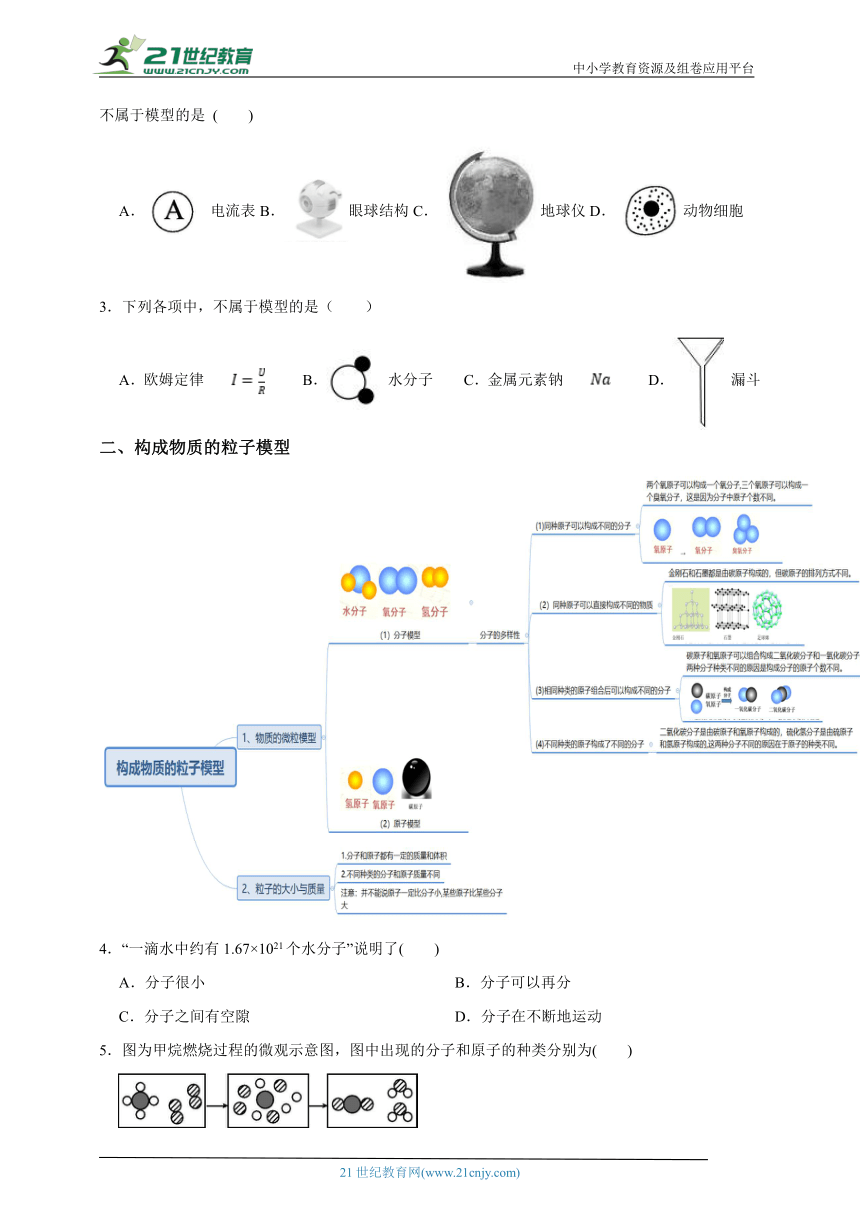
区分符号与模型
1.模型法是学习科学的重要方法。下列不属于模型的是( )
A.光线 B.磁感线
C.水分子 D.氢元素
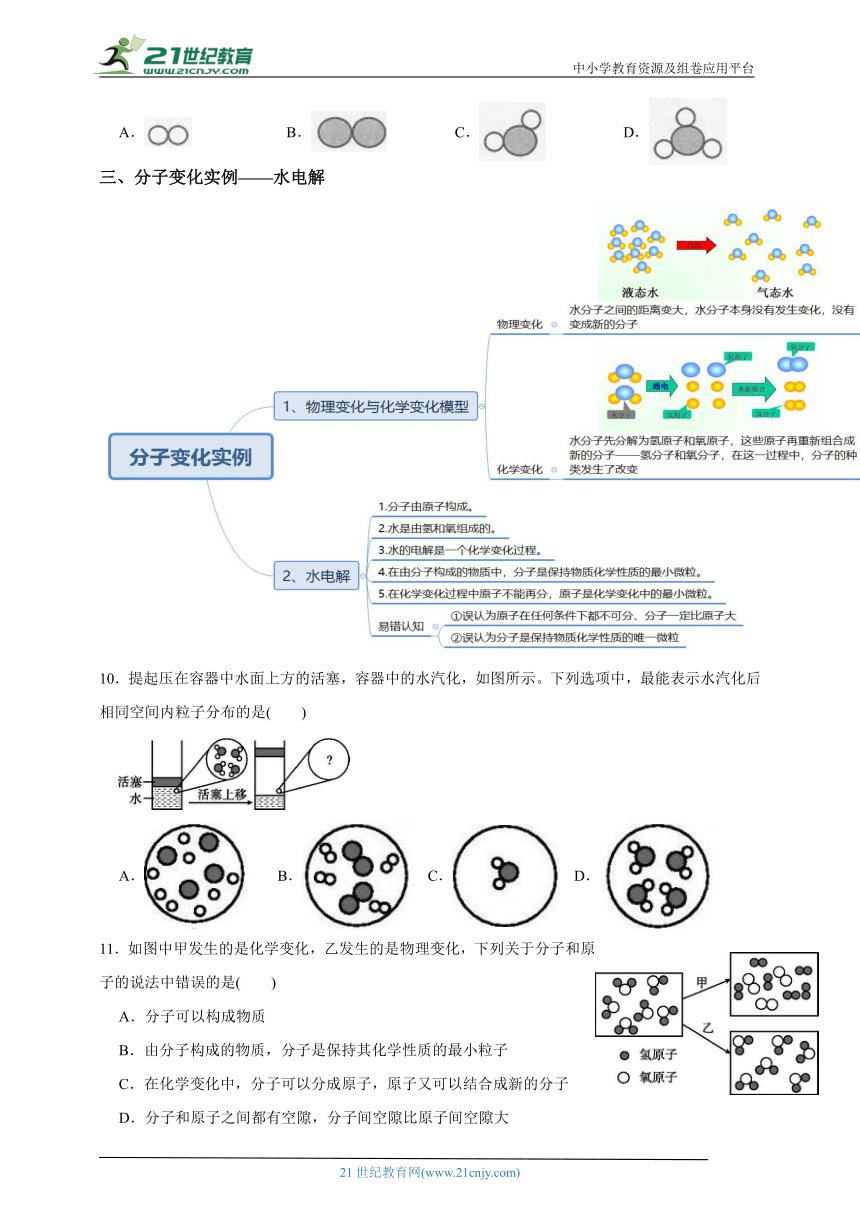
2.模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物,仔细观察下列四幅图片,不属于模型的是 ( )
A.电流表B.眼球结构C.地球仪D.动物细胞
3.下列各项中,不属于模型的是( )
A.欧姆定律 B. 水分子 C.金属元素钠 D. 漏斗
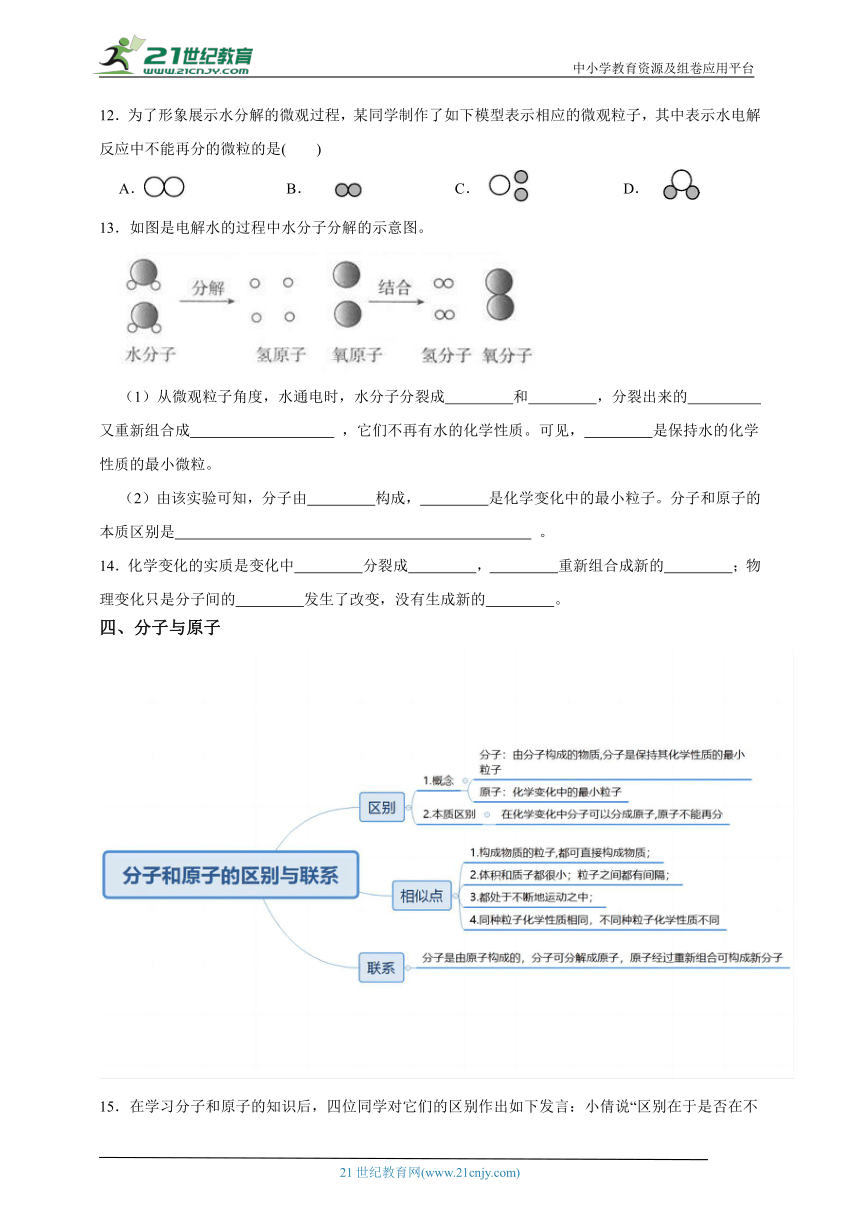
二、构成物质的粒子模型
4.“一滴水中约有1.67×1021个水分子”说明了( )
A.分子很小 B.分子可以再分
C.分子之间有空隙 D.分子在不断地运动
5.图为甲烷燃烧过程的微观示意图,图中出现的分子和原子的种类分别为( )
A.4和3 B.2和3 C.3和4 D.3和3
6.一氧化碳和二氧化碳的化学性质不同的主要原因是( )
A.构成物质的分子不同 B.密度不同
C.生成它们的反应条件不同 D.用途不同
7.根据图,回答下列问题。
(1)过氧化氢分子中有 种原子,甲醛分子中有 种原子;1个甲烷分子中有 个原子,1个甲醛分子中有 个原子,1个水分子中有 个原子。
(2)比较氢分子与水分子,可得出的结论为_____________________________________________
。
比较过氧化氢分子和水分子、乙炔分子和甲烷分子,可得出的结论____________________
。
8.为了贯彻“碳达峰”、“碳中和”理念,冬奥会摒弃了用氟利昂做制冷剂,而是采用了二氧化碳跨临界制冷制冰技术,原因是氟利昂会破坏臭氧层,其破坏过程见下图。
(1)从微观解释氧气和臭氧的化学性质不同的原因_______________________________________
。
(2)在氟利昂破坏臭氧层的过程中作为催化剂的是 。
9.英国科学家在金星大气层中发现了“生物标志”——磷化氢(PH3)气体。如果用“O”表示氢原子,用“”表示磷原子,则下列模型可以表示磷化氢分子PH3的是( )
A. B. C. D.
三、分子变化实例——水电解
10.提起压在容器中水面上方的活塞,容器中的水汽化,如图所示。下列选项中,最能表示水汽化后相同空间内粒子分布的是( )
A. B. C. D.
11.如图中甲发生的是化学变化,乙发生的是物理变化,下列关于分子和原子的说法中错误的是( )
A.分子可以构成物质
B.由分子构成的物质,分子是保持其化学性质的最小粒子
C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子
D.分子和原子之间都有空隙,分子间空隙比原子间空隙大
12.为了形象展示水分解的微观过程,某同学制作了如下模型表示相应的微观粒子,其中表示水电解反应中不能再分的微粒的是( )
A. B. C. D.
13.如图是电解水的过程中水分子分解的示意图。
(1)从微观粒子角度,水通电时,水分子分裂成 和 ,分裂出来的 又重新组合成 ,它们不再有水的化学性质。可见, 是保持水的化学性质的最小微粒。
(2)由该实验可知,分子由 构成, 是化学变化中的最小粒子。分子和原子的本质区别是 。
14.化学变化的实质是变化中 分裂成 , 重新组合成新的 ;物理变化只是分子间的 发生了改变,没有生成新的 。
四、分子与原子
15.在学习分子和原子的知识后,四位同学对它们的区别作出如下发言:小倩说“区别在于是否在不停地运动”;小丹说“区别在于是否能够构成物质”;小鑫说“区别在于化学反应中是否可分”;小娜说“区别在于分子和原子的大小和质量都不同”。你赞同( )
A.小倩 B.小丹 C.小鑫 D.小娜
16.下列关于分子和原子的说法,正确的是( )
A.分子能直接构成物质,而原子不能
B.分子质量一定比原子大
C.在化学反应中,分子可分,原子不可分
D.分子间有空隙,而原子间无空隙
17.关于下列四种分子的分析不正确的是( )
A.一个水分子和一个二氧化碳分子都由三个原子构成
B.比较水分子和二氧化碳分子,说明分子可以由不同种类的原子构成
C.原子都比分子体积小
D.比较氮气分子和氢气分子,说明一个分子可以由种类相同的原子构成
18.下面有关分子的说法中正确的是( )
①分子可由原子构成②分子是由一种原子构成的③分子是由不同的原子构成的④分子构成了所有物质⑤分子是构成物质的微粒之一
A.①②⑤ B.③④ C.①②④ D.①⑤
五、原子结构模型的建立
19.人类对原子结构的认识为现化量子理论的建立奠定了基础,以下几位科学家对原子的观点,按出现的先后顺序排列正确的是( )
A.③④①② B.③①②④ C.③①④② D.③②①④
20.在化学发展史上,道尔顿提出的近代原子学说对化学的发展起着十分重要的作用,因而拥有“原子之父”的美誉。在他的学说中有下述三个主要论点:①原子是不能再分的粒子;②质子数相同的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代的观点看,你认为这三个论点中不确切的是( )
A.③ B.①③ C.②③ D.①②③
21.下列科学家及其贡献对应正确的是( )
A.卢瑟福——发现原子中存在电子
B.法拉第——通电导线周围存在着磁场
C.拉瓦锡——发现空气由氮气和氧气组成
D.奥斯特——电磁感应现象
22.关于原子及原子结构发现史的说法中不正确的是( )
A.汤姆生、卢瑟福两位科学家都是在实验的基础上,通过推理和想象建构原子模型
B.汤姆生发现了电子,证实原子是可分的
C.原子的最外层电子数发生变化时,元素的种类也发生了变化
D.原子的种类由原子核决定
六、卢瑟福实验
23.如图甲是卢瑟福用a粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了如图乙所示的原子核式结构。下列说法中错误的是( )
A.通过该实验可知原子内部绝大部分是空的
B.a粒子可能是某种原子的原子核
C.图乙所示原子核式结构是一种模型
D.卢瑟福在研究过程中采用了控制变量法
24.探究原子结构的奥秘。
[情境提供]19世纪以前,人们一直以为原子是不可分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
[提出问题]电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
[进行实验]1911年英国科学家卢瑟福进行了著名的a粒子轰击金属箔的实验。如图所示:
①放射源——放射性物质放出 a粒子(带正电荷),质量是电子质量的7 000倍;
②金属箔——作为靶子,厚度 1 μm,重叠了3 000层左右的原子;
③荧光屏——α粒子打在上面发出闪光;
④显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
[收集证据]绝大多数α粒子穿过金属箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大角度的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达180°,像是被金属箔弹了回来。
[猜想与假设] α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构。上,否则大角度的散射是不可能的。
[解释与结论]
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就 (填“会”或“不 会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。
(2)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为 (填字母)。
A. 道尔顿模型特点:不可再分的实心球体
B. 汤姆生模型特点:正负电荷均匀分布
C. 卢瑟福模型特点:核位于原子中心,质量集中在核上
七、原子结构
25.下列有关原子的说法中正确的是( )
A.原子不显电性是因为在原子中不存在带电荷的粒子
B.原子中的质子数与中子数一定相等
C.原子中质子数和核外电子数相等
D.原子是不能再分的最小粒子
26.原子结构模型的建立经过了几代科学家的艰辛努力,直到现在仍在探索中。其中,行星模型的提出标志着原子结构现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子4个中子。不能根据原子结构的行星模型得出的结论是( )
A.原子始终在做无规则的运动
B.原子核的体积只占整个原子体积的很小一部分
C.构成原子核的粒子之间存在一种互相吸引的力
D.原子呈电中性
27.在原子结构中,下列等式成立的是( )
①中子数=质子数②核电荷数=电子数
③质子数=电子数④核电荷数=中子数
A.①④ B.①③ C.②③ D.①②③
28.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法中正确的是( )
A.决定该原子种类的粒子是b B.原子中b与c的数目一定相同
C.原子中a与c的数目一定相同 D.原子的质量集中在a和c上
29.我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示,下列有关说法正确的是( )
A.电子在离核远近不同的区域中运动
B.所有原子中,质子数=中子数=核外电子数
C.质子和中子由更小的、不能再分的夸克构成
D.中子的质量相对于带电的质子和电子,可以忽略
30.如图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。下列说法中正确的是( )
A.该原子核外有6个电子
B.该原子的核电荷数为4
C.该原子带电
D.该原子核由2个质子和2个中子构成
八、同位素与元素
31.根据三种不同的原子(如表所示),判断下列说法中正确的是( )
原子种类 A原子 B原子 C原子
质子数 8 8 7
中子数 8 9 7
A.A和B是同一种元素 B.A和B的核电荷数不同
C.B和C的核外电子数相等 D.B和C互为同位素原子
32.理清科学概念是学好科学的前提,科学上把具有相同核电荷数的一类原子总称为 ;互为同位素原子所具有的特征是原子核内的质子数相同、 数不同。
33.右表微粒中,属于同种元素的是 。互为同位素原子的是 。
组别 质子 中子 电子
A 14 14 14
B 17 18 17
C 17 20 17
D 17 18 18
34.化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,则1735Cl和1737Cl( )
A.属于同种元素 B.原子核内质子数不同
C.原子中核外电子数不同 D.原子中含有相同数目的中子
答案解析
1.D
A.用带箭头的直线表示光线,属于模型,故A不合题意;
B.磁感线并不存在,用它描述磁场的分布规律,属于模型,故B不合题意;
C.用大圆表示氧原子,用小圆表示氢原子,用 表示水分子,属于模型,故C不合题意;
D.用字母H表示氢元素,是符号,不属于模型,故D符合题意。
故选D。
2.A
模型可以是某种物体放大或缩小的复制品,可以是一幅图、一张表或计算机图像,可以表示一个过程,如描述水的三态变化的示意图 ,有的模型是抽象的,如一些数学公式;
A.电流表属于符号,错误;
B.眼球结构属于模型,正确;
C.地球仪属于模型,正确;
D.动物细胞图属于模型,正确;
故答案为:A.
3.C
A.公式反映的是电流与电压、电阻的等量关系,属于物理模型;
B.此图水分子结构模型;
C.此图为金属元素符号,不属于模型;
D.此图为漏斗模型。
故选C。
4.A
一滴水的体积就非常小,但其中还有1.67×1021个水分子,这说明水分子的体积很小,故A正确,而B、C、D错误。
故选A。
5.A
根据图片可知,甲烷燃烧过程中分子为:、、、,即分子有4种。
而原子为:、、,即原子有3种。
故选A。
6.A
分子是保持物质化学性质的最小微粒,则一氧化碳和二氧化碳的化学性质不同的原因为构成物质的分子不同,故A正确,而B、C、D错误。
故选A。
7.(1)2;3;5;4;3
(2)构成分子的原子可以是同种原子,也可以是不同种原子(合理即可)
(3)种类相同、个数不同的原子,可构成不同物质的分子(合理即可)
(1)①根据图片可知,过氧化氢分子中有2种原子,
②根据图片可知,甲醛分子中有3种原子;
③根据图片可知,1个甲烷分子中有5个原子;
④根据图片可知,1个甲醛分子中有4个原子,
⑤根据图片可知,1个水分子中有3个原子。
(2)根据图片和可知,构成分子的原子可以是同种原子,也可以是不同种原子。
(3)根据图片和可知,种类相同、个数不同的原子,可构成不同物质的分子。
8.(1)构成物质的分子不同(或每个分子含的氧原子个数不同)
(2)过氧化氯(Cl2O2)
(1)氧气分子由两个氧原子构成,臭氧分子由三个氧原子构成,则:氧气和臭氧的化学性质不同的原因:构成物质的分子不同(或每个分子含的氧原子个数不同)。
(2)根据图片可知,反应前后过氧化氯的质量和化学性质保持不变,因此催化剂为过氧化氯。
9.D
根据化学式PH3可知,磷化氢分子由1个磷原子和3个氢原子构成,故D正确,而A、B、C错误。
故选D。
10.C
当容器中的水发生汽化变成水蒸气后,水分子本身没有发生改变,只是分子之间的空隙增大了。从宏观上看,就是水蒸气的体积变大了,即相同体积的空间内,水分子的个数减少了。
故C正确,而A、B、D错误。
故选C。
11.D
A.分子可以构成物质,故A正确不合题意;
B.由分子构成的物质,分子是保持其化学性质的最小粒子,故B正确不合题意;
C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子,故C正确不合题意;
D.分子和原子之间都有空隙,但是分子间的空隙不一定大于原子之间的空隙,故D错误符合题意。
故选D。
12.C
水电解的过程,其实就是水分子先分解为原子,原子再重新结合生成氧分子和氢分子的过程,那么分子发生改变,而氢原子和氧原子保持不变。
故C正确,而A、B、D错误。
故选C。
13.(1)氢原子;氧原子;氢原子和氧原子;氢分子和氧分子;水分子
(2)原子;原子;在化学变化中,分子可以再分,而原子不可以再分
(1)从微观粒子角度,水通电时,水分子分裂成氢原子和氧原子,分裂出来的氢原子和氧原子又重新组合成氢分子和氧分子,它们不再有水的化学性质。可见,水分子是保持水的化学性质的最小微粒。
(2)由该实验可知,分子由原子构成,原子是化学变化中的最小粒子。分子和原子的本质区
别是:在化学变化中,分子可以再分,而原子不可以再分。
14.分子;原子;原子;分子;距离;分子
化学变化的实质是变化中分子分裂成原子,原子重新组合成新的分子,物理变化只是分子的间隔发生改变,没有生成新的分子;
故答案为:分子;原子;原子;分子;距离(或间隔);分子。
15.C
分子和原子都在不停的运动,都能直接构成物质,而质量大小并不确定。二者的不同为:在化学变化中 ,原子不能再分,而分子可以再分,故C正确,而A、B、D错误。
故选C。
16.C
A.分子和原子都能直接构成物质,故A错误;
B.分子质量不一定比原子大,故B错误;
C.在化学反应中,分子可分,原子不可分,故C正确;
D.分子间和原子间都有空隙,故D错误。
故选C。
17.C
A.水分子由一个氧原子和两个氢原子构成,二氧化碳分子由一个碳原子和两个氧原子构成,故A正确不合题意;
B.比较水分子和二氧化碳分子,说明分子可以由不同种类的原子构成,故B正确不合题意;
C.根据图片可知,水分子中的氧原子比氢分子体积大,故C错误符合题意;
D.比较氮气分子和氢气分子,说明一个分子可以由种类相同的原子构成,故D正确不合题意。
故选C。
18.D
①分子可由原子构成,故①正确;
②③分子是可能由一种原子构成的,也可能由多种原子构成,故②、③错误;
④有些物质由分子构成,有些物质由离子或原子构成,故④错误;
⑤分子是构成物质的微粒之一,故⑤正确。
那么正确的是①⑤。
故选D。
19.B
正确的排列顺序为:③道尔顿:原子是一个实心球;
①汤姆生:原子像面包镶嵌着葡萄干;
②卢瑟福:原子是一个核式结构;
④波尔:核外电子分层排布。
故B正确,而A、C、D错误。
故选B。
20.D
①原子可以再分,分成原子核和核外电子,而不是不能再分的粒子,论点不确切;②质子数相同的原子可能中子数不同,则质量不相同,论点不确切;③原子是由居于中心的原子核和核外运动的电子,原子不是微小的实心球体 ,论点不确切;
故选D。
21.C
A.卢瑟福——发现原子的核式模型,故A错误;
B.法拉第——发现了电磁感应现象,故B错误;
C.拉瓦锡——发现空气由氮气和氧气组成,故C正确;
D.奥斯特——发现通电导线周围存在磁场,故D错误。
故选C。
22.C
A.汤姆生、卢瑟福两位科学家都是在实验的基础上,通过推理和想象建构原子模型,故A正确不合题意;
B.汤姆生发现了电子,证实原子是可分的,故B正确不合题意;
C.原子的最外层电子数发生变化时,但是原子中间的质子数保持不变,因此元素种类不变,故C错误符合题意;
D.原子的种类由原子核决定,故D正确不合题意。
故选C。
23.D
A.根据图片可知,只有极少数a粒子发生大角度的散射,说明原子核内部绝大部分都是空的,故A正确不合题意;
B.a粒子带正电荷,则它可能是某种物质的原子核,故B正确不合题意;
C.图乙所示原子核式结构是一种模型,故C正确不合题意;
D.卢瑟福在研究过程中使用了推理法和模型法,没有使用控制变量法,故D错误符合题意。
故选D。
24.(1)不会;原子核
(2)C
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就不会发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是原子核。
(2)通过α粒子的散射实验可知,原子内部大部分都是空的,中间为体积很小的原子核,但质量却很大,故选C。
25.C
A.原子不显电性是因为原子核带的正电荷数与电子带的负电荷数相等,故A错误;
B.原子中的质子数与中子数不一定相等,故B错误;
C.原子中质子数和核外电子数相等 ,故C正确;
D.原子由原子核和核外电子构成,它可以再分,故D错误。
故选C。
26.A
A、该模型只给出了原子的内部构成,不能得出原子总是不断运动的结论,符合题意;
B、由模型可得出原子核的体积只占整个原子体积的很小一部分 ,不符合题意;
C、由行星模型可知,构成原子核的粒子之间存在一种互相吸引的力 ,不符合题意;
D、由行星模型可知,构成原子中子不带电,质子和电子所带电量相等,电性相反应,所以原子呈中性,不符合题意;
故选A。
27.C
在原子中,质子数=核电荷数=电子数,而中子数与质子、电子则不一定相等;
故选C。
28.C
A、 决定该原子种类的粒子质子,质子是原子核的构成粒子,带正电核由图示可知,C为质子 ,不符合题意;
B、b为中子,c为质子,在 原子中b与c的数目不一定相同 ,不符合题意;
C、 a为电子,c为质子,原子中a与c的数目一定相同 ,符合题意;
D、 原子的质量集中在原子核上,即b和c上 ,不符合题意;
故选C。
29.A
A.电子在离核远近不同的区域中运动,故A正确;
B.所有原子中,质子数=核外电子数,但是质子数不一定等于中子数,故B错误;
C.质子和中子由更小的夸克构成,而夸克也可以再分,故C错误;
D.中子的质量较大,不能忽略,故D错误。
故选A。
30.D
A.根据图片可知,原子核外有2个电子,故A错误;
B.根据核电荷数=核外电子数可知,该原子的核电荷数为2,故B错误;
C.该原子的正电荷数和负电荷数都是2,相互抵消,因此不带电,故C错误;
D.根据图片可知,该原子由2个质子和2个中子构成,故D正确。
故选D。
31.A
A、A和B质子数相同,属于同种元素,符合题意;
B、 A和B质子数相同,则核电荷数也相同 ,不符合题意;
C、原子中质子数=电子数, B和C的核外电子数不相等 ,不符合题意;
D、 B和C质子数不同,不是互为同位素原子 ,不符合题意;
故选A。
32.元素;中子
科学上把具有相同核电荷数的一类原子总称为元素;互为同位素原子所具有的特征是原子核内的质子数相同、中子数不同。
33.BCD;BC
根据表格可知,B、C、D三种原子的质子数相同,因此为同种元素;而B、C两种原子的质子数相同而中子数不同,为同位素原子。
34.A
A、决定元素种类的是质子数(或核电荷数),质子数都是17,所以属于同种元素,故A正确;
B、质子数都是17,故B错;
C、核外电子数等于核内质子数,都是17,故C错;
D、中子数不同,一个是18,一个是20,故D错。
故答案为:A
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
浙教版八下科学第五周周末专题(2.1-2.3)
区分符号与模型
1.模型法是学习科学的重要方法。下列不属于模型的是( )
A.光线 B.磁感线
C.水分子 D.氢元素
2.模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物,仔细观察下列四幅图片,不属于模型的是 ( )
A.电流表B.眼球结构C.地球仪D.动物细胞
3.下列各项中,不属于模型的是( )
A.欧姆定律 B. 水分子 C.金属元素钠 D. 漏斗
二、构成物质的粒子模型
4.“一滴水中约有1.67×1021个水分子”说明了( )
A.分子很小 B.分子可以再分
C.分子之间有空隙 D.分子在不断地运动
5.图为甲烷燃烧过程的微观示意图,图中出现的分子和原子的种类分别为( )
A.4和3 B.2和3 C.3和4 D.3和3
6.一氧化碳和二氧化碳的化学性质不同的主要原因是( )
A.构成物质的分子不同 B.密度不同
C.生成它们的反应条件不同 D.用途不同
7.根据图,回答下列问题。
(1)过氧化氢分子中有 种原子,甲醛分子中有 种原子;1个甲烷分子中有 个原子,1个甲醛分子中有 个原子,1个水分子中有 个原子。
(2)比较氢分子与水分子,可得出的结论为_____________________________________________
。
比较过氧化氢分子和水分子、乙炔分子和甲烷分子,可得出的结论____________________
。
8.为了贯彻“碳达峰”、“碳中和”理念,冬奥会摒弃了用氟利昂做制冷剂,而是采用了二氧化碳跨临界制冷制冰技术,原因是氟利昂会破坏臭氧层,其破坏过程见下图。
(1)从微观解释氧气和臭氧的化学性质不同的原因_______________________________________
。
(2)在氟利昂破坏臭氧层的过程中作为催化剂的是 。
9.英国科学家在金星大气层中发现了“生物标志”——磷化氢(PH3)气体。如果用“O”表示氢原子,用“”表示磷原子,则下列模型可以表示磷化氢分子PH3的是( )
A. B. C. D.
三、分子变化实例——水电解
10.提起压在容器中水面上方的活塞,容器中的水汽化,如图所示。下列选项中,最能表示水汽化后相同空间内粒子分布的是( )
A. B. C. D.
11.如图中甲发生的是化学变化,乙发生的是物理变化,下列关于分子和原子的说法中错误的是( )
A.分子可以构成物质
B.由分子构成的物质,分子是保持其化学性质的最小粒子
C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子
D.分子和原子之间都有空隙,分子间空隙比原子间空隙大
12.为了形象展示水分解的微观过程,某同学制作了如下模型表示相应的微观粒子,其中表示水电解反应中不能再分的微粒的是( )
A. B. C. D.
13.如图是电解水的过程中水分子分解的示意图。
(1)从微观粒子角度,水通电时,水分子分裂成 和 ,分裂出来的 又重新组合成 ,它们不再有水的化学性质。可见, 是保持水的化学性质的最小微粒。
(2)由该实验可知,分子由 构成, 是化学变化中的最小粒子。分子和原子的本质区别是 。
14.化学变化的实质是变化中 分裂成 , 重新组合成新的 ;物理变化只是分子间的 发生了改变,没有生成新的 。
四、分子与原子
15.在学习分子和原子的知识后,四位同学对它们的区别作出如下发言:小倩说“区别在于是否在不停地运动”;小丹说“区别在于是否能够构成物质”;小鑫说“区别在于化学反应中是否可分”;小娜说“区别在于分子和原子的大小和质量都不同”。你赞同( )
A.小倩 B.小丹 C.小鑫 D.小娜
16.下列关于分子和原子的说法,正确的是( )
A.分子能直接构成物质,而原子不能
B.分子质量一定比原子大
C.在化学反应中,分子可分,原子不可分
D.分子间有空隙,而原子间无空隙
17.关于下列四种分子的分析不正确的是( )
A.一个水分子和一个二氧化碳分子都由三个原子构成
B.比较水分子和二氧化碳分子,说明分子可以由不同种类的原子构成
C.原子都比分子体积小
D.比较氮气分子和氢气分子,说明一个分子可以由种类相同的原子构成
18.下面有关分子的说法中正确的是( )
①分子可由原子构成②分子是由一种原子构成的③分子是由不同的原子构成的④分子构成了所有物质⑤分子是构成物质的微粒之一
A.①②⑤ B.③④ C.①②④ D.①⑤
五、原子结构模型的建立
19.人类对原子结构的认识为现化量子理论的建立奠定了基础,以下几位科学家对原子的观点,按出现的先后顺序排列正确的是( )
A.③④①② B.③①②④ C.③①④② D.③②①④
20.在化学发展史上,道尔顿提出的近代原子学说对化学的发展起着十分重要的作用,因而拥有“原子之父”的美誉。在他的学说中有下述三个主要论点:①原子是不能再分的粒子;②质子数相同的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代的观点看,你认为这三个论点中不确切的是( )
A.③ B.①③ C.②③ D.①②③
21.下列科学家及其贡献对应正确的是( )
A.卢瑟福——发现原子中存在电子
B.法拉第——通电导线周围存在着磁场
C.拉瓦锡——发现空气由氮气和氧气组成
D.奥斯特——电磁感应现象
22.关于原子及原子结构发现史的说法中不正确的是( )
A.汤姆生、卢瑟福两位科学家都是在实验的基础上,通过推理和想象建构原子模型
B.汤姆生发现了电子,证实原子是可分的
C.原子的最外层电子数发生变化时,元素的种类也发生了变化
D.原子的种类由原子核决定
六、卢瑟福实验
23.如图甲是卢瑟福用a粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了如图乙所示的原子核式结构。下列说法中错误的是( )
A.通过该实验可知原子内部绝大部分是空的
B.a粒子可能是某种原子的原子核
C.图乙所示原子核式结构是一种模型
D.卢瑟福在研究过程中采用了控制变量法
24.探究原子结构的奥秘。
[情境提供]19世纪以前,人们一直以为原子是不可分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
[提出问题]电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
[进行实验]1911年英国科学家卢瑟福进行了著名的a粒子轰击金属箔的实验。如图所示:
①放射源——放射性物质放出 a粒子(带正电荷),质量是电子质量的7 000倍;
②金属箔——作为靶子,厚度 1 μm,重叠了3 000层左右的原子;
③荧光屏——α粒子打在上面发出闪光;
④显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
[收集证据]绝大多数α粒子穿过金属箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大角度的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达180°,像是被金属箔弹了回来。
[猜想与假设] α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构。上,否则大角度的散射是不可能的。
[解释与结论]
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就 (填“会”或“不 会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。
(2)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为 (填字母)。
A. 道尔顿模型特点:不可再分的实心球体
B. 汤姆生模型特点:正负电荷均匀分布
C. 卢瑟福模型特点:核位于原子中心,质量集中在核上
七、原子结构
25.下列有关原子的说法中正确的是( )
A.原子不显电性是因为在原子中不存在带电荷的粒子
B.原子中的质子数与中子数一定相等
C.原子中质子数和核外电子数相等
D.原子是不能再分的最小粒子
26.原子结构模型的建立经过了几代科学家的艰辛努力,直到现在仍在探索中。其中,行星模型的提出标志着原子结构现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子4个中子。不能根据原子结构的行星模型得出的结论是( )
A.原子始终在做无规则的运动
B.原子核的体积只占整个原子体积的很小一部分
C.构成原子核的粒子之间存在一种互相吸引的力
D.原子呈电中性
27.在原子结构中,下列等式成立的是( )
①中子数=质子数②核电荷数=电子数
③质子数=电子数④核电荷数=中子数
A.①④ B.①③ C.②③ D.①②③
28.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法中正确的是( )
A.决定该原子种类的粒子是b B.原子中b与c的数目一定相同
C.原子中a与c的数目一定相同 D.原子的质量集中在a和c上
29.我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示,下列有关说法正确的是( )
A.电子在离核远近不同的区域中运动
B.所有原子中,质子数=中子数=核外电子数
C.质子和中子由更小的、不能再分的夸克构成
D.中子的质量相对于带电的质子和电子,可以忽略
30.如图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。下列说法中正确的是( )
A.该原子核外有6个电子
B.该原子的核电荷数为4
C.该原子带电
D.该原子核由2个质子和2个中子构成
八、同位素与元素
31.根据三种不同的原子(如表所示),判断下列说法中正确的是( )
原子种类 A原子 B原子 C原子
质子数 8 8 7
中子数 8 9 7
A.A和B是同一种元素 B.A和B的核电荷数不同
C.B和C的核外电子数相等 D.B和C互为同位素原子
32.理清科学概念是学好科学的前提,科学上把具有相同核电荷数的一类原子总称为 ;互为同位素原子所具有的特征是原子核内的质子数相同、 数不同。
33.右表微粒中,属于同种元素的是 。互为同位素原子的是 。
组别 质子 中子 电子
A 14 14 14
B 17 18 17
C 17 20 17
D 17 18 18
34.化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,则1735Cl和1737Cl( )
A.属于同种元素 B.原子核内质子数不同
C.原子中核外电子数不同 D.原子中含有相同数目的中子
答案解析
1.D
A.用带箭头的直线表示光线,属于模型,故A不合题意;
B.磁感线并不存在,用它描述磁场的分布规律,属于模型,故B不合题意;
C.用大圆表示氧原子,用小圆表示氢原子,用 表示水分子,属于模型,故C不合题意;
D.用字母H表示氢元素,是符号,不属于模型,故D符合题意。
故选D。
2.A
模型可以是某种物体放大或缩小的复制品,可以是一幅图、一张表或计算机图像,可以表示一个过程,如描述水的三态变化的示意图 ,有的模型是抽象的,如一些数学公式;
A.电流表属于符号,错误;
B.眼球结构属于模型,正确;
C.地球仪属于模型,正确;
D.动物细胞图属于模型,正确;
故答案为:A.
3.C
A.公式反映的是电流与电压、电阻的等量关系,属于物理模型;
B.此图水分子结构模型;
C.此图为金属元素符号,不属于模型;
D.此图为漏斗模型。
故选C。
4.A
一滴水的体积就非常小,但其中还有1.67×1021个水分子,这说明水分子的体积很小,故A正确,而B、C、D错误。
故选A。
5.A
根据图片可知,甲烷燃烧过程中分子为:、、、,即分子有4种。
而原子为:、、,即原子有3种。
故选A。
6.A
分子是保持物质化学性质的最小微粒,则一氧化碳和二氧化碳的化学性质不同的原因为构成物质的分子不同,故A正确,而B、C、D错误。
故选A。
7.(1)2;3;5;4;3
(2)构成分子的原子可以是同种原子,也可以是不同种原子(合理即可)
(3)种类相同、个数不同的原子,可构成不同物质的分子(合理即可)
(1)①根据图片可知,过氧化氢分子中有2种原子,
②根据图片可知,甲醛分子中有3种原子;
③根据图片可知,1个甲烷分子中有5个原子;
④根据图片可知,1个甲醛分子中有4个原子,
⑤根据图片可知,1个水分子中有3个原子。
(2)根据图片和可知,构成分子的原子可以是同种原子,也可以是不同种原子。
(3)根据图片和可知,种类相同、个数不同的原子,可构成不同物质的分子。
8.(1)构成物质的分子不同(或每个分子含的氧原子个数不同)
(2)过氧化氯(Cl2O2)
(1)氧气分子由两个氧原子构成,臭氧分子由三个氧原子构成,则:氧气和臭氧的化学性质不同的原因:构成物质的分子不同(或每个分子含的氧原子个数不同)。
(2)根据图片可知,反应前后过氧化氯的质量和化学性质保持不变,因此催化剂为过氧化氯。
9.D
根据化学式PH3可知,磷化氢分子由1个磷原子和3个氢原子构成,故D正确,而A、B、C错误。
故选D。
10.C
当容器中的水发生汽化变成水蒸气后,水分子本身没有发生改变,只是分子之间的空隙增大了。从宏观上看,就是水蒸气的体积变大了,即相同体积的空间内,水分子的个数减少了。
故C正确,而A、B、D错误。
故选C。
11.D
A.分子可以构成物质,故A正确不合题意;
B.由分子构成的物质,分子是保持其化学性质的最小粒子,故B正确不合题意;
C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子,故C正确不合题意;
D.分子和原子之间都有空隙,但是分子间的空隙不一定大于原子之间的空隙,故D错误符合题意。
故选D。
12.C
水电解的过程,其实就是水分子先分解为原子,原子再重新结合生成氧分子和氢分子的过程,那么分子发生改变,而氢原子和氧原子保持不变。
故C正确,而A、B、D错误。
故选C。
13.(1)氢原子;氧原子;氢原子和氧原子;氢分子和氧分子;水分子
(2)原子;原子;在化学变化中,分子可以再分,而原子不可以再分
(1)从微观粒子角度,水通电时,水分子分裂成氢原子和氧原子,分裂出来的氢原子和氧原子又重新组合成氢分子和氧分子,它们不再有水的化学性质。可见,水分子是保持水的化学性质的最小微粒。
(2)由该实验可知,分子由原子构成,原子是化学变化中的最小粒子。分子和原子的本质区
别是:在化学变化中,分子可以再分,而原子不可以再分。
14.分子;原子;原子;分子;距离;分子
化学变化的实质是变化中分子分裂成原子,原子重新组合成新的分子,物理变化只是分子的间隔发生改变,没有生成新的分子;
故答案为:分子;原子;原子;分子;距离(或间隔);分子。
15.C
分子和原子都在不停的运动,都能直接构成物质,而质量大小并不确定。二者的不同为:在化学变化中 ,原子不能再分,而分子可以再分,故C正确,而A、B、D错误。
故选C。
16.C
A.分子和原子都能直接构成物质,故A错误;
B.分子质量不一定比原子大,故B错误;
C.在化学反应中,分子可分,原子不可分,故C正确;
D.分子间和原子间都有空隙,故D错误。
故选C。
17.C
A.水分子由一个氧原子和两个氢原子构成,二氧化碳分子由一个碳原子和两个氧原子构成,故A正确不合题意;
B.比较水分子和二氧化碳分子,说明分子可以由不同种类的原子构成,故B正确不合题意;
C.根据图片可知,水分子中的氧原子比氢分子体积大,故C错误符合题意;
D.比较氮气分子和氢气分子,说明一个分子可以由种类相同的原子构成,故D正确不合题意。
故选C。
18.D
①分子可由原子构成,故①正确;
②③分子是可能由一种原子构成的,也可能由多种原子构成,故②、③错误;
④有些物质由分子构成,有些物质由离子或原子构成,故④错误;
⑤分子是构成物质的微粒之一,故⑤正确。
那么正确的是①⑤。
故选D。
19.B
正确的排列顺序为:③道尔顿:原子是一个实心球;
①汤姆生:原子像面包镶嵌着葡萄干;
②卢瑟福:原子是一个核式结构;
④波尔:核外电子分层排布。
故B正确,而A、C、D错误。
故选B。
20.D
①原子可以再分,分成原子核和核外电子,而不是不能再分的粒子,论点不确切;②质子数相同的原子可能中子数不同,则质量不相同,论点不确切;③原子是由居于中心的原子核和核外运动的电子,原子不是微小的实心球体 ,论点不确切;
故选D。
21.C
A.卢瑟福——发现原子的核式模型,故A错误;
B.法拉第——发现了电磁感应现象,故B错误;
C.拉瓦锡——发现空气由氮气和氧气组成,故C正确;
D.奥斯特——发现通电导线周围存在磁场,故D错误。
故选C。
22.C
A.汤姆生、卢瑟福两位科学家都是在实验的基础上,通过推理和想象建构原子模型,故A正确不合题意;
B.汤姆生发现了电子,证实原子是可分的,故B正确不合题意;
C.原子的最外层电子数发生变化时,但是原子中间的质子数保持不变,因此元素种类不变,故C错误符合题意;
D.原子的种类由原子核决定,故D正确不合题意。
故选C。
23.D
A.根据图片可知,只有极少数a粒子发生大角度的散射,说明原子核内部绝大部分都是空的,故A正确不合题意;
B.a粒子带正电荷,则它可能是某种物质的原子核,故B正确不合题意;
C.图乙所示原子核式结构是一种模型,故C正确不合题意;
D.卢瑟福在研究过程中使用了推理法和模型法,没有使用控制变量法,故D错误符合题意。
故选D。
24.(1)不会;原子核
(2)C
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就不会发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是原子核。
(2)通过α粒子的散射实验可知,原子内部大部分都是空的,中间为体积很小的原子核,但质量却很大,故选C。
25.C
A.原子不显电性是因为原子核带的正电荷数与电子带的负电荷数相等,故A错误;
B.原子中的质子数与中子数不一定相等,故B错误;
C.原子中质子数和核外电子数相等 ,故C正确;
D.原子由原子核和核外电子构成,它可以再分,故D错误。
故选C。
26.A
A、该模型只给出了原子的内部构成,不能得出原子总是不断运动的结论,符合题意;
B、由模型可得出原子核的体积只占整个原子体积的很小一部分 ,不符合题意;
C、由行星模型可知,构成原子核的粒子之间存在一种互相吸引的力 ,不符合题意;
D、由行星模型可知,构成原子中子不带电,质子和电子所带电量相等,电性相反应,所以原子呈中性,不符合题意;
故选A。
27.C
在原子中,质子数=核电荷数=电子数,而中子数与质子、电子则不一定相等;
故选C。
28.C
A、 决定该原子种类的粒子质子,质子是原子核的构成粒子,带正电核由图示可知,C为质子 ,不符合题意;
B、b为中子,c为质子,在 原子中b与c的数目不一定相同 ,不符合题意;
C、 a为电子,c为质子,原子中a与c的数目一定相同 ,符合题意;
D、 原子的质量集中在原子核上,即b和c上 ,不符合题意;
故选C。
29.A
A.电子在离核远近不同的区域中运动,故A正确;
B.所有原子中,质子数=核外电子数,但是质子数不一定等于中子数,故B错误;
C.质子和中子由更小的夸克构成,而夸克也可以再分,故C错误;
D.中子的质量较大,不能忽略,故D错误。
故选A。
30.D
A.根据图片可知,原子核外有2个电子,故A错误;
B.根据核电荷数=核外电子数可知,该原子的核电荷数为2,故B错误;
C.该原子的正电荷数和负电荷数都是2,相互抵消,因此不带电,故C错误;
D.根据图片可知,该原子由2个质子和2个中子构成,故D正确。
故选D。
31.A
A、A和B质子数相同,属于同种元素,符合题意;
B、 A和B质子数相同,则核电荷数也相同 ,不符合题意;
C、原子中质子数=电子数, B和C的核外电子数不相等 ,不符合题意;
D、 B和C质子数不同,不是互为同位素原子 ,不符合题意;
故选A。
32.元素;中子
科学上把具有相同核电荷数的一类原子总称为元素;互为同位素原子所具有的特征是原子核内的质子数相同、中子数不同。
33.BCD;BC
根据表格可知,B、C、D三种原子的质子数相同,因此为同种元素;而B、C两种原子的质子数相同而中子数不同,为同位素原子。
34.A
A、决定元素种类的是质子数(或核电荷数),质子数都是17,所以属于同种元素,故A正确;
B、质子数都是17,故B错;
C、核外电子数等于核内质子数,都是17,故C错;
D、中子数不同,一个是18,一个是20,故D错。
故答案为:A
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
