第2章 微粒的模型与符号 同步加强练习(2.3-2.4,含解析)
文档属性
| 名称 | 第2章 微粒的模型与符号 同步加强练习(2.3-2.4,含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 542.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-11 16:53:38 | ||
图片预览




文档简介
同步加强练习(2.3-2.4)
、选择题
关于粒子和宇宙的下列说法不正确的是( )
A.哥白尼创立了“日心说”,牛顿创立了万有引力理论
B.原子核是由质子和电子构成的
C.汤姆生发现了电子,从而说明原子是可分的
D.我们认识到,宇宙是一个有层次的天体结构系统
钙是构成人体骨骼和牙齿的重要成分,这里的“钙”是指( )
A.钙单质 B.钙元素 C.钙原子 D.钙离子
化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如C表示核内有6个质子和7个中子的碳原子。下列关于I和I的说法错误的是( )
A.质子数相同 B.中子数相同
C.核外电子数相同 D.属于同种元素
按质量计算,无论在地壳里,还是在空气里,或是在生物的细胞里,其含量很丰富的一种元素是 ( )
A.氢 B.碳 C.氧 D.铝
如图为市场上销售的一种食用盐——竹盐,其中富含钙、镁、锌、硒、铁等。这里的钙、镁、锌、硒、铁是指( )
A.分子 B.原子 C.元素 D.单质
“朝核问题”引发国际关注,核问题的关键是核能的如何利用。已知某种核原料的原子核中含有1个质子和2个中子,那么( )
A. 该原子核带2个单位的正电荷 B. 该元素是金属元素
C. 该原子核外有3个电子 D. 该原子是一种氢原子
人类对原子结构的认识经历了一个相当长的时期.以下是科学家曾提出的原子结构模型(如图所示),其中符合原子结构模型建立先后顺序的是( )
A.①→②→③ B.③→②→① C.①→③→② D.③→①→②
下列叙述中,正确的是( )
A.所有原子的原子核都是由质子、中子构成的
B.物质在不同条件下的三态变化主要是由于分子的大小发生了变化
C.气体易被压缩,说明构成气体的分子在不断运动
D.原子的质量主要集中在原子核上
地壳中含量最多的元素是( )
A.氧 B.硅 C.铝 D.铁
模型法是科学学习重要的方法,如图为原子结构模型的演变图,
①为道尔顿实心球原子模型 ②为玻尔轨道式原子模型,
③为汤姆生葡萄干面包式原子模型 ④为近代电子云原子模型。
下列排列符合历史演变顺序的一组是( )
A.①③②④ B.①②③④ C.①②④③ D.①③④②
下列说法正确的是( )
①地壳中最多的金属元素是铝,也就是金属铝
②人体中只含有非金属元素,没有金属元素
③人体中氢、氧元素含量很高,这与水占人体质量的70%以上有关
④地壳中非金属元素的总含量大于金属元素,种类少于金属元素
A. ①③④ B. ②③④ C. ③④ D. ①②
图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构。下列说法错误的是( )
A.卢瑟福在研究过程中采用了控制变量法
B.α粒子可能是某种原子的原子核
C.图乙所示原子核式结构是一种模型
D.通过该实验可知原子是空心的
“朝核问题”引发国际关注,核问题的关键是核能的如何利用。已知某种核原料的原子核中含有1个质子和2个中子,那么( )
A.该原子核带2个单位的正电荷 B.该元素是金属元素
C.该原子核外有3个电子 D.该原子是一种氢原子
下列因果关系错误的是( )
A.因为分子构成不同,所以水和过氧化氢的化学性质不同
B.因为质子数不同,所以碳原子和氮原子所属的元素种类不同
C.因为碳原子排列方式不同,所以金刚石和石墨的性质完全不同
D.因为电子层数及最外层电子数不同,所以钠原子 和钠离子 的化学性质不同
、填空题
同学们通过学习化学,可以知道:
(1)石灰水中溶质的名称是 ;
(2)地壳中含量最多的金属元素的符号是 ;
(3)鱼类可在水中呼吸,是因为水中溶有一定量的 化学符号表示);
(4)符号“3SO2”的所代表意义为 ,其中的数字“2”所代表意义为 .
X原子的核电荷数为a,其阴离子Xm﹣的电子层结构与Y的阳离子Yn+的电子层结构相同,则Y原子的核电荷数为 。
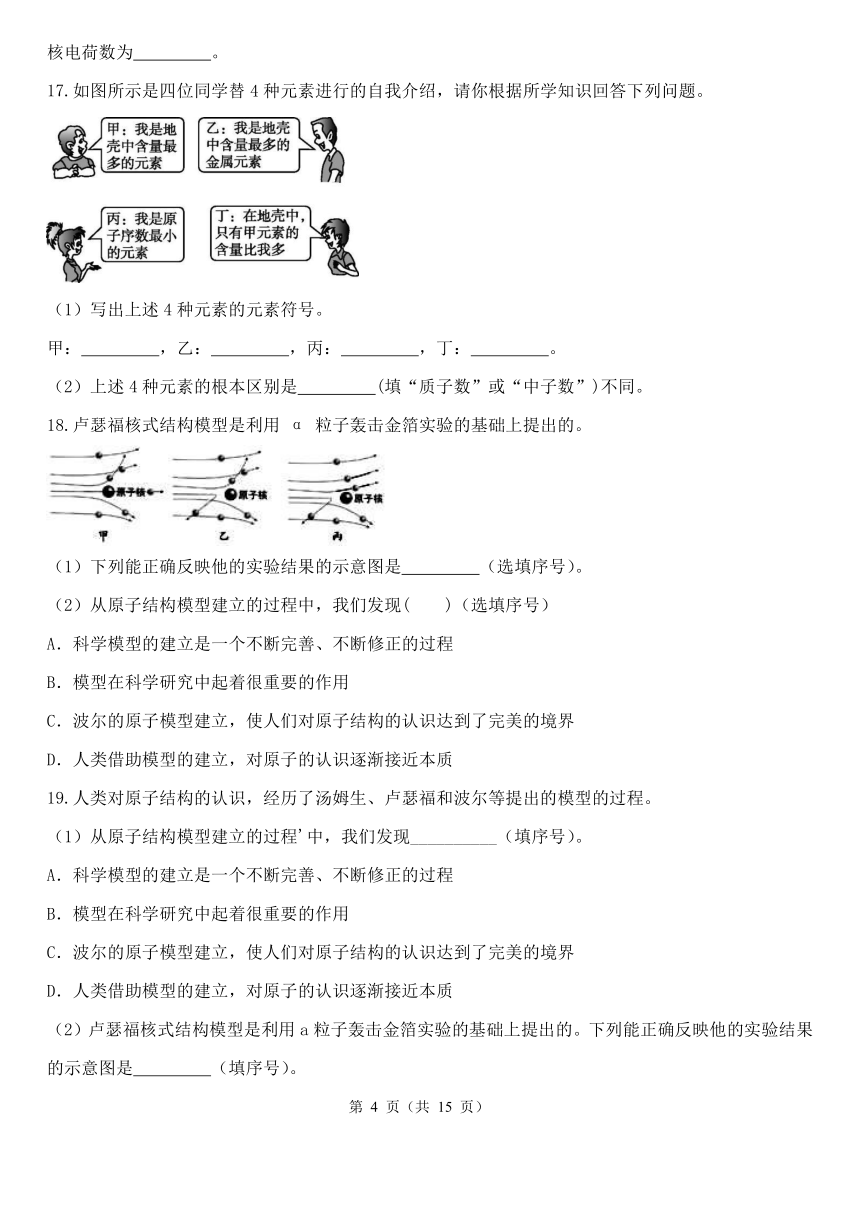
如图所示是四位同学替4种元素进行的自我介绍,请你根据所学知识回答下列问题。
(1)写出上述4种元素的元素符号。
甲: ,乙: ,丙: ,丁: 。
(2)上述4种元素的根本区别是 (填“质子数”或“中子数”)不同。
卢瑟福核式结构模型是利用 α 粒子轰击金箔实验的基础上提出的。
(1)下列能正确反映他的实验结果的示意图是 (选填序号)。
(2)从原子结构模型建立的过程中,我们发现( )(选填序号)
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
人类对原子结构的认识,经历了汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)从原子结构模型建立的过程'中,我们发现__________(填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
(2)卢瑟福核式结构模型是利用a粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
、实验题
为破解原子结构的奥秘,一代又一代科学家进行了不懈探索。
1897年,汤姆生提出了一个原子模型:原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干那样镶嵌在其中。
1911年,英国科学家卢瑟福为探索原子的内部结构,用带正电的α粒子轰击金属箔,发现有如下现象:①大多数α粒子能穿透金属箔而不改变原来的运动方向;②有小部分α粒子改变了原来的运动方向;③有极少部分α粒子被弹了回来。
1913年,丹麦科学家波尔改进了卢瑟福的原子核式结构模型,认为电子只能在原子内的一些特定的稳定轨道上运动。
(1)卢瑟福的α粒子轰击金属箔实验现象中,能证明原子核带正电的现象是 (填序号);
(2)反映卢瑟福α粒子轰击金箔实验结果的示意图最合理的是 (填字母);
(3)上述原子结构模型的建立过程,对你有哪些启示? (写出一点即可)。
伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是——一切东西都是由原子构成的”。人类在探索物质是由什么构成的历史长河中,充满了智慧。
(1)1803年,近代化学之父,英国科学家道尔顿在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。1897年,汤姆生通过实验发现了电子,进一步发展了原子一分子论。汤姆生主要是纠正了“道尔顿原子论”中 的观点。1911年,卢瑟福又通过实验,推测原子由 构成,并提出了沿用至今的现代原子结构理论。
(2)道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,对实验现象进行解释的过程叫作 。
(3)原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了 来表达他们的理论成果。
、解答题
人类对原子结构的认识,经历了道尔顿、汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是 (填“正确”或“错误”)的。
(2)卢瑟福核式结构模型是利用a粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
(3)从原子结构模型建立的过程中,我们发现 (填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
德国科学家埃特尔对一氧化碳在金属铂表面催化下的氧化反应的研究,催生了汽车尾气净化装置,实现了汽车尾气中一氧化碳的清洁排放。
(1) 和 是铂元素的两种同位素原子,则这两种原子的中子个数相差 个 。
(2)下图是汽车尾气净化装置里,一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化过程,则其先后顺序为 。(用图中的序号排列)
同步加强练习(2.3-2.4)答案解析
、选择题
B
【解析】【解答】A.由物理常识可知,白尼创立了“日心说”,牛顿创立了万有引力理论,故A说法正确;
B、原子核是由质子和中子组成,不是质子和电子构成的,故B说法错误;
C、由物理常识可知,汤姆生发现了电子,从而说明原子是可分的,故C说法正确;
D、由物理常识可知,我们认识到,宇宙是一个有层次的天体结构系统,故D说法正确.
故选B.
结合物理学史中对宏观和微观世界的研究结论,对选项中的描述逐一做出判断即可.
B
【解析】钙和磷是构成牙齿和骨骼的重要成分,儿童缺钙易患佝偻病。
【解答】钙是组成人体极为重要的元素,钙是构成人体骨骼和牙齿的重要成分,这里的“钙”是指钙元素,B符合题意。
故答案为:B
B
【详解】
A.I和I中质子数都为53,故A错误。
B、有题意可知,I和I的中子个数分别是131-53=78、127-53=74,故B错误。
C、I和I中质子数都为53,在原子中,质子数=核外电子数,故核外电子数相同,故C正确。
D、I和I中质子数都为53,质子数决定元素种类,所以属于同种元素,故D正确。
故选B。
C
【解析】【解答】地壳、空气、生物细胞中都含有丰富的氧元素。
该题考查了地壳中、空气中、生物细胞中的元素的分布与含量。
C
【解析】元素是具有相同的核电荷数的同一类原子的统称。
【解答】食用盐中的钙、镁、锌、硒、铁都是以化合物的形式存在的,是具有相同核电荷数的同一类原子的统称,因此指的是元素,故C正确,而A.B、D错误。
故选C。
D
B
【详解】
1904年汤姆生提出了葡萄干面包原子模型;1911 年卢瑟福提出原子结构行星模型;1913年波尔提出轨道式原子模型。
故选:B。
D
【详解】
A.氢原子核内只有质子而没有中子,故不正确;
B、物质的三态变化主要是分子间的间隔发生变化,分子的大小不变,故不正确
C、气体易被压缩主要是因为分子间有间隔,故不正确;
D、原子的质量主要集中在原子核上,电子的质量很小,可忽略,故正确。
故选D。
A
【解析】【解答】解:A.氧元素是第一位,故A选项正确;
B、硅元素是第二位,故B选项错误;
C、铝元素是第三位,故C选项错误;
D、铁元素是第四位,故D选项错误;
故选:A.
地壳中元素的质量分数,由高到低的前五种元素分别是:氧、硅、铝、铁、钙.
A
【解析】根据对原子结构探究的科学发展史分析判断。
【解答】关于原子结构探究的历史演变顺序为:
①为道尔顿实心球原子模型;
③为汤姆生葡萄干面包式原子模型;
②为玻尔轨道式原子模型;
④为近代电子云原子模型。
即正确顺序为①③②④。
故选A.
C
A
【解析】(1)探究一个因素对物理量的影响时,保证其它因素相同,这种方法叫控制变量法。
(2)原子核带正电荷;
(3)模型法借助于与原型相似的物质模型或抽象反映原型本质的思想模型,间接地研究客体原形的性质和规律。
(4)根据α粒子偏转的个数分析。
【解答】A.根据实验过程可知,卢瑟福在研究过程中没有采用控制变量法,故A错误符合题意;
B.α粒子带正电荷,可能是某种原子的原子核,故B正确不合题意;
C.图乙所示原子核式结构是一种模型,故C正确不合题意;
D.只有极少数的α粒子发生大角度偏转,这说明原子中间的原子核体积很小,大多数空间都是空的,故D正确不合题意。
故选A.
D
【解析】根据在原子中质子数=电子数,一个质子带一个单位的正电荷,质子数为1的为氢元素分析。
【解答】A.该原子核中含1个质子,所以带1个单位的正电荷,错误;
B、该元素为氢元素,为非金属元素,错误;
C、该原子核外电子数=质子数=1,错误;
D、该原子是一种氢原子,正确;
故答案为:D。
C
【解析】(1)同种分子化学性质相同,不同分子化学性质不同;
(2)决定元素种类的是核内质子数;
(3) 分子的排列方式不会影响化学性质,只会影响物理性质;
(4)决定元素化学性质的是最外层电子数。
【解答】A.同种分子化学性质相同,不同分子化学性质不同,因为分子构成不同,所以水和过氧化氢的化学性质不同,故A正确不合题意;
B.决定元素种类的是核内质子数,碳原子和氮原子的质子数不同,所以所属的元素种类不同,故B正确不合题意;
C.因为碳原子排列方式不同,所以金刚石和石墨的化学性质相同,而物理性质不同,故C错误符合题意;
D.决定元素化学性质的是最外层电子数,钠原子和钠离子的最外层电子数不同,所以钠原子和钠离子的化学性质不同,故D正确不合题意。
故选C。
、填空题
氢氧化钙或熟石灰;Al;O2;三个二氧化硫分子;一个二氧化硫分子中含有两个氧原子
【解析】【解答】(1)石灰水是氢氧化钙的水溶液,因此溶质是氢氧化钙;故答案为:氢氧化钙或熟石灰;
(2)地壳中元素的质量分数,由高到低的前五种元素分别是:氧、硅、铝、铁、钙;因此地壳中含量最多的金属元素是铝元素,故答案为:Al;
(3)鱼类可在水中呼吸,是因为水中溶有一定量的氧气,1体积水中大于溶解30mL氧气,故答案为:O2;
(4)符号“3SO2”的所代表三个二氧化硫分子,其中的数字“2”所代表意义是一个二氧化硫分子中含有两个氧原子.故答案为:三个二氧化硫分子;一个二氧化硫分子中含有两个氧原子.
石灰水是氢氧化钙的水溶液,因此溶质是氢氧化钙;地壳中元素的质量分数,由高到低的前五种元素分别是:氧、硅、铝、铁、钙;氧气能支持燃烧和供给呼吸;化学符号周围的数字表示不同的意义:符号前面的数字,表示原子或分子个数;右上角的数字表示一个离子所带的电荷数;右下角的数字表示几个原子构成一个分子.符号“3SO2”代表三个二氧化硫分子,其中的数字“2”代表意义是一个二氧化硫分子中含有两个氧原子.
a+m+n
【解析】原子失去电子带正电荷,得到电子带负电荷,据此列出方程计算即可。
【解答】设Y原子的核电荷数为z,
则:a+m=z-n;
解得:z=a+m+n。
(1)O;Al;H;Si
(2)质子数
【解析】(1)根据地壳的元素含量的知识分析解答。
(2)根据元素的定义分析解答。
【解答】(1)地壳中含量最多的元素是O,则甲为O;
地壳中含量最多的金属元素为Al,则乙为Al;
原子序数最小的元素是H,则丙为H;
地壳中含量排第二的元素是Si,则丁为Si。
(2)元素是具有相同核电荷数的同一类原子的统称,则元素的本质区别是质子数不同。
(1)乙
(2)A;B;D
【解析】原子不是一个实心球体,原子核体积很小,原子核外的电子质量很小,可以忽略不计,所以大多数α粒子能穿透过去,由于α粒子带正电荷,原子核也带正电荷,同性相斥,所以少数α粒子遇到原子核,就会发生偏向,由于原子的质量主要集中在原子核上,所以极少数α粒子被反弹了回来,或发生了很明显的偏向
【解答】(1)甲α粒子直接穿过原子核,错误,丙α粒子靠近原子核路径变化幅度太小,错误,只有乙满足条件;
(2)A.科学模型的建立是一个不断完善、不断修正的过程,正确;
B、利用模型可以把一些不能直接观察到的事物或者过程呈现出来,在科学研究者作用非常大,正确;
C、波尔的原子模型建立并不是很完美,还有缺点,故错误;
D、人类借助模型的建立,对原子的认识逐渐接近本质,正确。故ABD正确。
故答案为:(1)乙;(2)ABD
(1)A;B;D
(2)乙
【解析】(1)根据自己对科学研究的认识分析判断;
(2)根据电荷之间的相互作用规律分析判断。
【解答】(1)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,可以帮助我们认识世界,故B正确;
C.波尔的原子模型建立,加深了对原子结构的认识,但远没有达到完美的境界,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
(2)α粒子带正电荷,原子核也带正电荷,越靠近原子核的粒子受到的排斥力越大,因此它的运动轨迹偏转的角度越大,而远处的粒子几乎不受影响。
甲:α粒子不可能穿过原子核沿直线传播,故甲错误;
乙:符合上面的分析,故乙正确;
丙:上面的最靠近原子核的α粒子的运动方向的偏转应该比远处的角度更大,故丙错误。
故选乙。
、实验题
(1)②
(2)A
(3)建立模型是一个不断完善不断修正的过程
【解析】(1)原子核带正电荷,α粒子也带正电荷,因此α粒子靠近原子核时会受到排斥力而改变运动轨迹;
(2)α粒子越靠近原子核,它们受到的排斥力越大,它们的运动轨迹偏转的越厉害;
(3)根据自己对原子结构模型建立过程的理解解答。
【解答】(1)有小部分α粒子改变了原来的运动方向,说明它们受到了原子核的排斥力,根据“同种电荷相互排斥”可知,原子核带正电荷,故选②;
(2)α粒子越靠近原子核,它们受到的排斥力越大,它们的运动轨迹偏转的越厉害;少数α粒子正面撞击原子核时甚至沿原方向返回,故反映卢瑟福α粒子轰击金箔实验结果的示意图最合理的是A;
(3)根据题目可知,原子模型不是一下就建立起来的,而是经历了很长时间,历经很多科学家的不断研究而得到的,那么得到的启示为:建立模型是一个不断完善不断修正的过程。
(1)原子不可再分;原子核和核外电子
(2)推理
(3)模型
【解析】(1)道尔顿认为原子最小不可再分,而汤姆生发现了比原子更小的电子,即原子有可能是可以再分的。原子由原子中心的原子核和核外电子构成。
(2)推理,是逻辑学指思维的基本形式之一,是由一个或几个已知的判断(前提)推出新判断(结论)的过程,有直接推理、间接推理等;
(3)模型法即是通过引入模型,能方便我们解释那些难以直接观察到的事物的内部构造,事物的变化以及事物之间的关系的符号、公式、表格、实物等)将物理问题实际化。
【解答】(1)汤姆生主要是纠正了“道尔顿原子论”中 原子不可再分 的观点。1911年,卢瑟福又通过实验,推测原子由原子核和核外电子 构成,并提出了沿用至今的现代原子结构理论。
(2) 道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,对实验现象进行解释的过程叫作推理;
(3)原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了模型来表达他们的理论成果。
、解答题
(1)错误
(2)乙
(3)A;B;D
【解析】(1)原子内部绝大部分都是空的,原子核体积很小质量很大,在原子的中间。电子在周围绕原子核高速旋转,据此分析解答;
(2)根据电荷之间的相互作用规律分析解答;
(3)根据自己对科学研究的认识分析判断。
【解答】(1)根据卢瑟福的核实结构可知,道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是错误的。
(2)a粒子带正电荷,原子核也带正电荷,根据"同种电荷相互排斥”可知,a粒子会受到原子核的排斥力而改变运动方向,即从上方经过的运动轨迹向上弯曲,从下方经过的运动轨迹向下弯曲。极少数a粒子正面撞向原子核,此时它们受到的排斥力最大,几乎沿原路返回,故选乙。
(3)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,故B正确;
C.波尔的原子模型建立,使人们对原子结构的认识达到了新的高度,但是距离完美还有一段距离,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
(1)4
(2)①④⑤③②
【解析】(1)首先用相对原子质量减去质子数得到中子数,然后再将中子数相减即可;
(2)化学变化的本质就是分子分解为原子,原子再重新组合成分子的过程,据此分析解答。
【解答】(1) 的质子数为:202-78=124, 的中子数为:198-78=120,则二者的中子数差为:124-120=4;
(2)一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化过程如下:
①一氧化碳和二氧化氮靠近金属铂表面;
④一氧化碳和二氧化氮分子吸附在金属铂表面;
⑤两种分子在催化作用下分解为原子;
③氮原子结合成氮分子,碳原子和氧原子结合生成二氧化碳分子;
②两种分子脱离金属铂表面。
则顺序为: ①④⑤③② 。
第 1 页(共 1 页)
、选择题
关于粒子和宇宙的下列说法不正确的是( )
A.哥白尼创立了“日心说”,牛顿创立了万有引力理论
B.原子核是由质子和电子构成的
C.汤姆生发现了电子,从而说明原子是可分的
D.我们认识到,宇宙是一个有层次的天体结构系统
钙是构成人体骨骼和牙齿的重要成分,这里的“钙”是指( )
A.钙单质 B.钙元素 C.钙原子 D.钙离子
化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如C表示核内有6个质子和7个中子的碳原子。下列关于I和I的说法错误的是( )
A.质子数相同 B.中子数相同
C.核外电子数相同 D.属于同种元素
按质量计算,无论在地壳里,还是在空气里,或是在生物的细胞里,其含量很丰富的一种元素是 ( )
A.氢 B.碳 C.氧 D.铝
如图为市场上销售的一种食用盐——竹盐,其中富含钙、镁、锌、硒、铁等。这里的钙、镁、锌、硒、铁是指( )
A.分子 B.原子 C.元素 D.单质
“朝核问题”引发国际关注,核问题的关键是核能的如何利用。已知某种核原料的原子核中含有1个质子和2个中子,那么( )
A. 该原子核带2个单位的正电荷 B. 该元素是金属元素
C. 该原子核外有3个电子 D. 该原子是一种氢原子
人类对原子结构的认识经历了一个相当长的时期.以下是科学家曾提出的原子结构模型(如图所示),其中符合原子结构模型建立先后顺序的是( )
A.①→②→③ B.③→②→① C.①→③→② D.③→①→②
下列叙述中,正确的是( )
A.所有原子的原子核都是由质子、中子构成的
B.物质在不同条件下的三态变化主要是由于分子的大小发生了变化
C.气体易被压缩,说明构成气体的分子在不断运动
D.原子的质量主要集中在原子核上
地壳中含量最多的元素是( )
A.氧 B.硅 C.铝 D.铁
模型法是科学学习重要的方法,如图为原子结构模型的演变图,
①为道尔顿实心球原子模型 ②为玻尔轨道式原子模型,
③为汤姆生葡萄干面包式原子模型 ④为近代电子云原子模型。
下列排列符合历史演变顺序的一组是( )
A.①③②④ B.①②③④ C.①②④③ D.①③④②
下列说法正确的是( )
①地壳中最多的金属元素是铝,也就是金属铝
②人体中只含有非金属元素,没有金属元素
③人体中氢、氧元素含量很高,这与水占人体质量的70%以上有关
④地壳中非金属元素的总含量大于金属元素,种类少于金属元素
A. ①③④ B. ②③④ C. ③④ D. ①②
图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构。下列说法错误的是( )
A.卢瑟福在研究过程中采用了控制变量法
B.α粒子可能是某种原子的原子核
C.图乙所示原子核式结构是一种模型
D.通过该实验可知原子是空心的
“朝核问题”引发国际关注,核问题的关键是核能的如何利用。已知某种核原料的原子核中含有1个质子和2个中子,那么( )
A.该原子核带2个单位的正电荷 B.该元素是金属元素
C.该原子核外有3个电子 D.该原子是一种氢原子
下列因果关系错误的是( )
A.因为分子构成不同,所以水和过氧化氢的化学性质不同
B.因为质子数不同,所以碳原子和氮原子所属的元素种类不同
C.因为碳原子排列方式不同,所以金刚石和石墨的性质完全不同
D.因为电子层数及最外层电子数不同,所以钠原子 和钠离子 的化学性质不同
、填空题
同学们通过学习化学,可以知道:
(1)石灰水中溶质的名称是 ;
(2)地壳中含量最多的金属元素的符号是 ;
(3)鱼类可在水中呼吸,是因为水中溶有一定量的 化学符号表示);
(4)符号“3SO2”的所代表意义为 ,其中的数字“2”所代表意义为 .
X原子的核电荷数为a,其阴离子Xm﹣的电子层结构与Y的阳离子Yn+的电子层结构相同,则Y原子的核电荷数为 。
如图所示是四位同学替4种元素进行的自我介绍,请你根据所学知识回答下列问题。
(1)写出上述4种元素的元素符号。
甲: ,乙: ,丙: ,丁: 。
(2)上述4种元素的根本区别是 (填“质子数”或“中子数”)不同。
卢瑟福核式结构模型是利用 α 粒子轰击金箔实验的基础上提出的。
(1)下列能正确反映他的实验结果的示意图是 (选填序号)。
(2)从原子结构模型建立的过程中,我们发现( )(选填序号)
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
人类对原子结构的认识,经历了汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)从原子结构模型建立的过程'中,我们发现__________(填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
(2)卢瑟福核式结构模型是利用a粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
、实验题
为破解原子结构的奥秘,一代又一代科学家进行了不懈探索。
1897年,汤姆生提出了一个原子模型:原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干那样镶嵌在其中。
1911年,英国科学家卢瑟福为探索原子的内部结构,用带正电的α粒子轰击金属箔,发现有如下现象:①大多数α粒子能穿透金属箔而不改变原来的运动方向;②有小部分α粒子改变了原来的运动方向;③有极少部分α粒子被弹了回来。
1913年,丹麦科学家波尔改进了卢瑟福的原子核式结构模型,认为电子只能在原子内的一些特定的稳定轨道上运动。
(1)卢瑟福的α粒子轰击金属箔实验现象中,能证明原子核带正电的现象是 (填序号);
(2)反映卢瑟福α粒子轰击金箔实验结果的示意图最合理的是 (填字母);
(3)上述原子结构模型的建立过程,对你有哪些启示? (写出一点即可)。
伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是——一切东西都是由原子构成的”。人类在探索物质是由什么构成的历史长河中,充满了智慧。
(1)1803年,近代化学之父,英国科学家道尔顿在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。1897年,汤姆生通过实验发现了电子,进一步发展了原子一分子论。汤姆生主要是纠正了“道尔顿原子论”中 的观点。1911年,卢瑟福又通过实验,推测原子由 构成,并提出了沿用至今的现代原子结构理论。
(2)道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,对实验现象进行解释的过程叫作 。
(3)原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了 来表达他们的理论成果。
、解答题
人类对原子结构的认识,经历了道尔顿、汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是 (填“正确”或“错误”)的。
(2)卢瑟福核式结构模型是利用a粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
(3)从原子结构模型建立的过程中,我们发现 (填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
德国科学家埃特尔对一氧化碳在金属铂表面催化下的氧化反应的研究,催生了汽车尾气净化装置,实现了汽车尾气中一氧化碳的清洁排放。
(1) 和 是铂元素的两种同位素原子,则这两种原子的中子个数相差 个 。
(2)下图是汽车尾气净化装置里,一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化过程,则其先后顺序为 。(用图中的序号排列)
同步加强练习(2.3-2.4)答案解析
、选择题
B
【解析】【解答】A.由物理常识可知,白尼创立了“日心说”,牛顿创立了万有引力理论,故A说法正确;
B、原子核是由质子和中子组成,不是质子和电子构成的,故B说法错误;
C、由物理常识可知,汤姆生发现了电子,从而说明原子是可分的,故C说法正确;
D、由物理常识可知,我们认识到,宇宙是一个有层次的天体结构系统,故D说法正确.
故选B.
结合物理学史中对宏观和微观世界的研究结论,对选项中的描述逐一做出判断即可.
B
【解析】钙和磷是构成牙齿和骨骼的重要成分,儿童缺钙易患佝偻病。
【解答】钙是组成人体极为重要的元素,钙是构成人体骨骼和牙齿的重要成分,这里的“钙”是指钙元素,B符合题意。
故答案为:B
B
【详解】
A.I和I中质子数都为53,故A错误。
B、有题意可知,I和I的中子个数分别是131-53=78、127-53=74,故B错误。
C、I和I中质子数都为53,在原子中,质子数=核外电子数,故核外电子数相同,故C正确。
D、I和I中质子数都为53,质子数决定元素种类,所以属于同种元素,故D正确。
故选B。
C
【解析】【解答】地壳、空气、生物细胞中都含有丰富的氧元素。
该题考查了地壳中、空气中、生物细胞中的元素的分布与含量。
C
【解析】元素是具有相同的核电荷数的同一类原子的统称。
【解答】食用盐中的钙、镁、锌、硒、铁都是以化合物的形式存在的,是具有相同核电荷数的同一类原子的统称,因此指的是元素,故C正确,而A.B、D错误。
故选C。
D
B
【详解】
1904年汤姆生提出了葡萄干面包原子模型;1911 年卢瑟福提出原子结构行星模型;1913年波尔提出轨道式原子模型。
故选:B。
D
【详解】
A.氢原子核内只有质子而没有中子,故不正确;
B、物质的三态变化主要是分子间的间隔发生变化,分子的大小不变,故不正确
C、气体易被压缩主要是因为分子间有间隔,故不正确;
D、原子的质量主要集中在原子核上,电子的质量很小,可忽略,故正确。
故选D。
A
【解析】【解答】解:A.氧元素是第一位,故A选项正确;
B、硅元素是第二位,故B选项错误;
C、铝元素是第三位,故C选项错误;
D、铁元素是第四位,故D选项错误;
故选:A.
地壳中元素的质量分数,由高到低的前五种元素分别是:氧、硅、铝、铁、钙.
A
【解析】根据对原子结构探究的科学发展史分析判断。
【解答】关于原子结构探究的历史演变顺序为:
①为道尔顿实心球原子模型;
③为汤姆生葡萄干面包式原子模型;
②为玻尔轨道式原子模型;
④为近代电子云原子模型。
即正确顺序为①③②④。
故选A.
C
A
【解析】(1)探究一个因素对物理量的影响时,保证其它因素相同,这种方法叫控制变量法。
(2)原子核带正电荷;
(3)模型法借助于与原型相似的物质模型或抽象反映原型本质的思想模型,间接地研究客体原形的性质和规律。
(4)根据α粒子偏转的个数分析。
【解答】A.根据实验过程可知,卢瑟福在研究过程中没有采用控制变量法,故A错误符合题意;
B.α粒子带正电荷,可能是某种原子的原子核,故B正确不合题意;
C.图乙所示原子核式结构是一种模型,故C正确不合题意;
D.只有极少数的α粒子发生大角度偏转,这说明原子中间的原子核体积很小,大多数空间都是空的,故D正确不合题意。
故选A.
D
【解析】根据在原子中质子数=电子数,一个质子带一个单位的正电荷,质子数为1的为氢元素分析。
【解答】A.该原子核中含1个质子,所以带1个单位的正电荷,错误;
B、该元素为氢元素,为非金属元素,错误;
C、该原子核外电子数=质子数=1,错误;
D、该原子是一种氢原子,正确;
故答案为:D。
C
【解析】(1)同种分子化学性质相同,不同分子化学性质不同;
(2)决定元素种类的是核内质子数;
(3) 分子的排列方式不会影响化学性质,只会影响物理性质;
(4)决定元素化学性质的是最外层电子数。
【解答】A.同种分子化学性质相同,不同分子化学性质不同,因为分子构成不同,所以水和过氧化氢的化学性质不同,故A正确不合题意;
B.决定元素种类的是核内质子数,碳原子和氮原子的质子数不同,所以所属的元素种类不同,故B正确不合题意;
C.因为碳原子排列方式不同,所以金刚石和石墨的化学性质相同,而物理性质不同,故C错误符合题意;
D.决定元素化学性质的是最外层电子数,钠原子和钠离子的最外层电子数不同,所以钠原子和钠离子的化学性质不同,故D正确不合题意。
故选C。
、填空题
氢氧化钙或熟石灰;Al;O2;三个二氧化硫分子;一个二氧化硫分子中含有两个氧原子
【解析】【解答】(1)石灰水是氢氧化钙的水溶液,因此溶质是氢氧化钙;故答案为:氢氧化钙或熟石灰;
(2)地壳中元素的质量分数,由高到低的前五种元素分别是:氧、硅、铝、铁、钙;因此地壳中含量最多的金属元素是铝元素,故答案为:Al;
(3)鱼类可在水中呼吸,是因为水中溶有一定量的氧气,1体积水中大于溶解30mL氧气,故答案为:O2;
(4)符号“3SO2”的所代表三个二氧化硫分子,其中的数字“2”所代表意义是一个二氧化硫分子中含有两个氧原子.故答案为:三个二氧化硫分子;一个二氧化硫分子中含有两个氧原子.
石灰水是氢氧化钙的水溶液,因此溶质是氢氧化钙;地壳中元素的质量分数,由高到低的前五种元素分别是:氧、硅、铝、铁、钙;氧气能支持燃烧和供给呼吸;化学符号周围的数字表示不同的意义:符号前面的数字,表示原子或分子个数;右上角的数字表示一个离子所带的电荷数;右下角的数字表示几个原子构成一个分子.符号“3SO2”代表三个二氧化硫分子,其中的数字“2”代表意义是一个二氧化硫分子中含有两个氧原子.
a+m+n
【解析】原子失去电子带正电荷,得到电子带负电荷,据此列出方程计算即可。
【解答】设Y原子的核电荷数为z,
则:a+m=z-n;
解得:z=a+m+n。
(1)O;Al;H;Si
(2)质子数
【解析】(1)根据地壳的元素含量的知识分析解答。
(2)根据元素的定义分析解答。
【解答】(1)地壳中含量最多的元素是O,则甲为O;
地壳中含量最多的金属元素为Al,则乙为Al;
原子序数最小的元素是H,则丙为H;
地壳中含量排第二的元素是Si,则丁为Si。
(2)元素是具有相同核电荷数的同一类原子的统称,则元素的本质区别是质子数不同。
(1)乙
(2)A;B;D
【解析】原子不是一个实心球体,原子核体积很小,原子核外的电子质量很小,可以忽略不计,所以大多数α粒子能穿透过去,由于α粒子带正电荷,原子核也带正电荷,同性相斥,所以少数α粒子遇到原子核,就会发生偏向,由于原子的质量主要集中在原子核上,所以极少数α粒子被反弹了回来,或发生了很明显的偏向
【解答】(1)甲α粒子直接穿过原子核,错误,丙α粒子靠近原子核路径变化幅度太小,错误,只有乙满足条件;
(2)A.科学模型的建立是一个不断完善、不断修正的过程,正确;
B、利用模型可以把一些不能直接观察到的事物或者过程呈现出来,在科学研究者作用非常大,正确;
C、波尔的原子模型建立并不是很完美,还有缺点,故错误;
D、人类借助模型的建立,对原子的认识逐渐接近本质,正确。故ABD正确。
故答案为:(1)乙;(2)ABD
(1)A;B;D
(2)乙
【解析】(1)根据自己对科学研究的认识分析判断;
(2)根据电荷之间的相互作用规律分析判断。
【解答】(1)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,可以帮助我们认识世界,故B正确;
C.波尔的原子模型建立,加深了对原子结构的认识,但远没有达到完美的境界,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
(2)α粒子带正电荷,原子核也带正电荷,越靠近原子核的粒子受到的排斥力越大,因此它的运动轨迹偏转的角度越大,而远处的粒子几乎不受影响。
甲:α粒子不可能穿过原子核沿直线传播,故甲错误;
乙:符合上面的分析,故乙正确;
丙:上面的最靠近原子核的α粒子的运动方向的偏转应该比远处的角度更大,故丙错误。
故选乙。
、实验题
(1)②
(2)A
(3)建立模型是一个不断完善不断修正的过程
【解析】(1)原子核带正电荷,α粒子也带正电荷,因此α粒子靠近原子核时会受到排斥力而改变运动轨迹;
(2)α粒子越靠近原子核,它们受到的排斥力越大,它们的运动轨迹偏转的越厉害;
(3)根据自己对原子结构模型建立过程的理解解答。
【解答】(1)有小部分α粒子改变了原来的运动方向,说明它们受到了原子核的排斥力,根据“同种电荷相互排斥”可知,原子核带正电荷,故选②;
(2)α粒子越靠近原子核,它们受到的排斥力越大,它们的运动轨迹偏转的越厉害;少数α粒子正面撞击原子核时甚至沿原方向返回,故反映卢瑟福α粒子轰击金箔实验结果的示意图最合理的是A;
(3)根据题目可知,原子模型不是一下就建立起来的,而是经历了很长时间,历经很多科学家的不断研究而得到的,那么得到的启示为:建立模型是一个不断完善不断修正的过程。
(1)原子不可再分;原子核和核外电子
(2)推理
(3)模型
【解析】(1)道尔顿认为原子最小不可再分,而汤姆生发现了比原子更小的电子,即原子有可能是可以再分的。原子由原子中心的原子核和核外电子构成。
(2)推理,是逻辑学指思维的基本形式之一,是由一个或几个已知的判断(前提)推出新判断(结论)的过程,有直接推理、间接推理等;
(3)模型法即是通过引入模型,能方便我们解释那些难以直接观察到的事物的内部构造,事物的变化以及事物之间的关系的符号、公式、表格、实物等)将物理问题实际化。
【解答】(1)汤姆生主要是纠正了“道尔顿原子论”中 原子不可再分 的观点。1911年,卢瑟福又通过实验,推测原子由原子核和核外电子 构成,并提出了沿用至今的现代原子结构理论。
(2) 道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,对实验现象进行解释的过程叫作推理;
(3)原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了模型来表达他们的理论成果。
、解答题
(1)错误
(2)乙
(3)A;B;D
【解析】(1)原子内部绝大部分都是空的,原子核体积很小质量很大,在原子的中间。电子在周围绕原子核高速旋转,据此分析解答;
(2)根据电荷之间的相互作用规律分析解答;
(3)根据自己对科学研究的认识分析判断。
【解答】(1)根据卢瑟福的核实结构可知,道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是错误的。
(2)a粒子带正电荷,原子核也带正电荷,根据"同种电荷相互排斥”可知,a粒子会受到原子核的排斥力而改变运动方向,即从上方经过的运动轨迹向上弯曲,从下方经过的运动轨迹向下弯曲。极少数a粒子正面撞向原子核,此时它们受到的排斥力最大,几乎沿原路返回,故选乙。
(3)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,故B正确;
C.波尔的原子模型建立,使人们对原子结构的认识达到了新的高度,但是距离完美还有一段距离,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
(1)4
(2)①④⑤③②
【解析】(1)首先用相对原子质量减去质子数得到中子数,然后再将中子数相减即可;
(2)化学变化的本质就是分子分解为原子,原子再重新组合成分子的过程,据此分析解答。
【解答】(1) 的质子数为:202-78=124, 的中子数为:198-78=120,则二者的中子数差为:124-120=4;
(2)一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化过程如下:
①一氧化碳和二氧化氮靠近金属铂表面;
④一氧化碳和二氧化氮分子吸附在金属铂表面;
⑤两种分子在催化作用下分解为原子;
③氮原子结合成氮分子,碳原子和氧原子结合生成二氧化碳分子;
②两种分子脱离金属铂表面。
则顺序为: ①④⑤③② 。
第 1 页(共 1 页)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
