浙教版八下第七周周末专题(2.7化学式的相关计算)含解析
文档属性
| 名称 | 浙教版八下第七周周末专题(2.7化学式的相关计算)含解析 |  | |
| 格式 | doc | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-20 09:55:06 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2.7化学式的相关计算
相对原子质量计算
1.已知一个镁原子的质量为m,则一个碳-12原子的质量为( )
A.m B.0.5m C.2m D.12
2.已知某氧原子的实际质量为m,其相对原子质量为16。有一种铕原子的相对原子质量为152,该铕(Eu)原子的质量为( ) 21·世纪*教育网
A. B. g C. D. g
3.某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为 ( )
A.x+y B.x+n-y C.x-n+y D.x+y+n
4.已知某元素的原子与碳-12原子的质量比为9∶1,则该元素的相对原子质量为( )
A.108 B.1.33
C.108 g D.1.33 g
相对分子质量计算
5.维生素C(化学式:C6H8O6)对人体皮肤和牙龈健康有重要作用,缺乏维生素C,会引起坏血病,中学生每天需要补充60mg维生素C,请阅读信息后回答:
2·1·c·n·j·y
(1)维生素C中有 种元素组成
(2)维生素C分子的相对分子质量是 。
6.山林里空气中的自由电子附着在氧分子,上形成负氧离子( ),被称为“空气维生素”,那么 的相对分子质量是( ) www-2-1-cnjy-com
A.16 B.32 C.32克 D.33
7.在19世纪,化学家对氧化锆的化学式有争议。经测定,锆(Zr)的相对原子质量为91,其氯化物的相对分子质量是233。若氧化锆中锆的化合价与氯化物中相同,则氧化锆的化学式为 ( )
A.ZrO2 B.Zr2O C.Zr2O3 D.ZrO
8.“2MgO"的相对分子质量总和的计算式正确的是( )
A.2×24×16 B.2×24+16 C.2+24+16 D.2×(24+16)
元素质量比
9.乙炔是一种简单的有机物,其分子结构模型如下图所示(其中大球代表碳原子,小球代表氢原子),乙炔中碳、氢两种元素的质量比为
10.我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得2015年诺贝尔生理学或医学奖。回答下列问题。
(1)一个青蒿素分子中含有 个原子。
(2)青蒿素中的氢元素与氧元素的质量比是 。
11.燃放爆竹时会产生多种污染性气体,其中两种元素的质量比为1∶1的气体是( )
A.CO B.NO C.NO2 D.SO2
四、某元素的质量分数
12.科学家最近在-100℃的低温下合成一种化合物X,此分子模型如图,其中每个代表一个碳原子,每个代表一个氢原子。请完成以下问题: 21·cn·jy·com
(1)该分子的化学式是 ;
(2)该分子的相对分子质量为 ;
(3)该分子中碳元素的质量分数是 。
五、计算一定质量的化合物中某元素的质量
13.呋喹替尼(C21H19N3O5)胶囊是一款由我国企业自主研发的第一款创新抗癌药,该药是目前国内唯一获批的针对转移性结直肠癌的靶向药物,该药基本信息如图所示。
(1)呋喹替尼中氢元素和氮元素的质量比为
(2)每粒该胶囊中含呋喹替尼5mg,则每粒胶囊中含氮元素质量为多少mg? (计算结果准确到0.01mg)
14.“青团”是宁波的一种传统食物。在“青团”制作过程中,需要往糯米粉中添加艾草(或艾草汁)。艾草含有侧柏莲酮芳香油(C10H10O),侧柏莲酮芳香油是一种淡黄色液体,具有香脂香气,所以“青团”具有独特风味。
(1)侧柏莲酮芳香油由 种元素组成。
(2)7.3 g侧柏莲酮芳香油中碳元素的质量为 g。
15.茶叶中含茶氨酸(C7H14N2O3),茶氨酸中各元素的质量分数如图所示。其中①表示的元素是( )
A.碳 B.氢 C.氧 D.氮
16.通过高粱、玉米和薯类等发酵、蒸馏可得到乙醇,乙醇属于可再生资源。已知乙醇的化学式为C2H5OH。请回答: 【出处:21教育名师】
(1)乙醇中碳、氢、氧三种元素的质量比是 。
(2)等质量的乙醇和甲醇(化学式为CH3OH)中碳元素的质量比为 。
六、求化学式
17.回答下列问题。
(1)X、Y两种元素的相对原子质量之比为7∶2,X与Y组成的化合物中,X、Y两种元素的质量之比为21∶8,则该化合物的化学式可表示为 。
21教育名师原创作品
(2)已知X、Y两种元素的相对原子质量之比为2∶1,由这两种元素组成的化合物中,X、Y的质量之比为2∶3,其中X的化合价为+a,则在该化合物中Y的化合价为 。
18.(1)在K2R2O7中(R代表某种元素)含钾元素26.5%,含氧元素38.1%,R的相对原子质量是 。
(2)甲、乙两种化合物中都只含有X、Y两种元素,甲、乙两种化合物中X元素的质量分数分别为50%和40%。若已知甲的化学式为XY2,则乙的化学式为 。
19.某“高能气”是近几年才上市的一种新燃料,其化学式可表示为CxHy。已知该化合物中,碳元素和氢元素的质量比为9:2,则该化合物的化学式可能是( )
A.C9H2 B.C8H3 C.C3H8 D.CH4
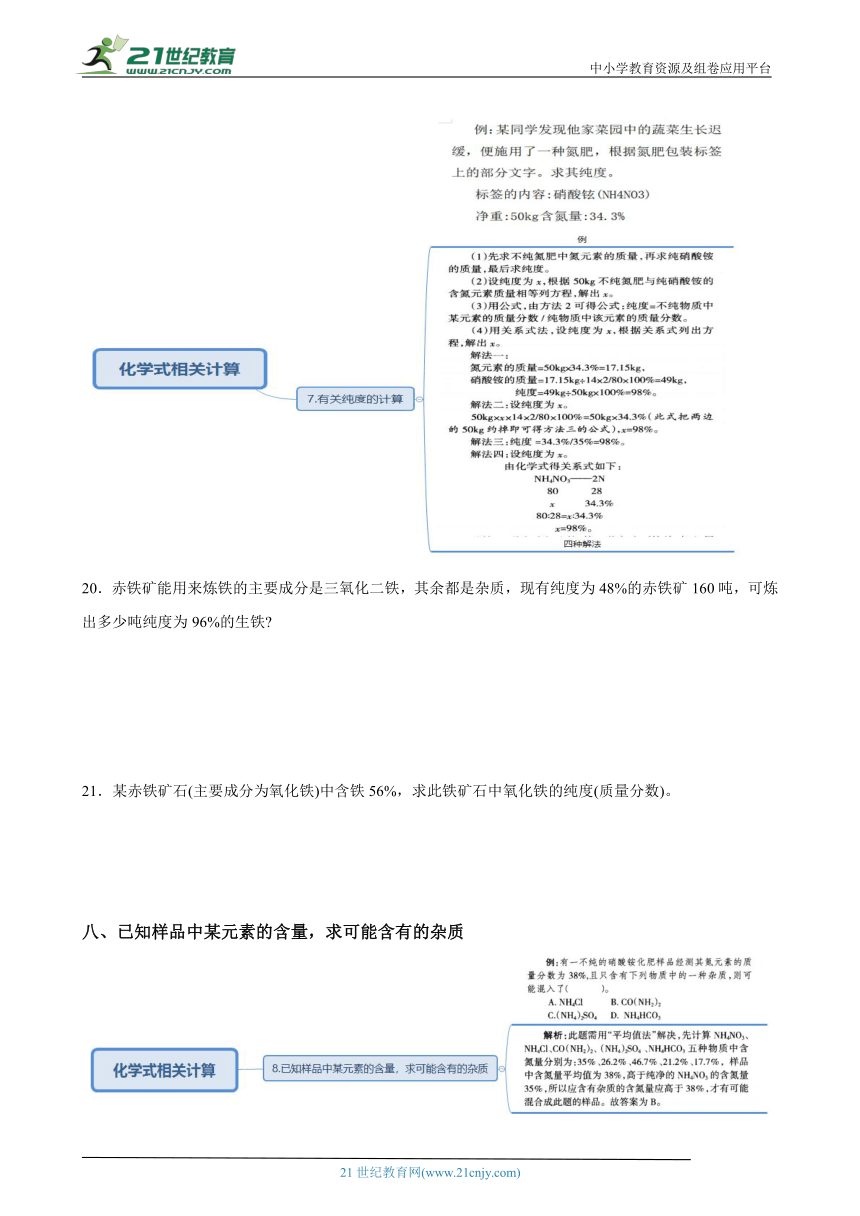
七、有关纯度计算
20.赤铁矿能用来炼铁的主要成分是三氧化二铁,其余都是杂质,现有纯度为48%的赤铁矿160吨,可炼出多少吨纯度为96%的生铁
21.某赤铁矿石(主要成分为氧化铁)中含铁56%,求此铁矿石中氧化铁的纯度(质量分数)。
八、已知样品中某元素的含量,求可能含有的杂质
22.只含铜和氧两种元素的固体样品18g,测得铜元素的质量为16g。已知铜的氧化物有CuO和Cu2O。请通过分析或计算回答下列问题:
(1)该样品的组成情况有 。(写出所有可能的组成);
(2)若固体样品由两种物质组成,则质量偏少的那种物质在样品中的质量分数为 。(用分数表示)
23.有一包含有杂质的硫酸铵【(NH4)2SO4】样品,经过分析可知其中氮元素的质量分数为 20%,那么可能含有的下列物质是( )
A.NH4HCO3 B.NH4NO3 C.CO(NH2)2 D.NH4Cl
24.含有杂质的某硝酸铵样品,经测定其含氮元素的质量分数为40%,则其所含有的杂质一定有( )
A.CO(NH2)2 B.NH4HCO3 C.NH4Cl D.(NH4)2SO4
九、已知混合物中各成分化学式及某元素的质量分数,求另一种元素的质量
25.在CO、HCOOH、OHC-COOH的混合物中,已知氢元素的质量分数为y,则碳元素的质量分数为( )
A. (1-9y) B. (1-y) C. (1-y) D. (1-6y)
26.已知MgSO3和MgHPO4组成的混和物中含镁为18%,则含氧约为( )
A.18% B.30% C.58% D.无法确定
27.由MgS、MgSO3、NaHSO4组成的混合物中,硫元素的质量分数为a,则氧元素的质量分数为
十、已知混合物中两种元素原子个数比或质量比求物质质量比
一定质量的SO2 和SO3,其中氧元素的质量相等,则 SO2 和SO3 的质量比是 ,
SO2 和SO3 的分子个数比是 。
十一、已知物中某元素的质量或质量分数,求含某物质的质量或质量分数
答案解析
1.B
镁的相对原子质量为24,一个镁原子的质量为m,则一个碳-12原子的质量为 = 0.5m;
故选B。
2.A
已知某氧原子的实际质量为mg,其相对原子质量为16,
有一种铕(Eu)原子的相对原子质量为152,
设铕(Eu)原子的质量为x,
则x:mg=152:16,
解得:。
故A。
3.D
某阳离子Mn+的核外电子共有x个电子,它是由该原子失去n个电子形成的,那么该原子的核外电子数为:x+n。
根据“质子数=核外电子数”可知,该原子的质子数为x+n;
那么它的相对原子质量为:x+n+y。
故选D。www.21-cn-jy.com
4.A
已知某元素的原子与碳-12原子的质量比为9∶1,
设碳原子的质量为m,则该原子的质量为9m,
那么该元素的相对原子质量为:.
故选A。
5.(1)3
(2)176
(1)由化学式可知 维生素C中含有C、H、O三种元素。
(2) 维生素C分子的相对分子质量=12×6+1×8+16×6=176.
故答案为:(1)3;(2)176
6.B
O2-的相对分子质量是 16×=32。
故选B。
7.A
设锆元素的化合价为+X,由氯的化合价为-1价,则氯化物的化学式为:ZrClx;
因为锆的氯化物的相对分子质量为233。
所以:91+35.5X=233,
解得:x=4;
因为在锆的氧化物中锆的化合价是+4价,氧元素的化合价是-2价。
设该氧化物的化学式为ZrzOy,
根据正负化合价代数和为零得到:(+4)z+(-2)y=0;
解得:z:y=1:2。
所以氧化物的化学式为ZrO2,
故选A。21世纪教育网版权所有
8.D
相对分子质量等于相对原子质量与个数的乘积之和。根据化学式2MgO可知,它的相对分子质量总和为:2×(24×1+16×1)=2×(24+16),故D正确,而A、B、C错误。
故选D。2-1-c-n-j-y
9.12:1
由乙炔的分子结构模型可以看出,乙炔的化学式为C2H2,根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得乙炔中碳、氢元素的质量比为(12×2):(1×2)=12:1。
故答案为:12:1。【来源:21·世纪·教育·网】
10.(1)42
(2)11:40
(1)一个青蒿素分子是由15个碳原子、22个氢原子和5个氧原子构成的,即一个青蒿素分子含有42个原子,故42
(2)青蒿素中氢氧元素质量之比为,故11:40
故答案为:(1)42(2)11:4021*cnjy*com
11.D
A.CO中C、O的质量之比为:12:16=3:4,故A不合题意;
B.NO中N、O的质量之比:14:16=7:8,故B不合题意;
C.NO2中N、O的质量之比:14:(16×2)=7:16,故C不合题意;
D.SO2中S、O的质量之比为:32:(16×2)=1:1,故D符合题意。
故选D。
12.(1)C5H4
(2)64
(3)93.75%
(1)根据图片可知,该分子由5个碳原子和4个氢原子构成,写作: C5H4 。
(2)根据化学式C5H4可知,该分子的相对分子质量为:12×5+1×4=64。
(3)该分子中碳元素的质量分数:。21*cnjy*com
13.(1)19:42
(2)每粒胶囊中含氮元素质量:。
(1)根据化学式 C21H19N3O5 可知,
呋喹替尼中氢元素和氮元素的质量比:(1×19):(14×3)=19:42;
(2)每粒胶囊中含氮元素质量:。
14.(1)3(或三)
(2)6
(1)根据化学式 C10H10O 可知,侧柏莲酮芳香油由C、H、O共三种元素组成;
(2)7.3g侧柏莲酮芳香油中碳元素的质量:。
15.A
茶氨酸中碳、氢、氮、氧四种元素的质量比为:(12×7):(1×14):(14×2):(16×3)=42:7:14:24,则①表示的元素是茶氨酸中质量分数最大的碳元素。
故选A。【版权所有:21教育】
16.(1)12∶3∶8
(2)32∶23
(1)根据化学式 C2H5OH 可知,
乙醇中碳、氢、氧的质量比为:(12×2):(1×6):(16×1)=12:3:8;
(2)设乙醇和甲醇的质量都是m,
则它们中碳元素的质量之比为:。
17.(1)X3Y4
(2)
(1)X、Y两元素的相对原子质量之比为7:2,X与Y形成的化合物中,X、Y两元素的质量之比为21:8,
化合物中X、Y的原子个数比为:.
则该化合物的化学式可表示为 X3Y4。
(2)已知X、Y两元素的相对原子质量之比是2:1,
由这两种元素形成的化合物中,X、Y的质量之比是2:3,
化合物中X、Y的原子个数比为;
化合物的化学式可表示为 XY3.其中X的化合价为+a。
根据化合物中正负化合价的代数和为零,
可得在化合物中Y的化合价为。21cnjy.com
18.(1)52
(2)XY3
(1)设K2R2O7的相对分子量为X,
K2R2O7中氧元素的质量分数:;
解得:x=294,
2R的相对分子质量:294×(1-26.5%-38.1%)≈104;
所以 R的相对原子质量为52;
(2)由题意可知,设X、Y两种元素原子的相对原子质量分别为a和b;
则甲中X元素的百分含量为:,
解得:a=2b ①;
设乙的化学式为:XmYn,
则乙中X元素的百分含量为:②;
①②联立得到:
可得,m:n=1:3;
故乙的化学式XY3。
19.C
碳元素和氢元素的质量之比为9:2,
那么该化学式中碳原子和氢原子的个数之比为:;
那么该化合物的化学式可能为C3H8。
故选C。
20.赤铁矿中三氧化二铁的质量为:160t×48%=76.8t;
设可以炼出生铁的质量为x,
76.8t×=96%x;
解得:x=56t。
21.解:氧化铁的化学式为 Fe2O3,该铁矿石中氧化铁的纯度为56%÷( ×100%)= 80%。
22.(1)Cu2O;CuO 和 Cu;Cu2O、CuO 和 Cu
(2)
(1)固体样品中铜元素的质量分数=;
;
CuO中铜元素的质量分数=;
Cu2O中铜元素的质量分数=;
。
那么样品的组成情况有:
①只有一种物质,Cu2O;
②两种物质:CuO和Cu;
③三者物质:CuO和Cu和Cu2O。
(2)若固体样品由两种物质组成,所以该混合物中一定Cu和CuO,其中铜的含量减少。
设铜的质量分数为a,
则:80%a+(18g-a)=16g;
解得:x=10g;
所以铜为18g-10g=8g,
所以铜的质量分数为。21教育网
23.A
(NH4)2SO4的含氮量为:,因此混入的化肥应小于20%,
A.NH4HCO3的含氮量为:,小于20%,故A符合题意;
B.NH4NO3氮元素的质量分数为 ,大于20%,故B不合题意;
C.CO(NH2)2的含氮量为:,大于20%,故C不合题意;
D.NH4Cl的含氮量为:,大于20%,故D不合题意。
故选A。
24.A
硝酸铵(NH4NO3)中氮元素的质量分数=。
A.CO(NH2)2中氮元素的质量分数为:;
B.NH4HCO3中氮元素的质量分数为:;
C.NH4Cl中氮元素的质量分数为:;
D.(NH4)2SO4中氮元素的质量分数为:;
要使化肥混合后氮元素的质量分数为40%,必须有一种是高于35%的,所以该样品中可能混有杂质是CO(NH2)2。
故选A。
25.A
已知氢元素的质量分数为y,则当做混合物中水的质量分数
因此混合物中当做CO质量分数为(1-9y),则混合物中C元素的质量分数
故答案为:A
26.C
在化学式MgSO3中硫的相对原子质量为32,在MgHPO4中氢和磷相对原子质量的和是32,相当于硫。
由于镁与硫的质量比是24:32=3:4,MgSO3和MgHPO4组成的混和物中含镁为18%,
所以硫的质量分数是:,
所以含氧约为:1-18%-24%=58%。
故选C。
27.
根据等效原理,可以转化为MgS、MgSO3、MgSO4(相当于NaHSO4)组成,
则视为两部分MgS和氧元素组成,
硫元素的质量分数为a,则镁元素的质量分数为;
则氧元素的质量分数为:。
28.6:5;3:2
(1)设SO2的质量为a,SO3的质量为b,
则:;
解得:a:b=6;5。
(2)设SO2的分子数为m,SO3的分子数为n,
则:;
解得:m:n=3:2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2.7化学式的相关计算
相对原子质量计算
1.已知一个镁原子的质量为m,则一个碳-12原子的质量为( )
A.m B.0.5m C.2m D.12
2.已知某氧原子的实际质量为m,其相对原子质量为16。有一种铕原子的相对原子质量为152,该铕(Eu)原子的质量为( ) 21·世纪*教育网
A. B. g C. D. g
3.某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为 ( )
A.x+y B.x+n-y C.x-n+y D.x+y+n
4.已知某元素的原子与碳-12原子的质量比为9∶1,则该元素的相对原子质量为( )
A.108 B.1.33
C.108 g D.1.33 g
相对分子质量计算
5.维生素C(化学式:C6H8O6)对人体皮肤和牙龈健康有重要作用,缺乏维生素C,会引起坏血病,中学生每天需要补充60mg维生素C,请阅读信息后回答:
2·1·c·n·j·y
(1)维生素C中有 种元素组成
(2)维生素C分子的相对分子质量是 。
6.山林里空气中的自由电子附着在氧分子,上形成负氧离子( ),被称为“空气维生素”,那么 的相对分子质量是( ) www-2-1-cnjy-com
A.16 B.32 C.32克 D.33
7.在19世纪,化学家对氧化锆的化学式有争议。经测定,锆(Zr)的相对原子质量为91,其氯化物的相对分子质量是233。若氧化锆中锆的化合价与氯化物中相同,则氧化锆的化学式为 ( )
A.ZrO2 B.Zr2O C.Zr2O3 D.ZrO
8.“2MgO"的相对分子质量总和的计算式正确的是( )
A.2×24×16 B.2×24+16 C.2+24+16 D.2×(24+16)
元素质量比
9.乙炔是一种简单的有机物,其分子结构模型如下图所示(其中大球代表碳原子,小球代表氢原子),乙炔中碳、氢两种元素的质量比为
10.我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得2015年诺贝尔生理学或医学奖。回答下列问题。
(1)一个青蒿素分子中含有 个原子。
(2)青蒿素中的氢元素与氧元素的质量比是 。
11.燃放爆竹时会产生多种污染性气体,其中两种元素的质量比为1∶1的气体是( )
A.CO B.NO C.NO2 D.SO2
四、某元素的质量分数
12.科学家最近在-100℃的低温下合成一种化合物X,此分子模型如图,其中每个代表一个碳原子,每个代表一个氢原子。请完成以下问题: 21·cn·jy·com
(1)该分子的化学式是 ;
(2)该分子的相对分子质量为 ;
(3)该分子中碳元素的质量分数是 。
五、计算一定质量的化合物中某元素的质量
13.呋喹替尼(C21H19N3O5)胶囊是一款由我国企业自主研发的第一款创新抗癌药,该药是目前国内唯一获批的针对转移性结直肠癌的靶向药物,该药基本信息如图所示。
(1)呋喹替尼中氢元素和氮元素的质量比为
(2)每粒该胶囊中含呋喹替尼5mg,则每粒胶囊中含氮元素质量为多少mg? (计算结果准确到0.01mg)
14.“青团”是宁波的一种传统食物。在“青团”制作过程中,需要往糯米粉中添加艾草(或艾草汁)。艾草含有侧柏莲酮芳香油(C10H10O),侧柏莲酮芳香油是一种淡黄色液体,具有香脂香气,所以“青团”具有独特风味。
(1)侧柏莲酮芳香油由 种元素组成。
(2)7.3 g侧柏莲酮芳香油中碳元素的质量为 g。
15.茶叶中含茶氨酸(C7H14N2O3),茶氨酸中各元素的质量分数如图所示。其中①表示的元素是( )
A.碳 B.氢 C.氧 D.氮
16.通过高粱、玉米和薯类等发酵、蒸馏可得到乙醇,乙醇属于可再生资源。已知乙醇的化学式为C2H5OH。请回答: 【出处:21教育名师】
(1)乙醇中碳、氢、氧三种元素的质量比是 。
(2)等质量的乙醇和甲醇(化学式为CH3OH)中碳元素的质量比为 。
六、求化学式
17.回答下列问题。
(1)X、Y两种元素的相对原子质量之比为7∶2,X与Y组成的化合物中,X、Y两种元素的质量之比为21∶8,则该化合物的化学式可表示为 。
21教育名师原创作品
(2)已知X、Y两种元素的相对原子质量之比为2∶1,由这两种元素组成的化合物中,X、Y的质量之比为2∶3,其中X的化合价为+a,则在该化合物中Y的化合价为 。
18.(1)在K2R2O7中(R代表某种元素)含钾元素26.5%,含氧元素38.1%,R的相对原子质量是 。
(2)甲、乙两种化合物中都只含有X、Y两种元素,甲、乙两种化合物中X元素的质量分数分别为50%和40%。若已知甲的化学式为XY2,则乙的化学式为 。
19.某“高能气”是近几年才上市的一种新燃料,其化学式可表示为CxHy。已知该化合物中,碳元素和氢元素的质量比为9:2,则该化合物的化学式可能是( )
A.C9H2 B.C8H3 C.C3H8 D.CH4
七、有关纯度计算
20.赤铁矿能用来炼铁的主要成分是三氧化二铁,其余都是杂质,现有纯度为48%的赤铁矿160吨,可炼出多少吨纯度为96%的生铁
21.某赤铁矿石(主要成分为氧化铁)中含铁56%,求此铁矿石中氧化铁的纯度(质量分数)。
八、已知样品中某元素的含量,求可能含有的杂质
22.只含铜和氧两种元素的固体样品18g,测得铜元素的质量为16g。已知铜的氧化物有CuO和Cu2O。请通过分析或计算回答下列问题:
(1)该样品的组成情况有 。(写出所有可能的组成);
(2)若固体样品由两种物质组成,则质量偏少的那种物质在样品中的质量分数为 。(用分数表示)
23.有一包含有杂质的硫酸铵【(NH4)2SO4】样品,经过分析可知其中氮元素的质量分数为 20%,那么可能含有的下列物质是( )
A.NH4HCO3 B.NH4NO3 C.CO(NH2)2 D.NH4Cl
24.含有杂质的某硝酸铵样品,经测定其含氮元素的质量分数为40%,则其所含有的杂质一定有( )
A.CO(NH2)2 B.NH4HCO3 C.NH4Cl D.(NH4)2SO4
九、已知混合物中各成分化学式及某元素的质量分数,求另一种元素的质量
25.在CO、HCOOH、OHC-COOH的混合物中,已知氢元素的质量分数为y,则碳元素的质量分数为( )
A. (1-9y) B. (1-y) C. (1-y) D. (1-6y)
26.已知MgSO3和MgHPO4组成的混和物中含镁为18%,则含氧约为( )
A.18% B.30% C.58% D.无法确定
27.由MgS、MgSO3、NaHSO4组成的混合物中,硫元素的质量分数为a,则氧元素的质量分数为
十、已知混合物中两种元素原子个数比或质量比求物质质量比
一定质量的SO2 和SO3,其中氧元素的质量相等,则 SO2 和SO3 的质量比是 ,
SO2 和SO3 的分子个数比是 。
十一、已知物中某元素的质量或质量分数,求含某物质的质量或质量分数
答案解析
1.B
镁的相对原子质量为24,一个镁原子的质量为m,则一个碳-12原子的质量为 = 0.5m;
故选B。
2.A
已知某氧原子的实际质量为mg,其相对原子质量为16,
有一种铕(Eu)原子的相对原子质量为152,
设铕(Eu)原子的质量为x,
则x:mg=152:16,
解得:。
故A。
3.D
某阳离子Mn+的核外电子共有x个电子,它是由该原子失去n个电子形成的,那么该原子的核外电子数为:x+n。
根据“质子数=核外电子数”可知,该原子的质子数为x+n;
那么它的相对原子质量为:x+n+y。
故选D。www.21-cn-jy.com
4.A
已知某元素的原子与碳-12原子的质量比为9∶1,
设碳原子的质量为m,则该原子的质量为9m,
那么该元素的相对原子质量为:.
故选A。
5.(1)3
(2)176
(1)由化学式可知 维生素C中含有C、H、O三种元素。
(2) 维生素C分子的相对分子质量=12×6+1×8+16×6=176.
故答案为:(1)3;(2)176
6.B
O2-的相对分子质量是 16×=32。
故选B。
7.A
设锆元素的化合价为+X,由氯的化合价为-1价,则氯化物的化学式为:ZrClx;
因为锆的氯化物的相对分子质量为233。
所以:91+35.5X=233,
解得:x=4;
因为在锆的氧化物中锆的化合价是+4价,氧元素的化合价是-2价。
设该氧化物的化学式为ZrzOy,
根据正负化合价代数和为零得到:(+4)z+(-2)y=0;
解得:z:y=1:2。
所以氧化物的化学式为ZrO2,
故选A。21世纪教育网版权所有
8.D
相对分子质量等于相对原子质量与个数的乘积之和。根据化学式2MgO可知,它的相对分子质量总和为:2×(24×1+16×1)=2×(24+16),故D正确,而A、B、C错误。
故选D。2-1-c-n-j-y
9.12:1
由乙炔的分子结构模型可以看出,乙炔的化学式为C2H2,根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得乙炔中碳、氢元素的质量比为(12×2):(1×2)=12:1。
故答案为:12:1。【来源:21·世纪·教育·网】
10.(1)42
(2)11:40
(1)一个青蒿素分子是由15个碳原子、22个氢原子和5个氧原子构成的,即一个青蒿素分子含有42个原子,故42
(2)青蒿素中氢氧元素质量之比为,故11:40
故答案为:(1)42(2)11:4021*cnjy*com
11.D
A.CO中C、O的质量之比为:12:16=3:4,故A不合题意;
B.NO中N、O的质量之比:14:16=7:8,故B不合题意;
C.NO2中N、O的质量之比:14:(16×2)=7:16,故C不合题意;
D.SO2中S、O的质量之比为:32:(16×2)=1:1,故D符合题意。
故选D。
12.(1)C5H4
(2)64
(3)93.75%
(1)根据图片可知,该分子由5个碳原子和4个氢原子构成,写作: C5H4 。
(2)根据化学式C5H4可知,该分子的相对分子质量为:12×5+1×4=64。
(3)该分子中碳元素的质量分数:。21*cnjy*com
13.(1)19:42
(2)每粒胶囊中含氮元素质量:。
(1)根据化学式 C21H19N3O5 可知,
呋喹替尼中氢元素和氮元素的质量比:(1×19):(14×3)=19:42;
(2)每粒胶囊中含氮元素质量:。
14.(1)3(或三)
(2)6
(1)根据化学式 C10H10O 可知,侧柏莲酮芳香油由C、H、O共三种元素组成;
(2)7.3g侧柏莲酮芳香油中碳元素的质量:。
15.A
茶氨酸中碳、氢、氮、氧四种元素的质量比为:(12×7):(1×14):(14×2):(16×3)=42:7:14:24,则①表示的元素是茶氨酸中质量分数最大的碳元素。
故选A。【版权所有:21教育】
16.(1)12∶3∶8
(2)32∶23
(1)根据化学式 C2H5OH 可知,
乙醇中碳、氢、氧的质量比为:(12×2):(1×6):(16×1)=12:3:8;
(2)设乙醇和甲醇的质量都是m,
则它们中碳元素的质量之比为:。
17.(1)X3Y4
(2)
(1)X、Y两元素的相对原子质量之比为7:2,X与Y形成的化合物中,X、Y两元素的质量之比为21:8,
化合物中X、Y的原子个数比为:.
则该化合物的化学式可表示为 X3Y4。
(2)已知X、Y两元素的相对原子质量之比是2:1,
由这两种元素形成的化合物中,X、Y的质量之比是2:3,
化合物中X、Y的原子个数比为;
化合物的化学式可表示为 XY3.其中X的化合价为+a。
根据化合物中正负化合价的代数和为零,
可得在化合物中Y的化合价为。21cnjy.com
18.(1)52
(2)XY3
(1)设K2R2O7的相对分子量为X,
K2R2O7中氧元素的质量分数:;
解得:x=294,
2R的相对分子质量:294×(1-26.5%-38.1%)≈104;
所以 R的相对原子质量为52;
(2)由题意可知,设X、Y两种元素原子的相对原子质量分别为a和b;
则甲中X元素的百分含量为:,
解得:a=2b ①;
设乙的化学式为:XmYn,
则乙中X元素的百分含量为:②;
①②联立得到:
可得,m:n=1:3;
故乙的化学式XY3。
19.C
碳元素和氢元素的质量之比为9:2,
那么该化学式中碳原子和氢原子的个数之比为:;
那么该化合物的化学式可能为C3H8。
故选C。
20.赤铁矿中三氧化二铁的质量为:160t×48%=76.8t;
设可以炼出生铁的质量为x,
76.8t×=96%x;
解得:x=56t。
21.解:氧化铁的化学式为 Fe2O3,该铁矿石中氧化铁的纯度为56%÷( ×100%)= 80%。
22.(1)Cu2O;CuO 和 Cu;Cu2O、CuO 和 Cu
(2)
(1)固体样品中铜元素的质量分数=;
;
CuO中铜元素的质量分数=;
Cu2O中铜元素的质量分数=;
。
那么样品的组成情况有:
①只有一种物质,Cu2O;
②两种物质:CuO和Cu;
③三者物质:CuO和Cu和Cu2O。
(2)若固体样品由两种物质组成,所以该混合物中一定Cu和CuO,其中铜的含量减少。
设铜的质量分数为a,
则:80%a+(18g-a)=16g;
解得:x=10g;
所以铜为18g-10g=8g,
所以铜的质量分数为。21教育网
23.A
(NH4)2SO4的含氮量为:,因此混入的化肥应小于20%,
A.NH4HCO3的含氮量为:,小于20%,故A符合题意;
B.NH4NO3氮元素的质量分数为 ,大于20%,故B不合题意;
C.CO(NH2)2的含氮量为:,大于20%,故C不合题意;
D.NH4Cl的含氮量为:,大于20%,故D不合题意。
故选A。
24.A
硝酸铵(NH4NO3)中氮元素的质量分数=。
A.CO(NH2)2中氮元素的质量分数为:;
B.NH4HCO3中氮元素的质量分数为:;
C.NH4Cl中氮元素的质量分数为:;
D.(NH4)2SO4中氮元素的质量分数为:;
要使化肥混合后氮元素的质量分数为40%,必须有一种是高于35%的,所以该样品中可能混有杂质是CO(NH2)2。
故选A。
25.A
已知氢元素的质量分数为y,则当做混合物中水的质量分数
因此混合物中当做CO质量分数为(1-9y),则混合物中C元素的质量分数
故答案为:A
26.C
在化学式MgSO3中硫的相对原子质量为32,在MgHPO4中氢和磷相对原子质量的和是32,相当于硫。
由于镁与硫的质量比是24:32=3:4,MgSO3和MgHPO4组成的混和物中含镁为18%,
所以硫的质量分数是:,
所以含氧约为:1-18%-24%=58%。
故选C。
27.
根据等效原理,可以转化为MgS、MgSO3、MgSO4(相当于NaHSO4)组成,
则视为两部分MgS和氧元素组成,
硫元素的质量分数为a,则镁元素的质量分数为;
则氧元素的质量分数为:。
28.6:5;3:2
(1)设SO2的质量为a,SO3的质量为b,
则:;
解得:a:b=6;5。
(2)设SO2的分子数为m,SO3的分子数为n,
则:;
解得:m:n=3:2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
