解答题1—期中分题型复习(第2章 微粒的模型与符号 含解析)
文档属性
| 名称 | 解答题1—期中分题型复习(第2章 微粒的模型与符号 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 227.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-25 15:50:48 | ||
图片预览




文档简介
解答题1—期中分题型复习
、解答题
人类对原子结构的认识,经历了道尔顿、汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是 (填“正确”或“错误”)的。
(2)卢瑟福核式结构模型是利用a粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
(3)从原子结构模型建立的过程中,我们发现 (填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母x表示)的概念,用来确定化合物中原子某种能力的相对大小.Linus Pauling假定F的电负性为4,井通过热化学方法建立了其它元素的电负性.LhlusPauhg建立的有关元素的电负性如下:
回答下列问题:
(1)写出元素电负性在上表中同一横行和同一纵行中的递变规律: __________
(2)预测Te元素x的取值范围_____________
(3)观察上表可得出如下结论:一般情况下,金属元素的电负性越小,它的金属活动性就越弱,该元素的原子__________(选填“失电子”或“得电子”)的能力越大。
(4)大量事实表明,当两种元素的x值相差大于或等于1.7时,形成的化合物一般是离子化合物.根据此经验规律,物质___________(选填“是”或“不是”)离子化合物.
如图为原子构成示意图,请你仔细观察此图片,你从中能获得哪些信息?(答出三条信息)
世界卫生组织正式将这次武汉疫情命名为“2019新型冠状病毒肺炎”(英文:COVID-19),简称“新冠肺炎”。国家食品药品监督管理总局药审中心(CDE)批准申请单位中日友好医院和中国医学科学院药物研究所,将瑞德西韦注射液用于治疗新冠肺炎三期临床试验,其申报书中部分内容如下图,据此回答:
(1)一个瑞德西韦分子含有 个原子,其中碳、氮原子个数比为 。
(2)该药品中氧元素的质量分数是 (精确到0.1%)。
中学生正处于生长发育的重要时期,需要补定量的钙。假设你所需的钙全由这种高钙奶产品提供,每日你至少应喝多少盒?请结合所示表格信息说明理由。
表一、高钙奶产品包装盒上的成分说明
营养成分(每100克含)
钙 80毫克 蛋白质 2.9克 脂肪 1.5克 维生素D3 40~160IU
每盒净重:250克
表二、中国营养学会建议的每日钙摄入量
中国营养学会推荐每日钙适宜摄入量
1~10岁 800毫克 11~24岁 1200毫克 25~50岁 800毫克 50岁以上 800毫克
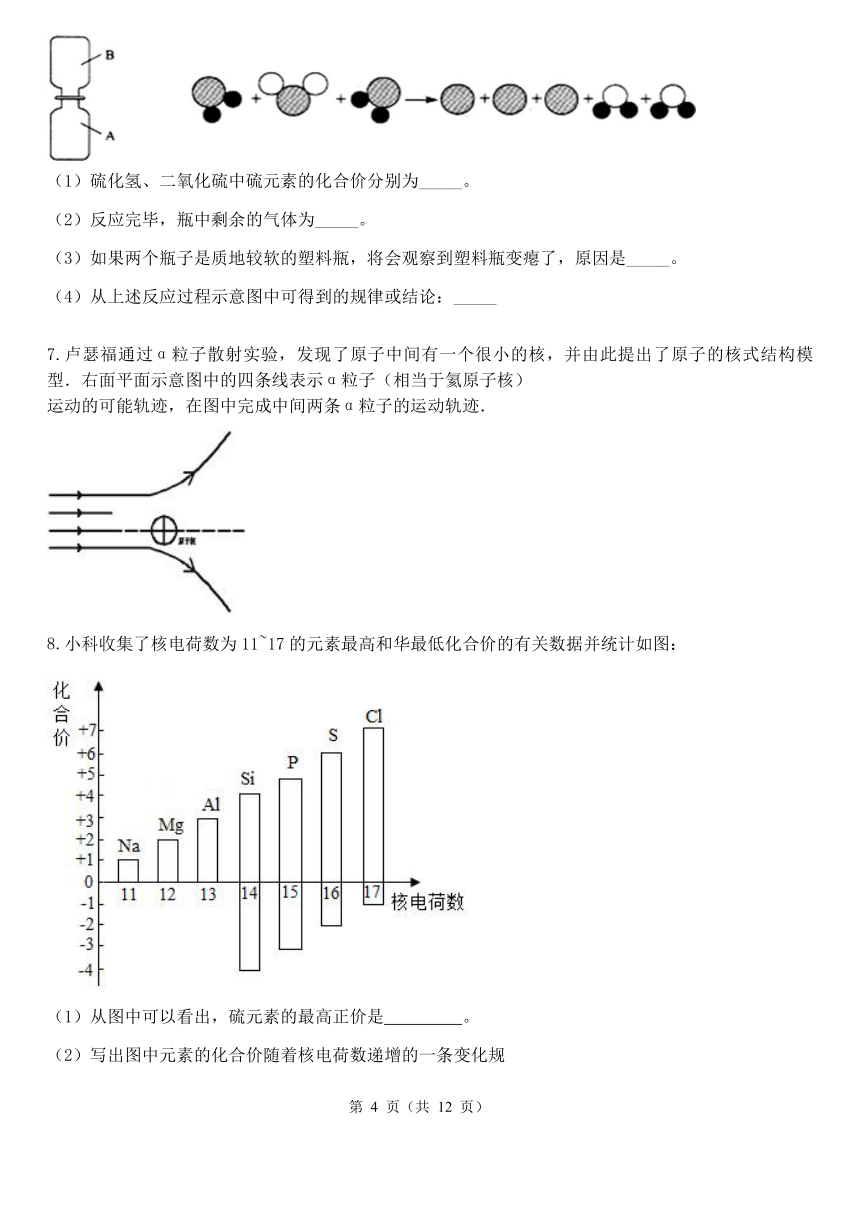
如下图,向A.B 两个体积相同的集气瓶中分别装有等分子数的无色硫化氢(H2S)气体
和二氧化硫气体。抽开毛玻璃片,瓶口对紧,颠倒几次,使两种气体充分混合。一会儿, 两瓶内壁可见附着淡黄色固体颗粒。若用●表示氢原子,用○表示氧原子,用 表示硫原子,上述反应过程可用下图表示:
(1)硫化氢、二氧化硫中硫元素的化合价分别为_____。
(2)反应完毕,瓶中剩余的气体为_____。
(3)如果两个瓶子是质地较软的塑料瓶,将会观察到塑料瓶变瘪了,原因是_____。
(4)从上述反应过程示意图中可得到的规律或结论:_____
卢瑟福通过α粒子散射实验,发现了原子中间有一个很小的核,并由此提出了原子的核式结构模型.右面平面示意图中的四条线表示α粒子(相当于氦原子核)
运动的可能轨迹,在图中完成中间两条α粒子的运动轨迹.
小科收集了核电荷数为11~17的元素最高和华最低化合价的有关数据并统计如图:
(1)从图中可以看出,硫元素的最高正价是 。
(2)写出图中元素的化合价随着核电荷数递增的一条变化规律 。
(3)若某元素既可显正价,又可显负价,则最高正价与最低负价之间的关系为 。
过量饮酒有害人体身心健康,在日常生活中,成年男性饮用50°的白酒不应超过 ,成年女性不应超过 。而50°的白酒,表示在 的酒中,含有乙醇(俗称酒精,化学式为 ) 。(已知乙醇的密度为 ,除乙醇外其他成分不含碳元素)
(1)乙醇的相对分子质量为 。
(2)23g乙醇中含氢元素 ▲ g。某同学的父亲在一次宴席中喝了50°白酒,该同学父亲摄入白酒中的乙醇所含碳元素质量与88g二氧化碳所含碳元素的质量相等,请通过计算说明其父亲是否饮用过度?
磁铁矿石(含Fe3O4)是常用的炼铁原料,工业上可通过如下反应:
4CO+Fe3O4 Fe+4CO,将其中的Fe3O4转化为Fe。
(1)Fe3O4中铁元素和氧元素的质量比为 。
(2)假设冶炼过程中铁没有损耗,用含有464吨Fe3O4的磁铁矿石可提炼出含铁质量分数为96%的生铁多少吨?
抗击新冠肺炎疫情中,一种名为瑞德西韦(分子式为C27H35N6O8P)的新药曾被寄予厚望。请回答:
(1)瑞德西韦中碳、氧元素的质量比为 (最简整数比)。
(2)该药品中氧元素的质量分数是 (精确到0.1%)。301mg瑞德西韦中含有氢元素的质量为 mg。
低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种.请回答:
(1)苹果酸钠盐的相对分子质量是 .
(2)苹果酸钠盐中各元素的质量比为C:H:O:Na= .
我国从 1994 年开始强制实行食盐加碘,即在食盐中加入碘酸钾(KIO3),以防止碘缺乏病的发生,2010 年开始下调食盐加碘量,由原来每千克食盐加碘40mg下调至 25mg。(碘的相对原子质量为 127)
(1)碘酸钾中钾元素、碘元素、氧元素的质量之比为 。
(2)碘酸钾中碘元素的质量分数为 (计算结果精确到 0.1%)。
(3)现售加碘食盐每袋(500g)应比调整前减少了 mg 碘,即少加碘酸钾 mg(计算结果精确至 0.1mg)。
解答题1—期中分题型复习答案解析
、解答题
(1)错误
(2)乙
(3)A;B;D
【解析】(1)原子内部绝大部分都是空的,原子核体积很小质量很大,在原子的中间。电子在周围绕原子核高速旋转,据此分析解答;
(2)根据电荷之间的相互作用规律分析解答;
(3)根据自己对科学研究的认识分析判断。
【解答】(1)根据卢瑟福的核实结构可知,道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是错误的。
(2)a粒子带正电荷,原子核也带正电荷,根据"同种电荷相互排斥”可知,a粒子会受到原子核的排斥力而改变运动方向,即从上方经过的运动轨迹向上弯曲,从下方经过的运动轨迹向下弯曲。极少数a粒子正面撞向原子核,此时它们受到的排斥力最大,几乎沿原路返回,故选乙。
(3)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,故B正确;
C.波尔的原子模型建立,使人们对原子结构的认识达到了新的高度,但是距离完美还有一段距离,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
同周期中从左到右逐渐增大2.0<x<2.4 失电子 不是
【解析】
【详解】
(1)由表格内的数据可知,同周期中从左到右逐渐增大(或同主族中从上到下逐渐减小);故填:同周期中从左到右逐渐增大(或同主族中从上到下逐渐减小);
(2)Te元素x的取值范围介于Se和Po之间,在同一周期内,由左到右电负性变大,失去电子的能力减弱; 故填:2.0<x<2.4,失电子;
(3)Cl的电负性为3.0,Al的电负性为1.5,二者的电负性差值为1.5,小于1.7,所以AlCl3不是离子化合物;故填不是。
原子很小;原子核由质子和中子组成;原子是由原子核和核外的电子组成.
【解析】【解答】解:由图看出,原子很小,原子核很小,原子由内层带正电的原子核和外层带负电的电子组成;原子核由带正电的质子和不带电的中子组成;
故答案为:原子很小;原子核由质子和中子组成;原子是由原子核和核外的电子组成.
解答本题需掌握:原子的核式结构及原子核的组成.结合图中内容总结能获取的信息.
(1)77;9:2
(2)21.3%
(1)根据化学式右下角数字为一个分子中原子个数分析;
(2)根据元素质量分数=相对原子质量×原子个数/相对分子质量分析;
【解答】(1) 一个瑞德西韦分子含有27+35+6+8+1=77个原子,其中碳、氮原子个数比为27:6=9:2;
(2) 该药品中氧元素的质量分数是 ;
故答案为:(1)77;9:2;(2)21.3%。
解:250克/100克=2.5,
2.5×80毫克=200毫克;
中学生11~24岁,1200毫克/200毫克=6盒
酸奶中所含钙的质量与酸奶的质量成正比,首先用每盒酸奶的净重与100g作比计算出倍数,再乘以80mg计算出每盒酸奶含钙元素的质量。根据表格确定中学生每日钙的摄入量,再除以每盒酸奶含有钙的质量得到喝奶的盒数。
-2 和+4 二氧化硫 H2S 与SO2 反应后生成固态的硫和液态的水,使瓶内的压强小于瓶外的大气压 化学反应中分子可分,原子不可分(或:化学反应中原子种类和数量不变)
【解析】
【详解】
根据反应的微观图示,每2个H2S分子可与1个SO2分子反应,生成三个硫原子和两个水分子,据此可写出化学方程式:2H2S+SO2=3S+2H2O;
(1)由化合价原则可知,硫化氢中,氢元素的化合价为+1价,可以推出硫元素的化合价为-2价,在二氧化硫中由于氧显-2价,可以推出硫显+4价;
(2)由方程可知,每2个硫化氢分子与1个二氧化硫分子反应,所以等体积混合物时,反应完毕,瓶中剩余的气体为二氧化硫。
(3)该反应H2S与SO2反应后生成固态的硫和液态的水,使瓶内的压强小于瓶外的大气压,所以塑料瓶变瘪了;
(4)由微粒的变化可知,在化学反应中分子可以再分,原子不可再分。
故答为:(1)-2;+4. (2)二氧化硫;(3)反应后瓶中气压变小,使塑料瓶变瘪了。(4)在化学反应中分子可以再分,原子不可再分。
如图:
(1)+6
(2)从左到右元素的最高正化合价逐渐从+1升高到十7
(3)绝对值的代数和为8
【解析】根据图示中所给各元素的化合价分析。
【解答】(1)由图示可知,硫元素化合价最高正价为+6价;
(2)图中元素从左到右元素的最高正化合价随核电荷数递增逐渐从+1升高到+7;
(3)由硅、磷、硫、氯最高正价与最低负价可知, 最高正价与最低负价绝对值的代数和都为8 ;
故答案为:(1)+6;(2) 从左到右元素的最高正化合价逐渐从+1升高到十7 ;(3) 绝对值的代数和为8 。
(1)46
(2)3g
设乙醇的质量为x,则:
x=46g
其体积为:46g÷0.8 克/厘米3=57.5厘米3=57.5mL
50°的白酒中含57.5mL乙醇,则白酒的体积为115mL,属于饮用过度。
答:属于饮酒过度。
(1)相对分子质量等于相对原子质量与个数的乘积之和。
(2)氢元素质量=乙醇质量×氢元素的质量分数。氢元素的质量相等,以此为等量条件,根据“元素质量=物质质量×元素的质量分数”列出方程计算出乙醇的质量,再根据公式计算出酒精的体积,最后再根据“白酒度数=”计算出白酒的体积,并与每天的饮用标准进行比较即可。
【解答】(1)根据化学式 可知,乙醇的相对分子质量:12×2+1×6+16×1=46;
(2)23g乙醇中含氢元素:。
设乙醇的质量为x,则:
解得:x=46g;
其体积为:
50°的白酒中酒精的体积占白酒总体积的50%,
则白酒的体积为:,
属于饮用过度。
(1)21:8
(2)解:Fe3O4中含铁元素的质量:
生铁的质量=
(1)根据元素质量比为相对原子质量×原子个数之比分析;
(2)根据元素质量为物质质量×元素质量分数分析。
【解答】(1) Fe3O4中铁元素和氧元素的质量比为(56×3) :(16×4)=21:8;
故答案为:(1)21:8;(2)350t。
(1)81:32
(2)21.3%;17.5mg
(1)根据元素质量比为相对原子质量×原子个数之比分析;
(2)根据元素质量分数=相对原子质量×原子个数/相对分子质量、元素质量为物质质量×元素质量分数分析。
【解答】(1)瑞德西韦中碳、氧元素的质量比为(12×27):(16×8)= 81:32;
(2) 该药品中氧元素的质量分数是=21.3%;301mg瑞德西韦中含有氢元素的质量为=17.5mg.
故答案为:(1)81:32;(2)21.3%;17.5mg.
(1)156
(2)48:5:80:23
【解析】【解答】(1)苹果酸钠盐的相对分子质量为:12×4+5+16×5+23=156;故答案为:156;(2)苹果酸钠盐中各元素的质量比为:(12×4):5:(16×5):23=48:5:80:23;故答案为:48:5:80:23;
根据相对分子的质量为组成分子的各原子的相对原子质量之和,化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答.
(1)2:1
(2)物理性质
(3)29:45
(1)在化学式中,元素符号右下角的数字就是该原子的个数;
(2)化学性质是物质在化学变化中表现出来的性质,如所属物质类别的化学通性:酸性、碱性、氧化性、还原性、热稳定性及一些其它特性。
物理性质是不需要发生化学变化就表现出来的性质,如:颜色、气味、状态、是否易融化、凝固、升华、挥发,还有些性质如熔点、沸点、硬度、导电性、导热性、延展性、溶解性、密度等。
(3)根据化学式可知,一个丁酸乙酯分子和一个葡萄糖分子中都含有6个碳原子,那么碳原子的个数相等,其实就是二者的分子数相等,然后根据“质量之比等于相对分子质量与个数的乘积之比”计算即可。
【解答】(1)根据化学式 C6H12O2 可知,丁酸乙酯中氢和碳的原子个数比为:12:6=2:1.
(2)丁酸乙酯作为溶剂,可以溶解多种有机物,这体现了它的物理性质。
(3)根据化学式可知,一个丁酸乙酯分子和一个葡萄糖分子中都含有6个碳原子,那么碳原子的个数相等,其实就是二者的分子数相等。
丁酸乙酯和葡萄糖的质量比为:(12×6+1×12+16×2)×n:(12×6+1×12+16×6)×n=29:45。
第 1 页(共 1 页)
、解答题
人类对原子结构的认识,经历了道尔顿、汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是 (填“正确”或“错误”)的。
(2)卢瑟福核式结构模型是利用a粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
(3)从原子结构模型建立的过程中,我们发现 (填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母x表示)的概念,用来确定化合物中原子某种能力的相对大小.Linus Pauling假定F的电负性为4,井通过热化学方法建立了其它元素的电负性.LhlusPauhg建立的有关元素的电负性如下:
回答下列问题:
(1)写出元素电负性在上表中同一横行和同一纵行中的递变规律: __________
(2)预测Te元素x的取值范围_____________
(3)观察上表可得出如下结论:一般情况下,金属元素的电负性越小,它的金属活动性就越弱,该元素的原子__________(选填“失电子”或“得电子”)的能力越大。
(4)大量事实表明,当两种元素的x值相差大于或等于1.7时,形成的化合物一般是离子化合物.根据此经验规律,物质___________(选填“是”或“不是”)离子化合物.
如图为原子构成示意图,请你仔细观察此图片,你从中能获得哪些信息?(答出三条信息)
世界卫生组织正式将这次武汉疫情命名为“2019新型冠状病毒肺炎”(英文:COVID-19),简称“新冠肺炎”。国家食品药品监督管理总局药审中心(CDE)批准申请单位中日友好医院和中国医学科学院药物研究所,将瑞德西韦注射液用于治疗新冠肺炎三期临床试验,其申报书中部分内容如下图,据此回答:
(1)一个瑞德西韦分子含有 个原子,其中碳、氮原子个数比为 。
(2)该药品中氧元素的质量分数是 (精确到0.1%)。
中学生正处于生长发育的重要时期,需要补定量的钙。假设你所需的钙全由这种高钙奶产品提供,每日你至少应喝多少盒?请结合所示表格信息说明理由。
表一、高钙奶产品包装盒上的成分说明
营养成分(每100克含)
钙 80毫克 蛋白质 2.9克 脂肪 1.5克 维生素D3 40~160IU
每盒净重:250克
表二、中国营养学会建议的每日钙摄入量
中国营养学会推荐每日钙适宜摄入量
1~10岁 800毫克 11~24岁 1200毫克 25~50岁 800毫克 50岁以上 800毫克
如下图,向A.B 两个体积相同的集气瓶中分别装有等分子数的无色硫化氢(H2S)气体
和二氧化硫气体。抽开毛玻璃片,瓶口对紧,颠倒几次,使两种气体充分混合。一会儿, 两瓶内壁可见附着淡黄色固体颗粒。若用●表示氢原子,用○表示氧原子,用 表示硫原子,上述反应过程可用下图表示:
(1)硫化氢、二氧化硫中硫元素的化合价分别为_____。
(2)反应完毕,瓶中剩余的气体为_____。
(3)如果两个瓶子是质地较软的塑料瓶,将会观察到塑料瓶变瘪了,原因是_____。
(4)从上述反应过程示意图中可得到的规律或结论:_____
卢瑟福通过α粒子散射实验,发现了原子中间有一个很小的核,并由此提出了原子的核式结构模型.右面平面示意图中的四条线表示α粒子(相当于氦原子核)
运动的可能轨迹,在图中完成中间两条α粒子的运动轨迹.
小科收集了核电荷数为11~17的元素最高和华最低化合价的有关数据并统计如图:
(1)从图中可以看出,硫元素的最高正价是 。
(2)写出图中元素的化合价随着核电荷数递增的一条变化规律 。
(3)若某元素既可显正价,又可显负价,则最高正价与最低负价之间的关系为 。
过量饮酒有害人体身心健康,在日常生活中,成年男性饮用50°的白酒不应超过 ,成年女性不应超过 。而50°的白酒,表示在 的酒中,含有乙醇(俗称酒精,化学式为 ) 。(已知乙醇的密度为 ,除乙醇外其他成分不含碳元素)
(1)乙醇的相对分子质量为 。
(2)23g乙醇中含氢元素 ▲ g。某同学的父亲在一次宴席中喝了50°白酒,该同学父亲摄入白酒中的乙醇所含碳元素质量与88g二氧化碳所含碳元素的质量相等,请通过计算说明其父亲是否饮用过度?
磁铁矿石(含Fe3O4)是常用的炼铁原料,工业上可通过如下反应:
4CO+Fe3O4 Fe+4CO,将其中的Fe3O4转化为Fe。
(1)Fe3O4中铁元素和氧元素的质量比为 。
(2)假设冶炼过程中铁没有损耗,用含有464吨Fe3O4的磁铁矿石可提炼出含铁质量分数为96%的生铁多少吨?
抗击新冠肺炎疫情中,一种名为瑞德西韦(分子式为C27H35N6O8P)的新药曾被寄予厚望。请回答:
(1)瑞德西韦中碳、氧元素的质量比为 (最简整数比)。
(2)该药品中氧元素的质量分数是 (精确到0.1%)。301mg瑞德西韦中含有氢元素的质量为 mg。
低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种.请回答:
(1)苹果酸钠盐的相对分子质量是 .
(2)苹果酸钠盐中各元素的质量比为C:H:O:Na= .
我国从 1994 年开始强制实行食盐加碘,即在食盐中加入碘酸钾(KIO3),以防止碘缺乏病的发生,2010 年开始下调食盐加碘量,由原来每千克食盐加碘40mg下调至 25mg。(碘的相对原子质量为 127)
(1)碘酸钾中钾元素、碘元素、氧元素的质量之比为 。
(2)碘酸钾中碘元素的质量分数为 (计算结果精确到 0.1%)。
(3)现售加碘食盐每袋(500g)应比调整前减少了 mg 碘,即少加碘酸钾 mg(计算结果精确至 0.1mg)。
解答题1—期中分题型复习答案解析
、解答题
(1)错误
(2)乙
(3)A;B;D
【解析】(1)原子内部绝大部分都是空的,原子核体积很小质量很大,在原子的中间。电子在周围绕原子核高速旋转,据此分析解答;
(2)根据电荷之间的相互作用规律分析解答;
(3)根据自己对科学研究的认识分析判断。
【解答】(1)根据卢瑟福的核实结构可知,道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是错误的。
(2)a粒子带正电荷,原子核也带正电荷,根据"同种电荷相互排斥”可知,a粒子会受到原子核的排斥力而改变运动方向,即从上方经过的运动轨迹向上弯曲,从下方经过的运动轨迹向下弯曲。极少数a粒子正面撞向原子核,此时它们受到的排斥力最大,几乎沿原路返回,故选乙。
(3)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,故B正确;
C.波尔的原子模型建立,使人们对原子结构的认识达到了新的高度,但是距离完美还有一段距离,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
同周期中从左到右逐渐增大2.0<x<2.4 失电子 不是
【解析】
【详解】
(1)由表格内的数据可知,同周期中从左到右逐渐增大(或同主族中从上到下逐渐减小);故填:同周期中从左到右逐渐增大(或同主族中从上到下逐渐减小);
(2)Te元素x的取值范围介于Se和Po之间,在同一周期内,由左到右电负性变大,失去电子的能力减弱; 故填:2.0<x<2.4,失电子;
(3)Cl的电负性为3.0,Al的电负性为1.5,二者的电负性差值为1.5,小于1.7,所以AlCl3不是离子化合物;故填不是。
原子很小;原子核由质子和中子组成;原子是由原子核和核外的电子组成.
【解析】【解答】解:由图看出,原子很小,原子核很小,原子由内层带正电的原子核和外层带负电的电子组成;原子核由带正电的质子和不带电的中子组成;
故答案为:原子很小;原子核由质子和中子组成;原子是由原子核和核外的电子组成.
解答本题需掌握:原子的核式结构及原子核的组成.结合图中内容总结能获取的信息.
(1)77;9:2
(2)21.3%
(1)根据化学式右下角数字为一个分子中原子个数分析;
(2)根据元素质量分数=相对原子质量×原子个数/相对分子质量分析;
【解答】(1) 一个瑞德西韦分子含有27+35+6+8+1=77个原子,其中碳、氮原子个数比为27:6=9:2;
(2) 该药品中氧元素的质量分数是 ;
故答案为:(1)77;9:2;(2)21.3%。
解:250克/100克=2.5,
2.5×80毫克=200毫克;
中学生11~24岁,1200毫克/200毫克=6盒
酸奶中所含钙的质量与酸奶的质量成正比,首先用每盒酸奶的净重与100g作比计算出倍数,再乘以80mg计算出每盒酸奶含钙元素的质量。根据表格确定中学生每日钙的摄入量,再除以每盒酸奶含有钙的质量得到喝奶的盒数。
-2 和+4 二氧化硫 H2S 与SO2 反应后生成固态的硫和液态的水,使瓶内的压强小于瓶外的大气压 化学反应中分子可分,原子不可分(或:化学反应中原子种类和数量不变)
【解析】
【详解】
根据反应的微观图示,每2个H2S分子可与1个SO2分子反应,生成三个硫原子和两个水分子,据此可写出化学方程式:2H2S+SO2=3S+2H2O;
(1)由化合价原则可知,硫化氢中,氢元素的化合价为+1价,可以推出硫元素的化合价为-2价,在二氧化硫中由于氧显-2价,可以推出硫显+4价;
(2)由方程可知,每2个硫化氢分子与1个二氧化硫分子反应,所以等体积混合物时,反应完毕,瓶中剩余的气体为二氧化硫。
(3)该反应H2S与SO2反应后生成固态的硫和液态的水,使瓶内的压强小于瓶外的大气压,所以塑料瓶变瘪了;
(4)由微粒的变化可知,在化学反应中分子可以再分,原子不可再分。
故答为:(1)-2;+4. (2)二氧化硫;(3)反应后瓶中气压变小,使塑料瓶变瘪了。(4)在化学反应中分子可以再分,原子不可再分。
如图:
(1)+6
(2)从左到右元素的最高正化合价逐渐从+1升高到十7
(3)绝对值的代数和为8
【解析】根据图示中所给各元素的化合价分析。
【解答】(1)由图示可知,硫元素化合价最高正价为+6价;
(2)图中元素从左到右元素的最高正化合价随核电荷数递增逐渐从+1升高到+7;
(3)由硅、磷、硫、氯最高正价与最低负价可知, 最高正价与最低负价绝对值的代数和都为8 ;
故答案为:(1)+6;(2) 从左到右元素的最高正化合价逐渐从+1升高到十7 ;(3) 绝对值的代数和为8 。
(1)46
(2)3g
设乙醇的质量为x,则:
x=46g
其体积为:46g÷0.8 克/厘米3=57.5厘米3=57.5mL
50°的白酒中含57.5mL乙醇,则白酒的体积为115mL,属于饮用过度。
答:属于饮酒过度。
(1)相对分子质量等于相对原子质量与个数的乘积之和。
(2)氢元素质量=乙醇质量×氢元素的质量分数。氢元素的质量相等,以此为等量条件,根据“元素质量=物质质量×元素的质量分数”列出方程计算出乙醇的质量,再根据公式计算出酒精的体积,最后再根据“白酒度数=”计算出白酒的体积,并与每天的饮用标准进行比较即可。
【解答】(1)根据化学式 可知,乙醇的相对分子质量:12×2+1×6+16×1=46;
(2)23g乙醇中含氢元素:。
设乙醇的质量为x,则:
解得:x=46g;
其体积为:
50°的白酒中酒精的体积占白酒总体积的50%,
则白酒的体积为:,
属于饮用过度。
(1)21:8
(2)解:Fe3O4中含铁元素的质量:
生铁的质量=
(1)根据元素质量比为相对原子质量×原子个数之比分析;
(2)根据元素质量为物质质量×元素质量分数分析。
【解答】(1) Fe3O4中铁元素和氧元素的质量比为(56×3) :(16×4)=21:8;
故答案为:(1)21:8;(2)350t。
(1)81:32
(2)21.3%;17.5mg
(1)根据元素质量比为相对原子质量×原子个数之比分析;
(2)根据元素质量分数=相对原子质量×原子个数/相对分子质量、元素质量为物质质量×元素质量分数分析。
【解答】(1)瑞德西韦中碳、氧元素的质量比为(12×27):(16×8)= 81:32;
(2) 该药品中氧元素的质量分数是=21.3%;301mg瑞德西韦中含有氢元素的质量为=17.5mg.
故答案为:(1)81:32;(2)21.3%;17.5mg.
(1)156
(2)48:5:80:23
【解析】【解答】(1)苹果酸钠盐的相对分子质量为:12×4+5+16×5+23=156;故答案为:156;(2)苹果酸钠盐中各元素的质量比为:(12×4):5:(16×5):23=48:5:80:23;故答案为:48:5:80:23;
根据相对分子的质量为组成分子的各原子的相对原子质量之和,化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答.
(1)2:1
(2)物理性质
(3)29:45
(1)在化学式中,元素符号右下角的数字就是该原子的个数;
(2)化学性质是物质在化学变化中表现出来的性质,如所属物质类别的化学通性:酸性、碱性、氧化性、还原性、热稳定性及一些其它特性。
物理性质是不需要发生化学变化就表现出来的性质,如:颜色、气味、状态、是否易融化、凝固、升华、挥发,还有些性质如熔点、沸点、硬度、导电性、导热性、延展性、溶解性、密度等。
(3)根据化学式可知,一个丁酸乙酯分子和一个葡萄糖分子中都含有6个碳原子,那么碳原子的个数相等,其实就是二者的分子数相等,然后根据“质量之比等于相对分子质量与个数的乘积之比”计算即可。
【解答】(1)根据化学式 C6H12O2 可知,丁酸乙酯中氢和碳的原子个数比为:12:6=2:1.
(2)丁酸乙酯作为溶剂,可以溶解多种有机物,这体现了它的物理性质。
(3)根据化学式可知,一个丁酸乙酯分子和一个葡萄糖分子中都含有6个碳原子,那么碳原子的个数相等,其实就是二者的分子数相等。
丁酸乙酯和葡萄糖的质量比为:(12×6+1×12+16×2)×n:(12×6+1×12+16×6)×n=29:45。
第 1 页(共 1 页)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
