第3节化学方程式(第2课时)
图片预览







文档简介
课件20张PPT。3.3 化学方程式(2)一、复习:什么是质量守恒定律?宏观:参加反应的各物质的质量总和=反应生成的各物质的质量总和微观:反应前原子 =反应后原子种类
数目
质量种类
数目
质量用化学式可以表示某种物质,那么,
能不能用化学式来表示化学反应呢?思考:
C CO2++三.化学方程式:用化学式来表示化 学反应的方程式。怎样来书写化学方程式呢? 书写化学方程式必须遵循什么原则?2.书写化学方程式的原则
(1)以客观事实为依据
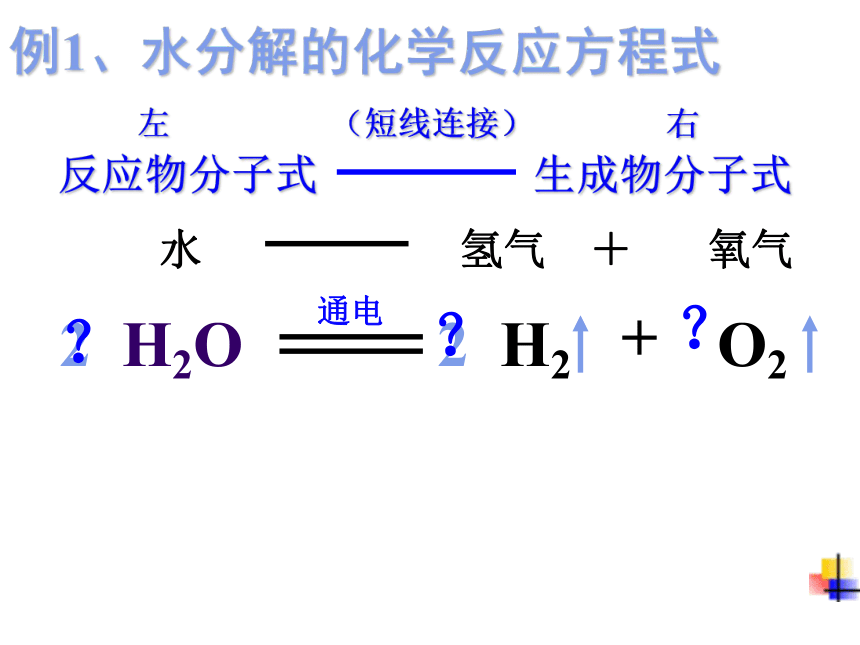
(2)要遵循质量守恒定律. (即在式子左、右两边各原子的种类与数目必须相等。)讨论:例1、水分解的化学反应方程式 左 (短线连接) 右 反应物分子式 生成物分子式水 氢气 + 氧气H2OH2+O222???通电书写化学方程式口诀:左边反应物,右边生成物写完化学式,系数要配平中间连等号,条件应注明生成气体、沉淀,箭头来表明简称:“一式二配三等四注”
4P+5O2 ??????2P2O5化学方程式的读法
点燃读作:磷和氧气在点燃的条件下,
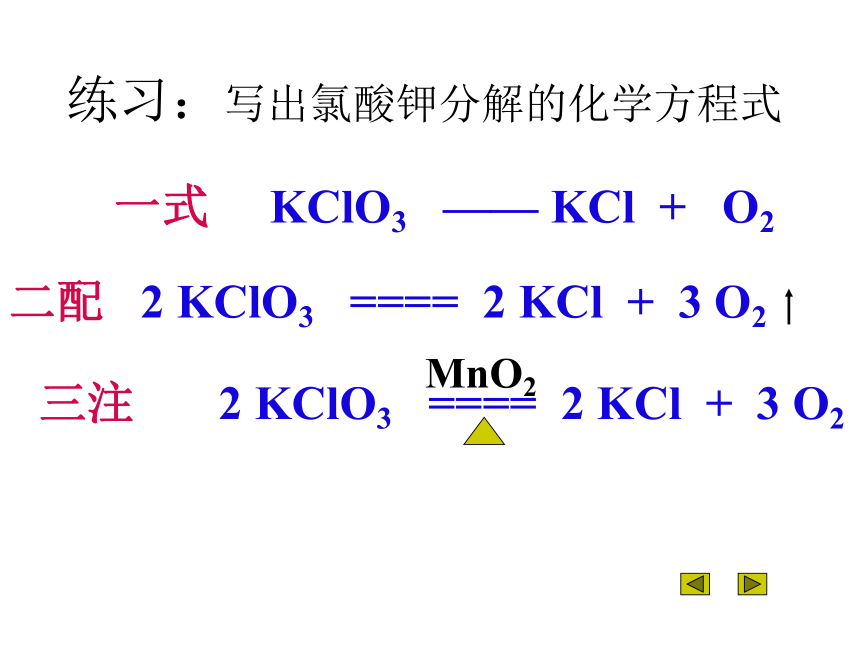
反应生成五氧化二磷。一式 KClO3 —— KCl + O2二配 2 KClO3 ==== 2 KCl + 3 O2三注 2 KClO3 ==== 2 KCl + 3 O2MnO2练习:写出氯酸钾分解的化学方程式指出下列化学方程式的错误
点燃
1. P2+O5==P2O5
点燃
2. Fe+O2 === Fe3O4
点燃
3. C+O2↑===CO2
燃烧
4. S+O2===SO2↑
△
5. 2KMnO4↓=====K2MnO4+MnO2↓+O2↑练习1:配平下列化学方程式
H2 + O2 —— H2O
Na + Cl2 —— NaCl
KMnO4 -—— K2MnO4 + MnO2 + O2
Fe2O3 + HCl —— FeCl3 + H2O
Fe2O3 + H2SO4—— Fe2(SO4)3 + H2O
Ca(OH)2 + K2CO3 —— CaCO3 + KOH
Fe2O3 + CO —— Fe + CO2点燃高温点燃 配平下列化学方程式
2H2 + O2 === 2H2O
2Na + Cl2 === 2 NaCl
2KMnO4 === K2MnO4 + MnO2 + O2
Fe2O3 +6 HCl ===2 FeCl3 +3 H2O
Fe2O3 + 3H2SO4=== Fe2(SO4)3 +3 H2O
Ca(OH)2 + K2CO3 === CaCO3 + 2KOH
Fe2O3 +3 CO === 2 Fe +3 CO2
点燃点燃高温答案1:练习2:写出下列反应的化学方程式
镁在氧气中燃烧,生成氧化镁
电解水,生成氢气和氧气
细铁丝在氧气中燃烧,生成四氧化三铁
氧化汞受热分解成汞和氧气
铝与稀硫酸反应,生成硫酸铝和氢气
乙炔(C2H2)在氧气中燃烧,生成二氧化碳和水
答案2:2Mg + O2 === 2MgO2H2O === 2H2 + O23Fe + 2O2 === Fe3O42HgO === 2 Hg + O22Al + 3H2SO4 == Al2(SO4)3 + 3H22C2H2 + 5O2 === 4 CO2 + 2H2O点燃点燃点燃通电1.化学方程式的意义: 1)表示什么物质参加反应,结果生成了什么物质。 4)表示反应物、生成物各物质间的质量比。 2)表示各物质间原子和分子的个数比。 3)表示反应在什么条件下进行。如:碳和氧气在点燃的条件下发生反应,生成二氧化碳.相对原子质量比:12: 32: 44微粒个数比: 1 :1 :1每12份质量的碳和32份质量的氧气反应,生成44份质量的二氧化碳.读图A、宏观上:表示什么物质参加 反应,结果生成了什么物质。
B、表示反应在什么条件下进行。
C、微观上:表示各物质间原子和分子的个数比。
D、质量上:表示反应物、生成 物各物质间的质量比。化学方程式的意义: H2O2 H2O + O2 22MnO2 68 322g=4.3g四、根据化学方程式的计算例题:实验室里用分解过氧化氢的方法制取氧气。现要制得2克氧气,需要多少克过氧化氢?x=x解:设需要过氧化氢质量为x答:需要过氧化氢4.3g.
根据化学方程式计算的步骤1.制取五氧化二磷142克,需燃烧多少克磷? 消耗多少克氧气?
2.工业上用电解水的方法制取氧气,现制得标准状态下氢气2.24升(密度为0.09克/升),则需电解多少克水?练习:3、把一定质量的碳放在一定质量的氧气中燃烧。实验数据如下表:
(1)这三次实验,从数据看,哪几次符合质量守恒定律?
(2)第二次实验为什么不生成28克CO2?哪种物质有剩余?余下多少克?
(3)第三次实验为什么不生成30克CO2?哪种物质有剩余?余下多少克?
数目
质量种类
数目
质量用化学式可以表示某种物质,那么,
能不能用化学式来表示化学反应呢?思考:
C CO2++三.化学方程式:用化学式来表示化 学反应的方程式。怎样来书写化学方程式呢? 书写化学方程式必须遵循什么原则?2.书写化学方程式的原则
(1)以客观事实为依据
(2)要遵循质量守恒定律. (即在式子左、右两边各原子的种类与数目必须相等。)讨论:例1、水分解的化学反应方程式 左 (短线连接) 右 反应物分子式 生成物分子式水 氢气 + 氧气H2OH2+O222???通电书写化学方程式口诀:左边反应物,右边生成物写完化学式,系数要配平中间连等号,条件应注明生成气体、沉淀,箭头来表明简称:“一式二配三等四注”
4P+5O2 ??????2P2O5化学方程式的读法
点燃读作:磷和氧气在点燃的条件下,
反应生成五氧化二磷。一式 KClO3 —— KCl + O2二配 2 KClO3 ==== 2 KCl + 3 O2三注 2 KClO3 ==== 2 KCl + 3 O2MnO2练习:写出氯酸钾分解的化学方程式指出下列化学方程式的错误
点燃
1. P2+O5==P2O5
点燃
2. Fe+O2 === Fe3O4
点燃
3. C+O2↑===CO2
燃烧
4. S+O2===SO2↑
△
5. 2KMnO4↓=====K2MnO4+MnO2↓+O2↑练习1:配平下列化学方程式
H2 + O2 —— H2O
Na + Cl2 —— NaCl
KMnO4 -—— K2MnO4 + MnO2 + O2
Fe2O3 + HCl —— FeCl3 + H2O
Fe2O3 + H2SO4—— Fe2(SO4)3 + H2O
Ca(OH)2 + K2CO3 —— CaCO3 + KOH
Fe2O3 + CO —— Fe + CO2点燃高温点燃 配平下列化学方程式
2H2 + O2 === 2H2O
2Na + Cl2 === 2 NaCl
2KMnO4 === K2MnO4 + MnO2 + O2
Fe2O3 +6 HCl ===2 FeCl3 +3 H2O
Fe2O3 + 3H2SO4=== Fe2(SO4)3 +3 H2O
Ca(OH)2 + K2CO3 === CaCO3 + 2KOH
Fe2O3 +3 CO === 2 Fe +3 CO2
点燃点燃高温答案1:练习2:写出下列反应的化学方程式
镁在氧气中燃烧,生成氧化镁
电解水,生成氢气和氧气
细铁丝在氧气中燃烧,生成四氧化三铁
氧化汞受热分解成汞和氧气
铝与稀硫酸反应,生成硫酸铝和氢气
乙炔(C2H2)在氧气中燃烧,生成二氧化碳和水
答案2:2Mg + O2 === 2MgO2H2O === 2H2 + O23Fe + 2O2 === Fe3O42HgO === 2 Hg + O22Al + 3H2SO4 == Al2(SO4)3 + 3H22C2H2 + 5O2 === 4 CO2 + 2H2O点燃点燃点燃通电1.化学方程式的意义: 1)表示什么物质参加反应,结果生成了什么物质。 4)表示反应物、生成物各物质间的质量比。 2)表示各物质间原子和分子的个数比。 3)表示反应在什么条件下进行。如:碳和氧气在点燃的条件下发生反应,生成二氧化碳.相对原子质量比:12: 32: 44微粒个数比: 1 :1 :1每12份质量的碳和32份质量的氧气反应,生成44份质量的二氧化碳.读图A、宏观上:表示什么物质参加 反应,结果生成了什么物质。
B、表示反应在什么条件下进行。
C、微观上:表示各物质间原子和分子的个数比。
D、质量上:表示反应物、生成 物各物质间的质量比。化学方程式的意义: H2O2 H2O + O2 22MnO2 68 322g=4.3g四、根据化学方程式的计算例题:实验室里用分解过氧化氢的方法制取氧气。现要制得2克氧气,需要多少克过氧化氢?x=x解:设需要过氧化氢质量为x答:需要过氧化氢4.3g.
根据化学方程式计算的步骤1.制取五氧化二磷142克,需燃烧多少克磷? 消耗多少克氧气?
2.工业上用电解水的方法制取氧气,现制得标准状态下氢气2.24升(密度为0.09克/升),则需电解多少克水?练习:3、把一定质量的碳放在一定质量的氧气中燃烧。实验数据如下表:
(1)这三次实验,从数据看,哪几次符合质量守恒定律?
(2)第二次实验为什么不生成28克CO2?哪种物质有剩余?余下多少克?
(3)第三次实验为什么不生成30克CO2?哪种物质有剩余?余下多少克?
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
