第1节 空气与氧气(第3课时氧气制取)
文档属性
| 名称 | 第1节 空气与氧气(第3课时氧气制取) |  | |
| 格式 | zip | ||
| 文件大小 | 506.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2014-05-09 21:20:46 | ||
图片预览




文档简介
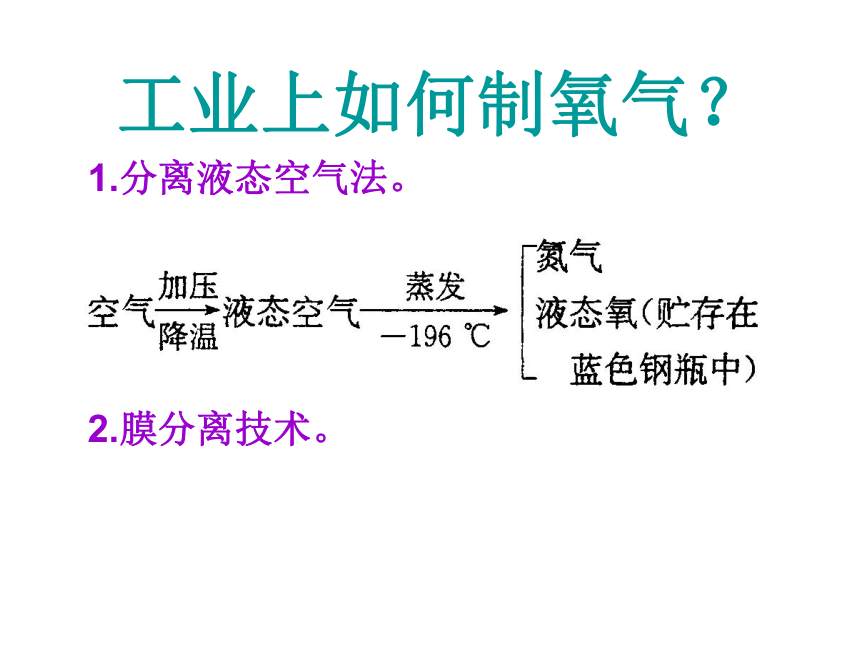
课件17张PPT。第1节 空气与氧气(3)——氧气的制取工业上如何制氧气?1.分离液态空气法。2.膜分离技术。一、氧气的制取氯酸钾加热分解法
高锰酸钾加热分解法
过氧化氢分解法3. 装置过氧化氢分解法 过氧化氢 二氧化锰 水 + 氧气 (H2O2)(MnO2 ) (H2O) (O2)1.药品:过氧化氢(白色固体)
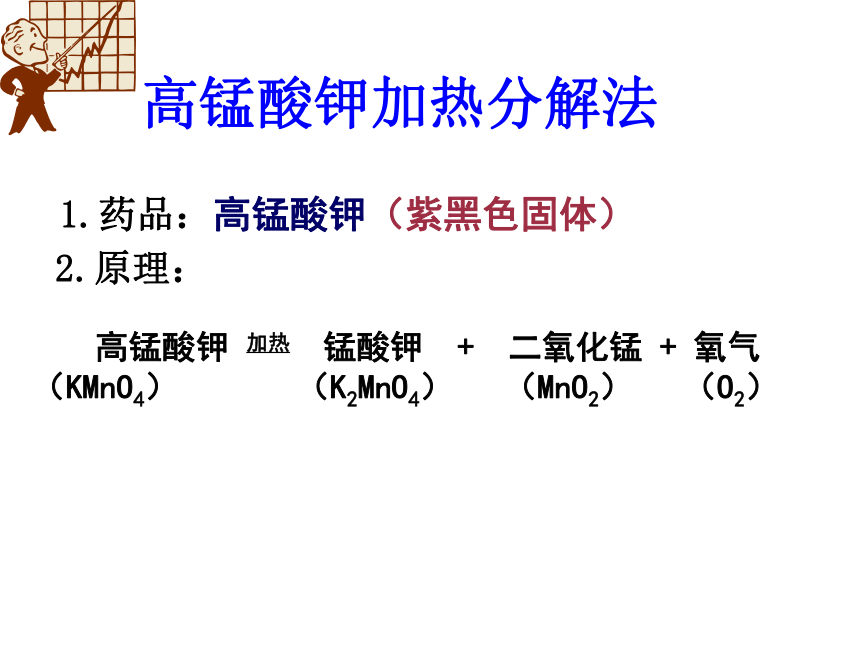
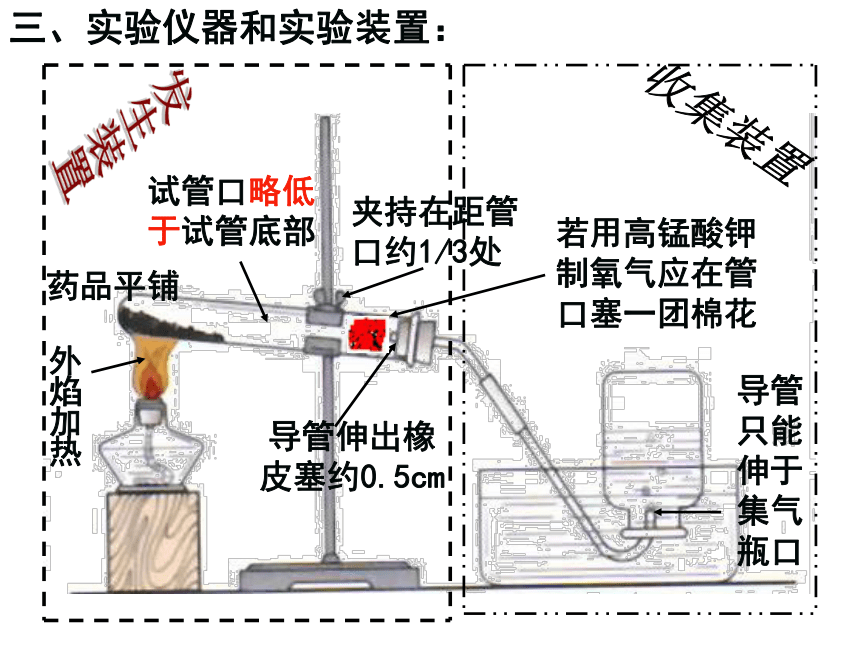
二氧化锰(黑色固体)2.原理:高锰酸钾加热分解法1.药品:高锰酸钾(紫黑色固体)高锰酸钾 加热 锰酸钾 + 二氧化锰 + 氧气 (KMnO4) (K2MnO4) (MnO2) (O2)2.原理:三、实验仪器和实验装置:外焰加热药品平铺夹持在距管口约1/3处若用高锰酸钾制氧气应在管口塞一团棉花试管口略低于试管底部导管伸出橡 皮塞约0.5cm导管只能伸于集气瓶口4.实验步骤:(1)查:检查装置的气密性。
(2)装:把药品装入试管中,使之平铺
于试管底部。(一斜、二送、三竖直)
(3)定:把试管固定在铁架台上
(铁夹要夹在试管的中上部)
(4)点:点燃酒精灯加热。(先预热)
(5)收:收集气体(气泡连续均匀时)
(6)离:将导管移离水面。
(7)熄:熄灭酒精灯。 (查、装、定、点、收、离、熄)1、固定试管时,为什么试管口要略低于试管底部?防止冷凝水回流到热的试管底部,炸裂试管2、用排水集气法应什么时候开始收集?当气泡连续均匀放出时开始收集;(哪种方法得到的氧气更纯?3、实验结束时应先将导管移离水面,还是先停止加热,为什么?先将导管移离水面,后停止加热,否则水将沿导管倒流回热的试管底部,炸裂试管注意事项:用排水法收集的气体更纯)4.用高锰酸钾制氧气时,为什么要在试管口塞一团棉花?可以防止加热时高锰酸钾粉末进入导管氯酸钾加热分解法1.药品:氯酸钾 和 二氧化锰
(白色固体)(黑色固体)3.装置:(试管口不放棉花)2.原理:氯酸钾 氯化钾 + 氧气 (KClO3) (KCl) (O2)二氧化锰 加热1.实验室制氧气反应原理(三个)归纳与整理2.发生装置选择的依据:
①反应物的状态
②反应条件氯酸钾 氯化钾 + 氧气 二氧化锰 加热高锰酸钾 锰酸钾+二氧化锰+氧气
(KMnO4) (K2MnO4) (MnO2) (O2) 加热(KClO3) (KCl) (O2)过氧化氢 水 + 氧气(H2O2) (H2O) (O2)二氧化锰归纳与整理H2O2制氧气KMnO4或KClO3制氧气固液不加热型固固加热型①节能(不需加热 )
②能控制产生气体的速率
③操作简便
④产物是水,无污染图1装置与图2装置制氧气相比较的优点:气体常见的收集方法:(1)排水法适于气体不易或难溶于水且不与水反应(2)排空气法:1)向上排空气法适于气体的密度比空气大且不与空气反应2)向下排空气法适于气体的密度比空气小且不与空气反应1. 有人设计用如图所示装置制取和收集
氧气。
(1)图中有四处明显
错误,请指出并改正。
(2)用排水法收集氧气时,若要得到纯净的氧气,应在 时收集。 (3)试管口没有略向下倾斜造成的后果
是 。气泡连续均匀试管炸裂练习:制气前必须首先检查装置的气密性。 将装置连接好,导气管的一端浸入水中,用手握住容器(试管)的外壁,若导管口有气泡冒出,放开后在导管中形成一段水柱不消失,则气密性良好,反之则不好。(也可以用双手握或用酒精灯微热)(1)排 水 法(氧气不易溶于水)(2)向上排空气法(氧气的密度比空气大)5.氧气的收集方法向上排空气法验满方法:将带火星的木条放在集气瓶口,若木条复燃,证明已收集满。当气泡连续均匀放出时才开始收集
高锰酸钾加热分解法
过氧化氢分解法3. 装置过氧化氢分解法 过氧化氢 二氧化锰 水 + 氧气 (H2O2)(MnO2 ) (H2O) (O2)1.药品:过氧化氢(白色固体)
二氧化锰(黑色固体)2.原理:高锰酸钾加热分解法1.药品:高锰酸钾(紫黑色固体)高锰酸钾 加热 锰酸钾 + 二氧化锰 + 氧气 (KMnO4) (K2MnO4) (MnO2) (O2)2.原理:三、实验仪器和实验装置:外焰加热药品平铺夹持在距管口约1/3处若用高锰酸钾制氧气应在管口塞一团棉花试管口略低于试管底部导管伸出橡 皮塞约0.5cm导管只能伸于集气瓶口4.实验步骤:(1)查:检查装置的气密性。
(2)装:把药品装入试管中,使之平铺
于试管底部。(一斜、二送、三竖直)
(3)定:把试管固定在铁架台上
(铁夹要夹在试管的中上部)
(4)点:点燃酒精灯加热。(先预热)
(5)收:收集气体(气泡连续均匀时)
(6)离:将导管移离水面。
(7)熄:熄灭酒精灯。 (查、装、定、点、收、离、熄)1、固定试管时,为什么试管口要略低于试管底部?防止冷凝水回流到热的试管底部,炸裂试管2、用排水集气法应什么时候开始收集?当气泡连续均匀放出时开始收集;(哪种方法得到的氧气更纯?3、实验结束时应先将导管移离水面,还是先停止加热,为什么?先将导管移离水面,后停止加热,否则水将沿导管倒流回热的试管底部,炸裂试管注意事项:用排水法收集的气体更纯)4.用高锰酸钾制氧气时,为什么要在试管口塞一团棉花?可以防止加热时高锰酸钾粉末进入导管氯酸钾加热分解法1.药品:氯酸钾 和 二氧化锰
(白色固体)(黑色固体)3.装置:(试管口不放棉花)2.原理:氯酸钾 氯化钾 + 氧气 (KClO3) (KCl) (O2)二氧化锰 加热1.实验室制氧气反应原理(三个)归纳与整理2.发生装置选择的依据:
①反应物的状态
②反应条件氯酸钾 氯化钾 + 氧气 二氧化锰 加热高锰酸钾 锰酸钾+二氧化锰+氧气
(KMnO4) (K2MnO4) (MnO2) (O2) 加热(KClO3) (KCl) (O2)过氧化氢 水 + 氧气(H2O2) (H2O) (O2)二氧化锰归纳与整理H2O2制氧气KMnO4或KClO3制氧气固液不加热型固固加热型①节能(不需加热 )
②能控制产生气体的速率
③操作简便
④产物是水,无污染图1装置与图2装置制氧气相比较的优点:气体常见的收集方法:(1)排水法适于气体不易或难溶于水且不与水反应(2)排空气法:1)向上排空气法适于气体的密度比空气大且不与空气反应2)向下排空气法适于气体的密度比空气小且不与空气反应1. 有人设计用如图所示装置制取和收集
氧气。
(1)图中有四处明显
错误,请指出并改正。
(2)用排水法收集氧气时,若要得到纯净的氧气,应在 时收集。 (3)试管口没有略向下倾斜造成的后果
是 。气泡连续均匀试管炸裂练习:制气前必须首先检查装置的气密性。 将装置连接好,导气管的一端浸入水中,用手握住容器(试管)的外壁,若导管口有气泡冒出,放开后在导管中形成一段水柱不消失,则气密性良好,反之则不好。(也可以用双手握或用酒精灯微热)(1)排 水 法(氧气不易溶于水)(2)向上排空气法(氧气的密度比空气大)5.氧气的收集方法向上排空气法验满方法:将带火星的木条放在集气瓶口,若木条复燃,证明已收集满。当气泡连续均匀放出时才开始收集
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
