第三节化学方程式计算
图片预览







文档简介
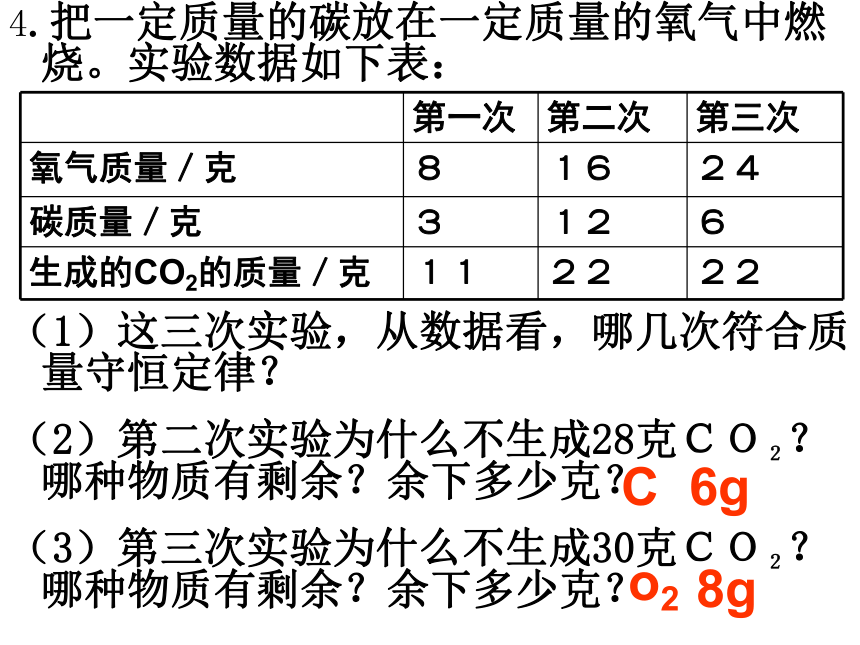
课件25张PPT。4.把一定质量的碳放在一定质量的氧气中燃烧。实验数据如下表:
(1)这三次实验,从数据看,哪几次符合质量守恒定律?
(2)第二次实验为什么不生成28克CO2?哪种物质有剩余?余下多少克?
(3)第三次实验为什么不生成30克CO2?哪种物质有剩余?余下多少克?
C6go28g方程要配平,
纯量代方程;
对应列比例 ,
单位不能忘;
6步骤需完整。 化学方程式计算中应注意的几个问题:1,解题格式一定要规范和程序化.
2,化学方程式一定要正确,一定要配平,否则违背客观事实和质量守恒定律.
3,各物质之间的质量比一定要计算准确,不能马虎,更不能张冠李戴.
4,化学方程式计算依据的是“质量守恒定律”,因此题中如给的条件是体积先要换算成单位.
5,化学方程式中各量都是纯物质之间的质量关系,计算时一定要把杂质去掉才行.例2、实验室用过氧化氢制取氧气,现欲制氧气2.24升 (氧气在常温下的密度为1.429克/升)。问:需过氧化氢多少克? 2H2O2 2H2O + O2↑MnO2X3.268 32 解:
m = ρv =1.429x2.24 = 3.2g68
X32
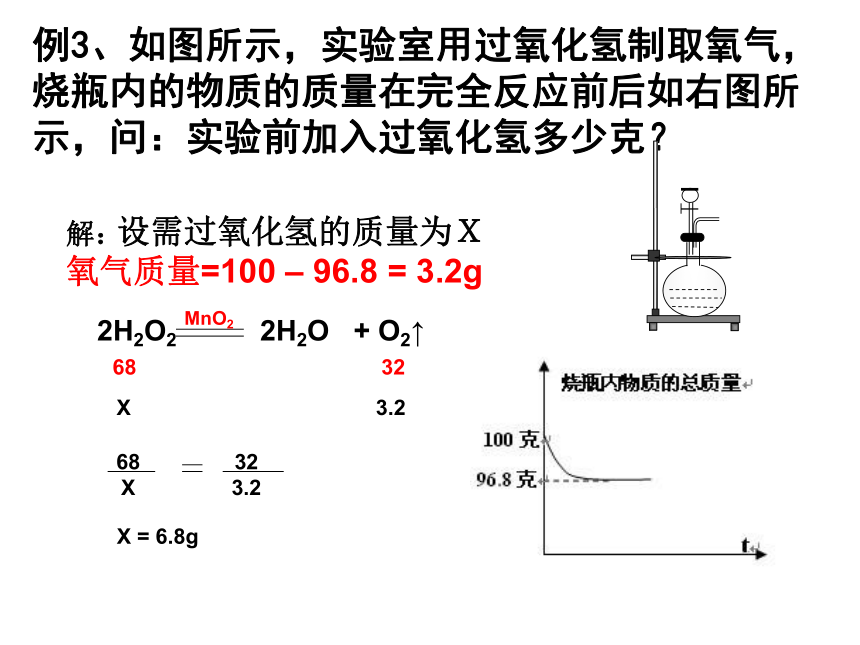
3.2X = 6.8g设需过氧化氢的质量为X例3、如图所示,实验室用过氧化氢制取氧气,烧瓶内的物质的质量在完全反应前后如右图所示,问:实验前加入过氧化氢多少克? 2H2O2 2H2O + O2↑MnO2X3.268 32 68
X32
3.2X = 6.8g解:
氧气质量=100 – 96.8 = 3.2g设需过氧化氢的质量为X 例4、实验室用100克过氧化氢溶液制取氧气,完全反应后生成氧气3.2克?问:原氧化氢溶液的质量分数是多少? 2H2O2 2H2O + O2↑MnO2X3.268 32 68
X32
3.2X = 6.8g解:6.8
100100%6.8%设需过氧化氢的质量为X你会做吗?5.在化学反应A+B=C+D中,40克A和1克B恰好完全反应,生成20克C,则生成D的质量是 ( )
A.20克 B.21克 C.41克 D.59克 6. a g与b g的氯酸钾和二氧化锰混合后,充分加热,得剩余固体c g,则生成氧气的质量为 g KCl的质量为______ g 。Ba+b-cc-b你会做吗?3.在A+2B===C+2D的反应中,若 A、B、C的相对分子质量依次为16、32、44,则D的相对分子质量为 ( )
A.4 B.36 C.18 D.无法确定4.将镁条点燃后,伸入到装有二氧化碳的集气瓶中,发现镁条仍能继续燃烧,生成了白色的氧化镁和黑色的碳粉。该过程用化学方程式表示为: 。我们可以知道,可燃物燃烧时不一定都与 反应。 C氧气CO2+Mg 点燃 MgO+C 由干燥的氯酸钾和二氧化锰组成的混合物的质量为9.9g。把该固体混合物放到大试管中加热,反应完全后,冷却到反应前的温度,称得试管中固体物质的质量为7.2g。
(1)求原混合物中氯酸钾的质量。
(2)反应后试管中固体物质是什么?它们的质量各是多少?练习:解题过程:解:根据质量守恒定律,生成氧气为9.9g-7.2g=2.7g
设原混合物中含氯酸钾质量为x 96 x 2.7g245 : 96 = x : 2.7gX=6.9g则MnO2的质量为9.9g - 6.9g = 3g剩余固体中KCl的质量为7.2g - 3g = 4.2g答:略例2:用多少克含杂质为10%的氯酸钾反应,可制得2克氧气?解:设需含杂质10%的氯酸钾X克245 96X90% 2克X=5.7克答:用5.7克含杂质为10%的氯酸钾反应,可制得2克氧气.
2、取氯酸钾和二氧化锰的混合物15.5克,放入一大试管中加热,反应完全后冷却到反应前温度,称残余固体质量为10.7克。求生成氧气多少克?生成氯化钾多少克?解:根据题意,生成氧气的质量为: 15.5克- 10.7克=4.8克。设生成的氯化钾的质量为x 149∶96 = x∶4.8克x 4.8克x = 7.45克答:生成氧气4.8克,生成氯化钾7.45克。149 96化学方程式计算中几个常用公式分解百分率= 已分解的物质质量未分解时该物质质量×100%物质纯度= 纯物质质量不纯物质质量×100%不纯物质质量= 纯物质质量+ 杂质质量质量=体积×密度化学计算题型小结:题型一,已知某反应物或生成物的质量,求另 一反应物或生成物的质量。例一:7.9克高锰酸钾受热完全分解,可制得氧气多少克?
化学计算题型小结:题型二,含杂质物质的计算例2:有一含杂质的的锌8 克与足量的稀硫酸反应共产生0.2克氢气,计算锌的纯度?
化学计算题型小结:题型三,理论数据与实际应用相关的计算例3,实验室计划把16克氧化铜用氢气完全还原,实际所需氢气的质量是多少?
化学计算题型小结:题型四,利用差量法例4,向一定量的锌粒中加入100克稀硫酸,过一会儿取出剩余的锌,称得溶液质量为106.3克,求有多少克锌参加了反应?化学计算题型小结:题型五,利用差量法例4,向一定量的锌粒中加入100克稀硫酸,过一会儿取出剩余的锌,称得溶液质量为106.3克,求有多少克锌参加了反应?
拓展题:对4.6克铜和氧化铜的混合物,在加热的条件下不断通入氢气,直至质量不再改变为止,冷却后,称得残留固体质量为3.76克,求原混合物中铜的质量分数?化学计算题型小结:题型五,无数据或缺少数据的计算例5,在氯酸钾和MnO2混合加热制O2的反应中,若MnO2在混合物中的质量分数由25%提高到30%,则氯酸钾的分解率是多少?化学计算题型小结:题型六,在化学计算中的天平问题例8,在托盘天平两盘上的烧杯里,各放入100g质量分数为9.8%的稀硫酸,再向两烧杯中放入一定质量的铁片和锌粒,通过计算回答(1)为保持天平平衡,至少加入的锌粒和铁片的质量为多少?(2)如果反应后酸有剩余,所加锌与铁的质量少于上述中的质量,天平是否平衡?若不平衡,天平指针指向哪一边?题型七:利用质量守恒定律1,化学方程式2A+B=C+2D中,A的相对分子质量为103,B的相对分子质量为71,C的相对分子质量为160,则D的相对分子质量是()
2,若反应206克A与71克B恰好完全反应,生成160克C,则生成D的质量是()巩固练习1,将氧化铜和铜的混合物2克加热,通入氢气使其质量不再减少为止,冷却后称得剩余固体1.68克,求原混合物中氧化铜的质量分数?巩固练习2,质量相同的下列金属分别与足量的盐酸反应,产生H2最多的是______
A, Mg B Al C Zn D Fe
3,有一不纯的铁片5.6克与足量的稀硫酸反应后,得0.18克氢气,则该铁片混有的金属可能是______
A Zn B Al C Mg D Na
讨论:若产生2.1克或2克氢气、又会是什么情况呢?解 (1)设未知数 ….... …….….设 (2)写出化学方程式…...…..写(3) 标出有关物质的式量、
已知量和未知量 ..…...标(4) 列比例式 .….……..列 ….. …... ……………… … ……….求解 答(5) 简明地写出答案..…...答
(1)这三次实验,从数据看,哪几次符合质量守恒定律?
(2)第二次实验为什么不生成28克CO2?哪种物质有剩余?余下多少克?
(3)第三次实验为什么不生成30克CO2?哪种物质有剩余?余下多少克?
C6go28g方程要配平,
纯量代方程;
对应列比例 ,
单位不能忘;
6步骤需完整。 化学方程式计算中应注意的几个问题:1,解题格式一定要规范和程序化.
2,化学方程式一定要正确,一定要配平,否则违背客观事实和质量守恒定律.
3,各物质之间的质量比一定要计算准确,不能马虎,更不能张冠李戴.
4,化学方程式计算依据的是“质量守恒定律”,因此题中如给的条件是体积先要换算成单位.
5,化学方程式中各量都是纯物质之间的质量关系,计算时一定要把杂质去掉才行.例2、实验室用过氧化氢制取氧气,现欲制氧气2.24升 (氧气在常温下的密度为1.429克/升)。问:需过氧化氢多少克? 2H2O2 2H2O + O2↑MnO2X3.268 32 解:
m = ρv =1.429x2.24 = 3.2g68
X32
3.2X = 6.8g设需过氧化氢的质量为X例3、如图所示,实验室用过氧化氢制取氧气,烧瓶内的物质的质量在完全反应前后如右图所示,问:实验前加入过氧化氢多少克? 2H2O2 2H2O + O2↑MnO2X3.268 32 68
X32
3.2X = 6.8g解:
氧气质量=100 – 96.8 = 3.2g设需过氧化氢的质量为X 例4、实验室用100克过氧化氢溶液制取氧气,完全反应后生成氧气3.2克?问:原氧化氢溶液的质量分数是多少? 2H2O2 2H2O + O2↑MnO2X3.268 32 68
X32
3.2X = 6.8g解:6.8
100100%6.8%设需过氧化氢的质量为X你会做吗?5.在化学反应A+B=C+D中,40克A和1克B恰好完全反应,生成20克C,则生成D的质量是 ( )
A.20克 B.21克 C.41克 D.59克 6. a g与b g的氯酸钾和二氧化锰混合后,充分加热,得剩余固体c g,则生成氧气的质量为 g KCl的质量为______ g 。Ba+b-cc-b你会做吗?3.在A+2B===C+2D的反应中,若 A、B、C的相对分子质量依次为16、32、44,则D的相对分子质量为 ( )
A.4 B.36 C.18 D.无法确定4.将镁条点燃后,伸入到装有二氧化碳的集气瓶中,发现镁条仍能继续燃烧,生成了白色的氧化镁和黑色的碳粉。该过程用化学方程式表示为: 。我们可以知道,可燃物燃烧时不一定都与 反应。 C氧气CO2+Mg 点燃 MgO+C 由干燥的氯酸钾和二氧化锰组成的混合物的质量为9.9g。把该固体混合物放到大试管中加热,反应完全后,冷却到反应前的温度,称得试管中固体物质的质量为7.2g。
(1)求原混合物中氯酸钾的质量。
(2)反应后试管中固体物质是什么?它们的质量各是多少?练习:解题过程:解:根据质量守恒定律,生成氧气为9.9g-7.2g=2.7g
设原混合物中含氯酸钾质量为x 96 x 2.7g245 : 96 = x : 2.7gX=6.9g则MnO2的质量为9.9g - 6.9g = 3g剩余固体中KCl的质量为7.2g - 3g = 4.2g答:略例2:用多少克含杂质为10%的氯酸钾反应,可制得2克氧气?解:设需含杂质10%的氯酸钾X克245 96X90% 2克X=5.7克答:用5.7克含杂质为10%的氯酸钾反应,可制得2克氧气.
2、取氯酸钾和二氧化锰的混合物15.5克,放入一大试管中加热,反应完全后冷却到反应前温度,称残余固体质量为10.7克。求生成氧气多少克?生成氯化钾多少克?解:根据题意,生成氧气的质量为: 15.5克- 10.7克=4.8克。设生成的氯化钾的质量为x 149∶96 = x∶4.8克x 4.8克x = 7.45克答:生成氧气4.8克,生成氯化钾7.45克。149 96化学方程式计算中几个常用公式分解百分率= 已分解的物质质量未分解时该物质质量×100%物质纯度= 纯物质质量不纯物质质量×100%不纯物质质量= 纯物质质量+ 杂质质量质量=体积×密度化学计算题型小结:题型一,已知某反应物或生成物的质量,求另 一反应物或生成物的质量。例一:7.9克高锰酸钾受热完全分解,可制得氧气多少克?
化学计算题型小结:题型二,含杂质物质的计算例2:有一含杂质的的锌8 克与足量的稀硫酸反应共产生0.2克氢气,计算锌的纯度?
化学计算题型小结:题型三,理论数据与实际应用相关的计算例3,实验室计划把16克氧化铜用氢气完全还原,实际所需氢气的质量是多少?
化学计算题型小结:题型四,利用差量法例4,向一定量的锌粒中加入100克稀硫酸,过一会儿取出剩余的锌,称得溶液质量为106.3克,求有多少克锌参加了反应?化学计算题型小结:题型五,利用差量法例4,向一定量的锌粒中加入100克稀硫酸,过一会儿取出剩余的锌,称得溶液质量为106.3克,求有多少克锌参加了反应?
拓展题:对4.6克铜和氧化铜的混合物,在加热的条件下不断通入氢气,直至质量不再改变为止,冷却后,称得残留固体质量为3.76克,求原混合物中铜的质量分数?化学计算题型小结:题型五,无数据或缺少数据的计算例5,在氯酸钾和MnO2混合加热制O2的反应中,若MnO2在混合物中的质量分数由25%提高到30%,则氯酸钾的分解率是多少?化学计算题型小结:题型六,在化学计算中的天平问题例8,在托盘天平两盘上的烧杯里,各放入100g质量分数为9.8%的稀硫酸,再向两烧杯中放入一定质量的铁片和锌粒,通过计算回答(1)为保持天平平衡,至少加入的锌粒和铁片的质量为多少?(2)如果反应后酸有剩余,所加锌与铁的质量少于上述中的质量,天平是否平衡?若不平衡,天平指针指向哪一边?题型七:利用质量守恒定律1,化学方程式2A+B=C+2D中,A的相对分子质量为103,B的相对分子质量为71,C的相对分子质量为160,则D的相对分子质量是()
2,若反应206克A与71克B恰好完全反应,生成160克C,则生成D的质量是()巩固练习1,将氧化铜和铜的混合物2克加热,通入氢气使其质量不再减少为止,冷却后称得剩余固体1.68克,求原混合物中氧化铜的质量分数?巩固练习2,质量相同的下列金属分别与足量的盐酸反应,产生H2最多的是______
A, Mg B Al C Zn D Fe
3,有一不纯的铁片5.6克与足量的稀硫酸反应后,得0.18克氢气,则该铁片混有的金属可能是______
A Zn B Al C Mg D Na
讨论:若产生2.1克或2克氢气、又会是什么情况呢?解 (1)设未知数 ….... …….….设 (2)写出化学方程式…...…..写(3) 标出有关物质的式量、
已知量和未知量 ..…...标(4) 列比例式 .….……..列 ….. …... ……………… … ……….求解 答(5) 简明地写出答案..…...答
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
