第7章应用广泛的酸、碱、盐检测题--2022-2023学年九年级化学沪教版(全国)下册(含答案)
文档属性
| 名称 | 第7章应用广泛的酸、碱、盐检测题--2022-2023学年九年级化学沪教版(全国)下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 245.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-19 06:56:03 | ||
图片预览


文档简介
第7章《应用广泛的酸、碱、盐》检测题
一、单选题
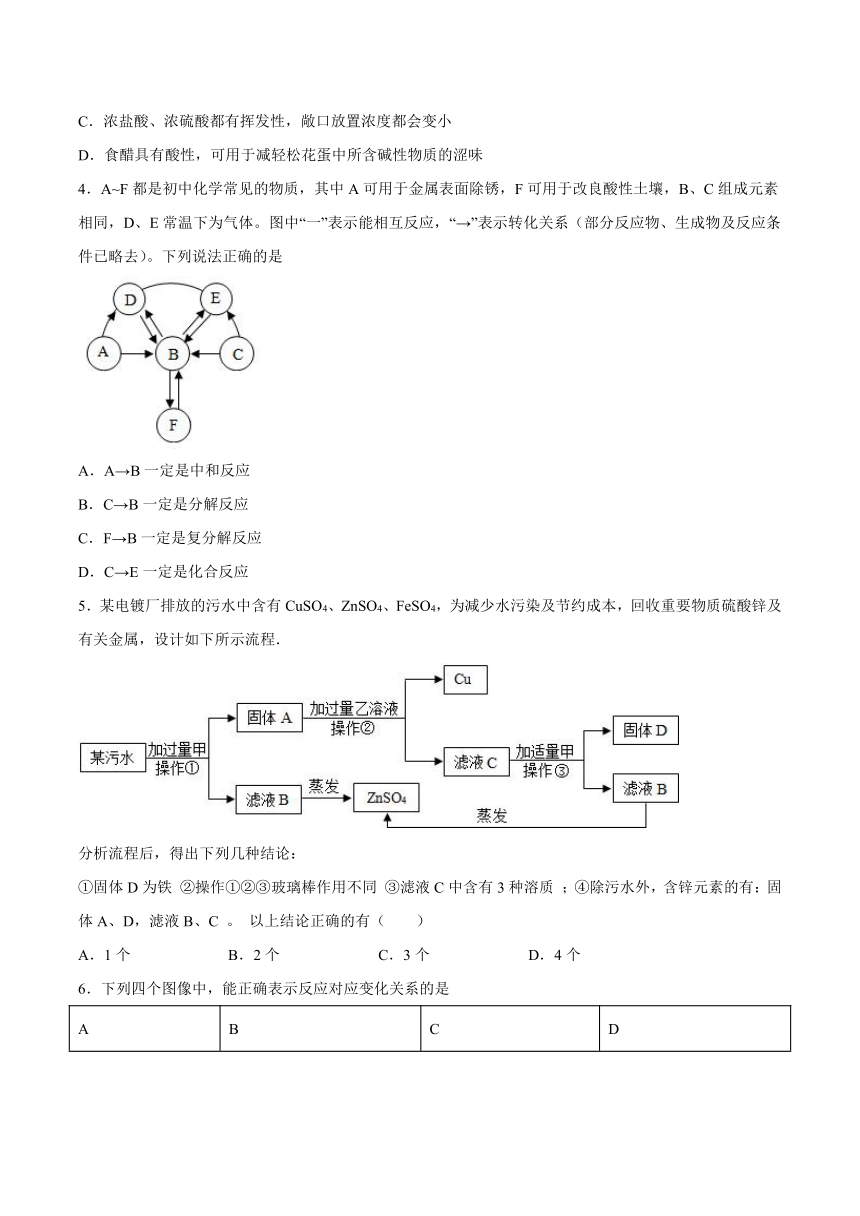
1.下列实验操作叙述正确的是
A.实验用剩的药品应放回原试剂瓶中
B.过滤时,将玻璃棒靠在三层滤纸的一边
C.测某酸性溶液的pH时,先用水将pH试纸润湿
D.在“粗盐中难溶性杂质的去除”实验中,将蒸发皿中的溶液直接蒸干
2.下列实验中,能达到实验目的的是
A.验证质量守恒定律
B. 探究合金与纯金属的硬度
C. 判断铝、铜、银的金属活动性顺序
D. 制取二氧化碳
3.下列说法中,正确的是
A.Fe、Fe2O3都能与稀盐酸反应,都属于置换反应
B.CaO、NaOH固体都能与水反应,都能作干燥剂
C.浓盐酸、浓硫酸都有挥发性,敞口放置浓度都会变小
D.食醋具有酸性,可用于减轻松花蛋中所含碱性物质的涩味
4.A~F都是初中化学常见的物质,其中A可用于金属表面除锈,F可用于改良酸性土壤,B、C组成元素相同,D、E常温下为气体。图中“一”表示能相互反应,“→”表示转化关系(部分反应物、生成物及反应条件已略去)。下列说法正确的是
A.A→B一定是中和反应
B.C→B一定是分解反应
C.F→B一定是复分解反应
D.C→E一定是化合反应
5.某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如下所示流程.
分析流程后,得出下列几种结论:
①固体D为铁 ②操作①②③玻璃棒作用不同 ③滤液C中含有3种溶质 ;④除污水外,含锌元素的有:固体A、D,滤液B、C 。 以上结论正确的有( )
A.1个 B.2个 C.3个 D.4个
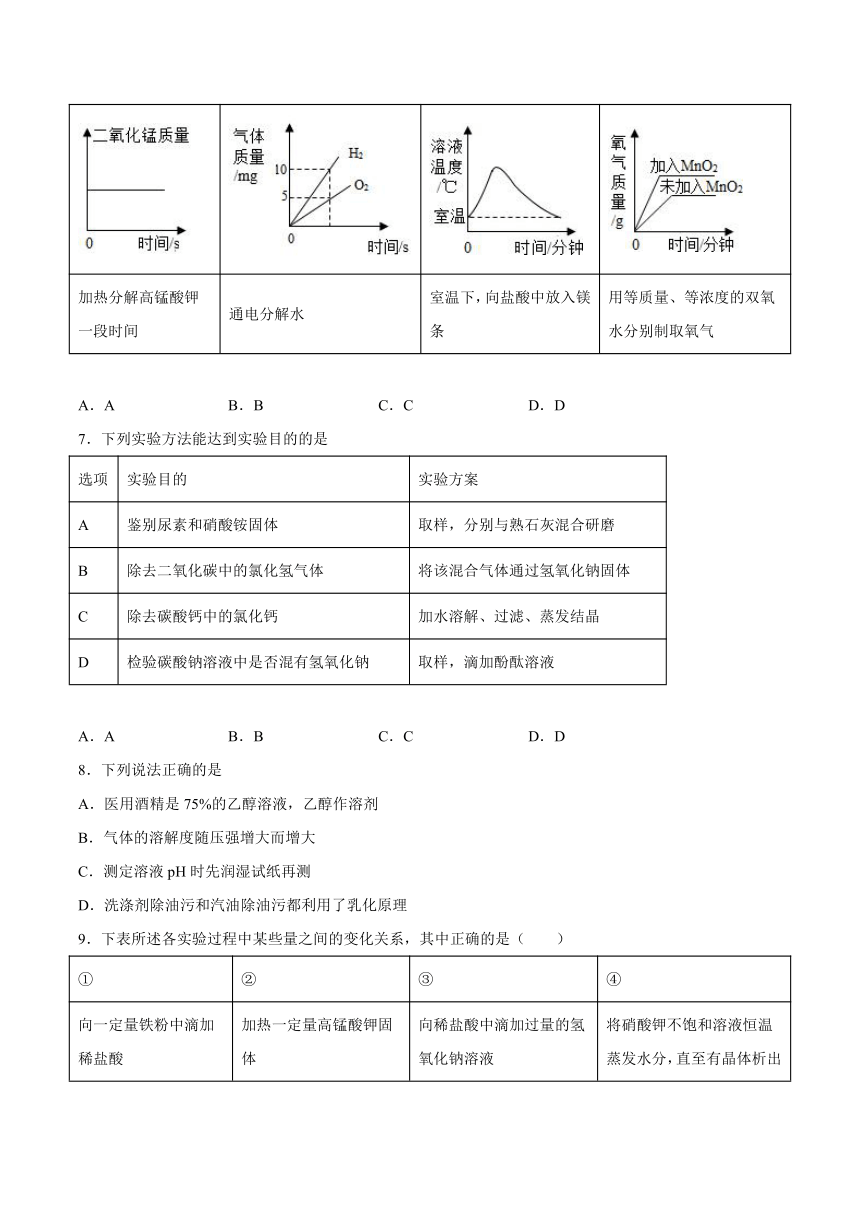
6.下列四个图像中,能正确表示反应对应变化关系的是
A B C D
加热分解高锰酸钾一段时间 通电分解水 室温下,向盐酸中放入镁条 用等质量、等浓度的双氧水分别制取氧气
A.A B.B C.C D.D
7.下列实验方法能达到实验目的的是
选项 实验目的 实验方案
A 鉴别尿素和硝酸铵固体 取样,分别与熟石灰混合研磨
B 除去二氧化碳中的氯化氢气体 将该混合气体通过氢氧化钠固体
C 除去碳酸钙中的氯化钙 加水溶解、过滤、蒸发结晶
D 检验碳酸钠溶液中是否混有氢氧化钠 取样,滴加酚酞溶液
A.A B.B C.C D.D
8.下列说法正确的是
A.医用酒精是75%的乙醇溶液,乙醇作溶剂
B.气体的溶解度随压强增大而增大
C.测定溶液pH时先润湿试纸再测
D.洗涤剂除油污和汽油除油污都利用了乳化原理
9.下表所述各实验过程中某些量之间的变化关系,其中正确的是( )
① ② ③ ④
向一定量铁粉中滴加稀盐酸 加热一定量高锰酸钾固体 向稀盐酸中滴加过量的氢氧化钠溶液 将硝酸钾不饱和溶液恒温蒸发水分,直至有晶体析出
A.只有① B.只有② C.①、②、④ D.②、③、④
10.下列归类正确的是()
选项 归类 物质(或元素)
A 常见碱 纯碱、烧碱、熟石灰
B 常见合金 生铁、铜绿、硬铝
C 常见干燥剂 浓硫酸,生石灰、苛性钠
D 人体中常见微量元素 碘、锌、硒、钙等
A.A B.B C.C D.D
11.下列实验现象的描述正确的是( )
A.木炭在氧气中燃烧发出白光产生二氧化碳气体
B.红磷在空气中燃烧,产生大量白雾
C.石蕊试液遇氨气变红色
D.升高饱和石灰水的温度,溶液会变浑浊
12.推理是一种重要的化学思维方法,以下推理合理的是
A.酸溶液的pH小于7,故pH小于7的溶液一定是酸溶液
B.溶液是均一、稳定的,所以均一、稳定的物质一定是溶液
C.洗涤剂去油污是利用了乳化作用,则汽油去油污也是利用了乳化作用
D.中和反应一定有盐和水生成,但是有盐和水生成的反应不一定是中和反应
13.下列对物质用途描述错误的是
A.用稀盐酸除铁锈 B.用液态二氧化碳灭火器扑灭图书档案室的火灾
C.用氮气作为灯泡填充气 D.用烧碱消除面团发酵产生的酸味
二、填空题
14.传感器探究氢氧化钠溶液与稀硫酸发生酸碱中和过程中温度和 pH的变化,实验测定结果如图甲、乙图所示。请回答:
(1)图甲表明酸和碱的反应_____(填吸热或放热)。
(2)图乙表明实验时将_____(填 酸溶液滴入碱溶液或碱溶液滴入酸溶液)中。
(3)写出氢氧化钠溶液和稀硫酸反应的化学方程式:_____。
(4)在反应50 s时的溶液中滴加酚酞溶液,可观察到实验现象是_____。
(5)请从微观的角度分析图丙中甲、乙处分别应填入的微粒符号为_____、_。
15.金属在生产、生活中有广泛的用途。
(1)下图金属制品中,利用金属的物理性质有导热性、导电性和 ______________ 。
(2)下列四个实验中,铁钉最易生锈的是(填序号) ____________ 。
(3)工业常用赤铁矿(主要成分为氧化铁)和一氧化碳在高温条件下炼铁,该反应的化学方程式为 _______________________ 。
(4)某同学将带锈铁钉放入稀盐酸中,观察到铁锈逐渐消失,溶液由无色逐渐变成黄色,并有气泡产生,有关反应的化学方程式为 __________________________________ 。
(5)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的锌和铁,待反应停止后,请判断:若天平仍保持平衡,烧杯中一定没有剩余的物质是 _________ ;若天平失去平衡,则指针偏向的一侧的烧杯中溶液中的溶质是 _____________ 。
16.金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是________(填字母)。
A铂金饰品 B铝壶 C铜导线
(2)铁生锈实际上是铁与空气中的氧气和________(填名称)发生反应的结果,生活
中可以采用________(写一种方法即可)的方法防止铁器生锈。
(3)铝比铁活泼,但铝却不易腐蚀,原因是________(用化学方程式表示)。
(4)在硫酸铜和硫酸亚铁的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤渣和滤液。
①滤液中一定含有的溶质是_______(填化学式);
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是________(填化学式)。
(5)某钢铁厂每天需消耗4000t含氧化铁87.5%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是______t。
三、简答题
17.如图是一种医用药品瓶上的标签,试根据标签上的内容回答有关问题。
(1)请叙述“咀嚼”后咽下的好处。(答出一点即可) _________________________
(2)请写出服用该药片后,在胃中可能发生的化学反应方程式。 __________________________
18.用化学知识解释:
(1)烛火外焰温度高,焰心温度低的原因________________。
(2)能治疗胃酸过多的物质必须具有的性质是______________________。
(3)野外烧烤选择燃料时,不选择潮湿的燃料的理由__________________________。
四、实验题
19.实验是学习化学的重要途径,小华做了如下实验,请你和他一起完成实验活动。
(1)在白色点滴板上完成实验A,请将实验现象补充完整。
稀硫酸 氢氧化钙溶液
实验现象 _________________ 溶液变蓝色
(2)实验B是稀释浓硫酸的实验操作,液体a应为__________;
(3)实验B和实验C都用到了玻璃棒,作用并不同,实验C中玻璃棒的作用是__________;
(4)实验D用于验证二氧化碳与氢氧化钠溶液反应,看到的现象是 ________________;
(5)根据碱的化学性质,氢氧化钠还可以和醋酸(CH3COOH)发生反应,反应的化学方程式为:NaOH + CH3COOH = CH3COONa + H2O,则氢氧化钙与醋酸反应的化学方程式为:_____。
五、计算题
20.将氯化钠和碳酸钠组成的固体混合物18.9克完全溶解于196.8克水中,向该溶液中 加入一定质量的氯化钡溶液恰好完全反应,滤出19.7克沉淀。若将滤液蒸发100克水后,所得溶液溶质质量分数为10%。
计算:(1)蒸发水后所得溶液的质量。
(2)所用氯化钡溶液中溶质的质量分数。
参考答案:
1.B 2.B 3.D 4.B 5.B 6.C 7.A 8.B 9.B 10.C 11.D 12.D 13.D
14. 放热 碱溶液滴入酸溶液 溶液变红色 OH- H+
15.(1)延展性
(2)A
(3)
(4),
(5) HCl HCl和ZnCl2
16. C 水 喷漆等 4Al+3O2=2Al2O3 ZnSO4 Fe 、Cu 2500
17. 嚼碎后药物与胃酸的反应快或反应物的接触面积增大,化学反应加快 Al(OH)3+3HCl=AlCl3+3H2O
18. 外焰氧气充足燃烧旺盛,焰心氧气少燃烧不旺 能与盐酸反应,无毒,无腐蚀性 水吸热,不易达到可燃物的着火点
19. 溶液变红 浓硫酸 引流,防止液体冲破滤纸 气球变大 Ca(OH)2 + 2CH3COOH = (CH3COO)2Ca + 2H2O
20.解:设反应后生成氯化钠为x,需要氯化钡的质量为y、碳酸钠的质量为z。
x=11.7g
y=20.8g
z=10.6g
反应后溶液中溶质的质量为:18.9g-10.6g+11.7g=20g。
(1)蒸发水后所得溶液的质量: 。
(2)所用氯化钡溶液的质量为:200g+100g-(18.9g+196.8g-19.7g)=104g。
所用氯化钡溶液中溶质的质量分数为:。
答:(1)蒸发水后所得溶液的质量200g;
(2)所用氯化钡溶液中溶质的质量分数为:20%
一、单选题
1.下列实验操作叙述正确的是
A.实验用剩的药品应放回原试剂瓶中
B.过滤时,将玻璃棒靠在三层滤纸的一边
C.测某酸性溶液的pH时,先用水将pH试纸润湿
D.在“粗盐中难溶性杂质的去除”实验中,将蒸发皿中的溶液直接蒸干
2.下列实验中,能达到实验目的的是
A.验证质量守恒定律
B. 探究合金与纯金属的硬度
C. 判断铝、铜、银的金属活动性顺序
D. 制取二氧化碳
3.下列说法中,正确的是
A.Fe、Fe2O3都能与稀盐酸反应,都属于置换反应
B.CaO、NaOH固体都能与水反应,都能作干燥剂
C.浓盐酸、浓硫酸都有挥发性,敞口放置浓度都会变小
D.食醋具有酸性,可用于减轻松花蛋中所含碱性物质的涩味
4.A~F都是初中化学常见的物质,其中A可用于金属表面除锈,F可用于改良酸性土壤,B、C组成元素相同,D、E常温下为气体。图中“一”表示能相互反应,“→”表示转化关系(部分反应物、生成物及反应条件已略去)。下列说法正确的是
A.A→B一定是中和反应
B.C→B一定是分解反应
C.F→B一定是复分解反应
D.C→E一定是化合反应
5.某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如下所示流程.
分析流程后,得出下列几种结论:
①固体D为铁 ②操作①②③玻璃棒作用不同 ③滤液C中含有3种溶质 ;④除污水外,含锌元素的有:固体A、D,滤液B、C 。 以上结论正确的有( )
A.1个 B.2个 C.3个 D.4个
6.下列四个图像中,能正确表示反应对应变化关系的是
A B C D
加热分解高锰酸钾一段时间 通电分解水 室温下,向盐酸中放入镁条 用等质量、等浓度的双氧水分别制取氧气
A.A B.B C.C D.D
7.下列实验方法能达到实验目的的是
选项 实验目的 实验方案
A 鉴别尿素和硝酸铵固体 取样,分别与熟石灰混合研磨
B 除去二氧化碳中的氯化氢气体 将该混合气体通过氢氧化钠固体
C 除去碳酸钙中的氯化钙 加水溶解、过滤、蒸发结晶
D 检验碳酸钠溶液中是否混有氢氧化钠 取样,滴加酚酞溶液
A.A B.B C.C D.D
8.下列说法正确的是
A.医用酒精是75%的乙醇溶液,乙醇作溶剂
B.气体的溶解度随压强增大而增大
C.测定溶液pH时先润湿试纸再测
D.洗涤剂除油污和汽油除油污都利用了乳化原理
9.下表所述各实验过程中某些量之间的变化关系,其中正确的是( )
① ② ③ ④
向一定量铁粉中滴加稀盐酸 加热一定量高锰酸钾固体 向稀盐酸中滴加过量的氢氧化钠溶液 将硝酸钾不饱和溶液恒温蒸发水分,直至有晶体析出
A.只有① B.只有② C.①、②、④ D.②、③、④
10.下列归类正确的是()
选项 归类 物质(或元素)
A 常见碱 纯碱、烧碱、熟石灰
B 常见合金 生铁、铜绿、硬铝
C 常见干燥剂 浓硫酸,生石灰、苛性钠
D 人体中常见微量元素 碘、锌、硒、钙等
A.A B.B C.C D.D
11.下列实验现象的描述正确的是( )
A.木炭在氧气中燃烧发出白光产生二氧化碳气体
B.红磷在空气中燃烧,产生大量白雾
C.石蕊试液遇氨气变红色
D.升高饱和石灰水的温度,溶液会变浑浊
12.推理是一种重要的化学思维方法,以下推理合理的是
A.酸溶液的pH小于7,故pH小于7的溶液一定是酸溶液
B.溶液是均一、稳定的,所以均一、稳定的物质一定是溶液
C.洗涤剂去油污是利用了乳化作用,则汽油去油污也是利用了乳化作用
D.中和反应一定有盐和水生成,但是有盐和水生成的反应不一定是中和反应
13.下列对物质用途描述错误的是
A.用稀盐酸除铁锈 B.用液态二氧化碳灭火器扑灭图书档案室的火灾
C.用氮气作为灯泡填充气 D.用烧碱消除面团发酵产生的酸味
二、填空题
14.传感器探究氢氧化钠溶液与稀硫酸发生酸碱中和过程中温度和 pH的变化,实验测定结果如图甲、乙图所示。请回答:
(1)图甲表明酸和碱的反应_____(填吸热或放热)。
(2)图乙表明实验时将_____(填 酸溶液滴入碱溶液或碱溶液滴入酸溶液)中。
(3)写出氢氧化钠溶液和稀硫酸反应的化学方程式:_____。
(4)在反应50 s时的溶液中滴加酚酞溶液,可观察到实验现象是_____。
(5)请从微观的角度分析图丙中甲、乙处分别应填入的微粒符号为_____、_。
15.金属在生产、生活中有广泛的用途。
(1)下图金属制品中,利用金属的物理性质有导热性、导电性和 ______________ 。
(2)下列四个实验中,铁钉最易生锈的是(填序号) ____________ 。
(3)工业常用赤铁矿(主要成分为氧化铁)和一氧化碳在高温条件下炼铁,该反应的化学方程式为 _______________________ 。
(4)某同学将带锈铁钉放入稀盐酸中,观察到铁锈逐渐消失,溶液由无色逐渐变成黄色,并有气泡产生,有关反应的化学方程式为 __________________________________ 。
(5)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的锌和铁,待反应停止后,请判断:若天平仍保持平衡,烧杯中一定没有剩余的物质是 _________ ;若天平失去平衡,则指针偏向的一侧的烧杯中溶液中的溶质是 _____________ 。
16.金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是________(填字母)。
A铂金饰品 B铝壶 C铜导线
(2)铁生锈实际上是铁与空气中的氧气和________(填名称)发生反应的结果,生活
中可以采用________(写一种方法即可)的方法防止铁器生锈。
(3)铝比铁活泼,但铝却不易腐蚀,原因是________(用化学方程式表示)。
(4)在硫酸铜和硫酸亚铁的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤渣和滤液。
①滤液中一定含有的溶质是_______(填化学式);
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是________(填化学式)。
(5)某钢铁厂每天需消耗4000t含氧化铁87.5%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是______t。
三、简答题
17.如图是一种医用药品瓶上的标签,试根据标签上的内容回答有关问题。
(1)请叙述“咀嚼”后咽下的好处。(答出一点即可) _________________________
(2)请写出服用该药片后,在胃中可能发生的化学反应方程式。 __________________________
18.用化学知识解释:
(1)烛火外焰温度高,焰心温度低的原因________________。
(2)能治疗胃酸过多的物质必须具有的性质是______________________。
(3)野外烧烤选择燃料时,不选择潮湿的燃料的理由__________________________。
四、实验题
19.实验是学习化学的重要途径,小华做了如下实验,请你和他一起完成实验活动。
(1)在白色点滴板上完成实验A,请将实验现象补充完整。
稀硫酸 氢氧化钙溶液
实验现象 _________________ 溶液变蓝色
(2)实验B是稀释浓硫酸的实验操作,液体a应为__________;
(3)实验B和实验C都用到了玻璃棒,作用并不同,实验C中玻璃棒的作用是__________;
(4)实验D用于验证二氧化碳与氢氧化钠溶液反应,看到的现象是 ________________;
(5)根据碱的化学性质,氢氧化钠还可以和醋酸(CH3COOH)发生反应,反应的化学方程式为:NaOH + CH3COOH = CH3COONa + H2O,则氢氧化钙与醋酸反应的化学方程式为:_____。
五、计算题
20.将氯化钠和碳酸钠组成的固体混合物18.9克完全溶解于196.8克水中,向该溶液中 加入一定质量的氯化钡溶液恰好完全反应,滤出19.7克沉淀。若将滤液蒸发100克水后,所得溶液溶质质量分数为10%。
计算:(1)蒸发水后所得溶液的质量。
(2)所用氯化钡溶液中溶质的质量分数。
参考答案:
1.B 2.B 3.D 4.B 5.B 6.C 7.A 8.B 9.B 10.C 11.D 12.D 13.D
14. 放热 碱溶液滴入酸溶液 溶液变红色 OH- H+
15.(1)延展性
(2)A
(3)
(4),
(5) HCl HCl和ZnCl2
16. C 水 喷漆等 4Al+3O2=2Al2O3 ZnSO4 Fe 、Cu 2500
17. 嚼碎后药物与胃酸的反应快或反应物的接触面积增大,化学反应加快 Al(OH)3+3HCl=AlCl3+3H2O
18. 外焰氧气充足燃烧旺盛,焰心氧气少燃烧不旺 能与盐酸反应,无毒,无腐蚀性 水吸热,不易达到可燃物的着火点
19. 溶液变红 浓硫酸 引流,防止液体冲破滤纸 气球变大 Ca(OH)2 + 2CH3COOH = (CH3COO)2Ca + 2H2O
20.解:设反应后生成氯化钠为x,需要氯化钡的质量为y、碳酸钠的质量为z。
x=11.7g
y=20.8g
z=10.6g
反应后溶液中溶质的质量为:18.9g-10.6g+11.7g=20g。
(1)蒸发水后所得溶液的质量: 。
(2)所用氯化钡溶液的质量为:200g+100g-(18.9g+196.8g-19.7g)=104g。
所用氯化钡溶液中溶质的质量分数为:。
答:(1)蒸发水后所得溶液的质量200g;
(2)所用氯化钡溶液中溶质的质量分数为:20%
