3.3 化学方程式 同步练习(含答案)
文档属性
| 名称 | 3.3 化学方程式 同步练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 208.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-04-21 07:30:31 | ||
图片预览



文档简介
3.3化学方程式
、选择题
在化学反应2A+5B=C+3D中,A、B两种物质恰好完全反应时的质量比为4:3,若生成C和D共21 g,则反应消耗B的质量为( )
A.6g B.9g C.12g D.16g
将一定量的某有机物R和氧气置于一个密闭容器中引燃,测得反应前后各物质的质量如下表所示:
物质 R 氧气 水 二氧化碳 一氧化碳
反应前质量(g) 4.4 12.8 0 0 0
反应后质量(g) 0 0 7.2 4.4 a
下列判断不正确的是( )
A.a值为5.6 B.R可能含有氧元素
C.R只含碳、氢元素 D.R中碳、氢元素的质量比为9:2
1.6g某物质在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列判断:①一定含C、H元素;②一定不含O元素:③可能含O元素:④一定含O元素;⑤分子中C、H原子个数比为1∶2;⑥分子中C、H原子个数比为1∶4。其中正确的是( )
A. ①②⑤ B.①②⑥ C.①③⑥ D.①④⑤
反应A+3B═2C,若7克A和一定量的B完全反应生成8.5克C,则A、B、C的相对分子质量比为( )
A.14:3:7 B.28:2:17 C.1:3:2 D.7:1.5:8.5
在化学方程式aC2H6+bO2 mCO2+nH2O中,各化学式计量数之间的关系正确的是( )
A.2m=a B.m=a C.3n=a D.2b=2m+n
O2和Cl2都是活泼的非金属单质,在一定条件下它们都能跟甲烷反应,已知氧气和甲烷充分反应后的生成物是二氧化碳和水,由此推断氯气和甲烷充分反应后的生成物是()
A.C和HCl B.CH2Cl2和HCl C.CCl4和HCl D.CCl4和H2
已知反应3A+2B═2C+D中,生成C和D的质量比为9:8,.若A和B两种物质共51g,充分混合后恰好完全反应,则生成D的质量是( )
A.24g B.18g C.27g D.48g
将a克碳放在b克氧气中燃烧所生成二氧化碳的质量是( )
A.等于(a+b)克 B.大于(a+b)克
C.小于(a+b)克 D.小于或等于(a+b)克
质量相等的两份固体甲和乙。甲是少量高锰酸钾和氯酸钾的混合物,乙是纯净的氯酸钾,将它们分别均匀加热。下列能正确反映产生氧气的质量和时间的关系的是( )
A. B.
C. D.
在一密闭的容器中,一定质量的硫与过量的氧气在点燃的条件下充分反应,容器内各相关量与时间(从反应开始计时)的对应关系正确的是()
A. B.
C. D.
、填空题
在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表所示:
物质 氧气 二氧化碳 水蒸气 M
反应前质量/g 100 1 1 24
反应后质量/g 4 67 55 x
(1)根据质量守恒定律,你认为X的值应为 ;
(2)未知物质M含有的元素为 ;
(3)该反应中,参加化学反应的M和氧气之间质量比为 。
在反应A+3B=2C+2D中,已知A和C的相对分子质量之比为7:11,一定量的A和B恰好完全反应后,生成4.4gC和1.8gD,则参加反应的A、B的质量之和为 ,参加反应的B的质量和生成D的质量比为 。
小凤又在一本参考书上发现,镁也能在二氧化碳中燃烧!于是她迫不及待地做起了这个实验(如图),将镁条点燃后迅速伸入盛有二氧化碳的集气瓶中,发现镁条剧烈燃烧,发出白光,放热,产生一种白色粉末和一种黑色粉末。
①根据这个现象,写出该反应的化学方程式:________;
②这个实验还引发了我们对过去某些知识的反思,从而有了新的发现.你认为新的发现是________(填序号):
A、在一定的条件下,二氧化碳也能支持燃烧;
B、活泼金属着火时不能用二氧化碳灭火;
C、燃烧不一定需要有氧气。
、实验题
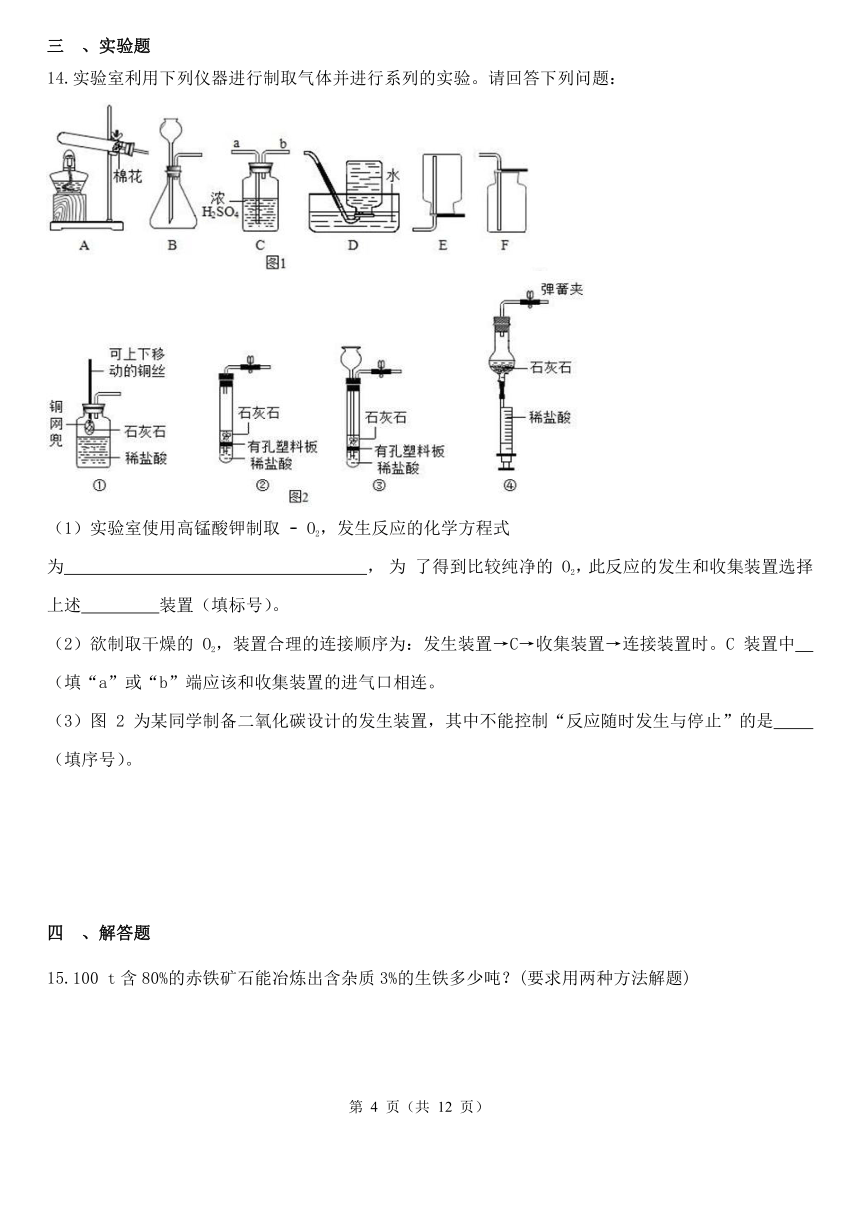
实验室利用下列仪器进行制取气体并进行系列的实验。请回答下列问题:
(1)实验室使用高锰酸钾制取 O2,发生反应的化学方程式为 , 为 了得到比较纯净的 O2,此反应的发生和收集装置选择上述 装置(填标号)。
(2)欲制取干燥的 O2,装置合理的连接顺序为:发生装置→C→收集装置→连接装置时。C 装置中 (填“a”或“b”端应该和收集装置的进气口相连。
(3)图 2 为某同学制备二氧化碳设计的发生装置,其中不能控制“反应随时发生与停止”的是 (填序号)。
、解答题
100 t含80%的赤铁矿石能冶炼出含杂质3%的生铁多少吨?(要求用两种方法解题)
3.3化学方程式答案解析
、选择题
B
【解析】根据质量守恒定律分析计算。
根据质量守恒定律可知,A和B的质量和等于C和D的质量和,
则参加反应的B的质量为: 。
故选B。
B
【解析】根据质量守恒定律,由物质质量的增减量可确定反应物和生成物及其质量,再根据物质的化学式和物质的质量可确定物质的元素组成.
解:根据质量守恒定律,4.4+12.8=7.2+4.4+a,a=5.6,R、氧气为反应物,水、二氧化碳、一氧化碳为生成物,
A、a值为5.6,正确;
B、R、氧气为反应物,水、二氧化碳、一氧化碳为生成物,生成物中的碳元素和氢元素一定来自R,即R中一定含有碳、氢两种元素;此反应可表示为:R+O2→CO2+H2O+CO,其中二氧化碳中含有氧元素的质量=4.4g× =3.2g,水中含有氧元素的质量=7.2g× =6.4g,一氧化碳中含有氧元素的质量=5.6g× =3.2g,即生成物中含有的氧元素质量=3.2g+6.4g+3.2g=12.8g,大于氧气的消耗量,所以R一定没有氧元素;错误;
C、由B知,R只含碳、氢元素,正确;
D、R中碳、氢元素的质量比为:(4.4﹣3.2+5.6﹣3.2):(7.2﹣6.4)=9:2,正确.
故选B.
B
【解析】(1)首先根据质量守恒定律计算出参加反应的氧气的质量,然后分别计算出二氧化碳和水中氧元素的质量然后相加,将得到的结果与参加反映的氧气质量进行比较,进而确定这种物质的元素组成;
(2)用物质质量减去氧元素质量,分别计算出碳元素的质量和氢元素的质量,然后根据元素的质量之比等于相对原子质量和个数的乘积之比计算出二者原子的个数之比。
(1)根据质量守恒定律得到,参加反应的氧气的质量为:4.4g+3.6g-1.6g=6.4g;
二氧化碳中氧元素的质量:;
水中氧元素的质量:;
因为3.2g+3.2g=6.4g,所以该物质中肯定不含氧元素;
根据元素种类守恒可知,该物质中一定含有C、H元素,故①②正确,而③④错误;
该物质中碳元素的质量:4.4g-3.2g=1.2g;
该物质中氢元素的质量:3.6g-3.2g=0.4g;
根据元素的质量之比等于相对原子质量和个数的乘积之比,
得到:1.2g:0.4g=12x:1y;
解得:x:y=1:4,故⑤错误,⑥正确。
那么正确的是①②⑥。
故选B。
B
【解析】根据化学方程式的意义进行分析,化学反应中各物质的质量比是定值,据此解答即可.
解:7克A和一定量的B完全反应生成8.5克C,根据质量守恒定律,则B的质量为:8.5g﹣7g=1.5g,设A、B、C的相对分子质量为x、y、z
A+ 3B═ 2C
x 3y 2z
7g 1.5g 8.5g
故x:y:z=28:2:17,观察选项,故选B.
D
【解析】根据化学反应前后原子种类和个数不变分析。
反应前各原子种类及个数为碳2a、氢6a、氧2b,反应后碳m、氢2n,氧(2m+n),根据反应前后原子种类和个数不变可知:
A、m=2a,不符合题意;
B、m=2a,不符合题意;
C、n=3a,不符合题意;
D、 2b=2m+n ,符合题意;
故答案为:D。
C
【解析】氧气和甲烷反应生成二氧化碳和水,生成的两种物质中都含有氧元素并且都是氧化物,所以可以判断氯气和甲烷反应的生成物中也应该都含氯元素并且都是氯的化合物;所以A中C为单质,不符合;B中CH2Cl2不是氯化物;D中氢气是单质;分析所给的选项可以知道选项C符合这一要求.
想解答好这类题目,首先要理解和熟记质量守恒定律及其应用,以及与之相关的知识,然后根据所给的问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生产或生活经验所得,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.
A
【解析】根据质量守恒定律,参加反应的各物质的质量之和等于生成的各物质的质量之和,结合题意进行分析解答.
解:反应3A+2B═2C+D中,生成C和D的质量比为9:8,若A和B两种物质共51g,充分混合后恰好完全反应,则参加反应的A和B的质量之和为51g,生成D的质量是51g× ×100%=24g.
故选:A.
D
【详解】
根据质量守恒定律,参加化学反应的各物质的质量之和等于反应后生成的各物质的质量之和,当a克碳和b克氧气恰好反应时,则生成二氧化碳的质量为(a+b)克;当a克碳或b克氧气有剩余时,则生成二氧化碳的质量小于(a+b)克。故选D。
B
【解析】根据反应的化学方程式确定生成氧气的质量大小,根据催化剂的作用分析产生氧气的快慢即可。
氯酸钾分解生成氧气的方程式为:
;
245 96
m ;
高锰酸钾分解生成氧气的方程式:
;
316 32
m ;
比较可知,相同质量的氯酸钾比高锰酸钾产生氧气的质量大,
因此甲最终生成氧气的质量小于乙。
由于甲中高锰酸钾分解会生成二氧化锰,作为氯酸钾分解的催化剂,
因此甲的反应速度大于乙。
故选B。
A
【解析】根据硫与过量氧气反应得到的产物及其对应的化学方程式S+O2SO2进行分析即可。
A.根据化学方程式可知,一个硫原子和一个氧气分子反应生成一个二氧化硫分子,其中氧气和二氧化硫是气体,则反应前后气体的分子数不变,A符合题意。
B.该反应是化合反应,根据质量守恒定律可知反应前后质量不变,二氧化硫的质量等于硫和氧气的质量之和,因此反应前后气体质量增加,B不符合题意。
C.反应后产物为气体,无固体,固体的气体为0,C不符合题意。
D.根据质量守恒可知,反应前后质量不变,D不符合题意。
故答案为:A
、填空题
(1)0
(2)C,H
(3)1:4
【解析】(1)根据质量守恒定律计算出X的数值;
(2)分别计算出二氧化碳和水蒸气中氧元素的质量,然后与氧气的质量进行比较,从而确定M中是否有氧元素存在;
(3)将反应前后氧气的质量相减,M的质量相减,然后求出它们的比值即可。
(1)根据质量守恒定律得到:100g+1g+1g+24g=4g+67g+55g+X,解得:X=0g;
(2)氧气和M的质量减小,都是反应物,而二氧化碳和水蒸气的质量增大,都是生成物。
氧气中只有氧元素,没有碳元素和氢元素,因此M中肯定含有碳元素和氢元素。
二氧化碳中氧元素的质量:;
水蒸气中氧元素的质量:;
二者中氧元素的质量为:48g+48g=96g;
正好与氧气的质量相等,则M中只含有碳和氢元素。
(3)该反应中,参加化学反应的M和氧气之间质量比为:(24g-0g):(100g-4g)=1:4。
6.2g;8:3
【解析】根据参加反应的各物质质量总和和反应后生成的各物质质量总和相等及化学方程式中各物质质量关系分析。
由质量守恒定律可知,参加反应的各物质质量总和和反应后生成的各物质质量总和相等,因该反应后生成 4.4gC和1.8gD ,则A和B的质量总和为4.4+1.8=6.2g, A和C的相对分子质量之比为7:11, 设参加反应的A质量为x,则 x:4.4g=7:22,x=1.4g,则B的质量为6.2-1.4=4.8g, 参加反应的B的质量和生成D的质量比为 4.8:1.8=8:3.
故答案为:6.2g;8:3。
ABC
【分析】
(1)根据实验现象可知,镁在二氧化碳中燃烧能生成氧化镁和碳;
(2)二氧化碳在特殊条件下能够支持燃烧。
【详解】
(1)镁在二氧化碳中燃烧能生成氧化镁和碳,反应的化学方程式为:;
(2)通过该实验可知,二氧化碳在一定条件下也能支持某些物质燃烧,二氧化碳有时不能用来灭火,燃烧不一定需要氧气参加等。
故选ABC。
、实验题
(1)2KMnO4 K2MnO4+MnO2+O2↑;AD
(2)b
(3)②
【解析】(1)确定反应物、反应条件和生成物,据此写出反应的方程式。根据反应物的状态和反应条件选择合适的气体发生装置,根据气体的性质选择合适的收集方法。
(2)如果要用浓硫酸干燥气体,那么气体就必须通入浓硫酸,让其从酸中逸出;
(3)根据各个装置的特点分析即可。
(1)加热高锰酸钾分解,生成锰酸钾、二氧化锰和氧气,反应的方程式为: 2KMnO4 K2MnO4+MnO2+O2↑ 。反应物为固态且需加热,则发生装置选A;氧气在水中的溶解度较小,因此可以用排水法收集纯净的氧气,故收集装置选D。
(2)C装置中为浓硫酸,氧气应该从长导管a进入,从短导管b排出,则b应该与收集装置的进气口相连。
(3)①中通过上下移动铜网兜,控制石灰石与稀盐酸的接触,可以控制反应的进度;
②不能控制石灰石与稀盐酸的接触,不能控制反应速度;
③关闭止水夹,生成的二氧化碳导致试管内压强增大,于是稀盐酸被压回长颈漏斗,与石灰石分开,导致反应停止;
④向下拉动注射器的活塞,稀盐酸被抽出,与石灰石分开,反应停止。
则不能控制“反应随时发生与停止”是②。
、解答题
解:第一种方法:利用反应前后铁元素的质量守恒来计算:
设生铁的质量为x列式:x×97%=100t×80%××100% 求出x=57.7 t
第二种方法:利用化学方程式计算:
设生铁的质量为x
Fe2O3+ CO = Fe + CO2
160 56
100t×80%x×97%
列式:,求出x=57.7 t
【解析】该题考查了含杂质物质的化学反应的有关计算。
第 1 页(共 1 页)
、选择题
在化学反应2A+5B=C+3D中,A、B两种物质恰好完全反应时的质量比为4:3,若生成C和D共21 g,则反应消耗B的质量为( )
A.6g B.9g C.12g D.16g
将一定量的某有机物R和氧气置于一个密闭容器中引燃,测得反应前后各物质的质量如下表所示:
物质 R 氧气 水 二氧化碳 一氧化碳
反应前质量(g) 4.4 12.8 0 0 0
反应后质量(g) 0 0 7.2 4.4 a
下列判断不正确的是( )
A.a值为5.6 B.R可能含有氧元素
C.R只含碳、氢元素 D.R中碳、氢元素的质量比为9:2
1.6g某物质在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列判断:①一定含C、H元素;②一定不含O元素:③可能含O元素:④一定含O元素;⑤分子中C、H原子个数比为1∶2;⑥分子中C、H原子个数比为1∶4。其中正确的是( )
A. ①②⑤ B.①②⑥ C.①③⑥ D.①④⑤
反应A+3B═2C,若7克A和一定量的B完全反应生成8.5克C,则A、B、C的相对分子质量比为( )
A.14:3:7 B.28:2:17 C.1:3:2 D.7:1.5:8.5
在化学方程式aC2H6+bO2 mCO2+nH2O中,各化学式计量数之间的关系正确的是( )
A.2m=a B.m=a C.3n=a D.2b=2m+n
O2和Cl2都是活泼的非金属单质,在一定条件下它们都能跟甲烷反应,已知氧气和甲烷充分反应后的生成物是二氧化碳和水,由此推断氯气和甲烷充分反应后的生成物是()
A.C和HCl B.CH2Cl2和HCl C.CCl4和HCl D.CCl4和H2
已知反应3A+2B═2C+D中,生成C和D的质量比为9:8,.若A和B两种物质共51g,充分混合后恰好完全反应,则生成D的质量是( )
A.24g B.18g C.27g D.48g
将a克碳放在b克氧气中燃烧所生成二氧化碳的质量是( )
A.等于(a+b)克 B.大于(a+b)克
C.小于(a+b)克 D.小于或等于(a+b)克
质量相等的两份固体甲和乙。甲是少量高锰酸钾和氯酸钾的混合物,乙是纯净的氯酸钾,将它们分别均匀加热。下列能正确反映产生氧气的质量和时间的关系的是( )
A. B.
C. D.
在一密闭的容器中,一定质量的硫与过量的氧气在点燃的条件下充分反应,容器内各相关量与时间(从反应开始计时)的对应关系正确的是()
A. B.
C. D.
、填空题
在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表所示:
物质 氧气 二氧化碳 水蒸气 M
反应前质量/g 100 1 1 24
反应后质量/g 4 67 55 x
(1)根据质量守恒定律,你认为X的值应为 ;
(2)未知物质M含有的元素为 ;
(3)该反应中,参加化学反应的M和氧气之间质量比为 。
在反应A+3B=2C+2D中,已知A和C的相对分子质量之比为7:11,一定量的A和B恰好完全反应后,生成4.4gC和1.8gD,则参加反应的A、B的质量之和为 ,参加反应的B的质量和生成D的质量比为 。
小凤又在一本参考书上发现,镁也能在二氧化碳中燃烧!于是她迫不及待地做起了这个实验(如图),将镁条点燃后迅速伸入盛有二氧化碳的集气瓶中,发现镁条剧烈燃烧,发出白光,放热,产生一种白色粉末和一种黑色粉末。
①根据这个现象,写出该反应的化学方程式:________;
②这个实验还引发了我们对过去某些知识的反思,从而有了新的发现.你认为新的发现是________(填序号):
A、在一定的条件下,二氧化碳也能支持燃烧;
B、活泼金属着火时不能用二氧化碳灭火;
C、燃烧不一定需要有氧气。
、实验题
实验室利用下列仪器进行制取气体并进行系列的实验。请回答下列问题:
(1)实验室使用高锰酸钾制取 O2,发生反应的化学方程式为 , 为 了得到比较纯净的 O2,此反应的发生和收集装置选择上述 装置(填标号)。
(2)欲制取干燥的 O2,装置合理的连接顺序为:发生装置→C→收集装置→连接装置时。C 装置中 (填“a”或“b”端应该和收集装置的进气口相连。
(3)图 2 为某同学制备二氧化碳设计的发生装置,其中不能控制“反应随时发生与停止”的是 (填序号)。
、解答题
100 t含80%的赤铁矿石能冶炼出含杂质3%的生铁多少吨?(要求用两种方法解题)
3.3化学方程式答案解析
、选择题
B
【解析】根据质量守恒定律分析计算。
根据质量守恒定律可知,A和B的质量和等于C和D的质量和,
则参加反应的B的质量为: 。
故选B。
B
【解析】根据质量守恒定律,由物质质量的增减量可确定反应物和生成物及其质量,再根据物质的化学式和物质的质量可确定物质的元素组成.
解:根据质量守恒定律,4.4+12.8=7.2+4.4+a,a=5.6,R、氧气为反应物,水、二氧化碳、一氧化碳为生成物,
A、a值为5.6,正确;
B、R、氧气为反应物,水、二氧化碳、一氧化碳为生成物,生成物中的碳元素和氢元素一定来自R,即R中一定含有碳、氢两种元素;此反应可表示为:R+O2→CO2+H2O+CO,其中二氧化碳中含有氧元素的质量=4.4g× =3.2g,水中含有氧元素的质量=7.2g× =6.4g,一氧化碳中含有氧元素的质量=5.6g× =3.2g,即生成物中含有的氧元素质量=3.2g+6.4g+3.2g=12.8g,大于氧气的消耗量,所以R一定没有氧元素;错误;
C、由B知,R只含碳、氢元素,正确;
D、R中碳、氢元素的质量比为:(4.4﹣3.2+5.6﹣3.2):(7.2﹣6.4)=9:2,正确.
故选B.
B
【解析】(1)首先根据质量守恒定律计算出参加反应的氧气的质量,然后分别计算出二氧化碳和水中氧元素的质量然后相加,将得到的结果与参加反映的氧气质量进行比较,进而确定这种物质的元素组成;
(2)用物质质量减去氧元素质量,分别计算出碳元素的质量和氢元素的质量,然后根据元素的质量之比等于相对原子质量和个数的乘积之比计算出二者原子的个数之比。
(1)根据质量守恒定律得到,参加反应的氧气的质量为:4.4g+3.6g-1.6g=6.4g;
二氧化碳中氧元素的质量:;
水中氧元素的质量:;
因为3.2g+3.2g=6.4g,所以该物质中肯定不含氧元素;
根据元素种类守恒可知,该物质中一定含有C、H元素,故①②正确,而③④错误;
该物质中碳元素的质量:4.4g-3.2g=1.2g;
该物质中氢元素的质量:3.6g-3.2g=0.4g;
根据元素的质量之比等于相对原子质量和个数的乘积之比,
得到:1.2g:0.4g=12x:1y;
解得:x:y=1:4,故⑤错误,⑥正确。
那么正确的是①②⑥。
故选B。
B
【解析】根据化学方程式的意义进行分析,化学反应中各物质的质量比是定值,据此解答即可.
解:7克A和一定量的B完全反应生成8.5克C,根据质量守恒定律,则B的质量为:8.5g﹣7g=1.5g,设A、B、C的相对分子质量为x、y、z
A+ 3B═ 2C
x 3y 2z
7g 1.5g 8.5g
故x:y:z=28:2:17,观察选项,故选B.
D
【解析】根据化学反应前后原子种类和个数不变分析。
反应前各原子种类及个数为碳2a、氢6a、氧2b,反应后碳m、氢2n,氧(2m+n),根据反应前后原子种类和个数不变可知:
A、m=2a,不符合题意;
B、m=2a,不符合题意;
C、n=3a,不符合题意;
D、 2b=2m+n ,符合题意;
故答案为:D。
C
【解析】氧气和甲烷反应生成二氧化碳和水,生成的两种物质中都含有氧元素并且都是氧化物,所以可以判断氯气和甲烷反应的生成物中也应该都含氯元素并且都是氯的化合物;所以A中C为单质,不符合;B中CH2Cl2不是氯化物;D中氢气是单质;分析所给的选项可以知道选项C符合这一要求.
想解答好这类题目,首先要理解和熟记质量守恒定律及其应用,以及与之相关的知识,然后根据所给的问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生产或生活经验所得,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.
A
【解析】根据质量守恒定律,参加反应的各物质的质量之和等于生成的各物质的质量之和,结合题意进行分析解答.
解:反应3A+2B═2C+D中,生成C和D的质量比为9:8,若A和B两种物质共51g,充分混合后恰好完全反应,则参加反应的A和B的质量之和为51g,生成D的质量是51g× ×100%=24g.
故选:A.
D
【详解】
根据质量守恒定律,参加化学反应的各物质的质量之和等于反应后生成的各物质的质量之和,当a克碳和b克氧气恰好反应时,则生成二氧化碳的质量为(a+b)克;当a克碳或b克氧气有剩余时,则生成二氧化碳的质量小于(a+b)克。故选D。
B
【解析】根据反应的化学方程式确定生成氧气的质量大小,根据催化剂的作用分析产生氧气的快慢即可。
氯酸钾分解生成氧气的方程式为:
;
245 96
m ;
高锰酸钾分解生成氧气的方程式:
;
316 32
m ;
比较可知,相同质量的氯酸钾比高锰酸钾产生氧气的质量大,
因此甲最终生成氧气的质量小于乙。
由于甲中高锰酸钾分解会生成二氧化锰,作为氯酸钾分解的催化剂,
因此甲的反应速度大于乙。
故选B。
A
【解析】根据硫与过量氧气反应得到的产物及其对应的化学方程式S+O2SO2进行分析即可。
A.根据化学方程式可知,一个硫原子和一个氧气分子反应生成一个二氧化硫分子,其中氧气和二氧化硫是气体,则反应前后气体的分子数不变,A符合题意。
B.该反应是化合反应,根据质量守恒定律可知反应前后质量不变,二氧化硫的质量等于硫和氧气的质量之和,因此反应前后气体质量增加,B不符合题意。
C.反应后产物为气体,无固体,固体的气体为0,C不符合题意。
D.根据质量守恒可知,反应前后质量不变,D不符合题意。
故答案为:A
、填空题
(1)0
(2)C,H
(3)1:4
【解析】(1)根据质量守恒定律计算出X的数值;
(2)分别计算出二氧化碳和水蒸气中氧元素的质量,然后与氧气的质量进行比较,从而确定M中是否有氧元素存在;
(3)将反应前后氧气的质量相减,M的质量相减,然后求出它们的比值即可。
(1)根据质量守恒定律得到:100g+1g+1g+24g=4g+67g+55g+X,解得:X=0g;
(2)氧气和M的质量减小,都是反应物,而二氧化碳和水蒸气的质量增大,都是生成物。
氧气中只有氧元素,没有碳元素和氢元素,因此M中肯定含有碳元素和氢元素。
二氧化碳中氧元素的质量:;
水蒸气中氧元素的质量:;
二者中氧元素的质量为:48g+48g=96g;
正好与氧气的质量相等,则M中只含有碳和氢元素。
(3)该反应中,参加化学反应的M和氧气之间质量比为:(24g-0g):(100g-4g)=1:4。
6.2g;8:3
【解析】根据参加反应的各物质质量总和和反应后生成的各物质质量总和相等及化学方程式中各物质质量关系分析。
由质量守恒定律可知,参加反应的各物质质量总和和反应后生成的各物质质量总和相等,因该反应后生成 4.4gC和1.8gD ,则A和B的质量总和为4.4+1.8=6.2g, A和C的相对分子质量之比为7:11, 设参加反应的A质量为x,则 x:4.4g=7:22,x=1.4g,则B的质量为6.2-1.4=4.8g, 参加反应的B的质量和生成D的质量比为 4.8:1.8=8:3.
故答案为:6.2g;8:3。
ABC
【分析】
(1)根据实验现象可知,镁在二氧化碳中燃烧能生成氧化镁和碳;
(2)二氧化碳在特殊条件下能够支持燃烧。
【详解】
(1)镁在二氧化碳中燃烧能生成氧化镁和碳,反应的化学方程式为:;
(2)通过该实验可知,二氧化碳在一定条件下也能支持某些物质燃烧,二氧化碳有时不能用来灭火,燃烧不一定需要氧气参加等。
故选ABC。
、实验题
(1)2KMnO4 K2MnO4+MnO2+O2↑;AD
(2)b
(3)②
【解析】(1)确定反应物、反应条件和生成物,据此写出反应的方程式。根据反应物的状态和反应条件选择合适的气体发生装置,根据气体的性质选择合适的收集方法。
(2)如果要用浓硫酸干燥气体,那么气体就必须通入浓硫酸,让其从酸中逸出;
(3)根据各个装置的特点分析即可。
(1)加热高锰酸钾分解,生成锰酸钾、二氧化锰和氧气,反应的方程式为: 2KMnO4 K2MnO4+MnO2+O2↑ 。反应物为固态且需加热,则发生装置选A;氧气在水中的溶解度较小,因此可以用排水法收集纯净的氧气,故收集装置选D。
(2)C装置中为浓硫酸,氧气应该从长导管a进入,从短导管b排出,则b应该与收集装置的进气口相连。
(3)①中通过上下移动铜网兜,控制石灰石与稀盐酸的接触,可以控制反应的进度;
②不能控制石灰石与稀盐酸的接触,不能控制反应速度;
③关闭止水夹,生成的二氧化碳导致试管内压强增大,于是稀盐酸被压回长颈漏斗,与石灰石分开,导致反应停止;
④向下拉动注射器的活塞,稀盐酸被抽出,与石灰石分开,反应停止。
则不能控制“反应随时发生与停止”是②。
、解答题
解:第一种方法:利用反应前后铁元素的质量守恒来计算:
设生铁的质量为x列式:x×97%=100t×80%××100% 求出x=57.7 t
第二种方法:利用化学方程式计算:
设生铁的质量为x
Fe2O3+ CO = Fe + CO2
160 56
100t×80%x×97%
列式:,求出x=57.7 t
【解析】该题考查了含杂质物质的化学反应的有关计算。
第 1 页(共 1 页)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
