第4节 二氧化碳(第2课时,10张ppt)
文档属性
| 名称 | 第4节 二氧化碳(第2课时,10张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 551.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-04-24 10:28:23 | ||
图片预览


文档简介
(共10张PPT)
二氧化碳2
一、实验室制备二氧化碳
1、原料
大理石或石灰石
(主要成分:CaCO3)
稀盐酸(HCl)
2、原理
二氧化碳在生活和化学中广泛运用,那么我们如何制备二氧化碳?
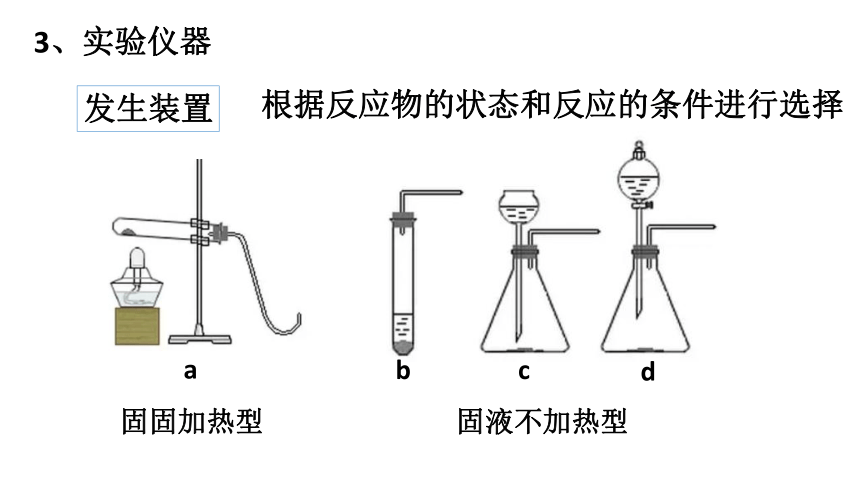
3、实验仪器
发生装置
固固加热型
固液不加热型
根据反应物的状态和反应的条件进行选择
a
b
c
d
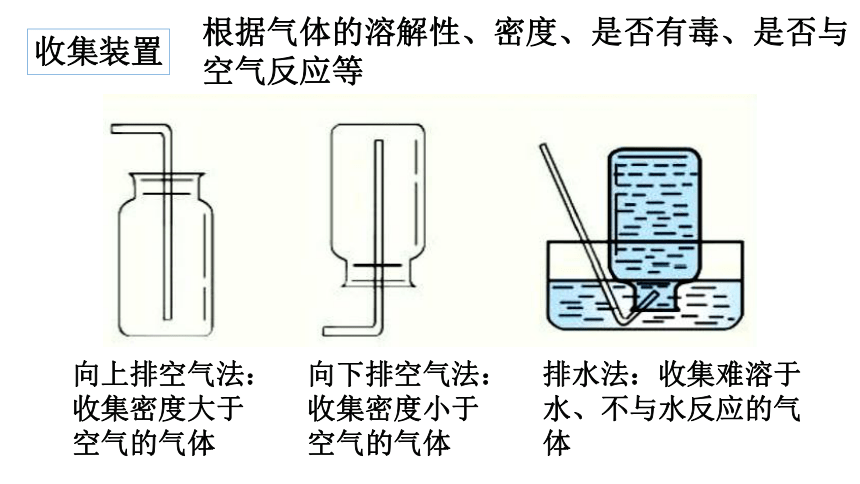
收集装置
根据气体的溶解性、密度、是否有毒、是否与空气反应等
向上排空气法:收集密度大于空气的气体
向下排空气法:收集密度小于空气的气体
排水法:收集难溶于水、不与水反应的气体
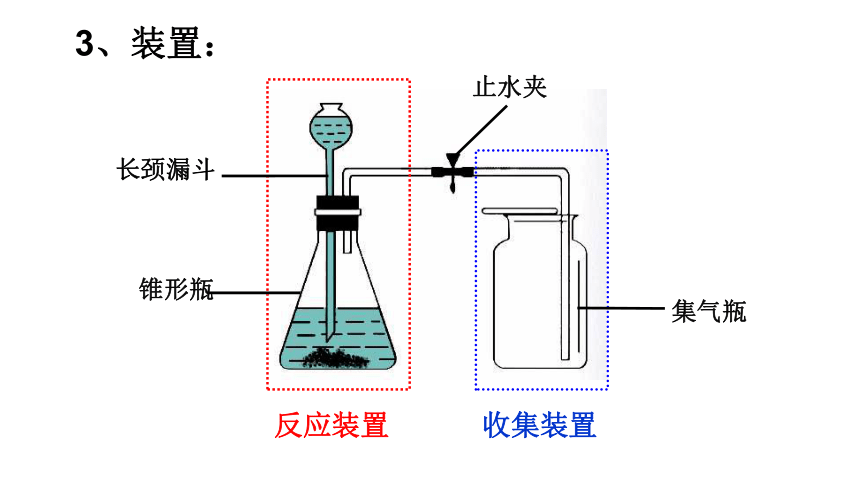
3、装置:
反应装置
收集装置
长颈漏斗
锥形瓶
止水夹
集气瓶
4、实验步骤:
1. 连接发生装置,检查装置的气密性;
2. 锥形瓶中加入大理石,塞紧橡皮塞;
3. 长颈漏斗中加入稀盐酸;
4. 用向上排空气法收集气体;
5. 用燃着的木条放在集气瓶口验满。
6. 收满盖好毛玻璃片,将集气瓶口向上放置。
稀盐酸要没过长颈漏斗底部,防止气体逃逸
1、锥形瓶中的稀盐酸没过长颈漏斗底部,防止气体逃逸。
2、锥形瓶中的导管不能伸入太长
有助于排尽锥形瓶中的空气,提高气体纯度
3、集气瓶中的导管要伸到底部
有助于排尽集气瓶中的空气,提高气体纯度
4、能不能用浓盐酸来代替稀盐酸?
不行,浓盐酸具有挥发性,会有氯化氢(HCl)气体杂质
5、能不能用稀硫酸(H2SO4)来代替稀盐酸?
不行,CaCO3+H2SO4 = CaSO4+H2O+CO2↑ 生成物硫酸钙是微溶于水,容易覆盖在大理石表面,使反应停止。
二、工业制二氧化碳
1、原料:石灰石(主要成分CaCO3)
2、原理:
碳酸钙在高温下能生成氧化钙和二氧化碳
生石灰
石灰石
石灰岩
生石灰
千锤万凿出深山
烈火焚烧若等闲
粉骨碎身浑不怕
要留清白在人间
CaCO3 CaO + CO2↑
高温
CaO + H2O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 ↓+ H2O
石灰墙
1、现有12.5g石灰石样品,将其与足量的稀盐酸进行反应(杂质不与稀盐酸反应),充分反应后收集到4.4g二氧化碳,通过计算说明该样品中碳酸钙的质量分数。
二氧化碳2
一、实验室制备二氧化碳
1、原料
大理石或石灰石
(主要成分:CaCO3)
稀盐酸(HCl)
2、原理
二氧化碳在生活和化学中广泛运用,那么我们如何制备二氧化碳?
3、实验仪器
发生装置
固固加热型
固液不加热型
根据反应物的状态和反应的条件进行选择
a
b
c
d
收集装置
根据气体的溶解性、密度、是否有毒、是否与空气反应等
向上排空气法:收集密度大于空气的气体
向下排空气法:收集密度小于空气的气体
排水法:收集难溶于水、不与水反应的气体
3、装置:
反应装置
收集装置
长颈漏斗
锥形瓶
止水夹
集气瓶
4、实验步骤:
1. 连接发生装置,检查装置的气密性;
2. 锥形瓶中加入大理石,塞紧橡皮塞;
3. 长颈漏斗中加入稀盐酸;
4. 用向上排空气法收集气体;
5. 用燃着的木条放在集气瓶口验满。
6. 收满盖好毛玻璃片,将集气瓶口向上放置。
稀盐酸要没过长颈漏斗底部,防止气体逃逸
1、锥形瓶中的稀盐酸没过长颈漏斗底部,防止气体逃逸。
2、锥形瓶中的导管不能伸入太长
有助于排尽锥形瓶中的空气,提高气体纯度
3、集气瓶中的导管要伸到底部
有助于排尽集气瓶中的空气,提高气体纯度
4、能不能用浓盐酸来代替稀盐酸?
不行,浓盐酸具有挥发性,会有氯化氢(HCl)气体杂质
5、能不能用稀硫酸(H2SO4)来代替稀盐酸?
不行,CaCO3+H2SO4 = CaSO4+H2O+CO2↑ 生成物硫酸钙是微溶于水,容易覆盖在大理石表面,使反应停止。
二、工业制二氧化碳
1、原料:石灰石(主要成分CaCO3)
2、原理:
碳酸钙在高温下能生成氧化钙和二氧化碳
生石灰
石灰石
石灰岩
生石灰
千锤万凿出深山
烈火焚烧若等闲
粉骨碎身浑不怕
要留清白在人间
CaCO3 CaO + CO2↑
高温
CaO + H2O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 ↓+ H2O
石灰墙
1、现有12.5g石灰石样品,将其与足量的稀盐酸进行反应(杂质不与稀盐酸反应),充分反应后收集到4.4g二氧化碳,通过计算说明该样品中碳酸钙的质量分数。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
