第7章 应用广泛的酸、碱、盐测试题(含答案)—2022-2023学年九年级化学沪教版(全国)下册
文档属性
| 名称 | 第7章 应用广泛的酸、碱、盐测试题(含答案)—2022-2023学年九年级化学沪教版(全国)下册 | 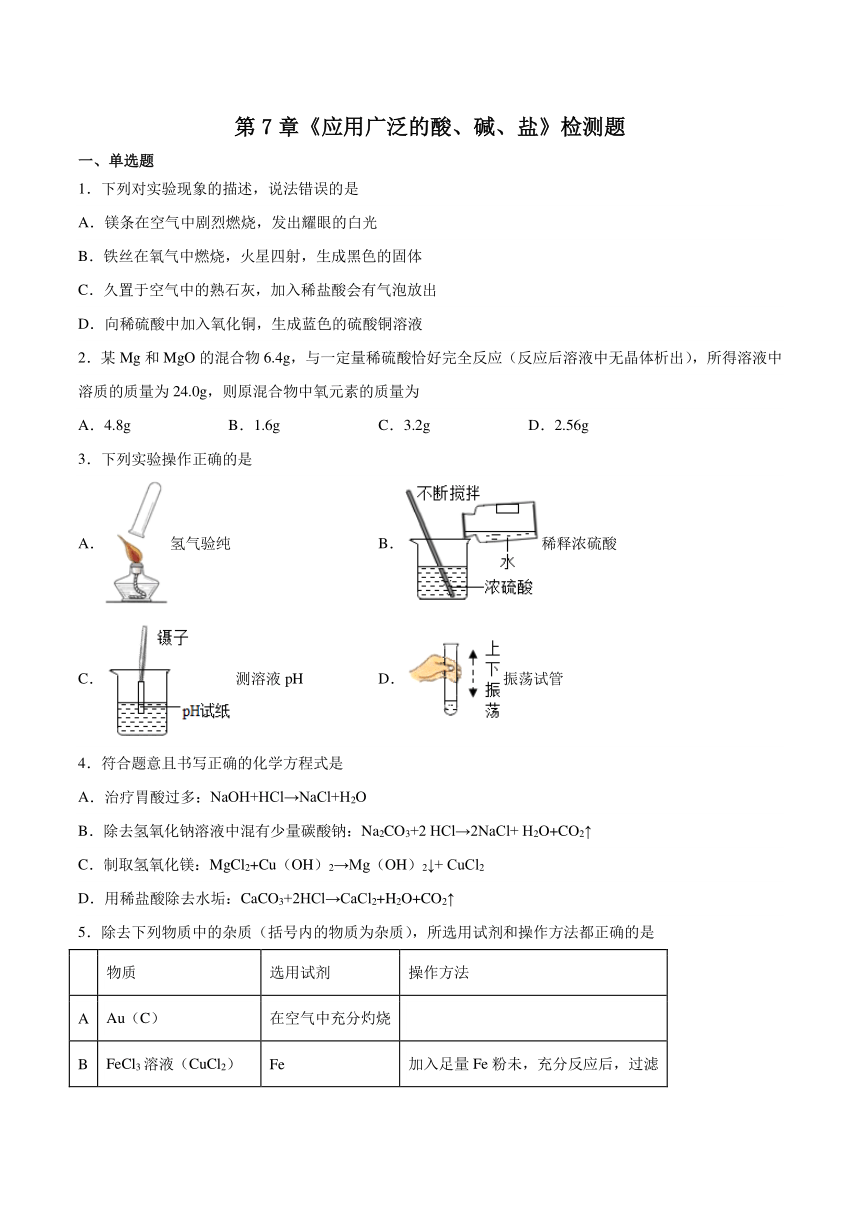 | |
| 格式 | docx | ||
| 文件大小 | 181.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-27 11:27:33 | ||
图片预览



文档简介
第7章《应用广泛的酸、碱、盐》检测题
一、单选题
1.下列对实验现象的描述,说法错误的是
A.镁条在空气中剧烈燃烧,发出耀眼的白光
B.铁丝在氧气中燃烧,火星四射,生成黑色的固体
C.久置于空气中的熟石灰,加入稀盐酸会有气泡放出
D.向稀硫酸中加入氧化铜,生成蓝色的硫酸铜溶液
2.某Mg和MgO的混合物6.4g,与一定量稀硫酸恰好完全反应(反应后溶液中无晶体析出),所得溶液中溶质的质量为24.0g,则原混合物中氧元素的质量为
A.4.8g B.1.6g C.3.2g D.2.56g
3.下列实验操作正确的是
A.氢气验纯 B.稀释浓硫酸
C.测溶液pH D.振荡试管
4.符合题意且书写正确的化学方程式是
A.治疗胃酸过多:NaOH+HCl→NaCl+H2O
B.除去氢氧化钠溶液中混有少量碳酸钠:Na2CO3+2 HCl→2NaCl+ H2O+CO2↑
C.制取氢氧化镁:MgCl2+Cu(OH)2→Mg(OH)2↓+ CuCl2
D.用稀盐酸除去水垢:CaCO3+2HCl→CaCl2+H2O+CO2↑
5.除去下列物质中的杂质(括号内的物质为杂质),所选用试剂和操作方法都正确的是
物质 选用试剂 操作方法
A Au(C) 在空气中充分灼烧
B FeCl3溶液(CuCl2) Fe 加入足量Fe粉未,充分反应后,过滤
C CuSO4溶液(H2SO4) Cu 加入是量Cu,充分反应后,过滤
D CO2(CO) NaOH溶液 将气体缓缓通过NaOH溶液即可
A.A B.B C.C D.D
6.实验是学习化学的重要手段,下列实验操作正确的是
A.过滤操作 B.加热固体
C.稀释浓硫酸 D.检查气密性)
7.下列化学方程式能表示所述事实的是( )
A.服用含Al(OH)3的药物治疗胃酸过多 Al(OH)3+HCl═AlCl3+3H2O
B.工业上用一氧化碳和赤铁矿(主要成分是氧化铁)炼铁 3CO+Fe2O3═2Fe+3CO2
C.除去铁器皿表面的铁锈 Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
D.除去一氧化碳中的二氧化碳 CO2+NaOH═NaCO3+H2O
8.反推是化学学习中的常用方法,下列反推错误的是
A.酸中都含有氢元素,含有氢元素的化合物不一定是酸
B.碱溶液的pH>7,pH>7的溶液不一定是碱溶液
C.溶液的特点是均一稳定,均一稳定的物质一定是混合物
D.活泼金属与盐酸反应放出气体,能与稀盐酸反应放出气体的不一定是金属
9.下列实验现象的描述正确的是( )
A.一氧化碳燃烧:无色气体燃烧,产生蓝色火焰,放热,生成二氧化碳气体
B.向加有稀盐酸的石蕊试液中滴加适量的氢氧化钠溶液:溶液由红色变成无色
C.紫色石蕊试液滴加到生石灰上:紫色石蕊溶液无明显变化
D.铝丝放在硫酸铜溶液中:银白色固体表面覆盖紫红色固体,溶液由蓝色变为无色
10.分类是化学学习的重要方法,下列各组物质按单质、氧化物、混合物的顺序排列的是
A.液氧、氯化镁、粗盐 B.焦炭、氧化铜、澄清石灰水
C.水、碳酸钙、海水 D.水银、冰水混合物、碘酒
11.下列选项与图像不相符的是
A.甲:向一定质量的AgNO3和Cu(NO3)2混合溶液中加入铁粉
B.乙:一定温度下,向饱和氯化钙溶液中加入氯化钙固体
C.丙:一氧化碳还原一定质量的氧化铁
D.丁:加热一定质量的高锰酸钾固体
12.下列对一些事实的解释中,不合理的是
选项 宏观事实 微观解释
A 盛夏的大明湖畔,荷香四溢 分子在不停的运动
B 降温加压条件下,氧气液化体积变小 氧气分子体积变小
C 在通电条件下,水变成氢气和氧气 化学反应中分子种类发生改变
D 稀盐酸、稀硫酸都能使紫色石蕊试液变红 稀盐酸、稀硫酸中含有大量的 H+
A.A B.B C.C D.D
13.下列化肥中是氮肥并属于有机物的是( )
A.CO(NH2)2 B.NH4Cl C.NaNO3 D.C12H22O11
二、填空题
14.从Ca(OH)2、CO2、NaHCO3和NH4H2PO4四种物质中,选择合适物质填空(填化学式):
(1)属于复合肥料的是______;
(2)用作发酵粉的是______;
(3)用于改良酸性土壤的是______;
(4)常用于灭火的是______。
15.化学源于生活,生活中蕴含着许多化学知识.
(1)用墨绘制的字画能够保存很长时间而不变色,原因是_________.
(2)节约用水人人有责,请写出一种节约用水的方法____________;
(3)俗语道“酒香不怕巷子深”,原因是__________(用微观粒子的观点解释);
(4)市场上售卖的“自嗨锅”,发热原理是利用发热包内的物质与水接触,释放出热量.发热包的成分之一氧化钙与水反应的化学方程式是_______.
(5)铝制品抗腐蚀性比较好,原因是_____________(用化学方程式的观点解释)
16.向AgNO3和KNO3的混合溶液中加入一些铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,结果没有现象产生,则滤渣中的物质是___,加入铁粉发生反应的化学方程式是___。
三、简答题
17.用海水制得的粗盐中含有不溶性杂质(泥沙等不溶物)和多种可溶性杂质。请回答下列问题:
(1)在“粗盐中难溶性杂质的去除”实验中,三次用到的玻璃仪器是______________;
(2)进一步去除样品中可溶性杂质(氯化钙、硫酸钠等),可以依次加入过量的______________(填化学式);过滤后向滤液中加入过量的盐酸,请写出此时发生反应的方程式______________;最后通过蒸发结晶得到较为纯净的氯化钠。
18.在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
(1)图1描述了稀盐酸与硝酸银溶液反应的微观实质,C处应填入的符号为___________;
(2)在稀盐酸中加入适量镁条的实验中:
①宏观表征:可以观察到的主要现象为__________,固体逐渐溶解;
②微观表征:图2表示反应前后溶液中的主要离子,写出“”所表示的微粒符号__________。
四、实验题
19.某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数。探究过程如下:
①连接实验装置并检查装置气密性。
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL.(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量1.4g。
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数。
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09g/L。
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为_____,实验过程中须加入稀硫酸至不再产生气体,目的是_____。
(2)步骤③中称量剩余固体之前的正确操作是_____、洗涤、干燥。
(3)根据实验测定的数据,上述三位同学中_____(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数。
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差。以下因素可能造成偏差的有_____(填标号)。
A 移出装置Ⅲ时,导管内留存了一部分水
B 实验测量前,没有排除装置Ⅰ中的空气
C 数据处理时,未排除加入稀硫酸所占的体积。
五、计算题
20.某学校化学实验室有一杯含盐酸和氯化铜的废液,该校化学兴趣小组的同学取109.8g废液于烧杯中,向其中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示,试计算:
(1)产生沉淀的总质量是 克。
(2)氢氧化钠溶液的溶质质量分数(写出计算过程)。
(3)计算加入100g氢氧化钠溶液并充分反应后烧杯内所得溶液中溶质的质量分数。(写出计算过程,结果精确到0.1%)
参考答案:
1.D 2.B 3.A 4.D 5.A 6.D 7.C 8.C 9.D 10.D 11.C 12.B 13.A
14. NH4H2PO4 NaHCO3 Ca(OH)2 CO2
15.(1)常温下,碳化学性质不活泼
(2)淘米水浇花(合理即可)
(3)分子在不断地运动
(4)
(5)
16. Ag 2AgNO3+Fe=2Ag+Fe(NO3)2
17. 玻璃棒 BaCl2、Na2CO3; Na2CO3+2HCl═2NaCl+H2O+CO2↑。
18.(1)AgCl
(2) 有气泡产生 Mg2+
19. 使样品中的锌完全反应 过滤 乙 AC
20.(1)9.8g
(2)解:设反应的NaOH质量为x,生成NaCl的质量为y
x=8g
y=11.7g
则
答:氢氧化钠溶液的溶质质量分数为16%
(3)设与HCl反应生成的NaCl质量为z
z=11.7g
则
答:充分反应后烧杯内所得溶液中溶质的质量分数为11.7%。
一、单选题
1.下列对实验现象的描述,说法错误的是
A.镁条在空气中剧烈燃烧,发出耀眼的白光
B.铁丝在氧气中燃烧,火星四射,生成黑色的固体
C.久置于空气中的熟石灰,加入稀盐酸会有气泡放出
D.向稀硫酸中加入氧化铜,生成蓝色的硫酸铜溶液
2.某Mg和MgO的混合物6.4g,与一定量稀硫酸恰好完全反应(反应后溶液中无晶体析出),所得溶液中溶质的质量为24.0g,则原混合物中氧元素的质量为
A.4.8g B.1.6g C.3.2g D.2.56g
3.下列实验操作正确的是
A.氢气验纯 B.稀释浓硫酸
C.测溶液pH D.振荡试管
4.符合题意且书写正确的化学方程式是
A.治疗胃酸过多:NaOH+HCl→NaCl+H2O
B.除去氢氧化钠溶液中混有少量碳酸钠:Na2CO3+2 HCl→2NaCl+ H2O+CO2↑
C.制取氢氧化镁:MgCl2+Cu(OH)2→Mg(OH)2↓+ CuCl2
D.用稀盐酸除去水垢:CaCO3+2HCl→CaCl2+H2O+CO2↑
5.除去下列物质中的杂质(括号内的物质为杂质),所选用试剂和操作方法都正确的是
物质 选用试剂 操作方法
A Au(C) 在空气中充分灼烧
B FeCl3溶液(CuCl2) Fe 加入足量Fe粉未,充分反应后,过滤
C CuSO4溶液(H2SO4) Cu 加入是量Cu,充分反应后,过滤
D CO2(CO) NaOH溶液 将气体缓缓通过NaOH溶液即可
A.A B.B C.C D.D
6.实验是学习化学的重要手段,下列实验操作正确的是
A.过滤操作 B.加热固体
C.稀释浓硫酸 D.检查气密性)
7.下列化学方程式能表示所述事实的是( )
A.服用含Al(OH)3的药物治疗胃酸过多 Al(OH)3+HCl═AlCl3+3H2O
B.工业上用一氧化碳和赤铁矿(主要成分是氧化铁)炼铁 3CO+Fe2O3═2Fe+3CO2
C.除去铁器皿表面的铁锈 Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
D.除去一氧化碳中的二氧化碳 CO2+NaOH═NaCO3+H2O
8.反推是化学学习中的常用方法,下列反推错误的是
A.酸中都含有氢元素,含有氢元素的化合物不一定是酸
B.碱溶液的pH>7,pH>7的溶液不一定是碱溶液
C.溶液的特点是均一稳定,均一稳定的物质一定是混合物
D.活泼金属与盐酸反应放出气体,能与稀盐酸反应放出气体的不一定是金属
9.下列实验现象的描述正确的是( )
A.一氧化碳燃烧:无色气体燃烧,产生蓝色火焰,放热,生成二氧化碳气体
B.向加有稀盐酸的石蕊试液中滴加适量的氢氧化钠溶液:溶液由红色变成无色
C.紫色石蕊试液滴加到生石灰上:紫色石蕊溶液无明显变化
D.铝丝放在硫酸铜溶液中:银白色固体表面覆盖紫红色固体,溶液由蓝色变为无色
10.分类是化学学习的重要方法,下列各组物质按单质、氧化物、混合物的顺序排列的是
A.液氧、氯化镁、粗盐 B.焦炭、氧化铜、澄清石灰水
C.水、碳酸钙、海水 D.水银、冰水混合物、碘酒
11.下列选项与图像不相符的是
A.甲:向一定质量的AgNO3和Cu(NO3)2混合溶液中加入铁粉
B.乙:一定温度下,向饱和氯化钙溶液中加入氯化钙固体
C.丙:一氧化碳还原一定质量的氧化铁
D.丁:加热一定质量的高锰酸钾固体
12.下列对一些事实的解释中,不合理的是
选项 宏观事实 微观解释
A 盛夏的大明湖畔,荷香四溢 分子在不停的运动
B 降温加压条件下,氧气液化体积变小 氧气分子体积变小
C 在通电条件下,水变成氢气和氧气 化学反应中分子种类发生改变
D 稀盐酸、稀硫酸都能使紫色石蕊试液变红 稀盐酸、稀硫酸中含有大量的 H+
A.A B.B C.C D.D
13.下列化肥中是氮肥并属于有机物的是( )
A.CO(NH2)2 B.NH4Cl C.NaNO3 D.C12H22O11
二、填空题
14.从Ca(OH)2、CO2、NaHCO3和NH4H2PO4四种物质中,选择合适物质填空(填化学式):
(1)属于复合肥料的是______;
(2)用作发酵粉的是______;
(3)用于改良酸性土壤的是______;
(4)常用于灭火的是______。
15.化学源于生活,生活中蕴含着许多化学知识.
(1)用墨绘制的字画能够保存很长时间而不变色,原因是_________.
(2)节约用水人人有责,请写出一种节约用水的方法____________;
(3)俗语道“酒香不怕巷子深”,原因是__________(用微观粒子的观点解释);
(4)市场上售卖的“自嗨锅”,发热原理是利用发热包内的物质与水接触,释放出热量.发热包的成分之一氧化钙与水反应的化学方程式是_______.
(5)铝制品抗腐蚀性比较好,原因是_____________(用化学方程式的观点解释)
16.向AgNO3和KNO3的混合溶液中加入一些铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,结果没有现象产生,则滤渣中的物质是___,加入铁粉发生反应的化学方程式是___。
三、简答题
17.用海水制得的粗盐中含有不溶性杂质(泥沙等不溶物)和多种可溶性杂质。请回答下列问题:
(1)在“粗盐中难溶性杂质的去除”实验中,三次用到的玻璃仪器是______________;
(2)进一步去除样品中可溶性杂质(氯化钙、硫酸钠等),可以依次加入过量的______________(填化学式);过滤后向滤液中加入过量的盐酸,请写出此时发生反应的方程式______________;最后通过蒸发结晶得到较为纯净的氯化钠。
18.在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
(1)图1描述了稀盐酸与硝酸银溶液反应的微观实质,C处应填入的符号为___________;
(2)在稀盐酸中加入适量镁条的实验中:
①宏观表征:可以观察到的主要现象为__________,固体逐渐溶解;
②微观表征:图2表示反应前后溶液中的主要离子,写出“”所表示的微粒符号__________。
四、实验题
19.某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数。探究过程如下:
①连接实验装置并检查装置气密性。
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL.(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量1.4g。
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数。
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09g/L。
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为_____,实验过程中须加入稀硫酸至不再产生气体,目的是_____。
(2)步骤③中称量剩余固体之前的正确操作是_____、洗涤、干燥。
(3)根据实验测定的数据,上述三位同学中_____(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数。
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差。以下因素可能造成偏差的有_____(填标号)。
A 移出装置Ⅲ时,导管内留存了一部分水
B 实验测量前,没有排除装置Ⅰ中的空气
C 数据处理时,未排除加入稀硫酸所占的体积。
五、计算题
20.某学校化学实验室有一杯含盐酸和氯化铜的废液,该校化学兴趣小组的同学取109.8g废液于烧杯中,向其中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示,试计算:
(1)产生沉淀的总质量是 克。
(2)氢氧化钠溶液的溶质质量分数(写出计算过程)。
(3)计算加入100g氢氧化钠溶液并充分反应后烧杯内所得溶液中溶质的质量分数。(写出计算过程,结果精确到0.1%)
参考答案:
1.D 2.B 3.A 4.D 5.A 6.D 7.C 8.C 9.D 10.D 11.C 12.B 13.A
14. NH4H2PO4 NaHCO3 Ca(OH)2 CO2
15.(1)常温下,碳化学性质不活泼
(2)淘米水浇花(合理即可)
(3)分子在不断地运动
(4)
(5)
16. Ag 2AgNO3+Fe=2Ag+Fe(NO3)2
17. 玻璃棒 BaCl2、Na2CO3; Na2CO3+2HCl═2NaCl+H2O+CO2↑。
18.(1)AgCl
(2) 有气泡产生 Mg2+
19. 使样品中的锌完全反应 过滤 乙 AC
20.(1)9.8g
(2)解:设反应的NaOH质量为x,生成NaCl的质量为y
x=8g
y=11.7g
则
答:氢氧化钠溶液的溶质质量分数为16%
(3)设与HCl反应生成的NaCl质量为z
z=11.7g
则
答:充分反应后烧杯内所得溶液中溶质的质量分数为11.7%。
