第7章应用广泛的酸、碱、盐检测题(含答案)--2022-2023学年九年级化学沪教版(全国)下册
文档属性
| 名称 | 第7章应用广泛的酸、碱、盐检测题(含答案)--2022-2023学年九年级化学沪教版(全国)下册 |
|
|
| 格式 | docx | ||
| 文件大小 | 181.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-28 00:00:00 | ||
图片预览


文档简介
第7章《应用广泛的酸、碱、盐》检测题
一、单选题
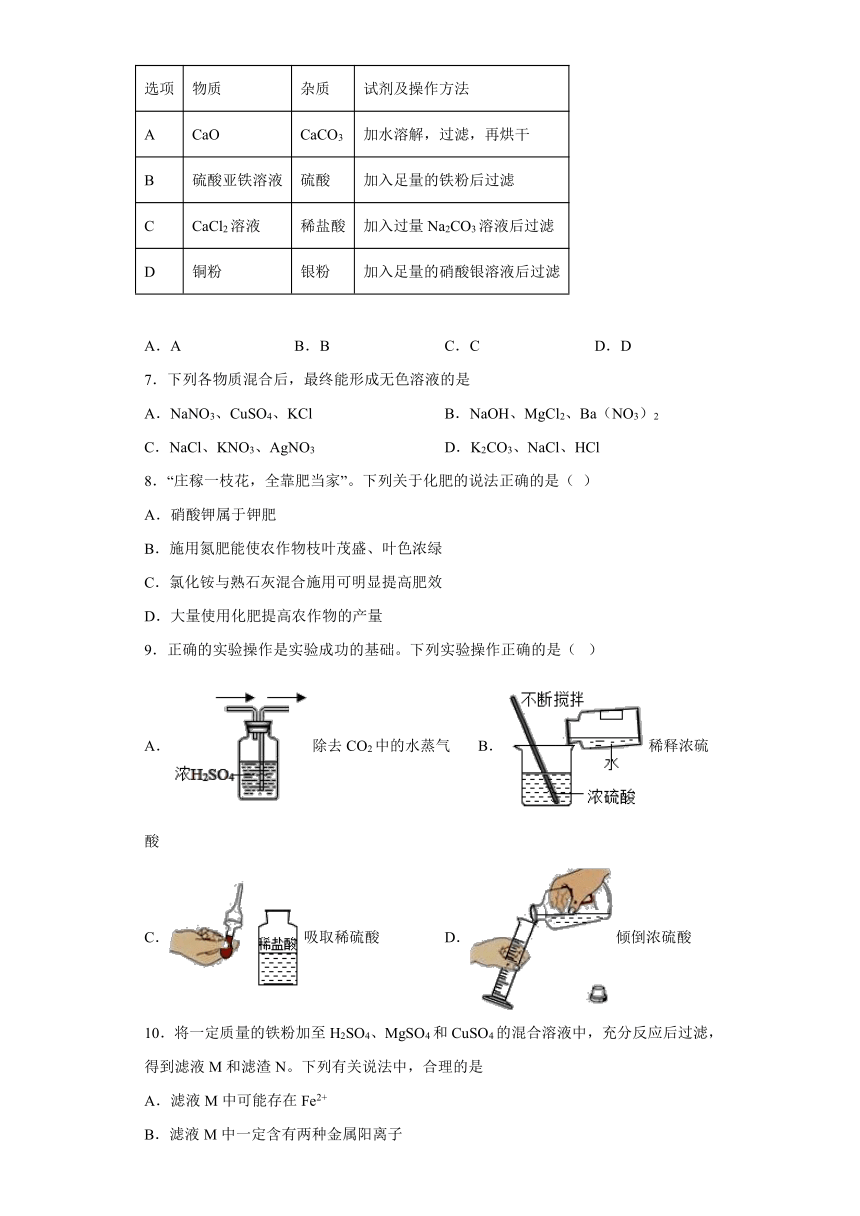
1.下列生产生活中所体现的化学反应原理正确的是
A.用赤铁矿和一氧化碳炼铁:CO+Fe2O3Fe+CO2
B.用硫酸除铁锈:Fe2O3+6H2SO4═2FeSO4+3H2O
C.用甲烷做燃料:CH4+2O2CO2+2H2O
D.用氢氧化镁治疗胃酸过多症:H2SO4+Mg(OH)2═MgSO4+2H2O
2.加“硒”食盐中添加有亚硒酸钠(Na2SeO3),亚硒酸钠能消除加速人体衰老的活性氧,下列说法中正确的是
A.Na2SeO3中钠、硒、氧元素的质量比为2:1:3 B.Na2SeO3属于盐类
C.硒是人体必须微量元素,尽可能多吃含硒的营养补剂 D.Na2SeO3中氧含量最高
3.下列实验操作不正确的是( )
A. 铁丝在氧气中燃烧 B.读取液体的体积
C.测溶液pH D.制取蒸馏水
4.下列实验现象描述正确的是
A.硫在空气中燃烧发出蓝紫色火焰
B.氢气在氧气中燃烧产生大量的白烟
C.铵盐与碱混合加热,产生了刺激性气味气体,并能使湿润的红色石蕊试纸变蓝
D.向FeCl3溶液中滴加Ba(OH)2溶液,生成红棕色沉淀
5.质量为5g的Mg、Zn的混合物与一定质量的稀硫酸恰好完全反应,经测定反应后的溶液质量增加了4.8g,将反应后的溶液蒸发水分,得到的固体混合物的质量为
A.14.6g B.18.4g C.19.6g D.25g
6.除去下列各物质中含有的少量杂质,选用方法正确的是
选项 物质 杂质 试剂及操作方法
A CaO CaCO3 加水溶解,过滤,再烘干
B 硫酸亚铁溶液 硫酸 加入足量的铁粉后过滤
C CaCl2溶液 稀盐酸 加入过量Na2CO3溶液后过滤
D 铜粉 银粉 加入足量的硝酸银溶液后过滤
A.A B.B C.C D.D
7.下列各物质混合后,最终能形成无色溶液的是
A.NaNO3、CuSO4、KCl B.NaOH、MgCl2、Ba(NO3)2
C.NaCl、KNO3、AgNO3 D.K2CO3、NaCl、HCl
8.“庄稼一枝花,全靠肥当家”。下列关于化肥的说法正确的是( )
A.硝酸钾属于钾肥
B.施用氮肥能使农作物枝叶茂盛、叶色浓绿
C.氯化铵与熟石灰混合施用可明显提高肥效
D.大量使用化肥提高农作物的产量
9.正确的实验操作是实验成功的基础。下列实验操作正确的是( )
A.除去CO2中的水蒸气 B.稀释浓硫酸
C.吸取稀硫酸 D.倾倒浓硫酸
10.将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混合溶液中,充分反应后过滤,得到滤液M和滤渣N。下列有关说法中,合理的是
A.滤液M中可能存在Fe2+
B.滤液M中一定含有两种金属阳离子
C.滤渣N中一定没有单质镁
D.滤渣N的质量一定大于加入铁粉的质量
11.下列实验中,能够达到实验目的的是
A.制备CaCO3:将足量CO2通入CaCl2溶液中,过滤、洗涤、烘于
B.鉴别稀硫酸和稀盐酸:取样,分别滴加Ba(OH)2溶液
C.分离CO和CO2气体:将气体通过足量的NaOH溶液
D.除去NaCl溶液中的盐酸:加入过量的CaCO3,过滤
12.下列化学方程式书写和对反应类型的判断,都正确的是
A. 化合反应
B. 分解反应
C. 置换反应
D. 复分解反应
二、填空题
13.运用所学化学知识填空。
(1)稀盐酸和稀硫酸具有相似化学性质是因为它们的溶液中都含有________________。
(2)氢氧化钠固体俗称________,常用于制肥皂、洗涤剂等。久置于空气中的氢氧化钠变质的原因是__________________________________(用化学方程式表示)。
(3)芋艿(俗称毛艿)是一种常见的食品。新鲜芋艿在去皮时会出现一种白色的液汁,液汁内含有一种碱性物质—皂角甙,沾上它会奇痒难忍,若在患处涂抹适量厨房中的________(填物质名称),则通过中和反应从而达到较好的止痒效果。
14.回答下列与金属有关的问题。
(1)黄铜片(铜锌合金)与铜片互相刻划时,在_______的表面可留下划痕;将它们分别放入稀盐酸中能产生气泡的是________;涉及的化学反应可用化学方程式表示为____________;
(2)铁生锈是铁与空气中的______发生化学反应的过程;
(3)向AgNO3和Zn(NO3)2的混合溶液中加入过量Fe粉,充分反应后过滤,滤渣中一定含有______。
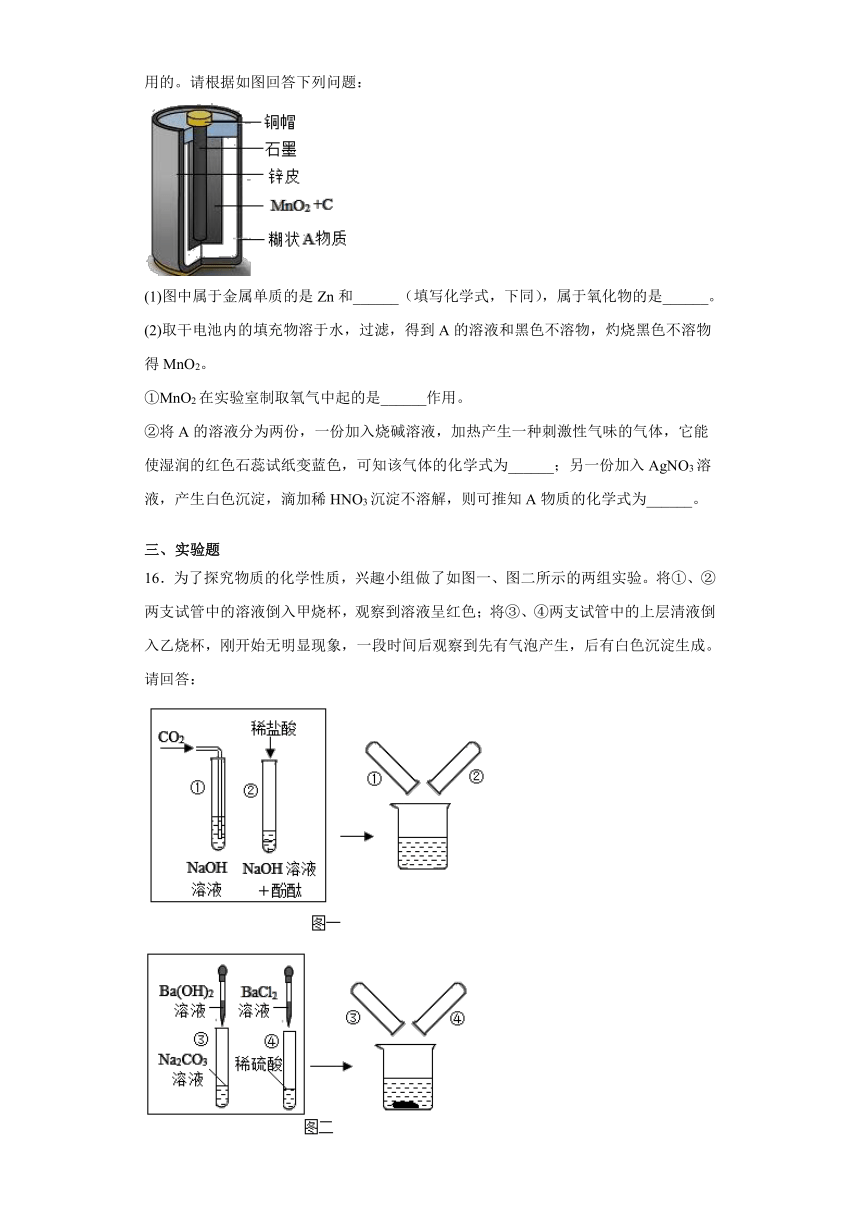
15.随意丢弃废旧干电池会造成环境污染,而废旧干电池中的许多物质都是可以回收利用的。请根据如图回答下列问题:
(1)图中属于金属单质的是Zn和______(填写化学式,下同),属于氧化物的是______。
(2)取干电池内的填充物溶于水,过滤,得到A的溶液和黑色不溶物,灼烧黑色不溶物得MnO2。
①MnO2在实验室制取氧气中起的是______作用。
②将A的溶液分为两份,一份加入烧碱溶液,加热产生一种刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝色,可知该气体的化学式为______;另一份加入AgNO3溶液,产生白色沉淀,滴加稀HNO3沉淀不溶解,则可推知A物质的化学式为______。
三、实验题
16.为了探究物质的化学性质,兴趣小组做了如图一、图二所示的两组实验。将①、②两支试管中的溶液倒入甲烧杯,观察到溶液呈红色;将③、④两支试管中的上层清液倒入乙烧杯,刚开始无明显现象,一段时间后观察到先有气泡产生,后有白色沉淀生成。请回答:
(1)写出试管①中反应的化学方程式____________;
(2)试管②中的溶液由红色变___________色,证明NaOH与HCl能反应;
(3)根据乙烧杯中有气泡产生的现象,试管③中所得溶液的溶质是NaOH和___________;
(4)试管④中出现的现象是______________;
(5)兴趣小组的同学完成上述实验后,为继续探究酸、碱、盐之间的反应,又对甲、乙烧杯内的混合物进行了如下图所示的实验操作,通过分析完成下列问题。
①沉淀M的化学式为___________;
②小红同学认为滤液A中的溶质可能含有NaOH,小组同学经过讨论后认为不正确,理由是____________;
③为了确定滤液B的溶质成分,先取少量滤液B加入少量Na2SO4溶液,无明显现象;再另取少量滤液B,只需加入___________溶液,即可判断滤液B中含有的溶质成分。
四、计算题
17.学习小组同学为测定某假黄金(铜锌合金)的组成,称取13g假黄金,向其中逐滴加入一定浓度的稀硫酸,所加稀硫酸的质量与生成氢气的质量关系如图所示。
(1)反应中生成氢气的质量是______g。
(2)计算假黄金中铜的质量分数。
18.取10g镁粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据。
第1次 第2次 第3次 第4次
加入稀硫酸的质量 20g 20g 20g 20g
剩余固体的质量 8.7g 7.4g 6.1g 5.2g
(1)混合物中铜粉的质量是___________。
(2)计算所用稀硫酸中溶质的质量分数?
试卷第6页,共6页
参考答案:
1.C
2.B
3.C
4.C
5.A
6.B
7.D
8.B
9.D
10.C
11.B
12.D
13. 氢离子 烧碱 食醋
14.(1) 铜片 黄铜
(2)水和氧气
(3)铁和银
15.(1) Cu MnO2
(2) 催化 NH3 NH4Cl
16.(1)
(2)无
(3)Na2CO3
(4)产生白色沉淀
(5) BaCO3 NaOH与盐酸完全反应后,盐酸才会和Na2CO3反应,有气泡产生说明NaOH已反应完 过量的BaCl2[或Ba(NO3)2或CaCl2或Ca(NO3)2]
17.(1)0.1
(2)解:设13g假黄金中锌的质量为x。
假黄金中铜的质量分数为
答:假黄金中铜的质量分数为75%。
18.(1)5.2g
(2)第1次加入20g稀硫酸,固体减少了10g-8.7g=1.3g,说明20g稀硫酸恰好与1.3g镁反应
解:设所用稀硫酸中溶质的质量分数为x
x≈26.5%
答:所用稀硫酸中溶质的质量分数是26.5%
一、单选题
1.下列生产生活中所体现的化学反应原理正确的是
A.用赤铁矿和一氧化碳炼铁:CO+Fe2O3Fe+CO2
B.用硫酸除铁锈:Fe2O3+6H2SO4═2FeSO4+3H2O
C.用甲烷做燃料:CH4+2O2CO2+2H2O
D.用氢氧化镁治疗胃酸过多症:H2SO4+Mg(OH)2═MgSO4+2H2O
2.加“硒”食盐中添加有亚硒酸钠(Na2SeO3),亚硒酸钠能消除加速人体衰老的活性氧,下列说法中正确的是
A.Na2SeO3中钠、硒、氧元素的质量比为2:1:3 B.Na2SeO3属于盐类
C.硒是人体必须微量元素,尽可能多吃含硒的营养补剂 D.Na2SeO3中氧含量最高
3.下列实验操作不正确的是( )
A. 铁丝在氧气中燃烧 B.读取液体的体积
C.测溶液pH D.制取蒸馏水
4.下列实验现象描述正确的是
A.硫在空气中燃烧发出蓝紫色火焰
B.氢气在氧气中燃烧产生大量的白烟
C.铵盐与碱混合加热,产生了刺激性气味气体,并能使湿润的红色石蕊试纸变蓝
D.向FeCl3溶液中滴加Ba(OH)2溶液,生成红棕色沉淀
5.质量为5g的Mg、Zn的混合物与一定质量的稀硫酸恰好完全反应,经测定反应后的溶液质量增加了4.8g,将反应后的溶液蒸发水分,得到的固体混合物的质量为
A.14.6g B.18.4g C.19.6g D.25g
6.除去下列各物质中含有的少量杂质,选用方法正确的是
选项 物质 杂质 试剂及操作方法
A CaO CaCO3 加水溶解,过滤,再烘干
B 硫酸亚铁溶液 硫酸 加入足量的铁粉后过滤
C CaCl2溶液 稀盐酸 加入过量Na2CO3溶液后过滤
D 铜粉 银粉 加入足量的硝酸银溶液后过滤
A.A B.B C.C D.D
7.下列各物质混合后,最终能形成无色溶液的是
A.NaNO3、CuSO4、KCl B.NaOH、MgCl2、Ba(NO3)2
C.NaCl、KNO3、AgNO3 D.K2CO3、NaCl、HCl
8.“庄稼一枝花,全靠肥当家”。下列关于化肥的说法正确的是( )
A.硝酸钾属于钾肥
B.施用氮肥能使农作物枝叶茂盛、叶色浓绿
C.氯化铵与熟石灰混合施用可明显提高肥效
D.大量使用化肥提高农作物的产量
9.正确的实验操作是实验成功的基础。下列实验操作正确的是( )
A.除去CO2中的水蒸气 B.稀释浓硫酸
C.吸取稀硫酸 D.倾倒浓硫酸
10.将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混合溶液中,充分反应后过滤,得到滤液M和滤渣N。下列有关说法中,合理的是
A.滤液M中可能存在Fe2+
B.滤液M中一定含有两种金属阳离子
C.滤渣N中一定没有单质镁
D.滤渣N的质量一定大于加入铁粉的质量
11.下列实验中,能够达到实验目的的是
A.制备CaCO3:将足量CO2通入CaCl2溶液中,过滤、洗涤、烘于
B.鉴别稀硫酸和稀盐酸:取样,分别滴加Ba(OH)2溶液
C.分离CO和CO2气体:将气体通过足量的NaOH溶液
D.除去NaCl溶液中的盐酸:加入过量的CaCO3,过滤
12.下列化学方程式书写和对反应类型的判断,都正确的是
A. 化合反应
B. 分解反应
C. 置换反应
D. 复分解反应
二、填空题
13.运用所学化学知识填空。
(1)稀盐酸和稀硫酸具有相似化学性质是因为它们的溶液中都含有________________。
(2)氢氧化钠固体俗称________,常用于制肥皂、洗涤剂等。久置于空气中的氢氧化钠变质的原因是__________________________________(用化学方程式表示)。
(3)芋艿(俗称毛艿)是一种常见的食品。新鲜芋艿在去皮时会出现一种白色的液汁,液汁内含有一种碱性物质—皂角甙,沾上它会奇痒难忍,若在患处涂抹适量厨房中的________(填物质名称),则通过中和反应从而达到较好的止痒效果。
14.回答下列与金属有关的问题。
(1)黄铜片(铜锌合金)与铜片互相刻划时,在_______的表面可留下划痕;将它们分别放入稀盐酸中能产生气泡的是________;涉及的化学反应可用化学方程式表示为____________;
(2)铁生锈是铁与空气中的______发生化学反应的过程;
(3)向AgNO3和Zn(NO3)2的混合溶液中加入过量Fe粉,充分反应后过滤,滤渣中一定含有______。
15.随意丢弃废旧干电池会造成环境污染,而废旧干电池中的许多物质都是可以回收利用的。请根据如图回答下列问题:
(1)图中属于金属单质的是Zn和______(填写化学式,下同),属于氧化物的是______。
(2)取干电池内的填充物溶于水,过滤,得到A的溶液和黑色不溶物,灼烧黑色不溶物得MnO2。
①MnO2在实验室制取氧气中起的是______作用。
②将A的溶液分为两份,一份加入烧碱溶液,加热产生一种刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝色,可知该气体的化学式为______;另一份加入AgNO3溶液,产生白色沉淀,滴加稀HNO3沉淀不溶解,则可推知A物质的化学式为______。
三、实验题
16.为了探究物质的化学性质,兴趣小组做了如图一、图二所示的两组实验。将①、②两支试管中的溶液倒入甲烧杯,观察到溶液呈红色;将③、④两支试管中的上层清液倒入乙烧杯,刚开始无明显现象,一段时间后观察到先有气泡产生,后有白色沉淀生成。请回答:
(1)写出试管①中反应的化学方程式____________;
(2)试管②中的溶液由红色变___________色,证明NaOH与HCl能反应;
(3)根据乙烧杯中有气泡产生的现象,试管③中所得溶液的溶质是NaOH和___________;
(4)试管④中出现的现象是______________;
(5)兴趣小组的同学完成上述实验后,为继续探究酸、碱、盐之间的反应,又对甲、乙烧杯内的混合物进行了如下图所示的实验操作,通过分析完成下列问题。
①沉淀M的化学式为___________;
②小红同学认为滤液A中的溶质可能含有NaOH,小组同学经过讨论后认为不正确,理由是____________;
③为了确定滤液B的溶质成分,先取少量滤液B加入少量Na2SO4溶液,无明显现象;再另取少量滤液B,只需加入___________溶液,即可判断滤液B中含有的溶质成分。
四、计算题
17.学习小组同学为测定某假黄金(铜锌合金)的组成,称取13g假黄金,向其中逐滴加入一定浓度的稀硫酸,所加稀硫酸的质量与生成氢气的质量关系如图所示。
(1)反应中生成氢气的质量是______g。
(2)计算假黄金中铜的质量分数。
18.取10g镁粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据。
第1次 第2次 第3次 第4次
加入稀硫酸的质量 20g 20g 20g 20g
剩余固体的质量 8.7g 7.4g 6.1g 5.2g
(1)混合物中铜粉的质量是___________。
(2)计算所用稀硫酸中溶质的质量分数?
试卷第6页,共6页
参考答案:
1.C
2.B
3.C
4.C
5.A
6.B
7.D
8.B
9.D
10.C
11.B
12.D
13. 氢离子 烧碱 食醋
14.(1) 铜片 黄铜
(2)水和氧气
(3)铁和银
15.(1) Cu MnO2
(2) 催化 NH3 NH4Cl
16.(1)
(2)无
(3)Na2CO3
(4)产生白色沉淀
(5) BaCO3 NaOH与盐酸完全反应后,盐酸才会和Na2CO3反应,有气泡产生说明NaOH已反应完 过量的BaCl2[或Ba(NO3)2或CaCl2或Ca(NO3)2]
17.(1)0.1
(2)解:设13g假黄金中锌的质量为x。
假黄金中铜的质量分数为
答:假黄金中铜的质量分数为75%。
18.(1)5.2g
(2)第1次加入20g稀硫酸,固体减少了10g-8.7g=1.3g,说明20g稀硫酸恰好与1.3g镁反应
解:设所用稀硫酸中溶质的质量分数为x
x≈26.5%
答:所用稀硫酸中溶质的质量分数是26.5%
