第6章溶解现象检测题(含答案)---2022-2023学年九年级化学沪教版(全国)下册
文档属性
| 名称 | 第6章溶解现象检测题(含答案)---2022-2023学年九年级化学沪教版(全国)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 156.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-05 09:56:03 | ||
图片预览

文档简介
第6章《溶解现象》检测题
一、单选题
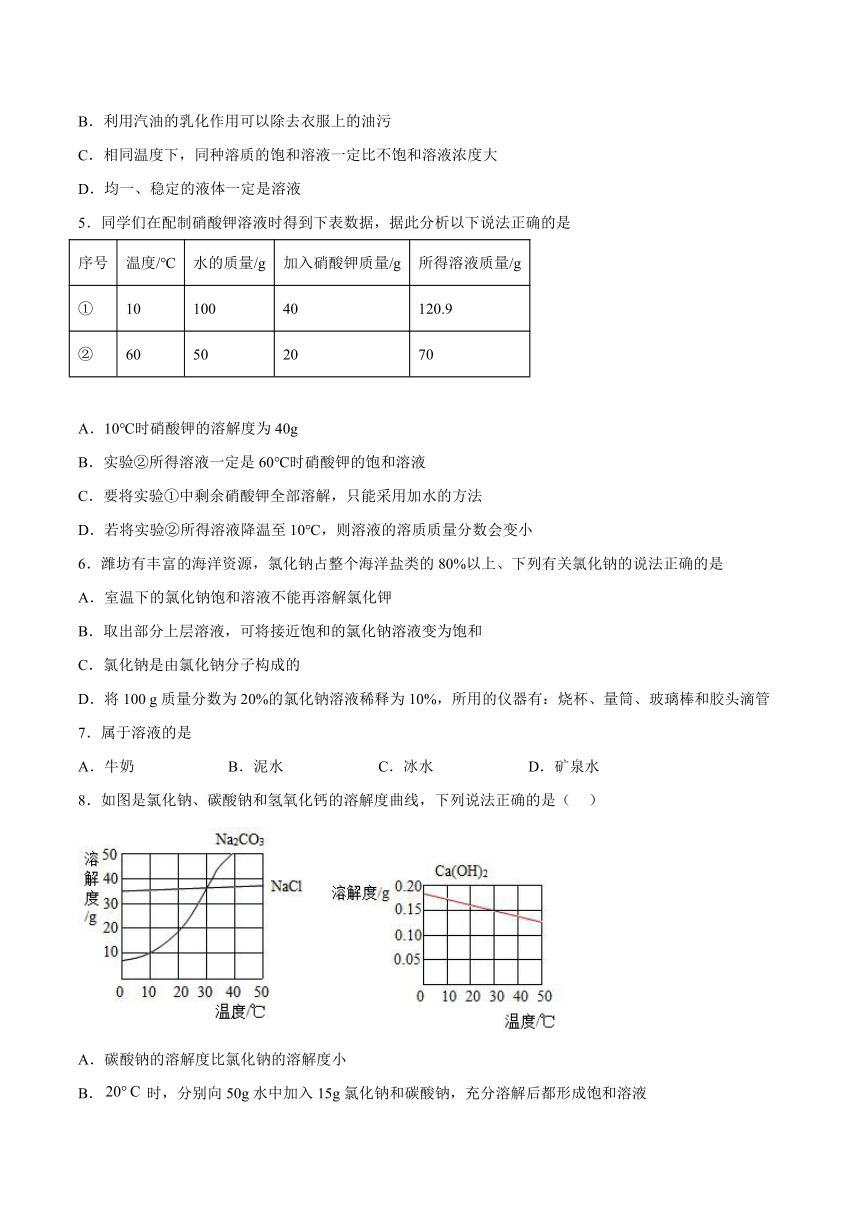
1.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,甲物质的溶解度为12
B.t1℃时,100g甲、乙两种物质的溶液中所含溶质的质量相等
C.将a点的乙溶液转化为饱和溶液,溶质质量分数不一定改变
D.t2℃时,在50g水中加入20g甲物质所得溶液的质量为70g
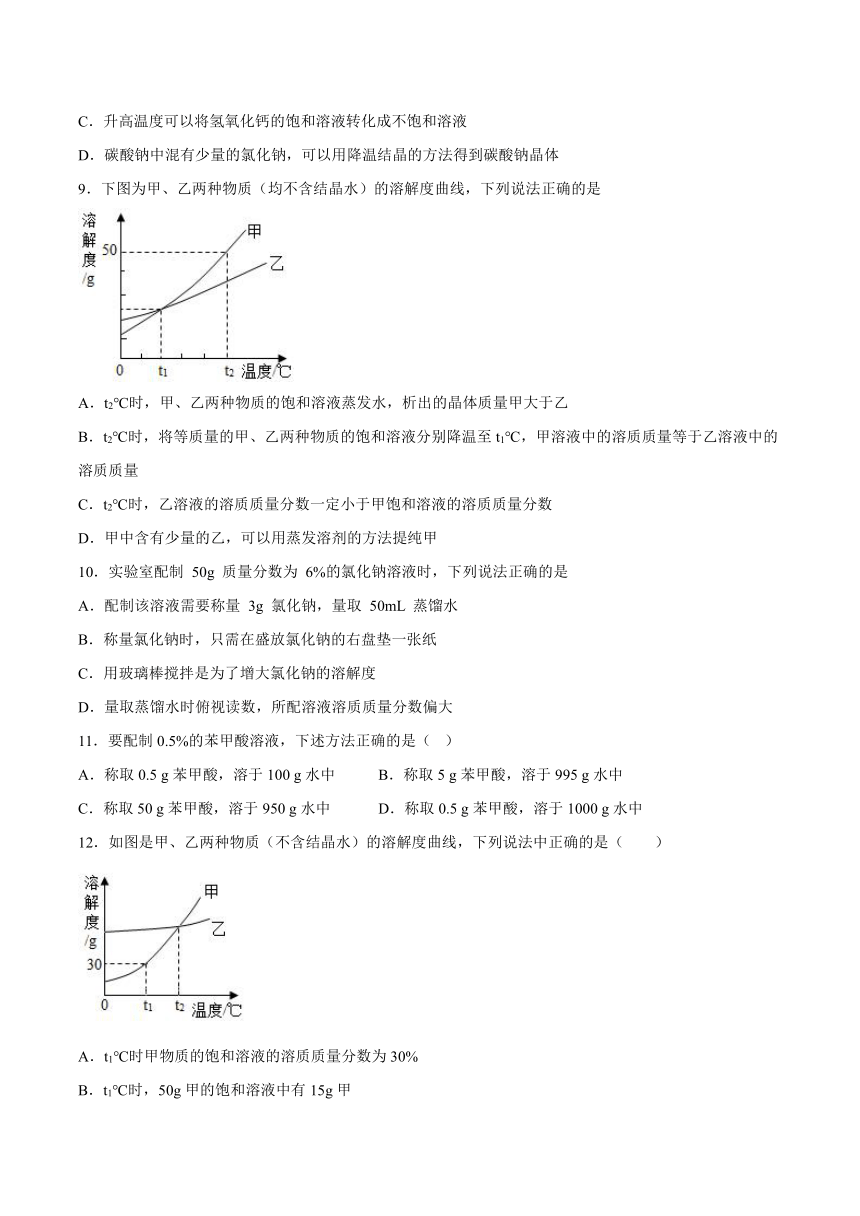
2.下图为某物质的溶解度曲线图。对于该物质下列说法错误的是
A.A点的溶液是不饱和溶液
B.50℃时的溶解度大于20℃时的溶解度
C.将A点溶液降温至20℃时,将有晶体析出
D.A、B点比较,B点溶液的溶质质量分数较大
3.人类离不开空气,下列有关空气及其成分的说法正确的是
A.洁净的空气是纯净物
B.氧气能支持燃烧,可以作燃料
C.空气中主要气体的体积分数由大到小依次是:O2、N2、CO2
D.夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小
4.下列说法正确的是 ( )
A.搅拌可以增大固体物质的溶解度
B.利用汽油的乳化作用可以除去衣服上的油污
C.相同温度下,同种溶质的饱和溶液一定比不饱和溶液浓度大
D.均一、稳定的液体一定是溶液
5.同学们在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是
序号 温度/℃ 水的质量/g 加入硝酸钾质量/g 所得溶液质量/g
① 10 100 40 120.9
② 60 50 20 70
A.10℃时硝酸钾的溶解度为40g
B.实验②所得溶液一定是60℃时硝酸钾的饱和溶液
C.要将实验①中剩余硝酸钾全部溶解,只能采用加水的方法
D.若将实验②所得溶液降温至10℃,则溶液的溶质质量分数会变小
6.潍坊有丰富的海洋资源,氯化钠占整个海洋盐类的80%以上、下列有关氯化钠的说法正确的是
A.室温下的氯化钠饱和溶液不能再溶解氯化钾
B.取出部分上层溶液,可将接近饱和的氯化钠溶液变为饱和
C.氯化钠是由氯化钠分子构成的
D.将100 g质量分数为20%的氯化钠溶液稀释为10%,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管
7.属于溶液的是
A.牛奶 B.泥水 C.冰水 D.矿泉水
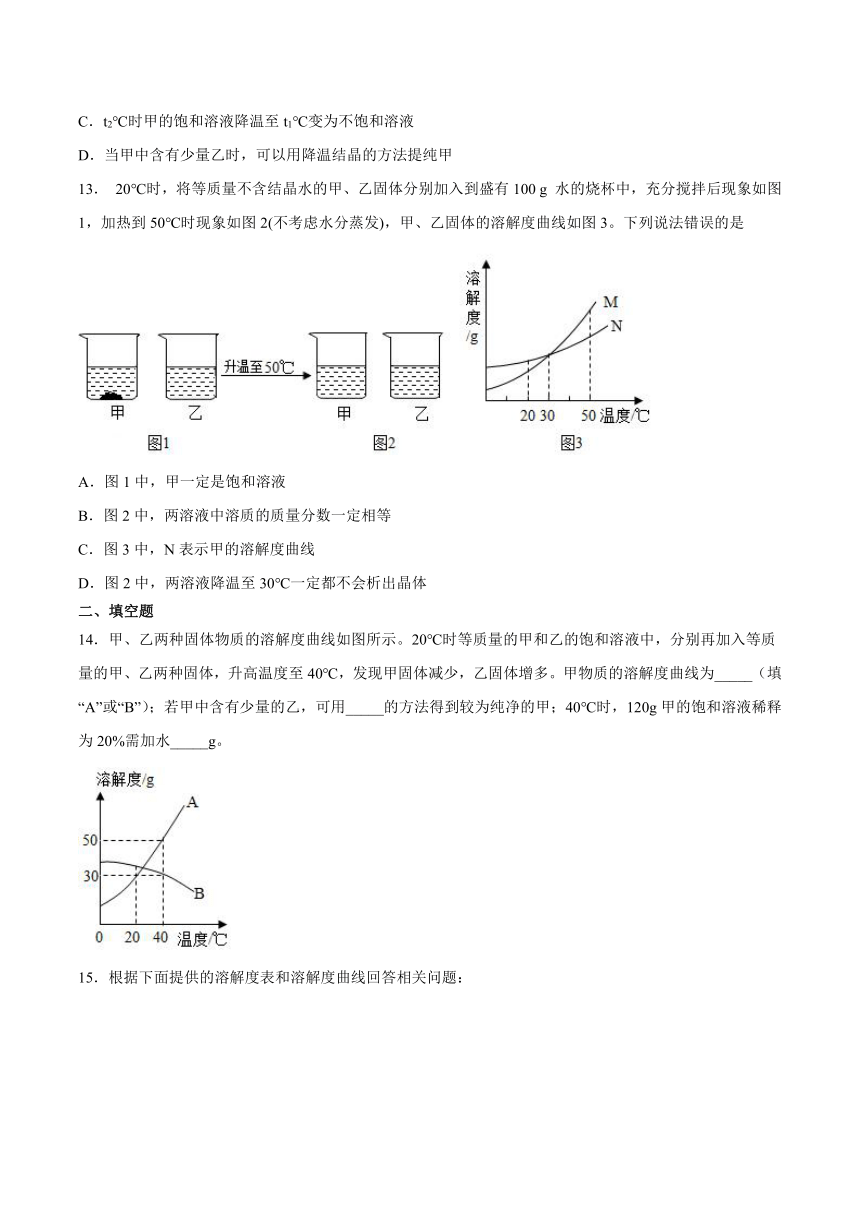
8.如图是氯化钠、碳酸钠和氢氧化钙的溶解度曲线,下列说法正确的是( )
A.碳酸钠的溶解度比氯化钠的溶解度小
B.时,分别向50g水中加入15g氯化钠和碳酸钠,充分溶解后都形成饱和溶液
C.升高温度可以将氢氧化钙的饱和溶液转化成不饱和溶液
D.碳酸钠中混有少量的氯化钠,可以用降温结晶的方法得到碳酸钠晶体
9.下图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.t2℃时,甲、乙两种物质的饱和溶液蒸发水,析出的晶体质量甲大于乙
B.t2℃时,将等质量的甲、乙两种物质的饱和溶液分别降温至t1℃,甲溶液中的溶质质量等于乙溶液中的溶质质量
C.t2℃时,乙溶液的溶质质量分数一定小于甲饱和溶液的溶质质量分数
D.甲中含有少量的乙,可以用蒸发溶剂的方法提纯甲
10.实验室配制 50g 质量分数为 6%的氯化钠溶液时,下列说法正确的是
A.配制该溶液需要称量 3g 氯化钠,量取 50mL 蒸馏水
B.称量氯化钠时,只需在盛放氯化钠的右盘垫一张纸
C.用玻璃棒搅拌是为了增大氯化钠的溶解度
D.量取蒸馏水时俯视读数,所配溶液溶质质量分数偏大
11.要配制0.5%的苯甲酸溶液,下述方法正确的是( )
A.称取0.5 g苯甲酸,溶于100 g水中 B.称取5 g苯甲酸,溶于995 g水中
C.称取50 g苯甲酸,溶于950 g水中 D.称取0.5 g苯甲酸,溶于1000 g水中
12.如图是甲、乙两种物质(不含结晶水)的溶解度曲线,下列说法中正确的是( )
A.t1℃时甲物质的饱和溶液的溶质质量分数为30%
B.t1℃时,50g甲的饱和溶液中有15g甲
C.t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液
D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲
13. 20℃时,将等质量不含结晶水的甲、乙固体分别加入到盛有100 g 水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙固体的溶解度曲线如图3。下列说法错误的是
A.图1中,甲一定是饱和溶液
B.图2中,两溶液中溶质的质量分数一定相等
C.图3中,N表示甲的溶解度曲线
D.图2中,两溶液降温至30℃一定都不会析出晶体
二、填空题
14.甲、乙两种固体物质的溶解度曲线如图所示。20℃时等质量的甲和乙的饱和溶液中,分别再加入等质量的甲、乙两种固体,升高温度至40℃,发现甲固体减少,乙固体增多。甲物质的溶解度曲线为_____(填“A”或“B”);若甲中含有少量的乙,可用_____的方法得到较为纯净的甲;40℃时,120g甲的饱和溶液稀释为20%需加水_____g。
15.根据下面提供的溶解度表和溶解度曲线回答相关问题:
温度/℃ 10 30 50 60 100
溶解度/g 氯化钠 35.8 36.3 37.0 37.3 39.8
硝酸钾 20.9 45.8 85.5 110 246
(1)A是_____的溶解度曲线(填“氯化钠”或“硝酸钾”);
(2)100℃时,100g水中加入200g硝酸钾,所得溶液是_____(填“饱和”或“不饱和”)溶液,将此溶液从100℃降温到60℃时,析出晶体的质量______g。
16.甲乙两种固体的溶解度曲线如图所示。请回答:
(1)10℃时,甲乙两种物质的溶解度大小关系:甲 _____ 乙(填“<”“>”或“=”)。20℃时,向50g水中加入20g乙,充分溶解后形成溶液质量为 _____ g。
(2)40℃时,取等质量的甲乙两种物质的饱和溶液分别蒸发等量的水后,恢复到40℃下列说法正确的是 _____ (填字母)
A 恢复到原温度后,溶液中溶剂的质量:甲=乙
B 恢复到原温度后,析出晶体的质量:乙>甲
C 若再降温到20℃时,溶液的溶质质量分数:甲=乙
三、实验题
17.请结合下列实验室制取气体的常见装置回答相关问题。
(1)仪器a的名称是______。
(2)实验室二氧化碳的反应方程式为______;用B装置制取CO2气体,长颈漏斗下端管口必须伸入液面下的原因是______。若用E装置收集二氧化碳,检验二氧化碳是否集满时应将______放在导管口c处。
(3)B、C装置均可用来制取CO2气体,C装置的优点是能控制反应的发生和停止,其原理是______;实验室更多使用B装置制取CO2气体的原因是______(答一点即可)。
(4)实验空制备二氧化碳常用1:3的稀盐酸(用体积比为1:3的浓盐酸与水混合配制)。(已知浓盐酸的溶质质量分数为37%,密度为1.19g/mL,水的密度可近似看作1.0g/mL),则1:3的稀盐酸溶质质量分数为______。(只列计算式)
四、推断题
18.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式: __________ ;
(2)操作1的名称为 __________ ;
(3)反应3中会有气体生成,该气体是 _________ ;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为 ________ ;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水 ________ g。
19.A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
(1)若A为气体氧化物,与溶液甲和溶液乙反应均生成盐和水.则A的化学式为______;取溶液D少量于试管中,加入碳酸钠溶液,有白色沉淀生成,则溶液D中溶质为______(写化学式);③反应的化学方程式为______.
(2)若向一定质量的碳酸钠溶液中加入足量的氯化钙溶液,所得沉淀质量等于原碳酸钠溶液质量的,则原碳酸钠溶液中溶质的质量分数为______.
五、计算题
20.某工厂排放的废水中含有亚硫酸钠(Na2SO3),若不经处理直接排放,会造成污染。现向50g的废水中加入CaC12溶液,恰好完全反应,反应后过滤、洗涤、干燥得到固体的质量为6g,试计算:
(1)亚硫酸钠中钠元素的质量分数;(结果保留至0.1%)
(2)废水中亚硫酸钠的质量分数。(提示:,且废水中的其他杂质不与CaCl2反应)
参考答案:
1.C 2.D 3.D 4.C 5.D 6.D 7.D 8.D 9.C 10.D 11.B 12.D 13.C
14. A 降温结晶 80
15. 硝酸钾 不饱和 90
16. > 65 BC
17.(1)铁架台
(2) 形成液封,防止生成的气体从长颈漏斗逸出 燃着的木条
(3) 关闭活塞,试管内压强变大,将液体压入长颈漏斗中,液体和固体分离,反应停止(合理即可) 反应容器为锥形瓶,可以制取大量的二氧化碳气体(合理即可)
(4)×100%
18. Fe + H2SO4 = Fe SO4 + H2↑ 过滤 CO2 7 : 9 1290
19. CO2 NaOH、Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 53%
20.(1)36.5%(2)12.6%
(1)亚硫酸钠中钠元素的质量分数=
(2)设50g废水中亚硫酸钠的质量为x
废水中亚硫酸钠的质量分数为:
答:水中亚硫酸钠的质量分数12.6%
一、单选题
1.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,甲物质的溶解度为12
B.t1℃时,100g甲、乙两种物质的溶液中所含溶质的质量相等
C.将a点的乙溶液转化为饱和溶液,溶质质量分数不一定改变
D.t2℃时,在50g水中加入20g甲物质所得溶液的质量为70g
2.下图为某物质的溶解度曲线图。对于该物质下列说法错误的是
A.A点的溶液是不饱和溶液
B.50℃时的溶解度大于20℃时的溶解度
C.将A点溶液降温至20℃时,将有晶体析出
D.A、B点比较,B点溶液的溶质质量分数较大
3.人类离不开空气,下列有关空气及其成分的说法正确的是
A.洁净的空气是纯净物
B.氧气能支持燃烧,可以作燃料
C.空气中主要气体的体积分数由大到小依次是:O2、N2、CO2
D.夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小
4.下列说法正确的是 ( )
A.搅拌可以增大固体物质的溶解度
B.利用汽油的乳化作用可以除去衣服上的油污
C.相同温度下,同种溶质的饱和溶液一定比不饱和溶液浓度大
D.均一、稳定的液体一定是溶液
5.同学们在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是
序号 温度/℃ 水的质量/g 加入硝酸钾质量/g 所得溶液质量/g
① 10 100 40 120.9
② 60 50 20 70
A.10℃时硝酸钾的溶解度为40g
B.实验②所得溶液一定是60℃时硝酸钾的饱和溶液
C.要将实验①中剩余硝酸钾全部溶解,只能采用加水的方法
D.若将实验②所得溶液降温至10℃,则溶液的溶质质量分数会变小
6.潍坊有丰富的海洋资源,氯化钠占整个海洋盐类的80%以上、下列有关氯化钠的说法正确的是
A.室温下的氯化钠饱和溶液不能再溶解氯化钾
B.取出部分上层溶液,可将接近饱和的氯化钠溶液变为饱和
C.氯化钠是由氯化钠分子构成的
D.将100 g质量分数为20%的氯化钠溶液稀释为10%,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管
7.属于溶液的是
A.牛奶 B.泥水 C.冰水 D.矿泉水
8.如图是氯化钠、碳酸钠和氢氧化钙的溶解度曲线,下列说法正确的是( )
A.碳酸钠的溶解度比氯化钠的溶解度小
B.时,分别向50g水中加入15g氯化钠和碳酸钠,充分溶解后都形成饱和溶液
C.升高温度可以将氢氧化钙的饱和溶液转化成不饱和溶液
D.碳酸钠中混有少量的氯化钠,可以用降温结晶的方法得到碳酸钠晶体
9.下图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.t2℃时,甲、乙两种物质的饱和溶液蒸发水,析出的晶体质量甲大于乙
B.t2℃时,将等质量的甲、乙两种物质的饱和溶液分别降温至t1℃,甲溶液中的溶质质量等于乙溶液中的溶质质量
C.t2℃时,乙溶液的溶质质量分数一定小于甲饱和溶液的溶质质量分数
D.甲中含有少量的乙,可以用蒸发溶剂的方法提纯甲
10.实验室配制 50g 质量分数为 6%的氯化钠溶液时,下列说法正确的是
A.配制该溶液需要称量 3g 氯化钠,量取 50mL 蒸馏水
B.称量氯化钠时,只需在盛放氯化钠的右盘垫一张纸
C.用玻璃棒搅拌是为了增大氯化钠的溶解度
D.量取蒸馏水时俯视读数,所配溶液溶质质量分数偏大
11.要配制0.5%的苯甲酸溶液,下述方法正确的是( )
A.称取0.5 g苯甲酸,溶于100 g水中 B.称取5 g苯甲酸,溶于995 g水中
C.称取50 g苯甲酸,溶于950 g水中 D.称取0.5 g苯甲酸,溶于1000 g水中
12.如图是甲、乙两种物质(不含结晶水)的溶解度曲线,下列说法中正确的是( )
A.t1℃时甲物质的饱和溶液的溶质质量分数为30%
B.t1℃时,50g甲的饱和溶液中有15g甲
C.t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液
D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲
13. 20℃时,将等质量不含结晶水的甲、乙固体分别加入到盛有100 g 水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙固体的溶解度曲线如图3。下列说法错误的是
A.图1中,甲一定是饱和溶液
B.图2中,两溶液中溶质的质量分数一定相等
C.图3中,N表示甲的溶解度曲线
D.图2中,两溶液降温至30℃一定都不会析出晶体
二、填空题
14.甲、乙两种固体物质的溶解度曲线如图所示。20℃时等质量的甲和乙的饱和溶液中,分别再加入等质量的甲、乙两种固体,升高温度至40℃,发现甲固体减少,乙固体增多。甲物质的溶解度曲线为_____(填“A”或“B”);若甲中含有少量的乙,可用_____的方法得到较为纯净的甲;40℃时,120g甲的饱和溶液稀释为20%需加水_____g。
15.根据下面提供的溶解度表和溶解度曲线回答相关问题:
温度/℃ 10 30 50 60 100
溶解度/g 氯化钠 35.8 36.3 37.0 37.3 39.8
硝酸钾 20.9 45.8 85.5 110 246
(1)A是_____的溶解度曲线(填“氯化钠”或“硝酸钾”);
(2)100℃时,100g水中加入200g硝酸钾,所得溶液是_____(填“饱和”或“不饱和”)溶液,将此溶液从100℃降温到60℃时,析出晶体的质量______g。
16.甲乙两种固体的溶解度曲线如图所示。请回答:
(1)10℃时,甲乙两种物质的溶解度大小关系:甲 _____ 乙(填“<”“>”或“=”)。20℃时,向50g水中加入20g乙,充分溶解后形成溶液质量为 _____ g。
(2)40℃时,取等质量的甲乙两种物质的饱和溶液分别蒸发等量的水后,恢复到40℃下列说法正确的是 _____ (填字母)
A 恢复到原温度后,溶液中溶剂的质量:甲=乙
B 恢复到原温度后,析出晶体的质量:乙>甲
C 若再降温到20℃时,溶液的溶质质量分数:甲=乙
三、实验题
17.请结合下列实验室制取气体的常见装置回答相关问题。
(1)仪器a的名称是______。
(2)实验室二氧化碳的反应方程式为______;用B装置制取CO2气体,长颈漏斗下端管口必须伸入液面下的原因是______。若用E装置收集二氧化碳,检验二氧化碳是否集满时应将______放在导管口c处。
(3)B、C装置均可用来制取CO2气体,C装置的优点是能控制反应的发生和停止,其原理是______;实验室更多使用B装置制取CO2气体的原因是______(答一点即可)。
(4)实验空制备二氧化碳常用1:3的稀盐酸(用体积比为1:3的浓盐酸与水混合配制)。(已知浓盐酸的溶质质量分数为37%,密度为1.19g/mL,水的密度可近似看作1.0g/mL),则1:3的稀盐酸溶质质量分数为______。(只列计算式)
四、推断题
18.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式: __________ ;
(2)操作1的名称为 __________ ;
(3)反应3中会有气体生成,该气体是 _________ ;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为 ________ ;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水 ________ g。
19.A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
(1)若A为气体氧化物,与溶液甲和溶液乙反应均生成盐和水.则A的化学式为______;取溶液D少量于试管中,加入碳酸钠溶液,有白色沉淀生成,则溶液D中溶质为______(写化学式);③反应的化学方程式为______.
(2)若向一定质量的碳酸钠溶液中加入足量的氯化钙溶液,所得沉淀质量等于原碳酸钠溶液质量的,则原碳酸钠溶液中溶质的质量分数为______.
五、计算题
20.某工厂排放的废水中含有亚硫酸钠(Na2SO3),若不经处理直接排放,会造成污染。现向50g的废水中加入CaC12溶液,恰好完全反应,反应后过滤、洗涤、干燥得到固体的质量为6g,试计算:
(1)亚硫酸钠中钠元素的质量分数;(结果保留至0.1%)
(2)废水中亚硫酸钠的质量分数。(提示:,且废水中的其他杂质不与CaCl2反应)
参考答案:
1.C 2.D 3.D 4.C 5.D 6.D 7.D 8.D 9.C 10.D 11.B 12.D 13.C
14. A 降温结晶 80
15. 硝酸钾 不饱和 90
16. > 65 BC
17.(1)铁架台
(2) 形成液封,防止生成的气体从长颈漏斗逸出 燃着的木条
(3) 关闭活塞,试管内压强变大,将液体压入长颈漏斗中,液体和固体分离,反应停止(合理即可) 反应容器为锥形瓶,可以制取大量的二氧化碳气体(合理即可)
(4)×100%
18. Fe + H2SO4 = Fe SO4 + H2↑ 过滤 CO2 7 : 9 1290
19. CO2 NaOH、Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 53%
20.(1)36.5%(2)12.6%
(1)亚硫酸钠中钠元素的质量分数=
(2)设50g废水中亚硫酸钠的质量为x
废水中亚硫酸钠的质量分数为:
答:水中亚硫酸钠的质量分数12.6%
