6.3物质的溶解性同步练习(含答案)—2022-2023学年九年级化学沪教版
文档属性
| 名称 | 6.3物质的溶解性同步练习(含答案)—2022-2023学年九年级化学沪教版 |  | |
| 格式 | docx | ||
| 文件大小 | 122.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-06 21:19:11 | ||
图片预览




文档简介
6.3物质的溶解性
同步练习
一、单选题
1.小明用50℃的水泡了一杯蔗糖水,充分搅拌后,发现杯子底部还有部分蔗糖不能溶解。已知蔗糖的溶解度随温度的升高而增大。下列能使杯底的蔗糖继续溶解的方法是
A.把蔗糖水放入冰箱 B.给蔗糖水加热
C.往蔗糖水里继续加蔗糖 D.把蔗糖水放在通风处
2. 20℃时,取下表中的四种物质各20g,分别加入到100g水中充分溶解后,有固体剩余的是
常见物质的溶解度(20℃)
物质名称 氯酸钾 硝酸钾 氯化钠 蔗糖
溶解度/g 7.4 31.6 36.0 203.9
A.氯酸钾 B.硝酸钾 C.氯化钠 D.蔗糖
3.2018年中国地质调查局矿产资源研究所公布我国罗布泊发现超大型规模钾盐矿2.5亿吨,已知,钾盐中KNO3和KCl固体溶解度曲线如图,下列说法正确的是
A.升高温度,可使KNO3的饱和溶液变为不饱和溶液
B.t℃时,KNO3和KCl溶液的溶质质量分数相等
C.60℃时,KNO3的饱和溶液中溶质与溶剂质量比为11:21
D.30℃时,在50g水中加入50gKCl,形成溶液的质量为100g
4.如图为A、B、C三种不含结晶水的固体物质的溶解度曲线。下列叙述正确的是
A.t1℃时,100g A的饱和溶液中含有A物质20g
B.t2℃时将三种物质的饱和溶液恒温蒸发等质量的水,析出晶体的质量关系是A>B>C
C.降低温度可使C的不饱和溶液变成饱和溶液
D.t2℃时将A、B、C三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数由大到小的顺序为B>A=C
5.根据图所示的溶解度曲线判断,下列说法正确的是( )
A.t1℃时,用等量水分别制成的甲、乙饱和溶液中,所用甲的质量比乙的大
B.t2℃时,甲、乙两种溶液中溶质质量分数相等
C.将t2℃甲、乙两物质的饱和溶液温度降低到t1℃时都会析出晶体
D.t2℃时,甲物质的饱和溶液与乙物质的饱和溶液中所含溶质的质量相等
6.下列有关溶液的说法正确的是
A.有水存在就是溶液
B.配制溶液时,搅拌溶液可以增大溶质的溶解度
C.将10%的KNO3溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.饱和溶液在一定条件下可转化为不饱和溶液
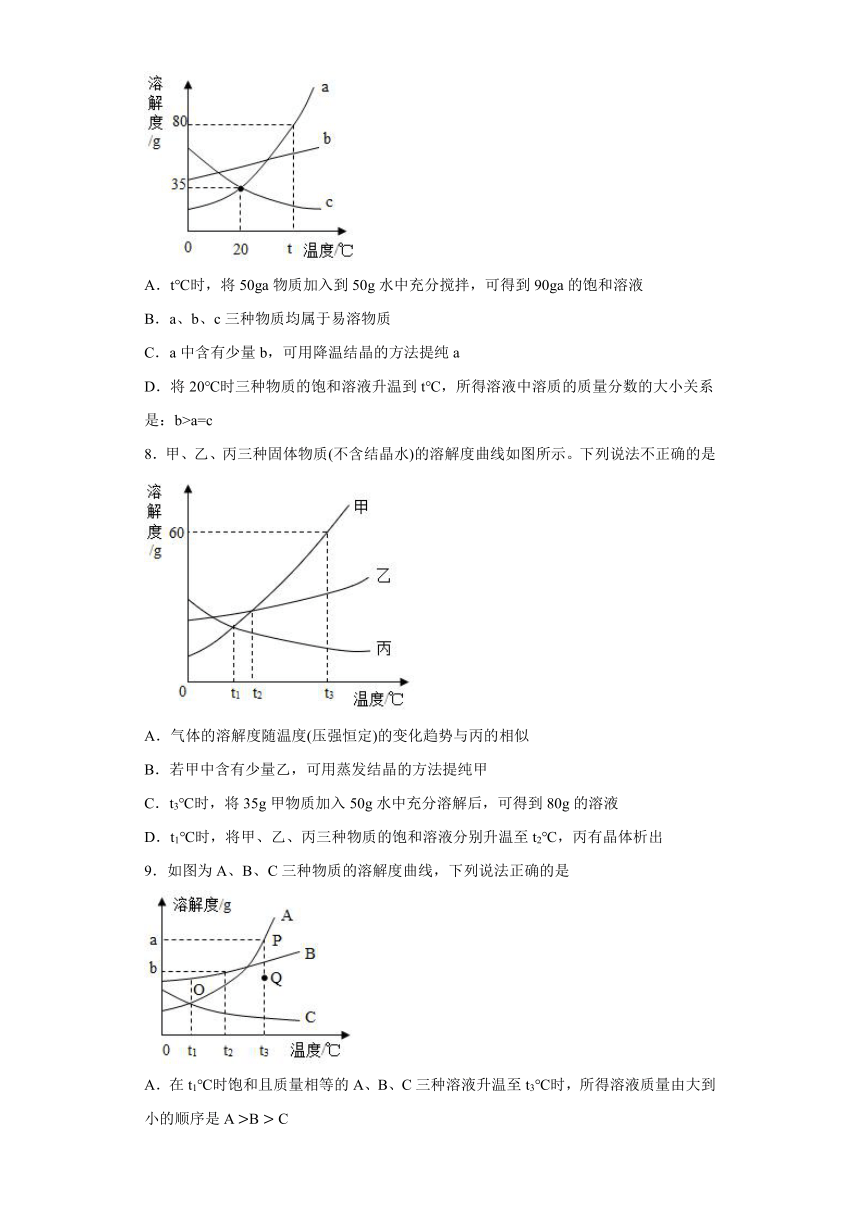
7.如图是a、b、c三种固体物质的溶解度曲线,下列说法错误的是
A.t℃时,将50ga物质加入到50g水中充分搅拌,可得到90ga的饱和溶液
B.a、b、c三种物质均属于易溶物质
C.a中含有少量b,可用降温结晶的方法提纯a
D.将20℃时三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a=c
8.甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法不正确的是
A.气体的溶解度随温度(压强恒定)的变化趋势与丙的相似
B.若甲中含有少量乙,可用蒸发结晶的方法提纯甲
C.t3℃时,将35g甲物质加入50g水中充分溶解后,可得到80g的溶液
D.t1℃时,将甲、乙、丙三种物质的饱和溶液分别升温至t2℃,丙有晶体析出
9.如图为A、B、C三种物质的溶解度曲线,下列说法正确的是
A.在t1℃时饱和且质量相等的A、B、C三种溶液升温至t3℃时,所得溶液质量由大到小的顺序是A B C
B.物质C的不饱和溶液可通过降温的方式变成饱和溶液
C.Q点可表示t3℃时A物质的饱和溶液
D.将t3℃时饱和的A、B、C三种溶液降温至t1℃时,所得溶液溶质质量分数由大到小的顺序是 B A C
10.根据实验判断下列说法不正确的是
A.溶液①和溶液②中溶质的质量分数相同,但均小于溶液③
B.溶液③可能是饱和溶液
C.溶液④的溶质质量分数大于溶液⑤的溶质质量分数
D.溶液中溶剂质量:①=②=③=④=⑤
11.甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
A.20℃时,甲乙两物质的溶解度相等
B.甲物质的溶解度比乙的溶解度大
C.升高温度可使甲物质的饱和溶液变为不饱和溶液
D.t℃时将乙物质的饱和溶液降温至20℃,溶液中溶质的质量分数增大
12.下列说法中不正确的是
A.糖水,汽水都是溶液
B.用洗洁精清洗油污是乳化现象
C.饱和溶液就是不能再溶解溶质的溶液
D.用水可以区分氯化钠、氢氧化钠、硝酸铵三种白色固体
13.某同学在验证“氢氧化钙溶液导电性”的实验时,发现除了两根石墨电极表面分别产生氢气、氧气外,还出现了一个意外现象:容器内的澄清石灰水变浑浊。对产生此现象原因的猜想不合理的是
A.电解过程中,溶剂减少,使氢氧化钙固体析出
B.电解过程中放热,温度升高,使氢氧化钙溶解度减小
C.氢氧化钙在通电的条件下发生分解反应而产生沉淀
D.石墨电极被通电时产生的氧气氧化,生成二氧化碳使石灰水变浑浊
14.如图是A、B、C三种物质的溶解度曲线,下列说法错误的是
A.t1℃时,A、B、C的饱和溶液恒温蒸发等质量的水,析出晶体质量: B>A=C
B. t1℃时,物质C饱和溶液的溶质质量分数为20%
C.A中混有少量C时,应采用降温结晶的方法提纯A
D.将t2℃时的物质A、B饱和溶液降温到t1℃时,两溶液的溶质质量分数: A>B
15.2022年3月23日,“天宫课堂”第二课在中国空间站开讲。航天员王亚平演示了太空“冰雪”实验:从一个装有过饱和乙酸钠溶液的袋子中缓缓挤出一个圆圆的液体球,随后用沾有晶体粉末的小棍触碰一下,液体球迅速“结冰”,成为一个通体洁白的“冰球”悬浮在空中,但摸上去却是温热的。液体球“结冰”实际是溶液中析出了晶体。通过这阶段的学习我们知道在溶液结晶过程中,下列判断正确的是
A.溶液质量增加 B.溶质一定减少
C.温度一定降低 D.溶剂一定减少
二、填空题
16.A、B、C三种固体物质的溶解度曲线如下图所示。据图回答问题:
(1)温度为______℃时,A与C物质的溶解度相等;
(2)t2℃时,把A、B物质各30g分别加到50g水中,不能形成饱和溶液的是________(填字母代号),若要使之达到饱和状态,还需要向溶液中加入________g该溶质。
17.甲、乙、丙三种物质的溶解度曲线如图所示,请回答。
(1)若甲的溶液中含有少量乙,提纯甲的方法是:_______。
(2)t3℃时,将40g甲物质加入60g水中,充分溶解后溶液的质量为_______。
(3)将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数大小关系为:_______。
(4)t3℃时,若要使60g质量分数为30%的甲溶液变为37.5%,采用的方法可以是 。(填序号)
A.恒温蒸发掉12g水 B.t3℃时,加入60g质量分数为45%的甲溶液
C.t3℃时,加入7.2g的甲粉末搅拌 D.t3℃时,加入12g的甲粉末搅拌
18.水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)城市中的生活用水是经自来水厂净化处理过的。有时可利用____________(填物质名称)溶于水后生成的胶状物对杂质的吸附,使杂质沉降来达到净水的目的。
(2)水是常见的溶剂,A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示。
①t2℃时,A的饱和溶液中溶质的质量分数为____________(保留一位小数)
②下列说法正确的是( )
A.t2℃时,A、B、C三种物质的溶解度大小为:A>B>C
B.将t2℃时A、B、C的饱和溶液分别降温至t1℃,所得溶液中溶质的质量分数大小为:B>A=C
C.从含有少量B的A的饱和溶液中得到较多的A晶体,通常可采用冷却热饱和溶液的方法
(3)压强为101 kPa和温度为0℃时,氮气在水中的溶解度为0.024,这句话的含义是______。
(4)下图实线方框内是化学反应的类型,相邻虚线方框内是对应的一个有水参加的反应的化学方程式,请在图中填空。
化合反应 H2O+CO2=H2CO3
分解反应 ____________
置换反应 Fe+4H2O____________+4H2
其它 6H2O+6CO2C6H12O6+6O2
(5)初中化学中,我们学习了稀盐酸和氢氧化钠溶液(如图所示)发生中和反应的实质是:H++OH = H2O,像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。以稀盐酸和氢氧化钠溶液反应为例,离子方程式的书写一般按以下步骤:
Ⅰ.写出稀盐酸与氢氧化钠溶液反应的化学方程式____________。
Ⅱ.把易溶于水且易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:H++Cl++Na++OH-= Na++Cl-+H2O;
Ⅲ.删去方程式两边不参加反应的离子,继续改写成:H++OH=H2O;
Ⅳ.检查方程式两边各元素的原子个数和电荷总数是否相等。则稀盐酸和氢氧化钠溶液反应的离子方程式为: H++OH-= H2O。请回答:
(6)写出稀盐酸和碳酸钙发生反应的离子方程式____________;
(7)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,生成物中有____________生成时,复分解反应才可以发生。
19.如图是a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点的含义是______。
(2)t2℃时,将50克a物质加入到100克水中,充分溶解后,所得溶液的质量是______克。
(3)若a中含有少量b,可用______的方法提纯a(选填“蒸发结晶”或“降温结晶”)。
(4)t2℃时,等质量a、b、c三种物质的饱和溶液中溶剂质量由大到小的顺序为______。
(5)t2℃时,等质量a、b、c三种物质的饱和溶液降温至t1℃时,析出晶体质量最多的是______,变成不饱和溶液的是______。
20.溶液在生产、生活中起着十分重要的作用。请回答下列问题。
(1)可以作为溶质的是_____(填字母序号)。
A 只有固体 B 只有液体
C 只有气体 D 气体、液体、固体都可以
(2)配制 100 g质量分数为 16%的氯化钠溶液,所需水的体积为_____mL(水的密度 为 1 g/cm3)。
(3)如图所示为 X、Y、Z 三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题:
①t2℃时,三种物质的溶解度的大小关系是_____。
②t3℃时,在 100gX 的饱和溶液中加入 10g 水,为使溶液 重新达到饱和,需加入 X 固体_____g。
③t3℃时,将 80gX 的饱和溶液降温到 t1℃,析出晶体质量是_____g。
三、实验题
21.硝酸钾的部分溶解度数据见下表。
温度(℃) 10 20 40 60
溶解度(g/100g 水) 20.9 31.6 63.9 110
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A.40-60 B.20-40 C. 10-20 D.低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。
参考答案:
1.B2.A3.A4.B5.C6.D7.D8.B9.D10.C11.C12.C13.C14.D15.B
16.(1)t1
(2)A 10
17.(1)降温结晶
(2)36g
(3)乙>甲>丙
(4)ABCD
18.明矾 33.3% AC 101kPa,0℃时,1体积水最多能溶解0.024体积的氮气 2H2O2H2↑+O2↑ Fe3O4; NaOH+HCl=NaCl+H2O; CaCO3+2H+=Ca2++H2O+CO2↑; 水、气体或沉淀
19.t1℃时,a、c物质的溶解度相等 140 降温结晶 c>b>a a c
20.D 84mL Y>X=Z 6 17.5
21.玻璃棒 不饱和 20% C 不能溶液 II 恒温蒸发 15 克后溶剂质量为 5g,此时最多可溶解 5.5g硝酸钾,此时溶液中溶质质量为 5g
同步练习
一、单选题
1.小明用50℃的水泡了一杯蔗糖水,充分搅拌后,发现杯子底部还有部分蔗糖不能溶解。已知蔗糖的溶解度随温度的升高而增大。下列能使杯底的蔗糖继续溶解的方法是
A.把蔗糖水放入冰箱 B.给蔗糖水加热
C.往蔗糖水里继续加蔗糖 D.把蔗糖水放在通风处
2. 20℃时,取下表中的四种物质各20g,分别加入到100g水中充分溶解后,有固体剩余的是
常见物质的溶解度(20℃)
物质名称 氯酸钾 硝酸钾 氯化钠 蔗糖
溶解度/g 7.4 31.6 36.0 203.9
A.氯酸钾 B.硝酸钾 C.氯化钠 D.蔗糖
3.2018年中国地质调查局矿产资源研究所公布我国罗布泊发现超大型规模钾盐矿2.5亿吨,已知,钾盐中KNO3和KCl固体溶解度曲线如图,下列说法正确的是
A.升高温度,可使KNO3的饱和溶液变为不饱和溶液
B.t℃时,KNO3和KCl溶液的溶质质量分数相等
C.60℃时,KNO3的饱和溶液中溶质与溶剂质量比为11:21
D.30℃时,在50g水中加入50gKCl,形成溶液的质量为100g
4.如图为A、B、C三种不含结晶水的固体物质的溶解度曲线。下列叙述正确的是
A.t1℃时,100g A的饱和溶液中含有A物质20g
B.t2℃时将三种物质的饱和溶液恒温蒸发等质量的水,析出晶体的质量关系是A>B>C
C.降低温度可使C的不饱和溶液变成饱和溶液
D.t2℃时将A、B、C三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数由大到小的顺序为B>A=C
5.根据图所示的溶解度曲线判断,下列说法正确的是( )
A.t1℃时,用等量水分别制成的甲、乙饱和溶液中,所用甲的质量比乙的大
B.t2℃时,甲、乙两种溶液中溶质质量分数相等
C.将t2℃甲、乙两物质的饱和溶液温度降低到t1℃时都会析出晶体
D.t2℃时,甲物质的饱和溶液与乙物质的饱和溶液中所含溶质的质量相等
6.下列有关溶液的说法正确的是
A.有水存在就是溶液
B.配制溶液时,搅拌溶液可以增大溶质的溶解度
C.将10%的KNO3溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.饱和溶液在一定条件下可转化为不饱和溶液
7.如图是a、b、c三种固体物质的溶解度曲线,下列说法错误的是
A.t℃时,将50ga物质加入到50g水中充分搅拌,可得到90ga的饱和溶液
B.a、b、c三种物质均属于易溶物质
C.a中含有少量b,可用降温结晶的方法提纯a
D.将20℃时三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a=c
8.甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法不正确的是
A.气体的溶解度随温度(压强恒定)的变化趋势与丙的相似
B.若甲中含有少量乙,可用蒸发结晶的方法提纯甲
C.t3℃时,将35g甲物质加入50g水中充分溶解后,可得到80g的溶液
D.t1℃时,将甲、乙、丙三种物质的饱和溶液分别升温至t2℃,丙有晶体析出
9.如图为A、B、C三种物质的溶解度曲线,下列说法正确的是
A.在t1℃时饱和且质量相等的A、B、C三种溶液升温至t3℃时,所得溶液质量由大到小的顺序是A B C
B.物质C的不饱和溶液可通过降温的方式变成饱和溶液
C.Q点可表示t3℃时A物质的饱和溶液
D.将t3℃时饱和的A、B、C三种溶液降温至t1℃时,所得溶液溶质质量分数由大到小的顺序是 B A C
10.根据实验判断下列说法不正确的是
A.溶液①和溶液②中溶质的质量分数相同,但均小于溶液③
B.溶液③可能是饱和溶液
C.溶液④的溶质质量分数大于溶液⑤的溶质质量分数
D.溶液中溶剂质量:①=②=③=④=⑤
11.甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
A.20℃时,甲乙两物质的溶解度相等
B.甲物质的溶解度比乙的溶解度大
C.升高温度可使甲物质的饱和溶液变为不饱和溶液
D.t℃时将乙物质的饱和溶液降温至20℃,溶液中溶质的质量分数增大
12.下列说法中不正确的是
A.糖水,汽水都是溶液
B.用洗洁精清洗油污是乳化现象
C.饱和溶液就是不能再溶解溶质的溶液
D.用水可以区分氯化钠、氢氧化钠、硝酸铵三种白色固体
13.某同学在验证“氢氧化钙溶液导电性”的实验时,发现除了两根石墨电极表面分别产生氢气、氧气外,还出现了一个意外现象:容器内的澄清石灰水变浑浊。对产生此现象原因的猜想不合理的是
A.电解过程中,溶剂减少,使氢氧化钙固体析出
B.电解过程中放热,温度升高,使氢氧化钙溶解度减小
C.氢氧化钙在通电的条件下发生分解反应而产生沉淀
D.石墨电极被通电时产生的氧气氧化,生成二氧化碳使石灰水变浑浊
14.如图是A、B、C三种物质的溶解度曲线,下列说法错误的是
A.t1℃时,A、B、C的饱和溶液恒温蒸发等质量的水,析出晶体质量: B>A=C
B. t1℃时,物质C饱和溶液的溶质质量分数为20%
C.A中混有少量C时,应采用降温结晶的方法提纯A
D.将t2℃时的物质A、B饱和溶液降温到t1℃时,两溶液的溶质质量分数: A>B
15.2022年3月23日,“天宫课堂”第二课在中国空间站开讲。航天员王亚平演示了太空“冰雪”实验:从一个装有过饱和乙酸钠溶液的袋子中缓缓挤出一个圆圆的液体球,随后用沾有晶体粉末的小棍触碰一下,液体球迅速“结冰”,成为一个通体洁白的“冰球”悬浮在空中,但摸上去却是温热的。液体球“结冰”实际是溶液中析出了晶体。通过这阶段的学习我们知道在溶液结晶过程中,下列判断正确的是
A.溶液质量增加 B.溶质一定减少
C.温度一定降低 D.溶剂一定减少
二、填空题
16.A、B、C三种固体物质的溶解度曲线如下图所示。据图回答问题:
(1)温度为______℃时,A与C物质的溶解度相等;
(2)t2℃时,把A、B物质各30g分别加到50g水中,不能形成饱和溶液的是________(填字母代号),若要使之达到饱和状态,还需要向溶液中加入________g该溶质。
17.甲、乙、丙三种物质的溶解度曲线如图所示,请回答。
(1)若甲的溶液中含有少量乙,提纯甲的方法是:_______。
(2)t3℃时,将40g甲物质加入60g水中,充分溶解后溶液的质量为_______。
(3)将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数大小关系为:_______。
(4)t3℃时,若要使60g质量分数为30%的甲溶液变为37.5%,采用的方法可以是 。(填序号)
A.恒温蒸发掉12g水 B.t3℃时,加入60g质量分数为45%的甲溶液
C.t3℃时,加入7.2g的甲粉末搅拌 D.t3℃时,加入12g的甲粉末搅拌
18.水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)城市中的生活用水是经自来水厂净化处理过的。有时可利用____________(填物质名称)溶于水后生成的胶状物对杂质的吸附,使杂质沉降来达到净水的目的。
(2)水是常见的溶剂,A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示。
①t2℃时,A的饱和溶液中溶质的质量分数为____________(保留一位小数)
②下列说法正确的是( )
A.t2℃时,A、B、C三种物质的溶解度大小为:A>B>C
B.将t2℃时A、B、C的饱和溶液分别降温至t1℃,所得溶液中溶质的质量分数大小为:B>A=C
C.从含有少量B的A的饱和溶液中得到较多的A晶体,通常可采用冷却热饱和溶液的方法
(3)压强为101 kPa和温度为0℃时,氮气在水中的溶解度为0.024,这句话的含义是______。
(4)下图实线方框内是化学反应的类型,相邻虚线方框内是对应的一个有水参加的反应的化学方程式,请在图中填空。
化合反应 H2O+CO2=H2CO3
分解反应 ____________
置换反应 Fe+4H2O____________+4H2
其它 6H2O+6CO2C6H12O6+6O2
(5)初中化学中,我们学习了稀盐酸和氢氧化钠溶液(如图所示)发生中和反应的实质是:H++OH = H2O,像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。以稀盐酸和氢氧化钠溶液反应为例,离子方程式的书写一般按以下步骤:
Ⅰ.写出稀盐酸与氢氧化钠溶液反应的化学方程式____________。
Ⅱ.把易溶于水且易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:H++Cl++Na++OH-= Na++Cl-+H2O;
Ⅲ.删去方程式两边不参加反应的离子,继续改写成:H++OH=H2O;
Ⅳ.检查方程式两边各元素的原子个数和电荷总数是否相等。则稀盐酸和氢氧化钠溶液反应的离子方程式为: H++OH-= H2O。请回答:
(6)写出稀盐酸和碳酸钙发生反应的离子方程式____________;
(7)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,生成物中有____________生成时,复分解反应才可以发生。
19.如图是a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点的含义是______。
(2)t2℃时,将50克a物质加入到100克水中,充分溶解后,所得溶液的质量是______克。
(3)若a中含有少量b,可用______的方法提纯a(选填“蒸发结晶”或“降温结晶”)。
(4)t2℃时,等质量a、b、c三种物质的饱和溶液中溶剂质量由大到小的顺序为______。
(5)t2℃时,等质量a、b、c三种物质的饱和溶液降温至t1℃时,析出晶体质量最多的是______,变成不饱和溶液的是______。
20.溶液在生产、生活中起着十分重要的作用。请回答下列问题。
(1)可以作为溶质的是_____(填字母序号)。
A 只有固体 B 只有液体
C 只有气体 D 气体、液体、固体都可以
(2)配制 100 g质量分数为 16%的氯化钠溶液,所需水的体积为_____mL(水的密度 为 1 g/cm3)。
(3)如图所示为 X、Y、Z 三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题:
①t2℃时,三种物质的溶解度的大小关系是_____。
②t3℃时,在 100gX 的饱和溶液中加入 10g 水,为使溶液 重新达到饱和,需加入 X 固体_____g。
③t3℃时,将 80gX 的饱和溶液降温到 t1℃,析出晶体质量是_____g。
三、实验题
21.硝酸钾的部分溶解度数据见下表。
温度(℃) 10 20 40 60
溶解度(g/100g 水) 20.9 31.6 63.9 110
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A.40-60 B.20-40 C. 10-20 D.低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。
参考答案:
1.B2.A3.A4.B5.C6.D7.D8.B9.D10.C11.C12.C13.C14.D15.B
16.(1)t1
(2)A 10
17.(1)降温结晶
(2)36g
(3)乙>甲>丙
(4)ABCD
18.明矾 33.3% AC 101kPa,0℃时,1体积水最多能溶解0.024体积的氮气 2H2O2H2↑+O2↑ Fe3O4; NaOH+HCl=NaCl+H2O; CaCO3+2H+=Ca2++H2O+CO2↑; 水、气体或沉淀
19.t1℃时,a、c物质的溶解度相等 140 降温结晶 c>b>a a c
20.D 84mL Y>X=Z 6 17.5
21.玻璃棒 不饱和 20% C 不能溶液 II 恒温蒸发 15 克后溶剂质量为 5g,此时最多可溶解 5.5g硝酸钾,此时溶液中溶质质量为 5g
