第6章溶解现象检测题(含答案) ---2022-2023学年九年级化学沪教版(全国)下册
文档属性
| 名称 | 第6章溶解现象检测题(含答案) ---2022-2023学年九年级化学沪教版(全国)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 153.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-07 21:46:24 | ||
图片预览


文档简介
第6章《溶解现象》检测题
一、单选题
1.如图是KNO3和NaCl两种物质的溶解度曲线,下列说法正确的是
A.图中阴影部分表示的KNO3和NaCl两溶液都是饱和溶液
B.t1℃时,等质量KNO3和NaCl溶液中溶质的质量一定相等
C.t2℃时,KNO3饱和溶液的溶质质量分数为60%
D.可以通过蒸发溶剂的方法从KNO3溶液中获得KNO3
2.配制一定质量分数的氯化钠溶液,下列操作正确的是
A.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
B.称量固体时,左盘放砝码,右盘放氯化钠
C.量取液体时,手持量筒,视线与液体的凹液面的最低处保持水平
D.称量固体时,发现指针向左偏,应该用镊子将游码向右移动直至天平平衡
3.如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。现有t2℃时甲、 乙、丙三种物质的饱和溶液(无固体存在)。 下列说法正确的是:
A.三种物质溶解度大小依次为:乙>丙>甲
B.将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>丙>甲
C.将温度由t2℃降到t1℃时,析出甲的质量比乙多
D.若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯
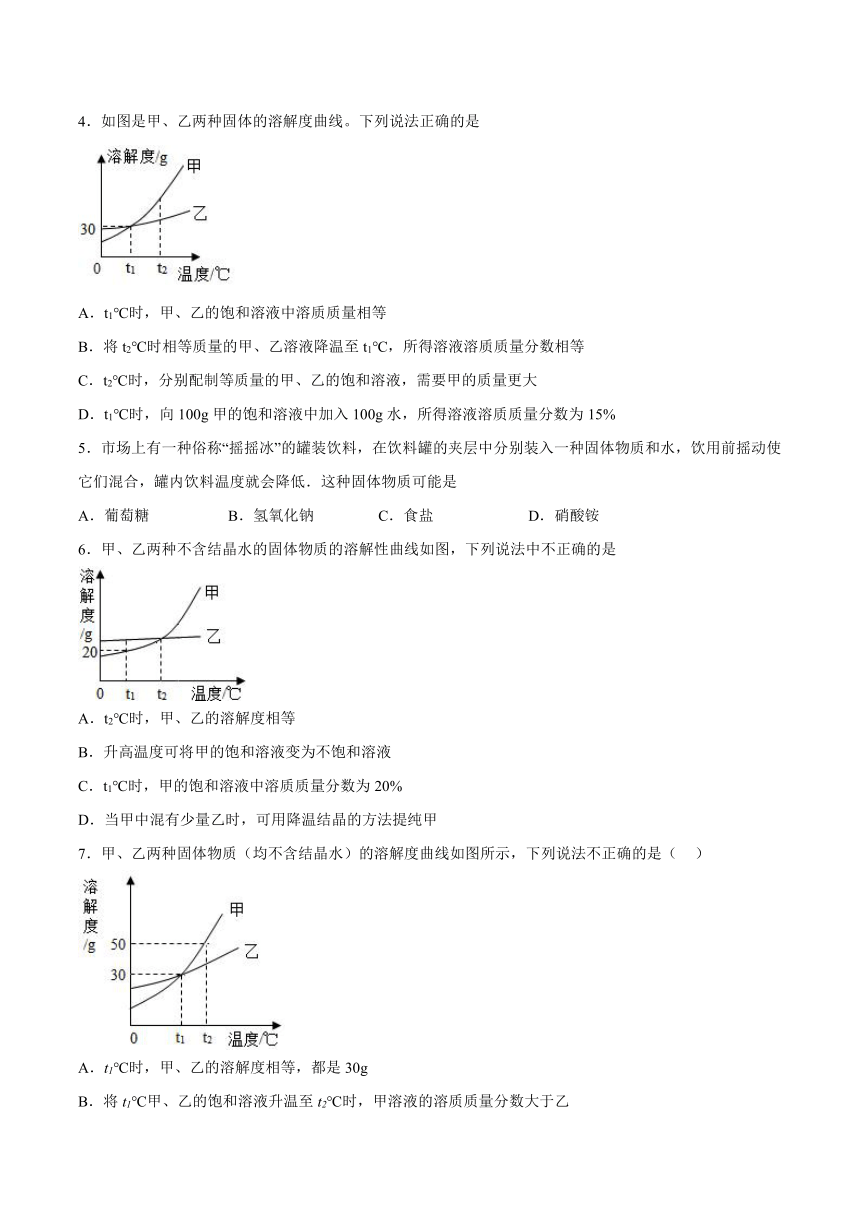
4.如图是甲、乙两种固体的溶解度曲线。下列说法正确的是
A.t1℃时,甲、乙的饱和溶液中溶质质量相等
B.将t2℃时相等质量的甲、乙溶液降温至t1℃,所得溶液溶质质量分数相等
C.t2℃时,分别配制等质量的甲、乙的饱和溶液,需要甲的质量更大
D.t1℃时,向100g甲的饱和溶液中加入100g水,所得溶液溶质质量分数为15%
5.市场上有一种俗称“摇摇冰”的罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料温度就会降低.这种固体物质可能是
A.葡萄糖 B.氢氧化钠 C.食盐 D.硝酸铵
6.甲、乙两种不含结晶水的固体物质的溶解性曲线如图,下列说法中不正确的是
A.t2℃时,甲、乙的溶解度相等
B.升高温度可将甲的饱和溶液变为不饱和溶液
C.t1℃时,甲的饱和溶液中溶质质量分数为20%
D.当甲中混有少量乙时,可用降温结晶的方法提纯甲
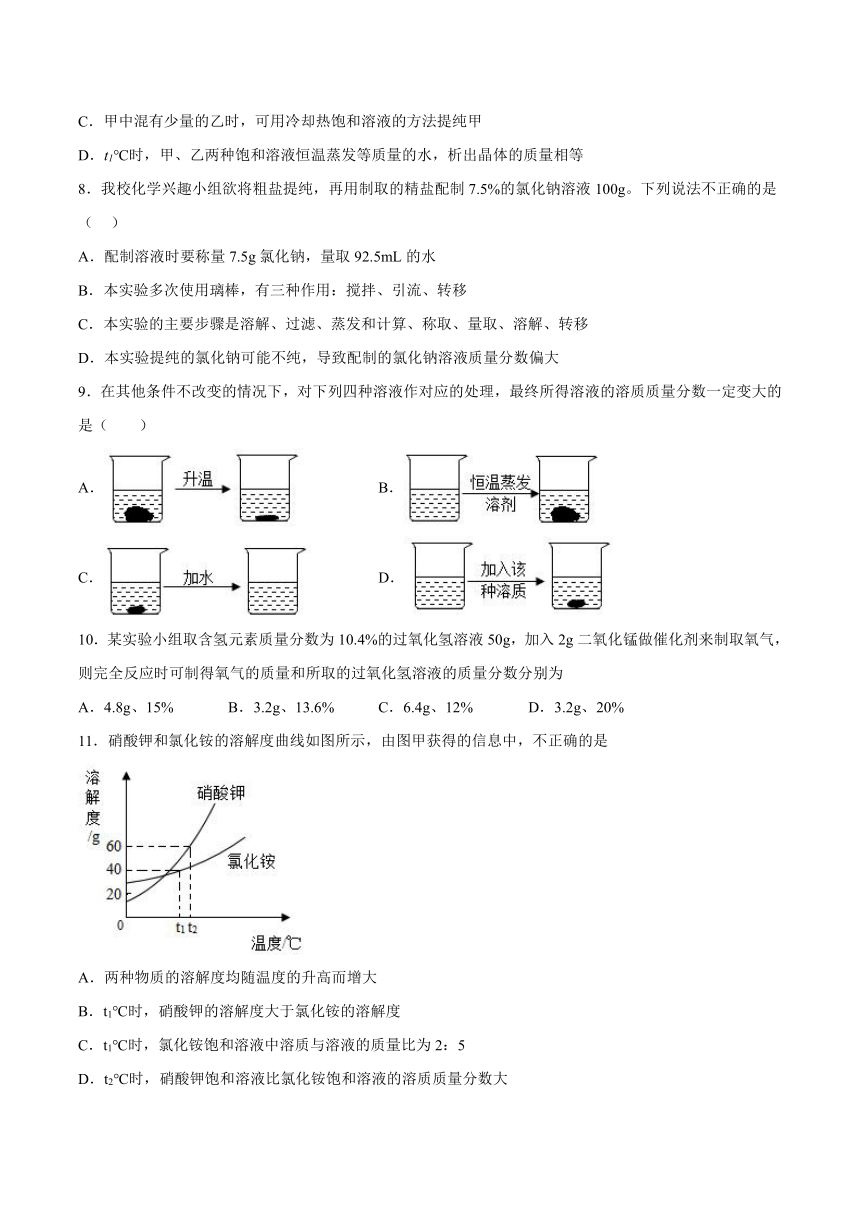
7.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是( )
A.t1℃时,甲、乙的溶解度相等,都是30g
B.将t1℃甲、乙的饱和溶液升温至t2℃时,甲溶液的溶质质量分数大于乙
C.甲中混有少量的乙时,可用冷却热饱和溶液的方法提纯甲
D.t1℃时,甲、乙两种饱和溶液恒温蒸发等质量的水,析出晶体的质量相等
8.我校化学兴趣小组欲将粗盐提纯,再用制取的精盐配制7.5%的氯化钠溶液100g。下列说法不正确的是( )
A.配制溶液时要称量7.5g氯化钠,量取92.5mL的水
B.本实验多次使用璃棒,有三种作用:搅拌、引流、转移
C.本实验的主要步骤是溶解、过滤、蒸发和计算、称取、量取、溶解、转移
D.本实验提纯的氯化钠可能不纯,导致配制的氯化钠溶液质量分数偏大
9.在其他条件不改变的情况下,对下列四种溶液作对应的处理,最终所得溶液的溶质质量分数一定变大的是( )
A. B.
C. D.
10.某实验小组取含氢元素质量分数为10.4%的过氧化氢溶液50g,加入2g二氧化锰做催化剂来制取氧气,则完全反应时可制得氧气的质量和所取的过氧化氢溶液的质量分数分别为
A.4.8g、15% B.3.2g、13.6% C.6.4g、12% D.3.2g、20%
11.硝酸钾和氯化铵的溶解度曲线如图所示,由图甲获得的信息中,不正确的是
A.两种物质的溶解度均随温度的升高而增大
B.t1℃时,硝酸钾的溶解度大于氯化铵的溶解度
C.t1℃时,氯化铵饱和溶液中溶质与溶液的质量比为2:5
D.t2℃时,硝酸钾饱和溶液比氯化铵饱和溶液的溶质质量分数大
12.如图是NaCl和KNO3两种物质的溶解度曲线。根据信息,下列说法正确的是
A.KNO3的溶解度比NaCl的溶解度大
B.20℃时,NaCl饱和溶液的溶质质量分数为36.0%
C.50℃时,40gKNO3在50g水中充分溶解,形成饱和溶液
D.通过加溶剂、升温等方法能将KNO3饱和溶液转化为不饱和溶液
二、填空题
13.请根据如图A、B、C三种物质的溶解度曲线,回答下列问题:
(1)温度越高,溶解度越小的物质是(填写代号)_______________;
(2)现有时A的饱和溶液,使其变为不饱和溶液可采用的是___________(填一种方法)
(3)从含有少量B的A物质混合物中提纯A物质,一般采用__________的方法。
(4)时,将25gA放入100g水中,发现固体先全部溶解,一段时间后又有晶体析出,请你解释A固体全部溶解的原因__________________。
14.医疗上用溶质质量分数为0.9%的生理盐水给患者输液。某化学兴趣小组欲配制500g溶质质量分数为0.9%的氯化钠溶液。请回答有关问题:
(1)计算:需要氯化钠_____g,蒸馏水_____g。
(2)有如下操作:①装瓶、贴签;②溶解氯化钠;③秤取氯化钠固体;④量取蒸馏水,正确的操作顺序是_____。
(3)实验结果反思与评价:下列操作导致所配制溶液的溶质质量分数有何偏差?(填“偏大”、“偏小”或“无影响”)
①将量筒中的蒸馏水倒入烧杯时,有少量水溅出。结果_____;
②量取水时,俯视刻度线。结果_____;
③转移配好的溶液时,有少许溶液溅出。结果_____。
15.甲、乙、丙三种物质在水中形成的饱和溶液溶质质量分数随温度变化如下图所示,请回答下列问题:
(1)50℃时,甲、乙、丙三种物质的溶解度从大到小的顺序为______。
(2)从乙溶液中获得乙晶体的方法是______(填“蒸发结晶”或“降温结晶”)。
(3)将50℃甲的饱和溶液降温至25℃,溶液为______(填“饱和溶液”或“不饱和溶液”)。
(4)气体的溶解度随温度的变化规律与______(填“甲”、“乙”或“丙”)相似。
(5)25℃时,甲物质中的溶解度为______g(答案保留一位小数)。
三、实验题
16.根据如图所示实验装置,回答问题。
(1)图1实验中,实验前先通入CO的目的是_______,该反应的化学方程式为_______。
(2)图2实验可用于研究CO2与NaOH溶液的反应。关闭弹簧夹K,将NaOH溶液全部挤入烧瓶,振荡;然后打开弹簧夹K,你预测可观察到的现象是_______。
(3)图3实验中,若要除去粗盐中难溶性的杂质,⑤中_______时停止加热,若按照②③①的步骤配制50g16%的氯化钠溶液,所配制溶液的溶质质量分数_______(填“偏大”或“偏小”)。
四、推断题
17.A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
(1)若A为气体氧化物,与溶液甲和溶液乙反应均生成盐和水.则A的化学式为______;取溶液D少量于试管中,加入碳酸钠溶液,有白色沉淀生成,则溶液D中溶质为______(写化学式);③反应的化学方程式为______.
(2)若向一定质量的碳酸钠溶液中加入足量的氯化钙溶液,所得沉淀质量等于原碳酸钠溶液质量的,则原碳酸钠溶液中溶质的质量分数为______.
18.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
五、计算题
19.为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质。其原理是把蛋白质中的氮元素完全转化成氨气(化学式为NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4
现取该牛奶样品30 mL,用“盖尔达法”分解其中的蛋白质,产生的氨气用9.5 g溶质质量分数为4.9%的稀硫酸恰好完全吸收。计算并回答下列问题:
(1)产生氨气的质量是多少克?(计算结果精确到0.01 g,下同)
(2)30 mL牛奶中含氮元素的质量是多少克?
(3)下图是该牛奶包装标签的部分内容。已知牛奶中的蛋白质含氮元素的质量分数为16%,请你通过计算确定,该牛奶样品中蛋白质的含量是否达到了包装标签所标示的蛋白质的质量标准。
配料:鲜牛奶保质期:8个月 净含量:250 mL/盒 营养成分:(每100 mL) 钙≥0.11 g 脂肪≥3.30 g 蛋白质≥2.90 g
参考答案:
1.D 2.A 3.D 4.C 5.D 6.C 7.B 8.D 9.A 10.B 11.C 12.D
13. C 升温(或加溶剂) 冷却热饱和溶液(或降温结晶) A物质溶于水放热
14. 4.5 495.5 ③④②① 偏大 偏大 不变
15.(1)甲>乙>丙
(2)蒸发结晶
(3)饱和溶液
(4)丙
(5)42.9
16.(1) 将装置内空气排尽,防止发生爆炸
(2)气球胀大
(3) 蒸发皿中有大部分固体析出 偏大
17. CO2 NaOH、Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 53%
18. 75 a>b>c
19.(1)0.16 g
(2)0.13 g
(3)2.70 g<2.90 g,所以该牛奶未达到标签所标示的质量标准
一、单选题
1.如图是KNO3和NaCl两种物质的溶解度曲线,下列说法正确的是
A.图中阴影部分表示的KNO3和NaCl两溶液都是饱和溶液
B.t1℃时,等质量KNO3和NaCl溶液中溶质的质量一定相等
C.t2℃时,KNO3饱和溶液的溶质质量分数为60%
D.可以通过蒸发溶剂的方法从KNO3溶液中获得KNO3
2.配制一定质量分数的氯化钠溶液,下列操作正确的是
A.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
B.称量固体时,左盘放砝码,右盘放氯化钠
C.量取液体时,手持量筒,视线与液体的凹液面的最低处保持水平
D.称量固体时,发现指针向左偏,应该用镊子将游码向右移动直至天平平衡
3.如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。现有t2℃时甲、 乙、丙三种物质的饱和溶液(无固体存在)。 下列说法正确的是:
A.三种物质溶解度大小依次为:乙>丙>甲
B.将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>丙>甲
C.将温度由t2℃降到t1℃时,析出甲的质量比乙多
D.若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯
4.如图是甲、乙两种固体的溶解度曲线。下列说法正确的是
A.t1℃时,甲、乙的饱和溶液中溶质质量相等
B.将t2℃时相等质量的甲、乙溶液降温至t1℃,所得溶液溶质质量分数相等
C.t2℃时,分别配制等质量的甲、乙的饱和溶液,需要甲的质量更大
D.t1℃时,向100g甲的饱和溶液中加入100g水,所得溶液溶质质量分数为15%
5.市场上有一种俗称“摇摇冰”的罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料温度就会降低.这种固体物质可能是
A.葡萄糖 B.氢氧化钠 C.食盐 D.硝酸铵
6.甲、乙两种不含结晶水的固体物质的溶解性曲线如图,下列说法中不正确的是
A.t2℃时,甲、乙的溶解度相等
B.升高温度可将甲的饱和溶液变为不饱和溶液
C.t1℃时,甲的饱和溶液中溶质质量分数为20%
D.当甲中混有少量乙时,可用降温结晶的方法提纯甲
7.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是( )
A.t1℃时,甲、乙的溶解度相等,都是30g
B.将t1℃甲、乙的饱和溶液升温至t2℃时,甲溶液的溶质质量分数大于乙
C.甲中混有少量的乙时,可用冷却热饱和溶液的方法提纯甲
D.t1℃时,甲、乙两种饱和溶液恒温蒸发等质量的水,析出晶体的质量相等
8.我校化学兴趣小组欲将粗盐提纯,再用制取的精盐配制7.5%的氯化钠溶液100g。下列说法不正确的是( )
A.配制溶液时要称量7.5g氯化钠,量取92.5mL的水
B.本实验多次使用璃棒,有三种作用:搅拌、引流、转移
C.本实验的主要步骤是溶解、过滤、蒸发和计算、称取、量取、溶解、转移
D.本实验提纯的氯化钠可能不纯,导致配制的氯化钠溶液质量分数偏大
9.在其他条件不改变的情况下,对下列四种溶液作对应的处理,最终所得溶液的溶质质量分数一定变大的是( )
A. B.
C. D.
10.某实验小组取含氢元素质量分数为10.4%的过氧化氢溶液50g,加入2g二氧化锰做催化剂来制取氧气,则完全反应时可制得氧气的质量和所取的过氧化氢溶液的质量分数分别为
A.4.8g、15% B.3.2g、13.6% C.6.4g、12% D.3.2g、20%
11.硝酸钾和氯化铵的溶解度曲线如图所示,由图甲获得的信息中,不正确的是
A.两种物质的溶解度均随温度的升高而增大
B.t1℃时,硝酸钾的溶解度大于氯化铵的溶解度
C.t1℃时,氯化铵饱和溶液中溶质与溶液的质量比为2:5
D.t2℃时,硝酸钾饱和溶液比氯化铵饱和溶液的溶质质量分数大
12.如图是NaCl和KNO3两种物质的溶解度曲线。根据信息,下列说法正确的是
A.KNO3的溶解度比NaCl的溶解度大
B.20℃时,NaCl饱和溶液的溶质质量分数为36.0%
C.50℃时,40gKNO3在50g水中充分溶解,形成饱和溶液
D.通过加溶剂、升温等方法能将KNO3饱和溶液转化为不饱和溶液
二、填空题
13.请根据如图A、B、C三种物质的溶解度曲线,回答下列问题:
(1)温度越高,溶解度越小的物质是(填写代号)_______________;
(2)现有时A的饱和溶液,使其变为不饱和溶液可采用的是___________(填一种方法)
(3)从含有少量B的A物质混合物中提纯A物质,一般采用__________的方法。
(4)时,将25gA放入100g水中,发现固体先全部溶解,一段时间后又有晶体析出,请你解释A固体全部溶解的原因__________________。
14.医疗上用溶质质量分数为0.9%的生理盐水给患者输液。某化学兴趣小组欲配制500g溶质质量分数为0.9%的氯化钠溶液。请回答有关问题:
(1)计算:需要氯化钠_____g,蒸馏水_____g。
(2)有如下操作:①装瓶、贴签;②溶解氯化钠;③秤取氯化钠固体;④量取蒸馏水,正确的操作顺序是_____。
(3)实验结果反思与评价:下列操作导致所配制溶液的溶质质量分数有何偏差?(填“偏大”、“偏小”或“无影响”)
①将量筒中的蒸馏水倒入烧杯时,有少量水溅出。结果_____;
②量取水时,俯视刻度线。结果_____;
③转移配好的溶液时,有少许溶液溅出。结果_____。
15.甲、乙、丙三种物质在水中形成的饱和溶液溶质质量分数随温度变化如下图所示,请回答下列问题:
(1)50℃时,甲、乙、丙三种物质的溶解度从大到小的顺序为______。
(2)从乙溶液中获得乙晶体的方法是______(填“蒸发结晶”或“降温结晶”)。
(3)将50℃甲的饱和溶液降温至25℃,溶液为______(填“饱和溶液”或“不饱和溶液”)。
(4)气体的溶解度随温度的变化规律与______(填“甲”、“乙”或“丙”)相似。
(5)25℃时,甲物质中的溶解度为______g(答案保留一位小数)。
三、实验题
16.根据如图所示实验装置,回答问题。
(1)图1实验中,实验前先通入CO的目的是_______,该反应的化学方程式为_______。
(2)图2实验可用于研究CO2与NaOH溶液的反应。关闭弹簧夹K,将NaOH溶液全部挤入烧瓶,振荡;然后打开弹簧夹K,你预测可观察到的现象是_______。
(3)图3实验中,若要除去粗盐中难溶性的杂质,⑤中_______时停止加热,若按照②③①的步骤配制50g16%的氯化钠溶液,所配制溶液的溶质质量分数_______(填“偏大”或“偏小”)。
四、推断题
17.A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
(1)若A为气体氧化物,与溶液甲和溶液乙反应均生成盐和水.则A的化学式为______;取溶液D少量于试管中,加入碳酸钠溶液,有白色沉淀生成,则溶液D中溶质为______(写化学式);③反应的化学方程式为______.
(2)若向一定质量的碳酸钠溶液中加入足量的氯化钙溶液,所得沉淀质量等于原碳酸钠溶液质量的,则原碳酸钠溶液中溶质的质量分数为______.
18.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
五、计算题
19.为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质。其原理是把蛋白质中的氮元素完全转化成氨气(化学式为NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4
现取该牛奶样品30 mL,用“盖尔达法”分解其中的蛋白质,产生的氨气用9.5 g溶质质量分数为4.9%的稀硫酸恰好完全吸收。计算并回答下列问题:
(1)产生氨气的质量是多少克?(计算结果精确到0.01 g,下同)
(2)30 mL牛奶中含氮元素的质量是多少克?
(3)下图是该牛奶包装标签的部分内容。已知牛奶中的蛋白质含氮元素的质量分数为16%,请你通过计算确定,该牛奶样品中蛋白质的含量是否达到了包装标签所标示的蛋白质的质量标准。
配料:鲜牛奶保质期:8个月 净含量:250 mL/盒 营养成分:(每100 mL) 钙≥0.11 g 脂肪≥3.30 g 蛋白质≥2.90 g
参考答案:
1.D 2.A 3.D 4.C 5.D 6.C 7.B 8.D 9.A 10.B 11.C 12.D
13. C 升温(或加溶剂) 冷却热饱和溶液(或降温结晶) A物质溶于水放热
14. 4.5 495.5 ③④②① 偏大 偏大 不变
15.(1)甲>乙>丙
(2)蒸发结晶
(3)饱和溶液
(4)丙
(5)42.9
16.(1) 将装置内空气排尽,防止发生爆炸
(2)气球胀大
(3) 蒸发皿中有大部分固体析出 偏大
17. CO2 NaOH、Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 53%
18. 75 a>b>c
19.(1)0.16 g
(2)0.13 g
(3)2.70 g<2.90 g,所以该牛奶未达到标签所标示的质量标准
