元素周期律和元素周期表_课件
图片预览











文档简介
课件46张PPT。第2节 元素周期律和元素周期表目标展示:
1.掌握元素周期律的实质。
2.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化。
3.了解元素周期表(长式)的结构。
4.理解原子结构与元素在元素周期表中的位置之间的关系。
5.了解ⅡA族、ⅤA族和过渡金属元素的某些性质和用途。基础内容展示:
一、元素周期律
1.原子序数
(1)概念:元素在___________中的序号。
(2)与构成原子微粒数间的关系
原子序数=________数=________数=______数
2.元素周期律的含义
元素的性质随着元素__________的递增而呈周期性变化的规律。元素周期表核内质子核外电子核电荷原子序数3.元素周期律的表现
随原子序数的递增:1~8由大到小+1到+7-4到-14.元素周期律的实质
元素性质的周期性变化是由_________________ 呈周期性变化的必然结果。原子核外电子排布[开放探究] 1.在分析H、O、C、N、Na、Al、F、S、Cl等元素化合价的基础上,探索:为什么有的元素既有正化合价又有负化合价,而有的元素只有正价而没有负价,又有的只有负价没有正价?同一元素的最高正价与最低负价在数值上有何关系?
提示: 金属元素在化学反应中只失电子而不能得电子,所以只有正价;非金属元素在反应中既可得电子也可失电子,所以既可显正价,亦可显负价;有的元素氧化能力很强(如氟)在反应中只能得电子,不能失电子,所以只显负价而没有正价。
同一种元素的最高正价和最低负价的绝对值之和等于8 。二、元素周期表
1.元素周期律与元素周期表的关系
元素周期表是___________的具体表现形式。
2.元素周期表的编排原则
(1)把原子____________的元素按原子序数递增 的顺序从左到右排成横行。
(2)把________________的元素按电子层数递增 的顺序从上到下排成纵行。元素周期律电子层数相同最外层电子数相同3.元素周期表的结构
(1)周期288181832长周期短周期周期序数=原子核外电子层数(2)族
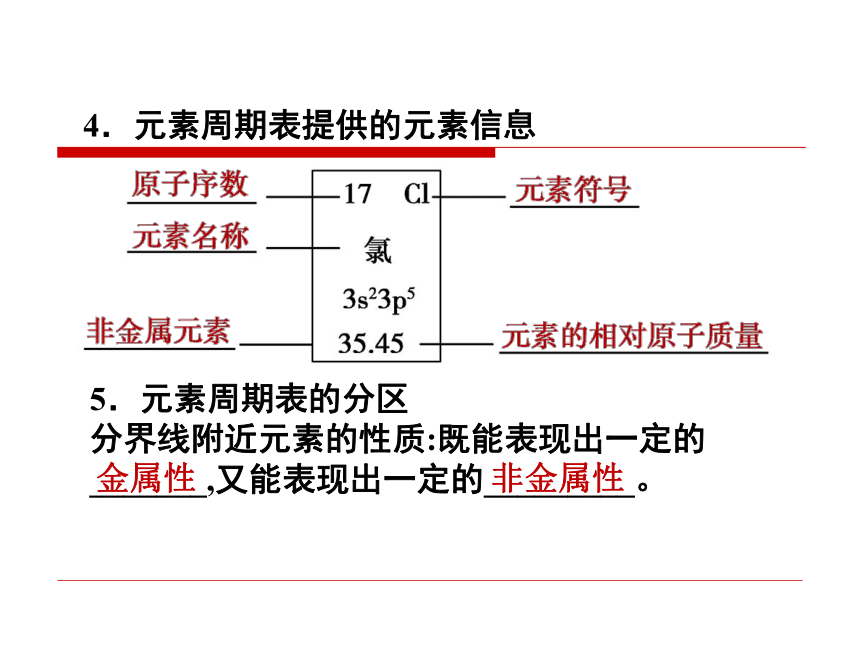
①元素周期表中共有18个纵列,16个族,包括 7个______,7个_____,1个_____,1个______。主族副族Ⅷ族零族②主族序数与原子结构的关系:主族序数= _________________。核外最外层电子数4.元素周期表提供的元素信息5.元素周期表的分区
分界线附近元素的性质:既能表现出一定的 _______,又能表现出一定的_________。金属性非金属性[开放探究] 2.元素周期表中所含元素种数最多的是哪一列?
提示: 第3列,第6周期第3列的镧系和第7周期第3列的锕系各包括15种元素 。三、周期表中的部分重要元素
1.ⅡA族元素(碱土金属元素)——国防金属
(1)包括:_______________________、锶(Sr)、 ______、镭(Ra)。
(2)物理共性:_____色,导电性,传热性,延展性。
(3)化学共性:R-2e-―→______。
(4)存在:在自然界中只以_____态存在。铍(Be)、镁(Mg)、钙(Ca)钡(Ba)亮白R2+化合2.ⅤA族元素
(1)包括:_____________________、锑(Sb)、铋 (Bi)。
(2)元素特点
从非金属元素逐渐过渡到金属元素,其中 _________为非金属元素,_______为金属元素。
(3)存在
在自然界中磷只以_____态存在,主要存在形式 为________,________被称为“生命元素”。氮(N)、磷(P)、砷(As)N、P、AsSb、Bi化合氮元素磷酸盐3.过渡元素
(1)包括元素周期表中第______列,全部是_____ 元素。
(2)大部分过渡元素的单质坚硬而有光泽,具有 良好的导电性,化学性质比较稳定,与空气和水 的反应缓慢或根本不反应。3~12金属[开放探究] 3.请结合元素周期表的结构推断,若ⅡA族某元素的原子序数为a,则同一周期ⅢA元素的原子序数为多少?
提示: (1)增加1(第二、三周期),如4Be―→5B,即a+1;
(2)增加11(第四、五周期),如38Sr―→49In,即a+11;
(3)增加25(第六、七周期),如56Ba―→81Tl,即a+25。 一、微粒半径大小的比较规律
1.一看电子层数
电子层数不同、最外层电子数相同时,电子层数越多,半径越大;如r(F)2.二看核电荷数
电子层数相同时,核电荷数越大,半径越小;如r(Na)>r(Mg)>r(Al)>r(S)>r(Cl),r(S2-)>r(Cl-)
>r(K+)>r(Ca2+)。
3.三看电子数
核电荷数相同时,电子数越多,半径越大;如r(Na+)r(Cl)。名师点拨: 解答此类题目应明确待比较微粒之间符合以下哪种关系:
(1)电子层结构相同的。
(2)电子层数相同的原子。
(3)最外层电子数相同的原子。
(4)同种元素的原子与离子或低价离子与高价离子。答案: B名师点睛: (1)比较微粒半径的解题思路
比较微粒半径时,首先要确定微粒间的相同点,即电子层数、核电荷数、核外电子排布是否相同,再利用规律进行比较,反之,亦可由微粒半径大小推断元素关系。
(2)具有相同电子层结构的微粒,比较其原子半径大小是各类考试的热点问题,应引起高度重
视。解析: 设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数为Z-n,则原子序数为A>C>B,A错;因An+、Bn-具有相同的电子层结构,阴离子半径大于阳离子半径,即r(Bn-)>r(An+),B项正确;An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构与An+、Bn-相同,所以C必为稀有气体元素的原子,故C正确;A应处于B、C的下一周期,根据同周期和同主族原子半径变化规律,A的原子半径应大于B,D项错误。
答案: BC二、元素化合价与最外层电子数的关系
随着原子序数的递增,元素的主要化合价呈现周期性变化(正价+1→+7,负价-4→-1)。
元素的主要化合价——最高正价和最低负价是由原子的最外层电子数决定的,它们与最外层电子数的关系为:
1.关系
主族元素最高正化合价=最外层电子数(O、F除外)
最低负化合价=最外层电子数-8(H除外)
|最高正化合价|+|最低负化合价|=82.元素化合价
(1)H元素的化合价有+1、-1、0价。
(2)F元素只有负价无正价。
(3)O元素常见化合价为-2、-1、0价。
(4)金属元素只有正价无负价。
(5)非金属元素既有正价又有负价(F除外)。答案: (1)+5 (2)7 (3)S2->Y-名师点睛: 当同一元素既已知正化合价又已知负化合价时如何确定元素原子的最外层电子呢?
(1)先判断正化合价是否为最高化合价,负化合价是否为最低负价;(2)利用“最高正价=原子最外层电子数(主族),|最低负价|=8-原子最外层电子数(H除外)”确定原子最外层电子数;(3)气态氢化物及单核阴离子中元素为最低负化合价;(4)主族元素的单核阳离子中元素为最高价。 2.某元素R的最高价氧化物的水化物是HnRO2n-2,则在气态氢化物中R元素的化合价是( )
A.3n-10 B.12-3n
C.3n-4 D.3n-12
解析: R的氧化物中R显正价,氢化物中R显负价。设R的最高正价为+x,由化合物中正负化合价代数和为0,有(+1)·n+x+(-2)·(2n-2)=0,解得x=3n-4。R元素的最高正价+|最低负价|=8,所以氢化物中R的化合价为-[8-(3n-4)]=-[12-3n]=3n-12。
答案: D三、原子序数及元素在元素周期表中位置的确定
1.零族元素原子序数定位法
(1)零族元素原子序数的确定(2)依据零族元素原子序数及元素周期表的结构可将已知原子序数的元素确定其在周期表中的位置;反之,已知元素在周期表中的位置可确定元素原子序数。2.由位置推导原子序数
(1)同周期(2)同族
若A、B为同主族元素,A所在周期有m种元素,B所在周期有n种元素,A在B的上一周期,设A的原子序数为a。
①若A、B为ⅠA族或ⅡA族(位于过渡元素左边的元素),则B的原子序数为(a+m)。
②若A、B为ⅢA~ⅦA族(位于过渡元素右边的元素),则B的原子序数为(a+n)。3.根据离子的电子层结构推导元素在周期表中的位置如:若A-与氖原子具有相同的电子层结构,A元素必和氖在同一周期,且比氖少一个电子,则A元素位于第2周期ⅦA族,名称为氟。某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素
B.它是第6周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子 核外电子数等于其质子数,C项正确;该元素的质子数为63,比第5周期零族54号元素原子序数大9,应在第6周期从左到右第9种元素,而第6周期第3纵行包含15种镧系元素,故该元素为ⅢB族,故A、B项均正确;由于存在同位素,所以其相对原子质量应是同位素的平均值,而不代表其中一种元素的质量数,故中子数不能用152-63=89来计算,D项错。答案: D解析: B、A所在周期相邻,A、B最多可排18和8种元素,所以B为第3周期,A为第4周期,A、B为第ⅤA族元素,其原子序数差18。
答案: A1.元素的性质呈周期性变化的根本原因是( )
A.相对原子质量递增,量变引起质变
B.原子半径呈周期性变化
C.原子核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化
解析: 元素的性质呈周期性变化的根本原因是原子核外电子排布呈周期性变化,其他周期性变化都是由它引起的。
答案: C2.(2011·济南高一质检)关于元素周期表的下列叙述错误的是( )
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.在元素周期表中,把电子层数相同的元素排成一横行,称为一周期
C.在元素周期表中,总共有18个纵列,18个族
D.第 Ⅰ A族的元素又称为碱金属元素(除了H),第ⅦA族的元素又称为卤族元素
解析: 周期表共有18个纵列,16个族,其中Ⅷ族包括8、9、10三列。
答案: C3.下列各组元素性质的递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的电子层数逐渐增多
解析: 根据元素周期律可知,随原子序数的递增,原子结构、原子半径、元素的化合价、元素的金属性和非金属性都呈现周期性的变化,A、B、D选项均正确,C选项中原子半径应是依次减小。
答案: C4.M2+有2个电子层,则M在元素周期表中的位置是( )
A.第2周期零族 B.第2周期Ⅷ族
C.第2周期Ⅱ A 族 D.第3周期Ⅱ A 族答案: D5.已知下列元素的原子半径:根据以上数据判断,磷原子的半径可能是( )
A.1.10×10-10 m B.0.80×10-10 m
C.0.70×10-10 m D.1.20×10-10 m答案: A6.A、B、C均为短周期元素,在周期表中所处的位置如右图所示,已知A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B、C三种元素的名称:
A________;B______;C_______。
(2)B元素位于周期表第_______周期_____族。
(3)C原子的结构示意图为________。解析: 由A、B、C均为短周期元素及A、B、C的相对位置,可知A、C位于第2周期,B位于第3周期,设B元素的质子数为b,则A、C原子的核外电子数分别为b-9,b-7。
依题意b-9+b-7=b,解之得b=16。
因此元素B是硫,则A是氮,C是氟。
1.掌握元素周期律的实质。
2.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化。
3.了解元素周期表(长式)的结构。
4.理解原子结构与元素在元素周期表中的位置之间的关系。
5.了解ⅡA族、ⅤA族和过渡金属元素的某些性质和用途。基础内容展示:
一、元素周期律
1.原子序数
(1)概念:元素在___________中的序号。
(2)与构成原子微粒数间的关系
原子序数=________数=________数=______数
2.元素周期律的含义
元素的性质随着元素__________的递增而呈周期性变化的规律。元素周期表核内质子核外电子核电荷原子序数3.元素周期律的表现
随原子序数的递增:1~8由大到小+1到+7-4到-14.元素周期律的实质
元素性质的周期性变化是由_________________ 呈周期性变化的必然结果。原子核外电子排布[开放探究] 1.在分析H、O、C、N、Na、Al、F、S、Cl等元素化合价的基础上,探索:为什么有的元素既有正化合价又有负化合价,而有的元素只有正价而没有负价,又有的只有负价没有正价?同一元素的最高正价与最低负价在数值上有何关系?
提示: 金属元素在化学反应中只失电子而不能得电子,所以只有正价;非金属元素在反应中既可得电子也可失电子,所以既可显正价,亦可显负价;有的元素氧化能力很强(如氟)在反应中只能得电子,不能失电子,所以只显负价而没有正价。
同一种元素的最高正价和最低负价的绝对值之和等于8 。二、元素周期表
1.元素周期律与元素周期表的关系
元素周期表是___________的具体表现形式。
2.元素周期表的编排原则
(1)把原子____________的元素按原子序数递增 的顺序从左到右排成横行。
(2)把________________的元素按电子层数递增 的顺序从上到下排成纵行。元素周期律电子层数相同最外层电子数相同3.元素周期表的结构
(1)周期288181832长周期短周期周期序数=原子核外电子层数(2)族
①元素周期表中共有18个纵列,16个族,包括 7个______,7个_____,1个_____,1个______。主族副族Ⅷ族零族②主族序数与原子结构的关系:主族序数= _________________。核外最外层电子数4.元素周期表提供的元素信息5.元素周期表的分区
分界线附近元素的性质:既能表现出一定的 _______,又能表现出一定的_________。金属性非金属性[开放探究] 2.元素周期表中所含元素种数最多的是哪一列?
提示: 第3列,第6周期第3列的镧系和第7周期第3列的锕系各包括15种元素 。三、周期表中的部分重要元素
1.ⅡA族元素(碱土金属元素)——国防金属
(1)包括:_______________________、锶(Sr)、 ______、镭(Ra)。
(2)物理共性:_____色,导电性,传热性,延展性。
(3)化学共性:R-2e-―→______。
(4)存在:在自然界中只以_____态存在。铍(Be)、镁(Mg)、钙(Ca)钡(Ba)亮白R2+化合2.ⅤA族元素
(1)包括:_____________________、锑(Sb)、铋 (Bi)。
(2)元素特点
从非金属元素逐渐过渡到金属元素,其中 _________为非金属元素,_______为金属元素。
(3)存在
在自然界中磷只以_____态存在,主要存在形式 为________,________被称为“生命元素”。氮(N)、磷(P)、砷(As)N、P、AsSb、Bi化合氮元素磷酸盐3.过渡元素
(1)包括元素周期表中第______列,全部是_____ 元素。
(2)大部分过渡元素的单质坚硬而有光泽,具有 良好的导电性,化学性质比较稳定,与空气和水 的反应缓慢或根本不反应。3~12金属[开放探究] 3.请结合元素周期表的结构推断,若ⅡA族某元素的原子序数为a,则同一周期ⅢA元素的原子序数为多少?
提示: (1)增加1(第二、三周期),如4Be―→5B,即a+1;
(2)增加11(第四、五周期),如38Sr―→49In,即a+11;
(3)增加25(第六、七周期),如56Ba―→81Tl,即a+25。 一、微粒半径大小的比较规律
1.一看电子层数
电子层数不同、最外层电子数相同时,电子层数越多,半径越大;如r(F)
电子层数相同时,核电荷数越大,半径越小;如r(Na)>r(Mg)>r(Al)>r(S)>r(Cl),r(S2-)>r(Cl-)
>r(K+)>r(Ca2+)。
3.三看电子数
核电荷数相同时,电子数越多,半径越大;如r(Na+)
(1)电子层结构相同的。
(2)电子层数相同的原子。
(3)最外层电子数相同的原子。
(4)同种元素的原子与离子或低价离子与高价离子。答案: B名师点睛: (1)比较微粒半径的解题思路
比较微粒半径时,首先要确定微粒间的相同点,即电子层数、核电荷数、核外电子排布是否相同,再利用规律进行比较,反之,亦可由微粒半径大小推断元素关系。
(2)具有相同电子层结构的微粒,比较其原子半径大小是各类考试的热点问题,应引起高度重
视。解析: 设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数为Z-n,则原子序数为A>C>B,A错;因An+、Bn-具有相同的电子层结构,阴离子半径大于阳离子半径,即r(Bn-)>r(An+),B项正确;An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构与An+、Bn-相同,所以C必为稀有气体元素的原子,故C正确;A应处于B、C的下一周期,根据同周期和同主族原子半径变化规律,A的原子半径应大于B,D项错误。
答案: BC二、元素化合价与最外层电子数的关系
随着原子序数的递增,元素的主要化合价呈现周期性变化(正价+1→+7,负价-4→-1)。
元素的主要化合价——最高正价和最低负价是由原子的最外层电子数决定的,它们与最外层电子数的关系为:
1.关系
主族元素最高正化合价=最外层电子数(O、F除外)
最低负化合价=最外层电子数-8(H除外)
|最高正化合价|+|最低负化合价|=82.元素化合价
(1)H元素的化合价有+1、-1、0价。
(2)F元素只有负价无正价。
(3)O元素常见化合价为-2、-1、0价。
(4)金属元素只有正价无负价。
(5)非金属元素既有正价又有负价(F除外)。答案: (1)+5 (2)7 (3)S2->Y-名师点睛: 当同一元素既已知正化合价又已知负化合价时如何确定元素原子的最外层电子呢?
(1)先判断正化合价是否为最高化合价,负化合价是否为最低负价;(2)利用“最高正价=原子最外层电子数(主族),|最低负价|=8-原子最外层电子数(H除外)”确定原子最外层电子数;(3)气态氢化物及单核阴离子中元素为最低负化合价;(4)主族元素的单核阳离子中元素为最高价。 2.某元素R的最高价氧化物的水化物是HnRO2n-2,则在气态氢化物中R元素的化合价是( )
A.3n-10 B.12-3n
C.3n-4 D.3n-12
解析: R的氧化物中R显正价,氢化物中R显负价。设R的最高正价为+x,由化合物中正负化合价代数和为0,有(+1)·n+x+(-2)·(2n-2)=0,解得x=3n-4。R元素的最高正价+|最低负价|=8,所以氢化物中R的化合价为-[8-(3n-4)]=-[12-3n]=3n-12。
答案: D三、原子序数及元素在元素周期表中位置的确定
1.零族元素原子序数定位法
(1)零族元素原子序数的确定(2)依据零族元素原子序数及元素周期表的结构可将已知原子序数的元素确定其在周期表中的位置;反之,已知元素在周期表中的位置可确定元素原子序数。2.由位置推导原子序数
(1)同周期(2)同族
若A、B为同主族元素,A所在周期有m种元素,B所在周期有n种元素,A在B的上一周期,设A的原子序数为a。
①若A、B为ⅠA族或ⅡA族(位于过渡元素左边的元素),则B的原子序数为(a+m)。
②若A、B为ⅢA~ⅦA族(位于过渡元素右边的元素),则B的原子序数为(a+n)。3.根据离子的电子层结构推导元素在周期表中的位置如:若A-与氖原子具有相同的电子层结构,A元素必和氖在同一周期,且比氖少一个电子,则A元素位于第2周期ⅦA族,名称为氟。某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素
B.它是第6周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子 核外电子数等于其质子数,C项正确;该元素的质子数为63,比第5周期零族54号元素原子序数大9,应在第6周期从左到右第9种元素,而第6周期第3纵行包含15种镧系元素,故该元素为ⅢB族,故A、B项均正确;由于存在同位素,所以其相对原子质量应是同位素的平均值,而不代表其中一种元素的质量数,故中子数不能用152-63=89来计算,D项错。答案: D解析: B、A所在周期相邻,A、B最多可排18和8种元素,所以B为第3周期,A为第4周期,A、B为第ⅤA族元素,其原子序数差18。
答案: A1.元素的性质呈周期性变化的根本原因是( )
A.相对原子质量递增,量变引起质变
B.原子半径呈周期性变化
C.原子核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化
解析: 元素的性质呈周期性变化的根本原因是原子核外电子排布呈周期性变化,其他周期性变化都是由它引起的。
答案: C2.(2011·济南高一质检)关于元素周期表的下列叙述错误的是( )
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.在元素周期表中,把电子层数相同的元素排成一横行,称为一周期
C.在元素周期表中,总共有18个纵列,18个族
D.第 Ⅰ A族的元素又称为碱金属元素(除了H),第ⅦA族的元素又称为卤族元素
解析: 周期表共有18个纵列,16个族,其中Ⅷ族包括8、9、10三列。
答案: C3.下列各组元素性质的递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的电子层数逐渐增多
解析: 根据元素周期律可知,随原子序数的递增,原子结构、原子半径、元素的化合价、元素的金属性和非金属性都呈现周期性的变化,A、B、D选项均正确,C选项中原子半径应是依次减小。
答案: C4.M2+有2个电子层,则M在元素周期表中的位置是( )
A.第2周期零族 B.第2周期Ⅷ族
C.第2周期Ⅱ A 族 D.第3周期Ⅱ A 族答案: D5.已知下列元素的原子半径:根据以上数据判断,磷原子的半径可能是( )
A.1.10×10-10 m B.0.80×10-10 m
C.0.70×10-10 m D.1.20×10-10 m答案: A6.A、B、C均为短周期元素,在周期表中所处的位置如右图所示,已知A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B、C三种元素的名称:
A________;B______;C_______。
(2)B元素位于周期表第_______周期_____族。
(3)C原子的结构示意图为________。解析: 由A、B、C均为短周期元素及A、B、C的相对位置,可知A、C位于第2周期,B位于第3周期,设B元素的质子数为b,则A、C原子的核外电子数分别为b-9,b-7。
依题意b-9+b-7=b,解之得b=16。
因此元素B是硫,则A是氮,C是氟。
