元素周期表的应用_课件
图片预览




文档简介
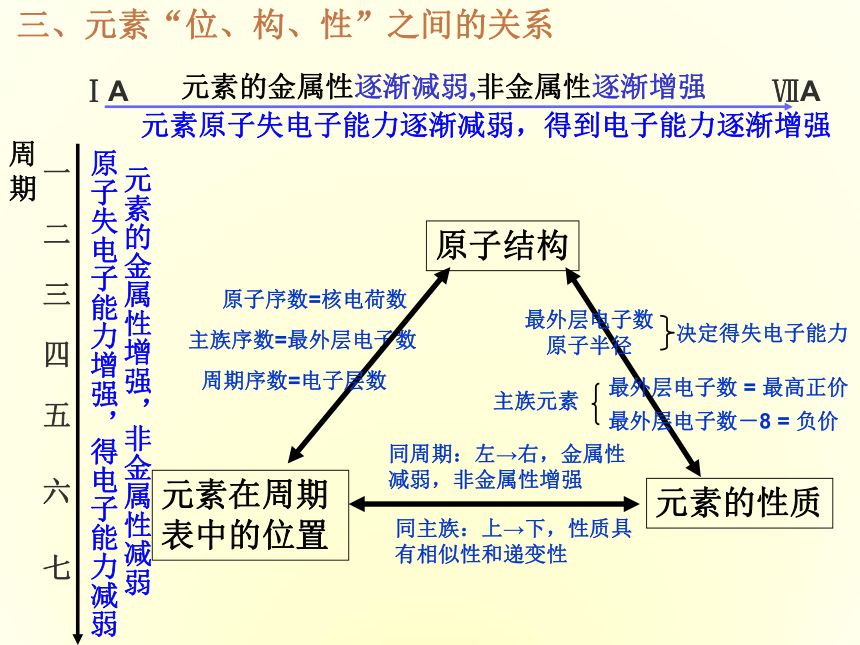
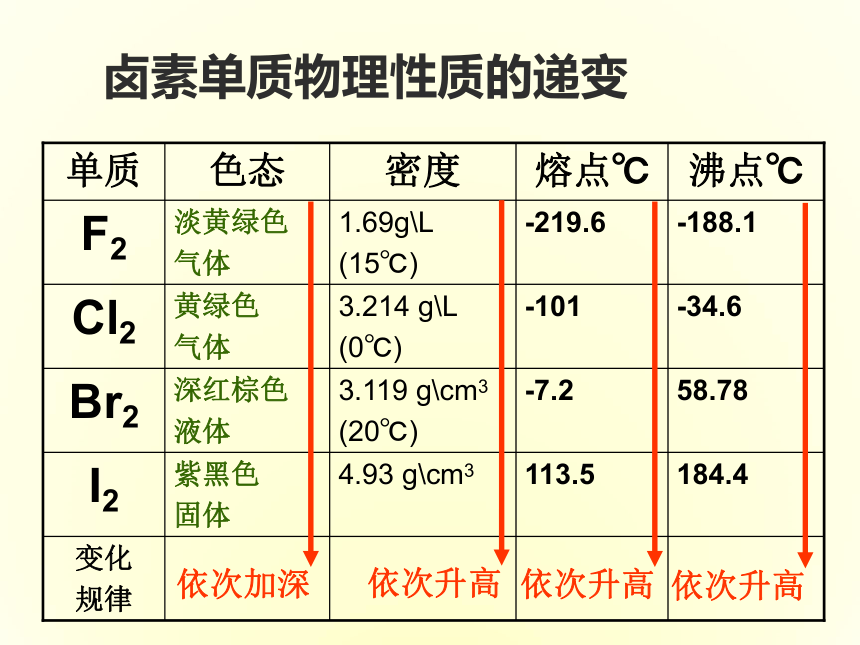
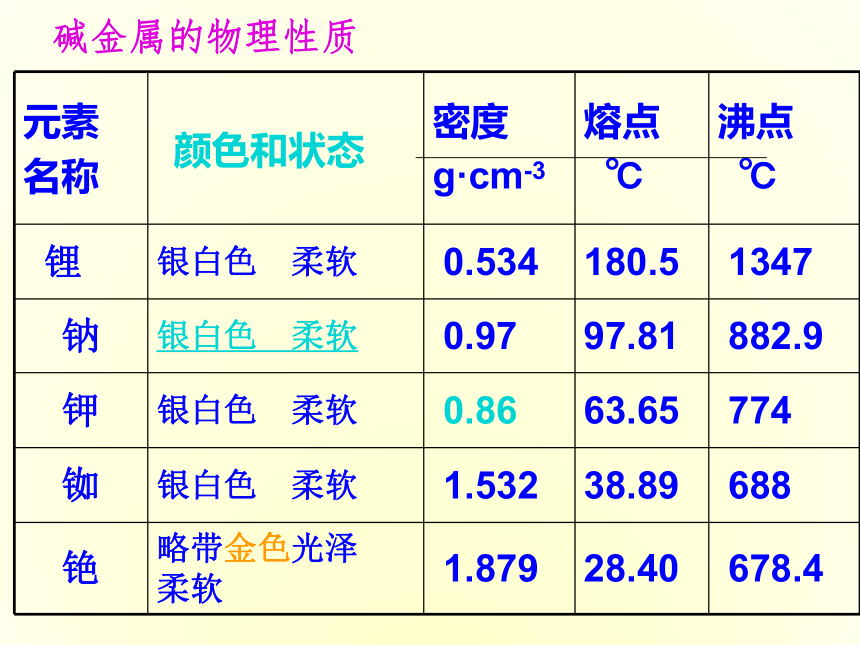
课件16张PPT。第三节元素周期表的应用ⅠA ⅦA元素的金属性逐渐减弱,非金属性逐渐增强元素原子失电子能力逐渐减弱,得到电子能力逐渐增强元素的金属性增强,非金属性减弱原子失电子能力增强,得电子能力减弱一 二 三 四 五 六 七周期主族序数=最外层电子数周期序数=电子层数最外层电子数原子半径 决定得失电子能力同周期:左→右,金属性减弱,非金属性增强 同主族:上→下,性质具有相似性和递变性 原子序数=核电荷数最外层电子数-8 = 负价最外层电子数 = 最高正价主族元素三、元素“位、构、性”之间的关系 卤素单质物理性质的递变碱金属的物理性质颜色和状态颜色和状态增大趁势(钾除外)逐渐减小逐渐减小练习1 第117号元素,在周期表中位于第七周期ⅦA族,下列关于117号元素性质的预测错误的是 ( )
A.单质在常温下是一种固体
B. 单质易溶于某些有机溶剂
C.比碘得电子能力强
D. 可能是金属C-----由位置推性质练习2-------由结构定位置 某种离子X2+的电子层结构为:
与此有关的叙述正确的是( )
A .第ⅣA族 B. 第ⅤA族
C. 第二周期 D. 第三周期A随堂练习1.第四周期某主族元素的原子,它的最外电子层上有2个电子,下列关于此元素的叙述正确的是( )
A.原子半径比钾的原子半径大
B.氯化物难溶于水
C.原子半径比镁的原子半径大
D.碳酸盐难溶于水C D2 . 下列各组中的性质比较正确的是( )
A.稳定性:NH3<PH3 < SiH4
B.酸性:HClO4 >H2SO4 > H3PO4
C.碱性:KOH < NaOH < Mg(OH)2
D.还原性:F- > Cl- > Br-B 3.下列氧化物按其形成的含氧酸酸性递增的顺序排列的是( )
A.SiO2 < CO2 < SO3 < P2O5
B.SiO2 < CO2 < P2O5 < SO3
C. CO2 < SiO2 < P2O5 < SO3
D. CO2 < P2O5 < SO3< SiO2B4.砹是原子序数最大的卤族元素,推测砹和砹的化合物不可能具有的性质是( )
A.砹是有色固体
B.砹易溶于有机溶剂
C.砹化氢很稳定
D.砹化银不溶于水C5.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是( )?
A.铍的原子半径大于硼的原子半径?
B.氯化铍化学式中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱?
D.单质铍跟冷水反应产生氢气? AC 6. 铊是超导材料的组成元素之一,铊在周期表中位于第六周期Ⅲ A,以下对铊 ( Tl )的性质的推断中不正确的是 ( )
A 铊是易导电的银白色金属
B 能生成+3价的离子
C 氢氧化铊是两性氢氧化物
D Tl3+的氧化性比Al3 + 弱C
7.由A、B两种元素组成的化合物,如果A、B两种元素的原子最外层电子数分别是1和6,则化合物的化学式可能是( )
A. AB2 B.A2B
C. AB D.A2B2BD四、元素周期表的重要意义元素周期律和元素周期表的诞生是19世纪化学科学的重大成就之一,具有重要的哲学意义、自然科学意义和实际应用价值。请你根据教材第24页资料,将下表中A、B两栏描述的内容对应起来。(c)(e)(a)(b)(d)下表为元素周期表的一部分,请回答有关问题:(1)⑤和⑧的元素符号是???????? 和? ????????????;
(2)表中最活泼的金属是??????????? ,非金属最强的元素是????? ?????? ;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是???? ???????,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:
???????????? ??????????????? ,???????????????????????????????????? ;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:?????? ???????????????????????????????????????????????????????????????? 。SiArKF铝(或Al)2Al(OH)3 + 3H2SO4=Al2(SO4)3 + 6H2OAl(OH)3+KOH=K[Al(OH)4]在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色)
A.单质在常温下是一种固体
B. 单质易溶于某些有机溶剂
C.比碘得电子能力强
D. 可能是金属C-----由位置推性质练习2-------由结构定位置 某种离子X2+的电子层结构为:
与此有关的叙述正确的是( )
A .第ⅣA族 B. 第ⅤA族
C. 第二周期 D. 第三周期A随堂练习1.第四周期某主族元素的原子,它的最外电子层上有2个电子,下列关于此元素的叙述正确的是( )
A.原子半径比钾的原子半径大
B.氯化物难溶于水
C.原子半径比镁的原子半径大
D.碳酸盐难溶于水C D2 . 下列各组中的性质比较正确的是( )
A.稳定性:NH3<PH3 < SiH4
B.酸性:HClO4 >H2SO4 > H3PO4
C.碱性:KOH < NaOH < Mg(OH)2
D.还原性:F- > Cl- > Br-B 3.下列氧化物按其形成的含氧酸酸性递增的顺序排列的是( )
A.SiO2 < CO2 < SO3 < P2O5
B.SiO2 < CO2 < P2O5 < SO3
C. CO2 < SiO2 < P2O5 < SO3
D. CO2 < P2O5 < SO3< SiO2B4.砹是原子序数最大的卤族元素,推测砹和砹的化合物不可能具有的性质是( )
A.砹是有色固体
B.砹易溶于有机溶剂
C.砹化氢很稳定
D.砹化银不溶于水C5.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是( )?
A.铍的原子半径大于硼的原子半径?
B.氯化铍化学式中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱?
D.单质铍跟冷水反应产生氢气? AC 6. 铊是超导材料的组成元素之一,铊在周期表中位于第六周期Ⅲ A,以下对铊 ( Tl )的性质的推断中不正确的是 ( )
A 铊是易导电的银白色金属
B 能生成+3价的离子
C 氢氧化铊是两性氢氧化物
D Tl3+的氧化性比Al3 + 弱C
7.由A、B两种元素组成的化合物,如果A、B两种元素的原子最外层电子数分别是1和6,则化合物的化学式可能是( )
A. AB2 B.A2B
C. AB D.A2B2BD四、元素周期表的重要意义元素周期律和元素周期表的诞生是19世纪化学科学的重大成就之一,具有重要的哲学意义、自然科学意义和实际应用价值。请你根据教材第24页资料,将下表中A、B两栏描述的内容对应起来。(c)(e)(a)(b)(d)下表为元素周期表的一部分,请回答有关问题:(1)⑤和⑧的元素符号是???????? 和? ????????????;
(2)表中最活泼的金属是??????????? ,非金属最强的元素是????? ?????? ;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是???? ???????,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:
???????????? ??????????????? ,???????????????????????????????????? ;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:?????? ???????????????????????????????????????????????????????????????? 。SiArKF铝(或Al)2Al(OH)3 + 3H2SO4=Al2(SO4)3 + 6H2OAl(OH)3+KOH=K[Al(OH)4]在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色)
