期末题型专练——有关化学方程式的计算(含解析)
文档属性
| 名称 | 期末题型专练——有关化学方程式的计算(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 49.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-20 11:37:41 | ||
图片预览




文档简介
期末题型专练——有关化学方程式的计算—2022-2023学年浙教版科学八年级下册
1.(2022春 温州期末)常见的制氧剂有氯酸钠(NaC1O3)过氧化钙(CaO2)和超氧化钾(KO2)等,这些制氧剂在一定条件下都可用来制取氧气,其反应原理分别为:2NaClO32NaCl+3O2↑,2CaO2+2H2O═Ca(OH)2+O2↑,4KO2+2H2O═KOH+3O2↑。
(1)以上三种制氧剂中属于氧化物的有 。
(2)3.6克过氧化钙(CaO2)中含氧元素的质量为 克。
(3)若要制取相等质量的氧气.需要氯酸钠和超氧化钾的质量比为 。
2.(2022春 柯桥区期末)实验室通常用化学方法制取氧气,某同学取质量为m的高锰酸钾固体加热,记录产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题:
(1)t0﹣t1时段氧气的质量未增加,其原因可能是t0﹣t1时段 ;
(2)请根据图中数据计算高锰酸钾的质量m为多少?(写出计算过程)
3.(2022春 钱塘区期末)某品牌钙片的部分信息:①钙片主要成分为碳酸钙;②每片钙片质量为1克。小应用该品牌钙片做了如下实验:把100克稀盐酸分成五等份,分次将稀盐酸添加到放有5片钙片的烧杯中,充分反应(钙片中其它成分不溶于水且不与盐酸反应)。得到的实验数据见下表。
实验次数 1 2 3 4 5
加入稀盐酸的质量/克 20 20 20 20 20
剩余固体的质量/克 4.0 3.0 2.0 1.1 1.1
回答下列问题:
(1)5片钙片中所含碳酸钙的总质量为 克。
(2)计算该实验中所用稀盐酸的溶质质量分数。(写出计算过程)
4.(2021春 萧山区期末)一定质量的氯酸钾(KClO3)中加入3.75克二氧化锰(MnO2),充分混合加热,如图为加热过程中氧气质量随时间变化的曲线,根据图象分析并计算。
(1)反应前后混合物的总质量减少 克。
(2)原混合物中氯酸钾占整个混合物的质量分数。(写出计算过程)
5.(2022春 西湖区期末)为测定某钟乳石样品中碳酸钙的质量分数,取50克钟乳石样品放在烧杯中,然后向其中逐渐加入稀盐酸,使之与样品充分反应(杂质不参加反应),加入稀盐酸的质量与生成气体的质量关系如图所示。请回答:
(1)分析图中数据可知,产生二氧化碳气体的质量是 克;
(2)求钟乳石样品中碳酸钙的质量分数;
(3)若杂质中含有碳酸镁,按上述方法测得钟乳石样品中碳酸钙的质量分数会 (填“偏大”“偏小”或“不变”)。(碳酸镁与稀盐酸的反应方程式为MgCO3+2HCl═MgCl2+H2O+CO2↑)
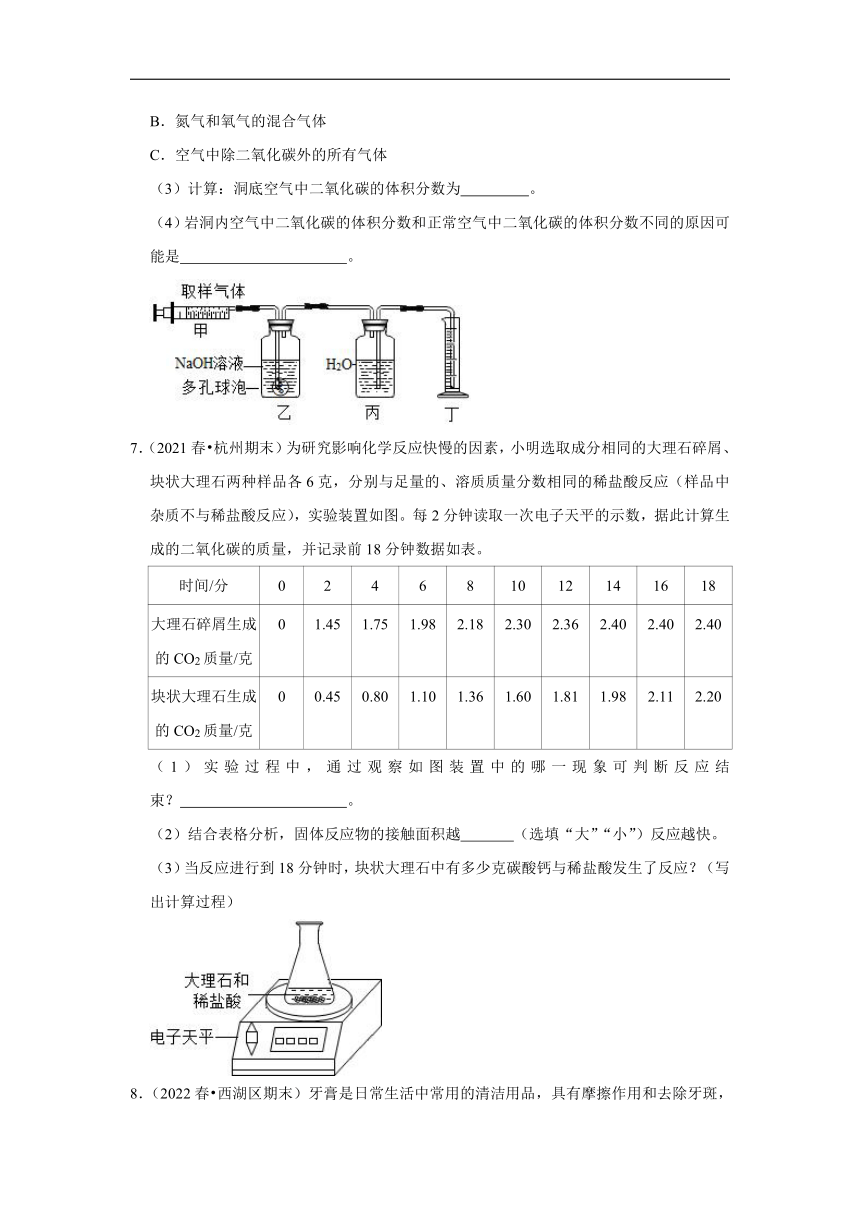
6.(2022春 杭州期末)某校课外活动小组,欲测定一待旅游开发的岩洞内空气中二氧化碳的体积分数(假设洞内空气中不含除二氧化碳外的其他酸性气体)。进行了如图实验:
(1)取样。他们准备从岩洞的底部取样,请你设计用广口瓶从洞中取回一瓶空气样品的方法: 。
(2)测定用150mL的注射器从广口瓶中抽取100mL气样,按如图所示的装置进行实验;若乙装置中NaOH溶液能吸收二氧化碳气体,且实验结束后,量筒内水的体积为99mL,此数据是 的体积数(用序号填写)。
A.二氧化碳
B.氮气和氧气的混合气体
C.空气中除二氧化碳外的所有气体
(3)计算:洞底空气中二氧化碳的体积分数为 。
(4)岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同的原因可能是 。
7.(2021春 杭州期末)为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如表。
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 。
(2)结合表格分析,固体反应物的接触面积越 (选填“大”“小”)反应越快。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
8.(2022春 西湖区期末)牙膏是日常生活中常用的清洁用品,具有摩擦作用和去除牙斑,摩擦剂是其主要成分,为了测定一种以碳酸钙为摩擦剂的牙膏中碳酸钙的含量。某小组称取这种牙膏100克放入烧杯中,向其中逐渐加稀盐酸至不再有气体放出(除碳酸钙外,这种牙膏中的其他成分不与盐酸发生反应),共用去盐酸150克,反应完毕后称得烧杯内物质的总质量为228克,请计算:
(1)上述实验中共生成二氧化碳 g。
(2)100克牙膏膏体中碳酸钙质量分数为多少?(列式计算)
9.(2021春 仙居县期末)石头纸是一种介于纸张和塑料之间的环保新型材料,主要成分为碳酸钙。为测定其中碳酸钙的含量,课外活动小组的同学进行了实验,实验数据见表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯① 烧杯② 烧杯③ 烧杯④ 烧杯⑤
加入样品的质量/g 10 10 10 10 10
加入稀盐酸的质量/g 10 20 30 40 50
充分反应后生成气体的质量/g 0.88 1.76 2.64 3.08 3.08
(1)根据表中的实验数据可知,烧杯④样品中的碳酸钙全部参加了反应,则10克样品完全反应生成二氧化碳的质量为 克。
(2)求样品中碳酸钙的质量分数。(需写出计算过程)
10.(2021春 上虞区期末)实验室用加热氯酸钾与0.3g二氧化锰混合物制取氧气,加热前称得混合物总质量为24.8g,加热一段时间后,称得剩余固体质量为20.0g,试回答下列问题。
(1)反应产生氧气的质量为 g。
(2)计算反应后剩余固体中氯化钾的质量?
(3)剩余固体中钾元素质量分数是多少?
期末题型专练——有关化学方程式的计算—2022-2023学年浙教版科学八年级下册
参考答案与试题解析
一.试题(共10小题)
1.【解答】(1)两种元素组成,一种为氧元素的化合物为氧化物,据此可知三个反应中属于氧化物的有:KO2、CaO2共计2种;
(2)3.6克过氧化钙(CaO2)中含氧元素的质量为3.6g100%=1.6g;
(3)根据方程式可知反应关系:2NaClO3~3O2,4KO2~3O2,据此可知:若要制取相等质量的氧气,需要氯酸钠和超氧化钾的质量比为2×(23+35.5+16×3):4×(39+16×2)=213:284。
故答案是:
(1)KO2、CaO2;
(2)1.6
(3)213:284。
2.【解答】解:(1)根据图中信息可知:t0﹣t1固体质量不变,是因为反应还未进行,高锰酸钾还未分解;
(2)由图象可知该反应生成的氧气质量是3.2g;
2KMnO4K2MnO4+MnO2+O2↑
316 32
m 3.2g
解得:m=31.6g
答:高锰酸钾的质量m为31.6g。
故答案为:(1)因为反应还未进行,高锰酸钾还未分解;
(2)31.6g。
3.【解答】解:(1)5片钙片中所含碳酸钙的总质量为:5g﹣1.1g=3.9g;
(2)设20g稀盐酸中氯化氢质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73
1g x
x=0.73g
该实验中所用稀盐酸的溶质质量分数是:100%=3.65%
答:该实验中所用稀盐酸的溶质质量分数是3.65%。
故答案为:(1)3.9;
(2)3.65%。
4.【解答】解:(1)由图象可知,氯酸钾完全分解生成氧气的质量是4.8g,反应前后混合物的总质量减少4.8克。
(2)设氯酸钾的质量为x,
2KClO32KCl+3O2↑
245 96
x 4.8g
解得:x=12.25g
原混合物中氯酸钾占整个混合物的质量分数是:76.6%。
答:原混合物中氯酸钾占整个混合物的质量分数水76.6%。
故答案为:(1)4.8。
(2)76.6%。
5.【解答】解:(1)由图可以看出生成的二氧化碳的质量为11g,故填:11。
(2)设样品中碳酸钙的质量分数为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
50g x 11g
x=50%
答:样品中碳酸钙的质量分数为50%。
(3)若杂质中含有碳酸镁,也会与盐酸反应生成二氧化碳,生成的二氧化碳都计入碳酸钙生成的二氧化碳中,所得碳酸钙的质量偏大,按上述方法测得钟乳石样品中碳酸钙的质量分数会偏大,故填:偏大。
6.【解答】解:(1)为了防止把洞外的气体带到洞中,必须先将广口瓶装满水,盖上玻璃片后带进洞中,将水倒掉,因为二氧化碳能溶于水,为了减少实验误差,必须要将广口瓶内残留的水分擦干,然后再盖上玻璃片,即可;故填:将广口瓶装满水,盖上玻璃片,带进洞中,将水倒掉,擦干瓶内,盖上玻璃片即可;
(2)氢氧化钠是为了吸收气体中的CO2剩下的气体进入装置丙中,排水法收集,排开的水进入量筒内,所以量筒内的水相当于是空气中除CO2外的所有气体体积;故填:C;
(3)洞底空气中CO2的体积分数为1%;故填:1%;
(4)岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳,所以岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同;故填:岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳。
7.【解答】解:(1)分析表格中的数据可知大理石碎屑生成的CO2质量在14分钟时为2.40g,16分钟时也是2.40g,18分钟时也为2.40g,说明在14分钟后反应已完成;故填:大理石碎屑生成的CO2质量在14分钟后不再变化;
(2)对比分析大理石碎屑生成的CO2质量随时间的变化情况和块状大理石生成的CO2质量随时间的变化情况可知相同时间内大理石碎屑生成的CO2质量比块状大理石生成的CO2质量多,并且14分钟后大理石碎屑就反应完了,而块状大理石在18分钟时还没有反应完,所以,固体反应物的接触面积越大反应速率越快,故填:大;
(3)分析表中数据可知18分钟时块状大理石生成二氧化碳的质量为2.20g,
设:反应进行到18分钟时,块状大理石中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.20g
x=5.00g
答:反应进行到18分钟时,块状大理石中碳酸钙的质量为5.00g。
8.【解答】解:(1)上述实验中共生成二氧化碳的质量为100g+150g﹣228g=22g。
故答案为:22。
(2)设100克牙膏膏体中碳酸钙质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 22g
x=50g
100克牙膏膏体中碳酸钙质量分数为100%=50%。
答:100克牙膏膏体中碳酸钙质量分数为50%。
9.【解答】解:(1)根据表中的实验数据可知,烧杯④样品中的碳酸钙全部参加了反应,则10克样品完全反应生成二氧化碳的质量为3.08克。
故填:3.08。
(2)设碳酸钙质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 3.08g
,
x=7g,
样品中碳酸钙的质量分数是:100%=70%,
答:样品中碳酸钙的质量分数是70%。
10.【解答】解:(1)反应产生氧气的质量为:24.8g﹣20.0g=4.8g,
故填:4.8。
(2)设反应后剩余固体中氯化钾的质量为x,
2KClO32KCl+3O2↑,
149 96
x 4.8g
,
x=7.45g,
答:反应后剩余固体中氯化钾的质量为7.45g。
(3)氯酸钾质量:24.8g﹣0.3g=24.5g,
剩余固体中钾元素质量:24.5g7.8g,
剩余固体中钾元素质量分数是:100%=39%,
答:剩余固体中钾元素质量分数是39%。
1.(2022春 温州期末)常见的制氧剂有氯酸钠(NaC1O3)过氧化钙(CaO2)和超氧化钾(KO2)等,这些制氧剂在一定条件下都可用来制取氧气,其反应原理分别为:2NaClO32NaCl+3O2↑,2CaO2+2H2O═Ca(OH)2+O2↑,4KO2+2H2O═KOH+3O2↑。
(1)以上三种制氧剂中属于氧化物的有 。
(2)3.6克过氧化钙(CaO2)中含氧元素的质量为 克。
(3)若要制取相等质量的氧气.需要氯酸钠和超氧化钾的质量比为 。
2.(2022春 柯桥区期末)实验室通常用化学方法制取氧气,某同学取质量为m的高锰酸钾固体加热,记录产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题:
(1)t0﹣t1时段氧气的质量未增加,其原因可能是t0﹣t1时段 ;
(2)请根据图中数据计算高锰酸钾的质量m为多少?(写出计算过程)
3.(2022春 钱塘区期末)某品牌钙片的部分信息:①钙片主要成分为碳酸钙;②每片钙片质量为1克。小应用该品牌钙片做了如下实验:把100克稀盐酸分成五等份,分次将稀盐酸添加到放有5片钙片的烧杯中,充分反应(钙片中其它成分不溶于水且不与盐酸反应)。得到的实验数据见下表。
实验次数 1 2 3 4 5
加入稀盐酸的质量/克 20 20 20 20 20
剩余固体的质量/克 4.0 3.0 2.0 1.1 1.1
回答下列问题:
(1)5片钙片中所含碳酸钙的总质量为 克。
(2)计算该实验中所用稀盐酸的溶质质量分数。(写出计算过程)
4.(2021春 萧山区期末)一定质量的氯酸钾(KClO3)中加入3.75克二氧化锰(MnO2),充分混合加热,如图为加热过程中氧气质量随时间变化的曲线,根据图象分析并计算。
(1)反应前后混合物的总质量减少 克。
(2)原混合物中氯酸钾占整个混合物的质量分数。(写出计算过程)
5.(2022春 西湖区期末)为测定某钟乳石样品中碳酸钙的质量分数,取50克钟乳石样品放在烧杯中,然后向其中逐渐加入稀盐酸,使之与样品充分反应(杂质不参加反应),加入稀盐酸的质量与生成气体的质量关系如图所示。请回答:
(1)分析图中数据可知,产生二氧化碳气体的质量是 克;
(2)求钟乳石样品中碳酸钙的质量分数;
(3)若杂质中含有碳酸镁,按上述方法测得钟乳石样品中碳酸钙的质量分数会 (填“偏大”“偏小”或“不变”)。(碳酸镁与稀盐酸的反应方程式为MgCO3+2HCl═MgCl2+H2O+CO2↑)
6.(2022春 杭州期末)某校课外活动小组,欲测定一待旅游开发的岩洞内空气中二氧化碳的体积分数(假设洞内空气中不含除二氧化碳外的其他酸性气体)。进行了如图实验:
(1)取样。他们准备从岩洞的底部取样,请你设计用广口瓶从洞中取回一瓶空气样品的方法: 。
(2)测定用150mL的注射器从广口瓶中抽取100mL气样,按如图所示的装置进行实验;若乙装置中NaOH溶液能吸收二氧化碳气体,且实验结束后,量筒内水的体积为99mL,此数据是 的体积数(用序号填写)。
A.二氧化碳
B.氮气和氧气的混合气体
C.空气中除二氧化碳外的所有气体
(3)计算:洞底空气中二氧化碳的体积分数为 。
(4)岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同的原因可能是 。
7.(2021春 杭州期末)为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如表。
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 。
(2)结合表格分析,固体反应物的接触面积越 (选填“大”“小”)反应越快。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
8.(2022春 西湖区期末)牙膏是日常生活中常用的清洁用品,具有摩擦作用和去除牙斑,摩擦剂是其主要成分,为了测定一种以碳酸钙为摩擦剂的牙膏中碳酸钙的含量。某小组称取这种牙膏100克放入烧杯中,向其中逐渐加稀盐酸至不再有气体放出(除碳酸钙外,这种牙膏中的其他成分不与盐酸发生反应),共用去盐酸150克,反应完毕后称得烧杯内物质的总质量为228克,请计算:
(1)上述实验中共生成二氧化碳 g。
(2)100克牙膏膏体中碳酸钙质量分数为多少?(列式计算)
9.(2021春 仙居县期末)石头纸是一种介于纸张和塑料之间的环保新型材料,主要成分为碳酸钙。为测定其中碳酸钙的含量,课外活动小组的同学进行了实验,实验数据见表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯① 烧杯② 烧杯③ 烧杯④ 烧杯⑤
加入样品的质量/g 10 10 10 10 10
加入稀盐酸的质量/g 10 20 30 40 50
充分反应后生成气体的质量/g 0.88 1.76 2.64 3.08 3.08
(1)根据表中的实验数据可知,烧杯④样品中的碳酸钙全部参加了反应,则10克样品完全反应生成二氧化碳的质量为 克。
(2)求样品中碳酸钙的质量分数。(需写出计算过程)
10.(2021春 上虞区期末)实验室用加热氯酸钾与0.3g二氧化锰混合物制取氧气,加热前称得混合物总质量为24.8g,加热一段时间后,称得剩余固体质量为20.0g,试回答下列问题。
(1)反应产生氧气的质量为 g。
(2)计算反应后剩余固体中氯化钾的质量?
(3)剩余固体中钾元素质量分数是多少?
期末题型专练——有关化学方程式的计算—2022-2023学年浙教版科学八年级下册
参考答案与试题解析
一.试题(共10小题)
1.【解答】(1)两种元素组成,一种为氧元素的化合物为氧化物,据此可知三个反应中属于氧化物的有:KO2、CaO2共计2种;
(2)3.6克过氧化钙(CaO2)中含氧元素的质量为3.6g100%=1.6g;
(3)根据方程式可知反应关系:2NaClO3~3O2,4KO2~3O2,据此可知:若要制取相等质量的氧气,需要氯酸钠和超氧化钾的质量比为2×(23+35.5+16×3):4×(39+16×2)=213:284。
故答案是:
(1)KO2、CaO2;
(2)1.6
(3)213:284。
2.【解答】解:(1)根据图中信息可知:t0﹣t1固体质量不变,是因为反应还未进行,高锰酸钾还未分解;
(2)由图象可知该反应生成的氧气质量是3.2g;
2KMnO4K2MnO4+MnO2+O2↑
316 32
m 3.2g
解得:m=31.6g
答:高锰酸钾的质量m为31.6g。
故答案为:(1)因为反应还未进行,高锰酸钾还未分解;
(2)31.6g。
3.【解答】解:(1)5片钙片中所含碳酸钙的总质量为:5g﹣1.1g=3.9g;
(2)设20g稀盐酸中氯化氢质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73
1g x
x=0.73g
该实验中所用稀盐酸的溶质质量分数是:100%=3.65%
答:该实验中所用稀盐酸的溶质质量分数是3.65%。
故答案为:(1)3.9;
(2)3.65%。
4.【解答】解:(1)由图象可知,氯酸钾完全分解生成氧气的质量是4.8g,反应前后混合物的总质量减少4.8克。
(2)设氯酸钾的质量为x,
2KClO32KCl+3O2↑
245 96
x 4.8g
解得:x=12.25g
原混合物中氯酸钾占整个混合物的质量分数是:76.6%。
答:原混合物中氯酸钾占整个混合物的质量分数水76.6%。
故答案为:(1)4.8。
(2)76.6%。
5.【解答】解:(1)由图可以看出生成的二氧化碳的质量为11g,故填:11。
(2)设样品中碳酸钙的质量分数为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
50g x 11g
x=50%
答:样品中碳酸钙的质量分数为50%。
(3)若杂质中含有碳酸镁,也会与盐酸反应生成二氧化碳,生成的二氧化碳都计入碳酸钙生成的二氧化碳中,所得碳酸钙的质量偏大,按上述方法测得钟乳石样品中碳酸钙的质量分数会偏大,故填:偏大。
6.【解答】解:(1)为了防止把洞外的气体带到洞中,必须先将广口瓶装满水,盖上玻璃片后带进洞中,将水倒掉,因为二氧化碳能溶于水,为了减少实验误差,必须要将广口瓶内残留的水分擦干,然后再盖上玻璃片,即可;故填:将广口瓶装满水,盖上玻璃片,带进洞中,将水倒掉,擦干瓶内,盖上玻璃片即可;
(2)氢氧化钠是为了吸收气体中的CO2剩下的气体进入装置丙中,排水法收集,排开的水进入量筒内,所以量筒内的水相当于是空气中除CO2外的所有气体体积;故填:C;
(3)洞底空气中CO2的体积分数为1%;故填:1%;
(4)岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳,所以岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同;故填:岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳。
7.【解答】解:(1)分析表格中的数据可知大理石碎屑生成的CO2质量在14分钟时为2.40g,16分钟时也是2.40g,18分钟时也为2.40g,说明在14分钟后反应已完成;故填:大理石碎屑生成的CO2质量在14分钟后不再变化;
(2)对比分析大理石碎屑生成的CO2质量随时间的变化情况和块状大理石生成的CO2质量随时间的变化情况可知相同时间内大理石碎屑生成的CO2质量比块状大理石生成的CO2质量多,并且14分钟后大理石碎屑就反应完了,而块状大理石在18分钟时还没有反应完,所以,固体反应物的接触面积越大反应速率越快,故填:大;
(3)分析表中数据可知18分钟时块状大理石生成二氧化碳的质量为2.20g,
设:反应进行到18分钟时,块状大理石中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.20g
x=5.00g
答:反应进行到18分钟时,块状大理石中碳酸钙的质量为5.00g。
8.【解答】解:(1)上述实验中共生成二氧化碳的质量为100g+150g﹣228g=22g。
故答案为:22。
(2)设100克牙膏膏体中碳酸钙质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 22g
x=50g
100克牙膏膏体中碳酸钙质量分数为100%=50%。
答:100克牙膏膏体中碳酸钙质量分数为50%。
9.【解答】解:(1)根据表中的实验数据可知,烧杯④样品中的碳酸钙全部参加了反应,则10克样品完全反应生成二氧化碳的质量为3.08克。
故填:3.08。
(2)设碳酸钙质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 3.08g
,
x=7g,
样品中碳酸钙的质量分数是:100%=70%,
答:样品中碳酸钙的质量分数是70%。
10.【解答】解:(1)反应产生氧气的质量为:24.8g﹣20.0g=4.8g,
故填:4.8。
(2)设反应后剩余固体中氯化钾的质量为x,
2KClO32KCl+3O2↑,
149 96
x 4.8g
,
x=7.45g,
答:反应后剩余固体中氯化钾的质量为7.45g。
(3)氯酸钾质量:24.8g﹣0.3g=24.5g,
剩余固体中钾元素质量:24.5g7.8g,
剩余固体中钾元素质量分数是:100%=39%,
答:剩余固体中钾元素质量分数是39%。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
