固体物质的溶解度(15张ppt)
图片预览






文档简介
课件15张PPT。固体物质的溶解度学习主题 固体物质的溶解度?
【问题导引】什么是溶解度?如何根据溶解度确定物质的溶
解性?
1.概念:
在_________下,某固态物质在______溶剂里达到_________时
所溶解的质量。
2.影响因素:
(1)内部因素:溶质的性质和溶剂的性质。
(2)外界因素:_____。一定温度100 g饱和状态温度【特别提醒】溶解度与溶剂的质量无关,原因是溶解度的概念中已对溶剂的质量作出了规定。3.溶解度的相对大小(20℃)与物质的溶解性:
4.固体物质的溶解度的表示方法:
(1)列表法。
(2)作图法——溶解度曲线。
①概念:用纵坐标表示_______,横坐标表示_____,得到物质
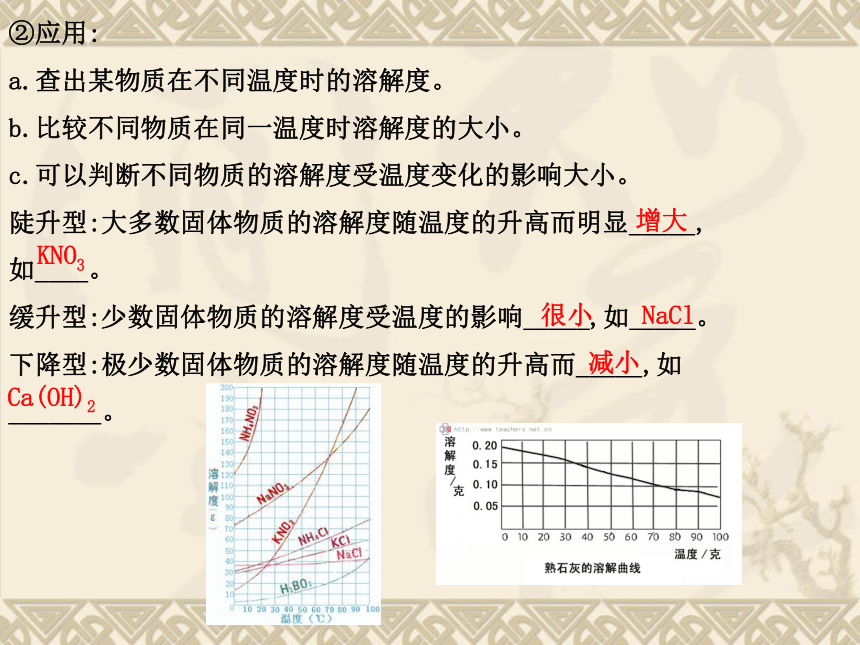
的溶解度随温度变化的曲线。 0.01~1>10难溶可溶溶解度温度②应用:
a.查出某物质在不同温度时的溶解度。
b.比较不同物质在同一温度时溶解度的大小。
c.可以判断不同物质的溶解度受温度变化的影响大小。
陡升型:大多数固体物质的溶解度随温度的升高而明显_____,
如____。
缓升型:少数固体物质的溶解度受温度的影响_____,如_____。
下降型:极少数固体物质的溶解度随温度的升高而_____,如
_______。增大KNO3很小NaCl减小Ca(OH)2考点 1 固体物质的溶解度?
【典例1】(2013·成都中考)20℃时,氯化钠的溶解度为36g。对这句话理解错误的是 ( )
A.20℃时,100 g水中最多能溶解氯化钠36 g
B.20℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液【解析】选B。本题考查溶解度的概念的理解,解题的关键是把握好溶解度概念中的四要素。根据溶解度的概念,20℃时,100 g水中最多能溶解氯化钠36 g,所得溶液为饱和溶液,其中水与氯化钠的质量比为100∶36;100 g为溶剂的质量,而不是溶液的质量。【典例2】(2013·临沂中考)如图为甲、乙两种固体物质的溶解度曲线,请回答:(1)t1℃时,甲、乙两种固体物质的溶解度大小关系为甲____乙(填“>”“<”或“=”)。
(2)t1℃时,把50 g甲物质放入100 g水中,充分搅拌,所得的溶液是 溶液(填“饱和”或“不饱和”),将温度升高到t2℃时,该溶液中溶质和溶剂的质量比是 。
(3)t2℃时,有一接近饱和的甲溶液,可采用 的方法(任写一种)使其变为饱和溶液。【解析】本题以溶解度曲线为主题,考查溶解度及饱和溶液的相关知识。t1℃时甲的溶解度大于乙的溶解度;t1℃时甲的溶解度为40 g,即100 g水中最多只能溶解40 g甲,t2℃时甲的溶解度为60 g,即100 g水中最多只能溶解60 g甲,故50 g甲完全溶解,溶液中溶质与溶剂的质量比为50∶100=1∶2;由于甲物质的溶解度随温度的降低而减小,故可采用降低温度的方法,使甲的不饱和溶液变为饱和溶液,另外还可采用加入溶质和蒸发溶剂的方法。
答案:(1)> (2)饱和 1∶2 (3)降温(或加入甲物质或蒸发溶剂) 【拓展延伸】溶解度曲线的意义及应用拓展:t2℃时,将等质量的a、b两种可溶性固体分别加入盛有相同质量水的烧杯中,充分搅拌后的现象如图1所示,a、b两种物质的溶解度曲线如图2所示。请结合图示回答下列问题:(1)图1中, (填“a”或“b”)物质的溶解一定达到了饱和状态。
(2)图2中, (填“甲”或“乙”)表示a的溶解度曲线。
(3)将图1中a溶液的温度从t2℃降低到t1℃,所得溶液与原溶液相比较,通常没有发生变化的是 (填序号)。
A.溶质的质量 B.溶剂的质量
C.溶解度【解析】(1)由充分搅拌后的现象可知,a不能完全溶解,故该溶液一定饱和。(2)t2℃时,相同质量水中溶解的b物质多,故t2℃时b物质的溶解度大,故乙表示a的溶解度曲线。(3)将图1中a溶液的温度从t2℃降低到t1℃,由于溶解度减小,故溶液中会析出溶质,溶剂的质量不变。
答案:(1)a (2)乙 (3)B
【问题导引】什么是溶解度?如何根据溶解度确定物质的溶
解性?
1.概念:
在_________下,某固态物质在______溶剂里达到_________时
所溶解的质量。
2.影响因素:
(1)内部因素:溶质的性质和溶剂的性质。
(2)外界因素:_____。一定温度100 g饱和状态温度【特别提醒】溶解度与溶剂的质量无关,原因是溶解度的概念中已对溶剂的质量作出了规定。3.溶解度的相对大小(20℃)与物质的溶解性:
4.固体物质的溶解度的表示方法:
(1)列表法。
(2)作图法——溶解度曲线。
①概念:用纵坐标表示_______,横坐标表示_____,得到物质
的溶解度随温度变化的曲线。 0.01~1>10难溶可溶溶解度温度②应用:
a.查出某物质在不同温度时的溶解度。
b.比较不同物质在同一温度时溶解度的大小。
c.可以判断不同物质的溶解度受温度变化的影响大小。
陡升型:大多数固体物质的溶解度随温度的升高而明显_____,
如____。
缓升型:少数固体物质的溶解度受温度的影响_____,如_____。
下降型:极少数固体物质的溶解度随温度的升高而_____,如
_______。增大KNO3很小NaCl减小Ca(OH)2考点 1 固体物质的溶解度?
【典例1】(2013·成都中考)20℃时,氯化钠的溶解度为36g。对这句话理解错误的是 ( )
A.20℃时,100 g水中最多能溶解氯化钠36 g
B.20℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液【解析】选B。本题考查溶解度的概念的理解,解题的关键是把握好溶解度概念中的四要素。根据溶解度的概念,20℃时,100 g水中最多能溶解氯化钠36 g,所得溶液为饱和溶液,其中水与氯化钠的质量比为100∶36;100 g为溶剂的质量,而不是溶液的质量。【典例2】(2013·临沂中考)如图为甲、乙两种固体物质的溶解度曲线,请回答:(1)t1℃时,甲、乙两种固体物质的溶解度大小关系为甲____乙(填“>”“<”或“=”)。
(2)t1℃时,把50 g甲物质放入100 g水中,充分搅拌,所得的溶液是 溶液(填“饱和”或“不饱和”),将温度升高到t2℃时,该溶液中溶质和溶剂的质量比是 。
(3)t2℃时,有一接近饱和的甲溶液,可采用 的方法(任写一种)使其变为饱和溶液。【解析】本题以溶解度曲线为主题,考查溶解度及饱和溶液的相关知识。t1℃时甲的溶解度大于乙的溶解度;t1℃时甲的溶解度为40 g,即100 g水中最多只能溶解40 g甲,t2℃时甲的溶解度为60 g,即100 g水中最多只能溶解60 g甲,故50 g甲完全溶解,溶液中溶质与溶剂的质量比为50∶100=1∶2;由于甲物质的溶解度随温度的降低而减小,故可采用降低温度的方法,使甲的不饱和溶液变为饱和溶液,另外还可采用加入溶质和蒸发溶剂的方法。
答案:(1)> (2)饱和 1∶2 (3)降温(或加入甲物质或蒸发溶剂) 【拓展延伸】溶解度曲线的意义及应用拓展:t2℃时,将等质量的a、b两种可溶性固体分别加入盛有相同质量水的烧杯中,充分搅拌后的现象如图1所示,a、b两种物质的溶解度曲线如图2所示。请结合图示回答下列问题:(1)图1中, (填“a”或“b”)物质的溶解一定达到了饱和状态。
(2)图2中, (填“甲”或“乙”)表示a的溶解度曲线。
(3)将图1中a溶液的温度从t2℃降低到t1℃,所得溶液与原溶液相比较,通常没有发生变化的是 (填序号)。
A.溶质的质量 B.溶剂的质量
C.溶解度【解析】(1)由充分搅拌后的现象可知,a不能完全溶解,故该溶液一定饱和。(2)t2℃时,相同质量水中溶解的b物质多,故t2℃时b物质的溶解度大,故乙表示a的溶解度曲线。(3)将图1中a溶液的温度从t2℃降低到t1℃,由于溶解度减小,故溶液中会析出溶质,溶剂的质量不变。
答案:(1)a (2)乙 (3)B
