第2章 微粒的模型与符号 复习提高练习卷(含解析)
文档属性
| 名称 | 第2章 微粒的模型与符号 复习提高练习卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 187.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-06-02 14:31:39 | ||
图片预览




文档简介
八下科学第二单元微粒的模型与符号复习提高练习卷
一、单选题
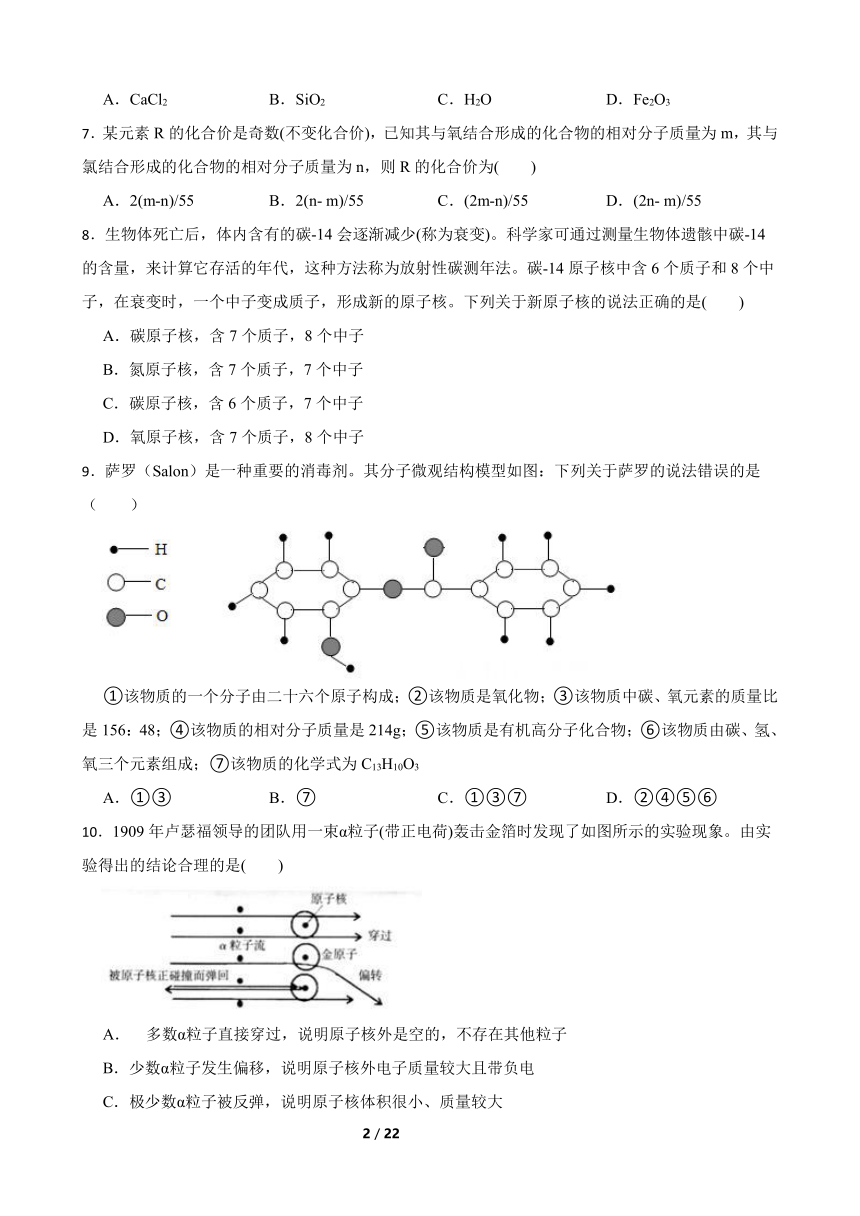
1.氚是氢的一种同位素,氚原子中含有1个质子和2个中子,下列示意图能正确表示氚原子结构的是( )
A.A B.B C.C D.D
2.下列说法正确的是( )
①地壳中含量最多的金属元素是铝,也就是金属铝
②人体中只含有非金属元素,没有金属元素
③人体中氢、氧元素含量很高,这与水占人体质量的70%以上有关
④地壳中非金属元素的总含量大于金属元素,种类少于金属元素
A.①③④ B.②③④ C.③④ D.①②
3.山林里空气中的自由电子附着在氧分子,上形成负氧离子( ),被称为“空气维生素”,那么 的相对分子质量是( )
A.16 B.32 C.32克 D.33
4.下列化学用语书写错误的是( )
A.硫酸根离子:SO42- B.铁的元素符号:Fe3+
C.碳酸根离子:CO32- D.3个二氧化硫分子:3SO2
5.元素观是化学的重要观念之一,下列有关元素的说法中,错误的是( )
A.元素是具有相同核电荷数的一类原子的总称
B.元素周期表中,元素的原子序数与该元素原子核电荷数在数值上相同
C.同种元素的原子核内质子数与中子数一定相等
D.在物质发生化学变化时,原子的种类不变,元素也不会改变
6.某矿石样本含有如图所示的四种元素,该矿石中可能含有的物质是( )
A.CaCl2 B.SiO2 C.H2O D.Fe2O3
7.某元素R的化合价是奇数(不变化合价),已知其与氧结合形成的化合物的相对分子质量为m,其与氯结合形成的化合物的相对分子质量为n,则R的化合价为( )
A.2(m-n)/55 B.2(n- m)/55 C.(2m-n)/55 D.(2n- m)/55
8.生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。科学家可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代,这种方法称为放射性碳测年法。碳-14原子核中含6个质子和8个中子,在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子,8个中子
B.氮原子核,含7个质子,7个中子
C.碳原子核,含6个质子,7个中子
D.氧原子核,含7个质子,8个中子
9.萨罗(Salon)是一种重要的消毒剂。其分子微观结构模型如图:下列关于萨罗的说法错误的是( )
①该物质的一个分子由二十六个原子构成;②该物质是氧化物;③该物质中碳、氧元素的质量比是156:48;④该物质的相对分子质量是214g;⑤该物质是有机高分子化合物;⑥该物质由碳、氢、氧三个元素组成;⑦该物质的化学式为C13H10O3
A.①③ B.⑦ C.①③⑦ D.②④⑤⑥
10.1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象。由实验得出的结论合理的是( )
A. 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子
B.少数α粒子发生偏移,说明原子核外电子质量较大且带负电
C.极少数α粒子被反弹,说明原子核体积很小、质量较大
D.该实验说明α粒子无法穿透原子与原子间的空隙
11.雄伟壮观的国家大剧院主体建筑表面安装了近 2 万块钛(Ti)金属板。已知 Ti 原子核内有 22个质子,则下列叙述正确的是( )
A.Ti可以表示一个钛原子 B.Ti4+核外有26个电子
C.TiO2中含有氧分子 D.CaTiO3属于氧化物
12.科学上用符号“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知abXn+和cdYm-的核外电子数相等。则下列关系正确的是( )
A.b-a=d-c B.a+n=c-m C.a-n=c+m D.b-n=d+m
13.今年4月,科学家在深海海底发现了大量未来太阳能光伏发电必需的元素——碲。碲元素在周期表中的信息如图所示。下列说法不正确的是( )
A.碲是非金属元素
B.碲的元素符号为Te
C.碲原子的核外电子数为52
D.碲元素的相对原子质量为127.6克
14.在科学王国里,数字被赋予了丰富的内涵。对下列化学用语中数字“2”的说法正确的是( )
①2H ②2NH3 ③SO2 ④ ⑤Mg2+ ⑥2OH- ⑦H2O
A.表示离子个数的是⑤⑥ B.表示离子所带电荷数的是④⑤
C.表示分子中原子个数的是③⑦ D.表示分子个数的是①②
15.下列氢原子的各种模型图中,正确的是( )
A. B. C. D.
16.将乙酸(CH3COOH)和葡萄糖(C6H12O6)溶于水得到混合溶液,测得溶液中氢元素的质量分数为a,则溶液中碳元素的质量分数为( )
A.1-9a B.1-8a C.12a D.8a
17.由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知 S 元素的质量分数W(S)=a%,则 O元素的质量分数W(O)为( )
A.1-1.75a% B.1.75a% C.1.25a% D.无法计算
18.某同学学了元素和物质的知识后,进行梳理,其中不正确的是( )
A.铁元素的质量分数由高到低:Fe3O4>Fe2O3>FeS
B.钙的化合物相对分子质量由大到小:CaCO3>CaCl2>Ca(OH)2
C.地壳中元素的含量由高到低:O> Si> Al
D.锰元素的化合价由高到低:KMnO4>K2MnO4 >MnO2
19.与铵根离子(NH )具有相同的质子数和电子数的微粒是( )
A.Na+ B.OH- C.H2O D.LiF
20.有两种元素X和Y,它们化合成两种化合物A和B,化合物A中X所占质量分数为75%,化合物B中X占80%。已知A的化学式为XY4,则B的化学式为( )
A.XY2 B.XY3 C.X2Y3 D.X3Y2
21.学习化学知识后,观察物质世界就要从化学视角看.下列对打火机主要燃料丁烷(C4H10)的看法不正确的是()
A.从组成上看:丁烷由碳、氢两种元素组成
B.从结构上看:一个丁烷分子由4个碳原子、10个氢原子构成
C.从变化上看:丁烷完全燃烧只生成水
D.从性质上看:丁烷具有可燃性
22.在O2和CO2的混合气体中,碳元素的质量分数是24%,则O2和CO2的质量比是( )
A.2∶5 B.3∶1 C.3∶22 D.8∶11
23.由碳、氧两种元素组成的气体中,碳与氧的质量比为3:5,则该气体可能是( )
A.只由CO组成的纯净物 B.只由CO2组成的纯净物
C.由CO2和O2共同组成的混合物 D.由CO和CO2共同组成的混合物
24.某硝酸铵(NH4NO3)样品中(杂质不含氮)氮元素的质量分数为28%,则其中硝酸铵的质量分数为( )
A.20% B.70% C.80% D.无法计算
25.已知一个SO2分子的质量为n千克,一个SO3分子的质量为m千克(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的 作为相对原子质量的标准,则SO2的相对分子质量为( )
A. B. C. D.
二、填空题
26.元素的阳离子结构示意图为,元素的阴离子比多8个电子,与形成的化合物为,与形成的化含物的化分式为,请回答: ,
27.某化合物的化学式为HnRO2n+1,其相对分子质量为A,则R的相对原子质量为 。R元素的化合价为 ,原子团RO2n+1的化合价为 。当R的化合价不变时,其与氧元素组成的化合物的化学式为 ,相对分子质量是 。
28.下列分别盛有不同物质的容器中,所盛物质属于单质的是 ,属于混合物的是 ,属于化合物的是 (均填容器下的字母)。若C瓶中CO2和CO所含的氧元素的质量相等,则CO2和CO中碳元素的质量比为 ,CO2和CO的质量比为 。D瓶中保持冰化学性质的最小粒子是 (填化学式)。
29.嫦娥四号月球探测器登上月球背面,成为世界首个着落在月球背面的探测器。此后,嫦娥四号通过“鹊桥”中继星向世界展现了首张月背的完整风貌。其实看似荒凉的月球矿产资源极为丰富。以铁为例,仅月面表层5厘米厚的沙土就含有上亿吨铁。
(1)科学研究发现,月球上富含铁的同位素:Fe﹣57(一个原子内质子数与中子数之和为57)和Fe﹣54,已知铁元素为26号元素,则下列相关说法错误的是_________。
A.Fe﹣57和Fe﹣54原子核外电子数相同,中子数不同
B.Fe﹣57和Fe﹣54在元素周期表中占同一个位置
C.Fe﹣57和Fe﹣54均属于铁元素,所以相对原子质量相同
(2)地球上的铁主要以氧化物形式存在,在Fe2O3、Fe3O4两种化合物中,与等质量铁元素相结合的氧元素的质量比为 ;某赤铁矿(主要成分为Fe2O3,且其它成分不含铁)探明含铁量为10.5%,则Fe2O3含量为 (以百分数的形式表示)。
30.某化合物的化学式为HnRO2n-1,若此化合物的相对分子质量为m,则元素R的相对原子质量为 。
31.小明利用12种元素制作了一张如图所示的“元素钟面”。
(1)钟面上的这些元素之间最根本的区别是 不同。
(2)小明根据钟面上提供的元素,写出了下列三种物质的化学式:O2、H2O和NaNO3,其中属于氧化物的是 。
(3)此刻钟面上的时针、分针和秒针分别指向三种不同元素,请写出由这三种元素组成的化合物 。(用化学式表示)
32.黄蜡石质地堪比翡翠美玉,具有极高的欣赏和收藏价值,黄蜡石的主要成分为二氧化硅。二氧化硅(SiO2)属于 (填“单质”或“化合物”),二氧化硅中硅元素的化合价为 价。进行固体熔化实验时常用的药品是硫代硫酸钠晶体(Na2S2O3·5H2O),该物质属于 (填“纯净物”或“混合物”),其中硫元素的化合价是 价。
33.一瓶未贴标签的粉末状常见金属R。为了测定R的相对原子质量,准确称取一定量金属粉末,在坩埚内加强热使其完全氧化,冷却后再称重。重复实验,获得如表数据。请回答:
实验次数 金属质量/克 金属氧化物质量/克
1 45.0 84.9
2 45.0 85.1
3 45.0 85.0
平均值 45.0 m
(1)表格中m= 。
(2)该金属氧化物(R元素和氧元素两种)中,R元素和氧元素的质量比为 。
(3)已知R的化合价为+3价,则R的相对原子质量为 。
34.在宏观、微观和符号之间建立联系是化学学科的特点.甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于下表:
物质 甲 乙 丙 丁 图例: ﹣﹣氢原子 ﹣﹣碳原子 ﹣﹣氧原子
化学式 ? C H2O H2
微观 示意图 ?
(1)请写出甲物质的化学式 ,画出丁物质的微观示意图 .
(2)能保持丙物质化学性质的微粒是 (填“分子”或“原子”),四种物质中属于氧化物的有 (填“甲、乙、丙、丁”).
三、实验探究题
35.2022年,首届完全实现“碳中和”的冬奥会在北京举办。其中,国家速滑馆的二氧化碳跨临界直冷制冰技术应用成为了外界关注的热点。它取代氟利昂这一类对环境污染较大的人工合成制冷剂,更为环保、节能。氟利昂是一种常见的制冷剂,它在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
(1)请写出臭氧的化学式 ;
(2)经过①②③的反应后,反应物氯原子的个数 (“减少”、“增加”或“不变”);
(3)有科学家指出:“少量的氟里昂就能对臭氧层产生巨大的影响”,请你根据该模型说明理由: 。
36.化合价是一个重要的化学概念.
(1)下面是对元素化合价的部分探究过程.
化学上用“化合价”来表示原子之间 .
(2)【提出问题一】元素正负化合价有何规律?
推测一:金属元素都显正价;
推测二:非金属元素只有负价.
【举例及分析一】
①.NaCl、FeO、Al2O3中金属元素化合价分别为+1、+2、+3,其他金属也都显正价,推测一正确.金属都显正价的可能原因为 .
②.H2O、SO2、CO2中H、O、S、C元素的化合价分别为+1、﹣2、+4、+4,说明推测二 (填“成立”或“不成立”).
③金属元素与非金属元素形成化合物时,非金属元素显 价.
(3)【提出问题二】一种元素只有一种化合价吗?
推测一:一种元素只有一种化合价;
推测二: .
【举例及分析二】
①NaCl、NaOH、NaNO3、Na2SO4等物质中Na元素都显+1价,推测一成立.
②H2S、SO2、SO3、H2SO3等物质中S元素化合不同,S元素化合价分别为﹣2、+4、+6、 价.推测二成立.
【结论二】推测一、二都有道理,通过上述举例分析及结合教材上所给元素的化合价,可知
(4)【提出问题三】在同种化合物中,同种元素一定具有相同的化合价吗?
推测一:在同种化合物中,同种元素一定具有相同的化合价;
推测二:在同种化合物中,同种元素不一定具有相同的化合价.
【举例及分析三】NH4NO3中N元素的化合价分别为 、 .
【结论三】推测二成立.
四、分析计算题
37.现代生活中,人们越来越注重对微量元素的摄入。血红蛋白中的铁是人体内氧的输送者,缺铁易患贫血。请回答:
(1)一种添加了营养剂的“铁强化”酱油已上市,根据卫生部制定的铁强化剂添加标准,每100毫升酱油中铁营养剂的添加量是200毫克,该铁营养剂中铁的质量分数为12.5%,由实验测知,酱油中的铁只有10%能被人体吸收,以某人一天食用16毫升该酱油计算,他一天从酱油中吸收的铁元素有多少毫克?
(2)小明的妈妈最近身体虚弱,脸色苍白且厌食,医生诊断说她患缺铁性贫血,除正常饮食吸收的铁元素外,建议服用硫酸亚铁(FeSO4)口服液。若小明的妈妈共需要补充1.4克铁元素,需要服用多少克硫酸亚铁?
(3)152克硫酸亚铁中铁的含量相当于多少克氧化铁中铁的含量?
38.某化肥厂的墙体上做了一个大型户外广告,如图所示,根据相关信息回答。
(1)碳酸氢铵中氮元素的质量分数是多少?(精确到0.1%)
(2)通过计算判断该广告属于“真实”或“虚假”广告?
(3)当地质检部门对该厂生产的化肥做了质量检测,该化肥的实际含氮量仅有11.7%,试计算每袋这样的化肥实际含氮量是多少?该产品中碳酸氢铵的质量分数为多少?(要求写出计算过程)
39.某同学发现他家菜园中的蔬菜生长迟缓,准备到市场上购买氮肥,硝酸铵和尿素是两种常见的氮肥,每千克售价如下:
氮肥 化学式 每千克的售价
硝酸铵 NH4NO3 10元
尿素 CO(NH2)2 16元
根据表格回答计算分析问题(写出计算过程,保留2个有效数字):
(1)尿素中氮元素的质量分数是多少?
(2)一千克尿素的含氮质量与多少千克硝酸铵的含氮量相等?
(3)根据尿素和硝酸铵含氮的比例分析,计算说明哪种化肥更经济。
40.氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如下表。试回答:
名称 符号 相对原子质量
氕 H 1
氘 D 2
氚 T 3
(1)原子结构模型中的“ ”表示的粒子是 。
(2)超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O。T2O中T的化合价为 。
(3)重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100吨海水中所含氘的质量是多少
答案解析部分
1.【答案】A
【解析】【分析】根据氚原子的组成分析,结合图示中各粒子的带电情况解答。
【解答】 氚原子中含有1个质子和2个中子, 核外一个带负电荷的电子,由图示可知,A正确;
故选A。
2.【答案】C
【解析】【分析】根据地壳、人体中元素的含量分析。
【解答】①地壳中含量最多的金属元素是铝,指的是铝元素,错误;②人体中含有大量的钙元素,钙元素属于金属元素,错误;③人体中氢、氧元素含量很高,这与水占人体质量的70%以上有关,正确;④地壳中非金属元素的总含量大于金属元素,种类少于金属元素,正确;
故选C。
3.【答案】B
【解析】【分析】根据相对分子质量是各原子的相对原子质量总和分析。
【解答】 O2-的相对分子质量是 16×=32。
故选B。
4.【答案】B
【解析】【分析】元素符号的意义:一、宏观上说表示一种元素;微观上说表示这种元素的一个原子.二、对直接有原子构成的物质,还可以表示这种单质;
【解答】B、Fe3+中表示是铁的离子;而不是铁元素;故B错误;
故答案为:B;
5.【答案】C
【解析】【分析】元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称。
【解答】元素的概念是具有相同核电荷数(即核内质子数)的一类原子的总称,同种元素的质子数一定相等,中子数不一定相等。
故答案为:C。
6.【答案】B
【解析】【分析】根据图示中所给元素种类及所给物质的元素种类分析。
【解答】由图示可知,该矿石中含有氧、硅、硫、钙元素,A中氯元素不含,C中氢元素不含,D中铁元素不含;
故答案为:B。
7.【答案】D
【解析】【分析】O的化合价为-2,Cl的化合价为-1,根据正负化合价代数和为零推算出化合物的化学式,然后根据“相对分子质量等于相对原子质量与个数的乘积之和”列出两个方程,从而计算出R的化学式。
【解答】设R的化合价为x,R的相对原子质量为y。
当R的化合价为奇数时,形成化合物的化学式分别为:R2Ox、RClx;
那么得到:2y+16x=m;
y+35.5x=n
解得:
。
故选D。
8.【答案】B
【解析】【分析】根据质子数为7的原子为氮原子分析。
【解答】 碳-14原子核中含6个质子和8个中子,在衰变时,一个中子变成质子,形成新的原子核 ,则新原子核内7个质子,7个中子,即为氮原子核;
故选B。
9.【答案】D
【解析】【分析】根据结构图中物质的分子构成,确定物质的化学式,再由化学式确定一个分子中的原子个数、元素的质量比、相对分子质量分析。
【解答】 ①由结构图可知该物质的一个分子由二十六个原子构成,正确;②该物质由碳、氢、氧三种元素组成,不是氧化物,错误;③该物质中碳、氧元素的质量比是(12×13):(16×3)=156:48,正确;④该物质的相对分子质量是214,错误;⑤该物质不是有机高分子化合物,错误;⑥该物质由碳、氢、氧三种元素组成,元素不论个数,错误;⑦该物质的化学式为C13H10O3,正确;
故选D。
10.【答案】C
【解析】【分析】根据原子结构的知识判断。
【解答】A.多数α粒子直接穿过,这说明原子核外绝大部分空间是空的,但是还有电子的存在,故A错误;
B.少数α粒子发生偏移,是因为受到原子核内质子所带正电荷的排斥作用,这说明原子核的质量很大,几乎占据了整个原子的全部质量,故B错误;
C.极少数α粒子被反弹,说明原子核体积很小、质量较大,故C正确;
D.该实验说明α粒子可以穿透原子与原子间的空隙,故D错误。
故选C。
11.【答案】A
【解析】【分析】A、根据元素符号的含义分析;
B、根据离子与原子转化的方法分析;
C、根据分子中含有原子分析;
D、根据氧化物定义分析,氧化物要由两种元素其中一种是氧元素组成。
【解答】A、元素符号除表示一种元素外,还可表示该元素的一个原子,正确;
B、 Ti4+是钛原子失去4个电子形成的,所以核外有18个电子,错误;
C、 TiO2中含有氧原子,不含氧分子,错误;
D、 CaTiO3由三种元素组成,不属于氧化物 ,错误;
故答案为:A。
12.【答案】C
【解析】【分析】本题为分析题,结合本节所学知识点,分析题意即可得出答案。科学上把具有相同核电荷数(即质子数)的一类原子总称为元素。原子中核内的质子数相同、中子数不相同的同类原子统称为同位素。
【解答】“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和,则因为abXn+和cdYm-的核外电子数分别为a-n和c+m,所以a-n=c+m。
故答案为C.
13.【答案】D
【解析】【分析】根据元素周期表小格中信息分析,元素周期表小格中左上角为原子序数,在原子中,原子序数=质子数=核电荷数=电子数,右上角为元素符号,中间为元素名称,最下面为相对原子质量。
【解答】A、碲名称还“石”,为非金属元素,不符合题意;
B、 碲的元素符号为Te ,不符合题意;
C、 碲原子的核外电子数=质子数=原子序数=52 ,不符合题意;
D、相对原子质量是比值,单位为“1”不是“g”,符合题意;
故答案为:D。
14.【答案】C
【解析】【分析】根据符号前数字表示粒子的个数、元素符号右上角数字表示离子所带电荷数、元素符号右下角数字表示一个分子中原子个数、元素符号正上方数字表示元素化合价分析。
【解答】A、 ⑤ 中2表示一个镁离子带2个单位的正电荷,不符合题意;
B、 ④ 中2 表示元素的化合价,不符合题意;
C、 ③⑦ 中2都在元素符号右下角,表示一个分子中的原子个数,符合题意;
D、 ① 中2表示原子个数,不符合题意;
故答案为:C。
15.【答案】A
【解析】【分析】根据氢原子的构成分析。
【解答】氢原子核内只有一个质子,没有中子,核外一个电子;
故答案为:A。
16.【答案】A
【解析】【分析】根据乙酸、葡萄糖、水中,氢原子和氧原子的个数比均为2:1,进行分析解答。
【解答】乙酸和葡萄糖中氢、氧原子个数比为2:1,水中氢、氧原子个数比也为2:1,所以形成溶液中氢、氧元素质量比为1:8,氢元素质量分数为a,则氧元素质量分数为8a,所以碳元素质量分数为1-9a;
故答案为:A。
17.【答案】A
【解析】【分析】将化学式变形,利用S元素的质量分数计算出Mg元素的质量分数,最后根据“三者的质量分子之和等于1”计算O元素的质量分数。
【解答】Na的相对原子质量为23,H的相对原子质量为1,而Mg的相对分子质量为24,则NaH=S,则三种物质的化学式可转换为:MgS、MgSO4、MgSO3 。
S元素的质量分数为a%;
则MgS的质量分数应该为:。
则O元素的质量分数为:1-1.75a%。
故选A。
18.【答案】B
【解析】【分析】(1)元素的质量分数=分析;
(2)相对分子质量等于相对原子质量与个数的乘积之和;
(3)根据地壳中的元素含量分布分析;
(4)在化学式中,正负化合价的代数和为零,据此计算出化合价进行比较即可。
【解答】A.要比较这三种物质中铁元素的质量分数大小,可以将这三种物质的化学式分别改写为:Fe6O8、Fe6O9、Fe6S6,因为硫原子的相对原子质量是氧原子的2倍,故Fe6S6还可以改写为Fe6O12;铁原子的个数相同,则氧原子对应的相对质量越小,铁元素的质量分数越大,故铁元素的质量分数由高到低:Fe3O4>Fe2O3>FeS,故A正确不合题意;
B.CaCO3的相对分子量为100,CaCl2的相对分子量为111,Ca(OH)2的相对分子量为74,故钙的化合物相对分子量由大到小:CaCl2>CaCO3>Ca(OH)2,故B错误符合题意;
C.地壳中元素的含量由高到低:O>Si>Al,故C正确不合题意;
D.KMnO4中锰元素为+7价,K2MnO4中锰元素为+6价,MnO2中锰元素为+4价,锰元素的化合价由高到低:KMnO4>K2MnO4>MnO2,故D正确不合题意。
故选B。
19.【答案】A
【解析】【分析】微粒中质子数为各原子的质子数之和,若微粒为分子,质子数=电子数;若微粒为阳离子,电子数=质子数-电荷数;若微粒为阴离子,电子数=质子数+电荷数。本题考查了微粒中质子数和电子数之间的关系,难度不大,明确阳离子中电子数=质子数-电荷数、阴离子中电子数=质子数+电荷数。
【解答】解:方法一:NH 中N原子的质子数为7,H原子的质子数为1,所以NH 的质子数为11,电子数=11-1=10。
A、Na+中质子数为11,电子数=11-1=10;
B、OH-中质子数为9,电子数=9+1=10;
C、H2O中质子数=1×2+8=10,分子中质子数=电子数,故其电子数也为10;
D、LiF中质子数=3+9=12,分子中质子数=电子数,故其电子数也为13;
方法二:由于铵根离子属于阳离子,而要求的微粒和铵根离子具有相同的质子数和电子数,故符合条件的微粒一定是阳离子。
故答案为:A
20.【答案】B
【解析】【分析】根据化学式及元素质量比先计算出各原子的相对原子质量比,再利用相对原子质量及元素质量分数的关系计算化学式中原子个数比分析。
【解答】 化合物A中X所占质量分数为75% ,则Y占25%,设X和Y的相对原子质量分别为a和b
a:4b=75%:25%
a:b=12:1
设B的化学式为XmYn,则12m:n=80%:20%
m:n=1:3
故答案为:B。
21.【答案】C
【解析】【解答】 A、由化学式可知丁烷由碳、氢两种元素组成,故A说法正确;B、元素右下角数字就是该元素的原子个数,所以一个丁烷分子由4个碳原子、10个氢原子构成,故B说法正确;C、根据质量守恒定律可知反应前后元素种类不变,所以丁烷完全燃烧生成二氧化碳和水,故C说法错误;D、打火机主要燃料是丁烷(C4H10),所以丁烷具有可燃性,故D说法正确.故选C.
【分析】A、根据物质的元素组成考虑;B、根据分子的原子构成考虑;C、根据质量守恒定律考虑;D、根据丁烷的用途考虑.
22.【答案】C
【解析】【分析】根据氧气和二氧化碳中碳元素质量即为二氧化碳中碳元素质量及元素质量为物质质量×元素质量分数分析。
【解答】混合气体中碳元素为二氧化碳中碳元素,设混合气体质量为100克,则碳元素质量为24克,二氧化碳质量为,则氧气质量为12克,氧气和二氧化碳质量比为12:88=3:22;
故选C。
23.【答案】D
【解析】【分析】根据二氧化碳和一氧化碳中碳氧元素质量比分析。
【解答】二氧化碳中碳、氧元素质量比为3:8,一氧化碳中碳、氧元素质量比为3:4,现混合气体碳与氧元素质量比为3:5,则由一氧化碳和二氧化碳混合气体组成;
故答案为:D。
24.【答案】C
【解析】【分析】根据样品中氮元素质量与硝酸铵中氮元素质量相等及元素质量分数=相对原子质量×原子个数/相对分子质量分析。
【解答】含氮元素28%的硝酸铵中硝酸锓质量分数为;
故答案为:C。
25.【答案】B
【解析】【分析】根据一个三氧化硫分子比一个二氧化硫分子多一个氧原子,从而计算出一个氧原子质量,再利用题目中所给氧原子质量的标准计算相对分子质量分析。
【解答】 一个SO2分子的质量为n千克,一个SO3分子的质量为m千克 ,则一个氧原子的质量为m-n, 若以一个氧原子质量的 作为相对原子质量的标准,则SO2的相对分子质量为;
故答案为:B。
26.【答案】11;1
【解析】【分析】在化学物中,正负离子所带电荷数的代数和为零,然后根据“失去电子带正电荷,而得到电子带负电荷”推算出x、n的数值。
【解答】(1)化合物NaB所带的电荷数为零。根据“
与形成的化合物为
”可知,Na+带一个单位的正电荷,那么
肯定带一个单位的负电荷,即B-。根据“
与形成的化含物的化分式为 ”可知,二者所带的电荷数相同,电性相反,则
为
,即n=1;
(2)A+是A原子失去1个电子形成的,根据图片可知,A原子核外的电子数为:2+8+1=11。根据“质子数=核外电子数”可知,质子数x=11。
27.【答案】A-33n-16;+(3n+2);-n;R2On+2;2A-18n
【解析】【分析】根据相对分子质量为构成分子的各原子的相对原子质量之和,在化合物中正负化合价代数和为零,进行分析解答.
【解答】(1)某化合物的化学式HnRO2n+1,其相对分子质量为A,设R的相对原子质量为x,则:1×n+x+16×(2n+1)=A,
解得:x=A-33n-16;
即R的相对原子质量为:A-33n-16;
(2)氢元素显+1价,氧元素显-2价,设R元素的化合价是y,
根据在化合物中正负化合价代数和为零,
可得:(+1)×n+y+(-2)×(2n+1)=0,
解得:y=+(3n+2)价.
(3)氢元素显+1价,设原子团RO2n+1的化合价为z,
根据在化合物中正负化合价代数和为零,
可得:(+1)×n+z=0,
解得:z=-n价。
(4)设与氧元素组成化合物的化学式为RaOb,
根据正负化合价代数和为零得到:(3n+2)a+(-2)b=0,
解得:a:b=2:(3n+2);
则化学式为:R2O3n+2;
(5)该化合物的相对分子质量为:2(A-33n-16)+16×(3n+2)=2A-18n。
28.【答案】A;BCE;D;1:2;11:14;H2O
【解析】【分析】(1)只由一种物质组成纯净物,多种物质组成混合物;只由一种元素组成的纯净物叫单质,由两种或多种元素组成的纯净物叫化合物。
(2)根据计算出二氧化碳和一氧化碳的质量之比,再根据碳元素质量=物质质量×碳元素质量分数计算出两种物质中碳元素的质量之比;
(3)分子是保持物质化学性质的最小微粒。
【解答】(1)A:氧气和液氧都是氧气,只是状态不同,它们为只由一种氧元素组成的纯净物,则为单质;
B:氧气和臭氧为两种不同的物质,二者构成混合物;
C:一氧化碳和二氧化碳为两种不同的物质,二者构成混合物;
D:冰和水为同种物质,只是状态不同,因为它们都是由两种元素组成的纯净物,则为化合物;
E:过氧化氢和水是两种不同的物质,二者构成混合物。
那么所盛物质属于单质的是A,属于混合物的是BCE,属于化合物的是D。
(2)设C瓶中CO2和CO所含的氧元素的质量都是m,那么它们的质量之比为:;
则CO2和CO中碳元素的质量比:。
(3)冰是固态的水,分子为H2O,那么D瓶中冰保持化学性质的最小微粒为:H2O。
29.【答案】(1)C
(2)9:8;15%
【解析】【分析】(1)①同种元素,质子数相同,且核外电子数=质子数;中子数=相对原子质量-质子数;
②在元素周期表中,排序的依据就是质子数;
③根据两种铁元素的符号判断。
(2)将两种化合物的化学式适当变形,然后计算氧元素的质量比。用铁的质量分数÷铁元素在 Fe2O3 中的质量分数即可。
【解答】(1)A.Fe﹣57和Fe﹣54的质子数都是26,则它们的原子核外电子数也都是26,而中子数分别为:57-26=31,54-26=28,故A正确不合题意;
B.Fe﹣57和Fe﹣54的质子数都是26,即原子序数相同,故B正确不合题意;
C.Fe﹣57和Fe﹣54均属于铁元素,但是相对原子质量不相同,分别为57和54,故C错误符合题意。
故选C。
(2)铁元素的质量相同,即在分子中铁原子的个数相同,将二者的化学式变形为: 3Fe2O3、2Fe3O4 ,此时化合物中氧原子的个数比为:9:8,则氧元素的质量比为:9:8。
在赤铁矿中, Fe2O3 的含量为:。
30.【答案】m-33n+16
【解析】【分析】相对分子质量就是化学式中各个原子的相对原子质量的总和;
【解答】;
R=m-33n+16;
故答案为:m-33n+16;
31.【答案】(1)质子数(或“核电荷数”)
(2)H2O
(3)Mg(OH)2
【解析】【分析】(1)本题考查了元素种类的决定因素。根据已有的知识进行分析解答,元素的种类与原子的核内质子数有关,据此解答;(2)由两种元素组成的化合物中,其中一种元素是氧化物,这种化合物叫氧化物,根据氧化物的特点进行分析;(3)根据指针写出三种元素能组成的化合物。
【解答】(1)元素之间的根本区别是其核内的质子数(核电荷数)不同;
(2)由两种元素组成的化合物中,其中一种元素是氧化物的是H2O;
(3)时针、分针和秒针指的三种元素分别为Mg、O、H,可以组成化合物Mg(OH)2。
故答案为:(1)质子数(或“核电荷数”);(2)H2O;(3)Mg(OH)2。
32.【答案】化合物;+4;纯净物;+2
【解析】【分析】根据纯净物、混合物的定义分析,纯净物为一种物质组成的物质,混合物为多种物质组成的物质。根据单质、化合物定义分析,单质是由同种元素组成的纯净物,化合物为不同种元素组成的纯净物;根据元素化合价规律分析,单质中元素化合价为0,化合物中各元素化合价代数和为0,所以要计算化合物中某元素化合物时,先确定出其他元素的化合价,再根据化合价规律计算所求元素的化合价。
【解答】 二氧化硅为由两种元素组成的纯净物,属于化合物,硅元素的化合价为+4价; 硫代硫酸钠晶体是一种物质,属于纯净物,其中钠元素化合价为+1价,氧元素为-2价,设硫元素化合价为x,则(+1)2+2x+(-2)3=0,x=+2价;
故答案为:化合物;+4;纯净物;+2.
33.【答案】(1)85
(2)9∶8
(3)27
【解析】【分析】元素质量比=元素的相对原子质量*原子个数的比;
【解答】(1)通过计算可知,平均值为:(84.9克+85.1克+85.0克)÷3=85克;
(2)金属元素质量是45克,所以氧元素质量是85克-45克=40克,所以R元素和氧元素的质量比为9∶8;
(3)设R的相对原子质量为x,所以(2x)∶(3×16)=9∶8 所以x=27;
故答案为:(1)85;(2)9:8;(3)27.
34.【答案】(1)CO;
(2)分子;甲、丙
【解析】【分析】(1)根据微观示意图确定甲的分子构成,从而确定它的化学式;根据丁的化学式确定它的原子构成,从而画出对应的微观示意图;
(2)分子是保持物质化学性质的最小微粒;只由两种元素组成,其中一种为氧元素的化合物叫氧化物。
【解答】(1)甲的微观示意图为:,那么它的分子由一个碳原子和一个氧原子构成,化学式为CO。丁的化学式为H2,它的分子由两个氢原子构成,那么微观示意图为: 。
(2)能保持丙物质化学性质的微粒是分子。根据微观示意图可知,四种物质中,乙和丁只由一种元素组成,肯定不是氧化物;甲和丙都由两种元素组成,其中一种为氧元素,因此为氧化物。
35.【答案】(1)O3
(2)不变
(3)反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子就能对臭氧层产生巨大影响。
【解析】【分析】(1)根据臭氧的分子图片确定组成,据此写出化学式。
(2)根据化学变化的本质解答;
(3)根据图片,确定氯原子在反应中的循环情况对臭氧的影响即可。
【解答】(1)根据图片可知,每个臭氧分子由3个氧原子构成,即化学式为O3;
(2)根据图片可知,过氧化氯为反应物,而同时还是生成物,因此经过①②③后,反应物氯原子的个数不变。
(3)有科学家指出:“少量的氟里昂就能对臭氧层产生巨大的影响”,根据该模型说明理由:反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子就能对臭氧层产生巨大影响。
36.【答案】(1)相互化合的数目
(2)金属元素形成化合物时只能失去电子而不能得到电子;不成立;负
(3)一种元素有多种化合价;+4;一些元素只有一种化合价,一些元素有多种化合价
(4)-3;+5
【解析】【分析】根据元素化合价和原子最外层电子数的关系进行分析;
【举例及分析一】根据金属元素的最外层电子数一般少于4个,在化学反应中容易失去电子进行分析;根据题中非金属元素显示的化合价进行分析;根据非金属和金属形成的化合物是离子化合物进行分析;
【举例及分析二】根据化合价代数和为零进行分析;
【结论二】根据推测一、二中的结论进行分析;
【举例及分析三】根据化合价代数和为零,在计算硝酸铵中氮元素的化合价时,需要分解计算铵根离子、硝酸根离子中氮元素的化合价.
【解答】解:化学上用“化合价”来表示原子之间相互化合的数目;
【举例及分析一】金属元素的最外层电子数一般少于4个,在化学反应中容易失去电子,所以金属都显正价的可能原因为:金属元素形成化合物时只能失去电子而不能得到电子;H2O、SO2、CO2中H、O、S、C元素的化合价分别为+1、﹣2、+4、+4,说明推测二不成立;非金属和金属形成的化合物是离子化合物,金属是失去电子,非金属得到电子,所以金属元素与非金属元素形成化合物时,非金属元素显负价;
【举例及分析二】H2S、SO2、SO3、H2SO3等物质中S元素化合不同,S元素化合价分别为﹣2、+4、+6、+4价,推测二成立;
【结论二】推测一、二都有道理,通过上述举例分析及结合教材上所给元素的化合价,可知一些元素只有一种化合价,一些元素有多种化合价;
【举例及分析三】化合价代数和为零,在计算硝酸铵中氮元素的化合价时,需要分解计算铵根离子、硝酸根离子中氮元素的化合价,所以NH4NO3中N元素的化合价分别为﹣3、+5.
故答案为:相互化合的数目;
【举例及分析一】金属元素形成化合物时只能失去电子而不能得到电子;不成立;负;
【举例及分析二】+4;
【结论二】一些元素只有一种化合价,一些元素有多种化合价;
【举例及分析三】﹣3、+5.
37.【答案】(1)解:mFe=16毫升× ×12.5%×10%=0.4毫克。
(2)解:FeSO4中Fe%= ,mFeSO4= =1.4克× =3.8克。
(3)解:设152克硫酸亚铁中铁的含量相当于质量为x的氧化铁中铁的含量。Fe2O3中Fe%= =70%,152克× =x×70%,x=80克。
【解析】【分析】元素质量分数指某种元素在物质中所占的质量分数是元素质量与物质质量之比。 该题主要考查的是方程思想在元素质量计算中的应用;
【解答】(1)mFe=16毫升× ×12.5%×10%=0.4毫克;
(2)FeSO4中Fe%= ,mFeSO4= m (F e) F e % =1.4克× =3.8克;
(3)设152克硫酸亚铁中铁的含量相当于质量为x的氧化铁中铁的含量
Fe2O3中Fe%= 112 160 =70%
152克× =X×70%
x=80g。
38.【答案】(1)解:碳酸氢铵中氮元素的质量分数是 ×100%=17.7%
(2)解:因为24.1%>17.7%,所以为虚假广告。
(3)解:每袋该化肥中含氮元素的质量为
50千克×11.7%=5.85千克
该产品中碳酸氢铵的质量分数为11.7%÷17.7%×100%=66.1%。
【解析】【分析】(1)根据元素质量分数=相对原子质量×原子个数/相对分子质量分析;
(2)根据纯净物中氮元素质量分数与广告中的对比分析;
(3)根据元素质量=化合物质量×元素质量分数分析。
39.【答案】(1) 尿素中氮元素的质量分数是;
(2) 设 一千克尿素的含氮质量与质量为x的硝酸铵的含氮量相等
1kg47%=x
x=1.3kg;
(3) 取100元分别购买两种化肥
可购硝酸铵中含氮元素质量为
可购买尿素中含氮元素质量为,
所以买硝酸铵更经济;
【解析】【分析】(1)根据元素质量分数=相对原子质量原子个数/相对分子质量分析;
(2)根据元素质量=化合物质量×元素质量分数分析;
(3)根据相同的钱数购买氮元素质量多少来确定经济的肥料分析。
40.【答案】(1)中子
(2)+1
(3)解:重水中氘的质量分数=
100t海水中所含氘的质量=100t×0.02%×20%=0.004t=4kg
答:100t海水中所含的质量为4kg。
【解析】【分析】(1)具有相同质子数和不同中子数的原子成为同位素原子,据此分析解答;
(2)在化学式中,正负化合价的代数和为零,据此分析计算;
(3)首先根据化学式计算出重水中氘的质量分数,在用海水的质量×重水的质量分数×氘的质量分数计算出海水中含有氘的质量。
【解答】(1)根据图片可知,三种原子中 的个数不同,根据“同位素原子中子数不同”可知,它表示中子。
(2)在T2O中O元素的化合价为-2价,根据正负化合价代数和为零得到:2x+(-2)=0,解得:x=+1价。
(3)重水中氘的质量分数= ;
100t海水中所含氘的质量=100t×0.02%×20%=0.004t=4kg;
1 / 1
一、单选题
1.氚是氢的一种同位素,氚原子中含有1个质子和2个中子,下列示意图能正确表示氚原子结构的是( )
A.A B.B C.C D.D
2.下列说法正确的是( )
①地壳中含量最多的金属元素是铝,也就是金属铝
②人体中只含有非金属元素,没有金属元素
③人体中氢、氧元素含量很高,这与水占人体质量的70%以上有关
④地壳中非金属元素的总含量大于金属元素,种类少于金属元素
A.①③④ B.②③④ C.③④ D.①②
3.山林里空气中的自由电子附着在氧分子,上形成负氧离子( ),被称为“空气维生素”,那么 的相对分子质量是( )
A.16 B.32 C.32克 D.33
4.下列化学用语书写错误的是( )
A.硫酸根离子:SO42- B.铁的元素符号:Fe3+
C.碳酸根离子:CO32- D.3个二氧化硫分子:3SO2
5.元素观是化学的重要观念之一,下列有关元素的说法中,错误的是( )
A.元素是具有相同核电荷数的一类原子的总称
B.元素周期表中,元素的原子序数与该元素原子核电荷数在数值上相同
C.同种元素的原子核内质子数与中子数一定相等
D.在物质发生化学变化时,原子的种类不变,元素也不会改变
6.某矿石样本含有如图所示的四种元素,该矿石中可能含有的物质是( )
A.CaCl2 B.SiO2 C.H2O D.Fe2O3
7.某元素R的化合价是奇数(不变化合价),已知其与氧结合形成的化合物的相对分子质量为m,其与氯结合形成的化合物的相对分子质量为n,则R的化合价为( )
A.2(m-n)/55 B.2(n- m)/55 C.(2m-n)/55 D.(2n- m)/55
8.生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。科学家可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代,这种方法称为放射性碳测年法。碳-14原子核中含6个质子和8个中子,在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子,8个中子
B.氮原子核,含7个质子,7个中子
C.碳原子核,含6个质子,7个中子
D.氧原子核,含7个质子,8个中子
9.萨罗(Salon)是一种重要的消毒剂。其分子微观结构模型如图:下列关于萨罗的说法错误的是( )
①该物质的一个分子由二十六个原子构成;②该物质是氧化物;③该物质中碳、氧元素的质量比是156:48;④该物质的相对分子质量是214g;⑤该物质是有机高分子化合物;⑥该物质由碳、氢、氧三个元素组成;⑦该物质的化学式为C13H10O3
A.①③ B.⑦ C.①③⑦ D.②④⑤⑥
10.1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象。由实验得出的结论合理的是( )
A. 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子
B.少数α粒子发生偏移,说明原子核外电子质量较大且带负电
C.极少数α粒子被反弹,说明原子核体积很小、质量较大
D.该实验说明α粒子无法穿透原子与原子间的空隙
11.雄伟壮观的国家大剧院主体建筑表面安装了近 2 万块钛(Ti)金属板。已知 Ti 原子核内有 22个质子,则下列叙述正确的是( )
A.Ti可以表示一个钛原子 B.Ti4+核外有26个电子
C.TiO2中含有氧分子 D.CaTiO3属于氧化物
12.科学上用符号“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知abXn+和cdYm-的核外电子数相等。则下列关系正确的是( )
A.b-a=d-c B.a+n=c-m C.a-n=c+m D.b-n=d+m
13.今年4月,科学家在深海海底发现了大量未来太阳能光伏发电必需的元素——碲。碲元素在周期表中的信息如图所示。下列说法不正确的是( )
A.碲是非金属元素
B.碲的元素符号为Te
C.碲原子的核外电子数为52
D.碲元素的相对原子质量为127.6克
14.在科学王国里,数字被赋予了丰富的内涵。对下列化学用语中数字“2”的说法正确的是( )
①2H ②2NH3 ③SO2 ④ ⑤Mg2+ ⑥2OH- ⑦H2O
A.表示离子个数的是⑤⑥ B.表示离子所带电荷数的是④⑤
C.表示分子中原子个数的是③⑦ D.表示分子个数的是①②
15.下列氢原子的各种模型图中,正确的是( )
A. B. C. D.
16.将乙酸(CH3COOH)和葡萄糖(C6H12O6)溶于水得到混合溶液,测得溶液中氢元素的质量分数为a,则溶液中碳元素的质量分数为( )
A.1-9a B.1-8a C.12a D.8a
17.由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知 S 元素的质量分数W(S)=a%,则 O元素的质量分数W(O)为( )
A.1-1.75a% B.1.75a% C.1.25a% D.无法计算
18.某同学学了元素和物质的知识后,进行梳理,其中不正确的是( )
A.铁元素的质量分数由高到低:Fe3O4>Fe2O3>FeS
B.钙的化合物相对分子质量由大到小:CaCO3>CaCl2>Ca(OH)2
C.地壳中元素的含量由高到低:O> Si> Al
D.锰元素的化合价由高到低:KMnO4>K2MnO4 >MnO2
19.与铵根离子(NH )具有相同的质子数和电子数的微粒是( )
A.Na+ B.OH- C.H2O D.LiF
20.有两种元素X和Y,它们化合成两种化合物A和B,化合物A中X所占质量分数为75%,化合物B中X占80%。已知A的化学式为XY4,则B的化学式为( )
A.XY2 B.XY3 C.X2Y3 D.X3Y2
21.学习化学知识后,观察物质世界就要从化学视角看.下列对打火机主要燃料丁烷(C4H10)的看法不正确的是()
A.从组成上看:丁烷由碳、氢两种元素组成
B.从结构上看:一个丁烷分子由4个碳原子、10个氢原子构成
C.从变化上看:丁烷完全燃烧只生成水
D.从性质上看:丁烷具有可燃性
22.在O2和CO2的混合气体中,碳元素的质量分数是24%,则O2和CO2的质量比是( )
A.2∶5 B.3∶1 C.3∶22 D.8∶11
23.由碳、氧两种元素组成的气体中,碳与氧的质量比为3:5,则该气体可能是( )
A.只由CO组成的纯净物 B.只由CO2组成的纯净物
C.由CO2和O2共同组成的混合物 D.由CO和CO2共同组成的混合物
24.某硝酸铵(NH4NO3)样品中(杂质不含氮)氮元素的质量分数为28%,则其中硝酸铵的质量分数为( )
A.20% B.70% C.80% D.无法计算
25.已知一个SO2分子的质量为n千克,一个SO3分子的质量为m千克(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的 作为相对原子质量的标准,则SO2的相对分子质量为( )
A. B. C. D.
二、填空题
26.元素的阳离子结构示意图为,元素的阴离子比多8个电子,与形成的化合物为,与形成的化含物的化分式为,请回答: ,
27.某化合物的化学式为HnRO2n+1,其相对分子质量为A,则R的相对原子质量为 。R元素的化合价为 ,原子团RO2n+1的化合价为 。当R的化合价不变时,其与氧元素组成的化合物的化学式为 ,相对分子质量是 。
28.下列分别盛有不同物质的容器中,所盛物质属于单质的是 ,属于混合物的是 ,属于化合物的是 (均填容器下的字母)。若C瓶中CO2和CO所含的氧元素的质量相等,则CO2和CO中碳元素的质量比为 ,CO2和CO的质量比为 。D瓶中保持冰化学性质的最小粒子是 (填化学式)。
29.嫦娥四号月球探测器登上月球背面,成为世界首个着落在月球背面的探测器。此后,嫦娥四号通过“鹊桥”中继星向世界展现了首张月背的完整风貌。其实看似荒凉的月球矿产资源极为丰富。以铁为例,仅月面表层5厘米厚的沙土就含有上亿吨铁。
(1)科学研究发现,月球上富含铁的同位素:Fe﹣57(一个原子内质子数与中子数之和为57)和Fe﹣54,已知铁元素为26号元素,则下列相关说法错误的是_________。
A.Fe﹣57和Fe﹣54原子核外电子数相同,中子数不同
B.Fe﹣57和Fe﹣54在元素周期表中占同一个位置
C.Fe﹣57和Fe﹣54均属于铁元素,所以相对原子质量相同
(2)地球上的铁主要以氧化物形式存在,在Fe2O3、Fe3O4两种化合物中,与等质量铁元素相结合的氧元素的质量比为 ;某赤铁矿(主要成分为Fe2O3,且其它成分不含铁)探明含铁量为10.5%,则Fe2O3含量为 (以百分数的形式表示)。
30.某化合物的化学式为HnRO2n-1,若此化合物的相对分子质量为m,则元素R的相对原子质量为 。
31.小明利用12种元素制作了一张如图所示的“元素钟面”。
(1)钟面上的这些元素之间最根本的区别是 不同。
(2)小明根据钟面上提供的元素,写出了下列三种物质的化学式:O2、H2O和NaNO3,其中属于氧化物的是 。
(3)此刻钟面上的时针、分针和秒针分别指向三种不同元素,请写出由这三种元素组成的化合物 。(用化学式表示)
32.黄蜡石质地堪比翡翠美玉,具有极高的欣赏和收藏价值,黄蜡石的主要成分为二氧化硅。二氧化硅(SiO2)属于 (填“单质”或“化合物”),二氧化硅中硅元素的化合价为 价。进行固体熔化实验时常用的药品是硫代硫酸钠晶体(Na2S2O3·5H2O),该物质属于 (填“纯净物”或“混合物”),其中硫元素的化合价是 价。
33.一瓶未贴标签的粉末状常见金属R。为了测定R的相对原子质量,准确称取一定量金属粉末,在坩埚内加强热使其完全氧化,冷却后再称重。重复实验,获得如表数据。请回答:
实验次数 金属质量/克 金属氧化物质量/克
1 45.0 84.9
2 45.0 85.1
3 45.0 85.0
平均值 45.0 m
(1)表格中m= 。
(2)该金属氧化物(R元素和氧元素两种)中,R元素和氧元素的质量比为 。
(3)已知R的化合价为+3价,则R的相对原子质量为 。
34.在宏观、微观和符号之间建立联系是化学学科的特点.甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于下表:
物质 甲 乙 丙 丁 图例: ﹣﹣氢原子 ﹣﹣碳原子 ﹣﹣氧原子
化学式 ? C H2O H2
微观 示意图 ?
(1)请写出甲物质的化学式 ,画出丁物质的微观示意图 .
(2)能保持丙物质化学性质的微粒是 (填“分子”或“原子”),四种物质中属于氧化物的有 (填“甲、乙、丙、丁”).
三、实验探究题
35.2022年,首届完全实现“碳中和”的冬奥会在北京举办。其中,国家速滑馆的二氧化碳跨临界直冷制冰技术应用成为了外界关注的热点。它取代氟利昂这一类对环境污染较大的人工合成制冷剂,更为环保、节能。氟利昂是一种常见的制冷剂,它在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
(1)请写出臭氧的化学式 ;
(2)经过①②③的反应后,反应物氯原子的个数 (“减少”、“增加”或“不变”);
(3)有科学家指出:“少量的氟里昂就能对臭氧层产生巨大的影响”,请你根据该模型说明理由: 。
36.化合价是一个重要的化学概念.
(1)下面是对元素化合价的部分探究过程.
化学上用“化合价”来表示原子之间 .
(2)【提出问题一】元素正负化合价有何规律?
推测一:金属元素都显正价;
推测二:非金属元素只有负价.
【举例及分析一】
①.NaCl、FeO、Al2O3中金属元素化合价分别为+1、+2、+3,其他金属也都显正价,推测一正确.金属都显正价的可能原因为 .
②.H2O、SO2、CO2中H、O、S、C元素的化合价分别为+1、﹣2、+4、+4,说明推测二 (填“成立”或“不成立”).
③金属元素与非金属元素形成化合物时,非金属元素显 价.
(3)【提出问题二】一种元素只有一种化合价吗?
推测一:一种元素只有一种化合价;
推测二: .
【举例及分析二】
①NaCl、NaOH、NaNO3、Na2SO4等物质中Na元素都显+1价,推测一成立.
②H2S、SO2、SO3、H2SO3等物质中S元素化合不同,S元素化合价分别为﹣2、+4、+6、 价.推测二成立.
【结论二】推测一、二都有道理,通过上述举例分析及结合教材上所给元素的化合价,可知
(4)【提出问题三】在同种化合物中,同种元素一定具有相同的化合价吗?
推测一:在同种化合物中,同种元素一定具有相同的化合价;
推测二:在同种化合物中,同种元素不一定具有相同的化合价.
【举例及分析三】NH4NO3中N元素的化合价分别为 、 .
【结论三】推测二成立.
四、分析计算题
37.现代生活中,人们越来越注重对微量元素的摄入。血红蛋白中的铁是人体内氧的输送者,缺铁易患贫血。请回答:
(1)一种添加了营养剂的“铁强化”酱油已上市,根据卫生部制定的铁强化剂添加标准,每100毫升酱油中铁营养剂的添加量是200毫克,该铁营养剂中铁的质量分数为12.5%,由实验测知,酱油中的铁只有10%能被人体吸收,以某人一天食用16毫升该酱油计算,他一天从酱油中吸收的铁元素有多少毫克?
(2)小明的妈妈最近身体虚弱,脸色苍白且厌食,医生诊断说她患缺铁性贫血,除正常饮食吸收的铁元素外,建议服用硫酸亚铁(FeSO4)口服液。若小明的妈妈共需要补充1.4克铁元素,需要服用多少克硫酸亚铁?
(3)152克硫酸亚铁中铁的含量相当于多少克氧化铁中铁的含量?
38.某化肥厂的墙体上做了一个大型户外广告,如图所示,根据相关信息回答。
(1)碳酸氢铵中氮元素的质量分数是多少?(精确到0.1%)
(2)通过计算判断该广告属于“真实”或“虚假”广告?
(3)当地质检部门对该厂生产的化肥做了质量检测,该化肥的实际含氮量仅有11.7%,试计算每袋这样的化肥实际含氮量是多少?该产品中碳酸氢铵的质量分数为多少?(要求写出计算过程)
39.某同学发现他家菜园中的蔬菜生长迟缓,准备到市场上购买氮肥,硝酸铵和尿素是两种常见的氮肥,每千克售价如下:
氮肥 化学式 每千克的售价
硝酸铵 NH4NO3 10元
尿素 CO(NH2)2 16元
根据表格回答计算分析问题(写出计算过程,保留2个有效数字):
(1)尿素中氮元素的质量分数是多少?
(2)一千克尿素的含氮质量与多少千克硝酸铵的含氮量相等?
(3)根据尿素和硝酸铵含氮的比例分析,计算说明哪种化肥更经济。
40.氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如下表。试回答:
名称 符号 相对原子质量
氕 H 1
氘 D 2
氚 T 3
(1)原子结构模型中的“ ”表示的粒子是 。
(2)超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O。T2O中T的化合价为 。
(3)重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100吨海水中所含氘的质量是多少
答案解析部分
1.【答案】A
【解析】【分析】根据氚原子的组成分析,结合图示中各粒子的带电情况解答。
【解答】 氚原子中含有1个质子和2个中子, 核外一个带负电荷的电子,由图示可知,A正确;
故选A。
2.【答案】C
【解析】【分析】根据地壳、人体中元素的含量分析。
【解答】①地壳中含量最多的金属元素是铝,指的是铝元素,错误;②人体中含有大量的钙元素,钙元素属于金属元素,错误;③人体中氢、氧元素含量很高,这与水占人体质量的70%以上有关,正确;④地壳中非金属元素的总含量大于金属元素,种类少于金属元素,正确;
故选C。
3.【答案】B
【解析】【分析】根据相对分子质量是各原子的相对原子质量总和分析。
【解答】 O2-的相对分子质量是 16×=32。
故选B。
4.【答案】B
【解析】【分析】元素符号的意义:一、宏观上说表示一种元素;微观上说表示这种元素的一个原子.二、对直接有原子构成的物质,还可以表示这种单质;
【解答】B、Fe3+中表示是铁的离子;而不是铁元素;故B错误;
故答案为:B;
5.【答案】C
【解析】【分析】元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称。
【解答】元素的概念是具有相同核电荷数(即核内质子数)的一类原子的总称,同种元素的质子数一定相等,中子数不一定相等。
故答案为:C。
6.【答案】B
【解析】【分析】根据图示中所给元素种类及所给物质的元素种类分析。
【解答】由图示可知,该矿石中含有氧、硅、硫、钙元素,A中氯元素不含,C中氢元素不含,D中铁元素不含;
故答案为:B。
7.【答案】D
【解析】【分析】O的化合价为-2,Cl的化合价为-1,根据正负化合价代数和为零推算出化合物的化学式,然后根据“相对分子质量等于相对原子质量与个数的乘积之和”列出两个方程,从而计算出R的化学式。
【解答】设R的化合价为x,R的相对原子质量为y。
当R的化合价为奇数时,形成化合物的化学式分别为:R2Ox、RClx;
那么得到:2y+16x=m;
y+35.5x=n
解得:
。
故选D。
8.【答案】B
【解析】【分析】根据质子数为7的原子为氮原子分析。
【解答】 碳-14原子核中含6个质子和8个中子,在衰变时,一个中子变成质子,形成新的原子核 ,则新原子核内7个质子,7个中子,即为氮原子核;
故选B。
9.【答案】D
【解析】【分析】根据结构图中物质的分子构成,确定物质的化学式,再由化学式确定一个分子中的原子个数、元素的质量比、相对分子质量分析。
【解答】 ①由结构图可知该物质的一个分子由二十六个原子构成,正确;②该物质由碳、氢、氧三种元素组成,不是氧化物,错误;③该物质中碳、氧元素的质量比是(12×13):(16×3)=156:48,正确;④该物质的相对分子质量是214,错误;⑤该物质不是有机高分子化合物,错误;⑥该物质由碳、氢、氧三种元素组成,元素不论个数,错误;⑦该物质的化学式为C13H10O3,正确;
故选D。
10.【答案】C
【解析】【分析】根据原子结构的知识判断。
【解答】A.多数α粒子直接穿过,这说明原子核外绝大部分空间是空的,但是还有电子的存在,故A错误;
B.少数α粒子发生偏移,是因为受到原子核内质子所带正电荷的排斥作用,这说明原子核的质量很大,几乎占据了整个原子的全部质量,故B错误;
C.极少数α粒子被反弹,说明原子核体积很小、质量较大,故C正确;
D.该实验说明α粒子可以穿透原子与原子间的空隙,故D错误。
故选C。
11.【答案】A
【解析】【分析】A、根据元素符号的含义分析;
B、根据离子与原子转化的方法分析;
C、根据分子中含有原子分析;
D、根据氧化物定义分析,氧化物要由两种元素其中一种是氧元素组成。
【解答】A、元素符号除表示一种元素外,还可表示该元素的一个原子,正确;
B、 Ti4+是钛原子失去4个电子形成的,所以核外有18个电子,错误;
C、 TiO2中含有氧原子,不含氧分子,错误;
D、 CaTiO3由三种元素组成,不属于氧化物 ,错误;
故答案为:A。
12.【答案】C
【解析】【分析】本题为分析题,结合本节所学知识点,分析题意即可得出答案。科学上把具有相同核电荷数(即质子数)的一类原子总称为元素。原子中核内的质子数相同、中子数不相同的同类原子统称为同位素。
【解答】“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和,则因为abXn+和cdYm-的核外电子数分别为a-n和c+m,所以a-n=c+m。
故答案为C.
13.【答案】D
【解析】【分析】根据元素周期表小格中信息分析,元素周期表小格中左上角为原子序数,在原子中,原子序数=质子数=核电荷数=电子数,右上角为元素符号,中间为元素名称,最下面为相对原子质量。
【解答】A、碲名称还“石”,为非金属元素,不符合题意;
B、 碲的元素符号为Te ,不符合题意;
C、 碲原子的核外电子数=质子数=原子序数=52 ,不符合题意;
D、相对原子质量是比值,单位为“1”不是“g”,符合题意;
故答案为:D。
14.【答案】C
【解析】【分析】根据符号前数字表示粒子的个数、元素符号右上角数字表示离子所带电荷数、元素符号右下角数字表示一个分子中原子个数、元素符号正上方数字表示元素化合价分析。
【解答】A、 ⑤ 中2表示一个镁离子带2个单位的正电荷,不符合题意;
B、 ④ 中2 表示元素的化合价,不符合题意;
C、 ③⑦ 中2都在元素符号右下角,表示一个分子中的原子个数,符合题意;
D、 ① 中2表示原子个数,不符合题意;
故答案为:C。
15.【答案】A
【解析】【分析】根据氢原子的构成分析。
【解答】氢原子核内只有一个质子,没有中子,核外一个电子;
故答案为:A。
16.【答案】A
【解析】【分析】根据乙酸、葡萄糖、水中,氢原子和氧原子的个数比均为2:1,进行分析解答。
【解答】乙酸和葡萄糖中氢、氧原子个数比为2:1,水中氢、氧原子个数比也为2:1,所以形成溶液中氢、氧元素质量比为1:8,氢元素质量分数为a,则氧元素质量分数为8a,所以碳元素质量分数为1-9a;
故答案为:A。
17.【答案】A
【解析】【分析】将化学式变形,利用S元素的质量分数计算出Mg元素的质量分数,最后根据“三者的质量分子之和等于1”计算O元素的质量分数。
【解答】Na的相对原子质量为23,H的相对原子质量为1,而Mg的相对分子质量为24,则NaH=S,则三种物质的化学式可转换为:MgS、MgSO4、MgSO3 。
S元素的质量分数为a%;
则MgS的质量分数应该为:。
则O元素的质量分数为:1-1.75a%。
故选A。
18.【答案】B
【解析】【分析】(1)元素的质量分数=分析;
(2)相对分子质量等于相对原子质量与个数的乘积之和;
(3)根据地壳中的元素含量分布分析;
(4)在化学式中,正负化合价的代数和为零,据此计算出化合价进行比较即可。
【解答】A.要比较这三种物质中铁元素的质量分数大小,可以将这三种物质的化学式分别改写为:Fe6O8、Fe6O9、Fe6S6,因为硫原子的相对原子质量是氧原子的2倍,故Fe6S6还可以改写为Fe6O12;铁原子的个数相同,则氧原子对应的相对质量越小,铁元素的质量分数越大,故铁元素的质量分数由高到低:Fe3O4>Fe2O3>FeS,故A正确不合题意;
B.CaCO3的相对分子量为100,CaCl2的相对分子量为111,Ca(OH)2的相对分子量为74,故钙的化合物相对分子量由大到小:CaCl2>CaCO3>Ca(OH)2,故B错误符合题意;
C.地壳中元素的含量由高到低:O>Si>Al,故C正确不合题意;
D.KMnO4中锰元素为+7价,K2MnO4中锰元素为+6价,MnO2中锰元素为+4价,锰元素的化合价由高到低:KMnO4>K2MnO4>MnO2,故D正确不合题意。
故选B。
19.【答案】A
【解析】【分析】微粒中质子数为各原子的质子数之和,若微粒为分子,质子数=电子数;若微粒为阳离子,电子数=质子数-电荷数;若微粒为阴离子,电子数=质子数+电荷数。本题考查了微粒中质子数和电子数之间的关系,难度不大,明确阳离子中电子数=质子数-电荷数、阴离子中电子数=质子数+电荷数。
【解答】解:方法一:NH 中N原子的质子数为7,H原子的质子数为1,所以NH 的质子数为11,电子数=11-1=10。
A、Na+中质子数为11,电子数=11-1=10;
B、OH-中质子数为9,电子数=9+1=10;
C、H2O中质子数=1×2+8=10,分子中质子数=电子数,故其电子数也为10;
D、LiF中质子数=3+9=12,分子中质子数=电子数,故其电子数也为13;
方法二:由于铵根离子属于阳离子,而要求的微粒和铵根离子具有相同的质子数和电子数,故符合条件的微粒一定是阳离子。
故答案为:A
20.【答案】B
【解析】【分析】根据化学式及元素质量比先计算出各原子的相对原子质量比,再利用相对原子质量及元素质量分数的关系计算化学式中原子个数比分析。
【解答】 化合物A中X所占质量分数为75% ,则Y占25%,设X和Y的相对原子质量分别为a和b
a:4b=75%:25%
a:b=12:1
设B的化学式为XmYn,则12m:n=80%:20%
m:n=1:3
故答案为:B。
21.【答案】C
【解析】【解答】 A、由化学式可知丁烷由碳、氢两种元素组成,故A说法正确;B、元素右下角数字就是该元素的原子个数,所以一个丁烷分子由4个碳原子、10个氢原子构成,故B说法正确;C、根据质量守恒定律可知反应前后元素种类不变,所以丁烷完全燃烧生成二氧化碳和水,故C说法错误;D、打火机主要燃料是丁烷(C4H10),所以丁烷具有可燃性,故D说法正确.故选C.
【分析】A、根据物质的元素组成考虑;B、根据分子的原子构成考虑;C、根据质量守恒定律考虑;D、根据丁烷的用途考虑.
22.【答案】C
【解析】【分析】根据氧气和二氧化碳中碳元素质量即为二氧化碳中碳元素质量及元素质量为物质质量×元素质量分数分析。
【解答】混合气体中碳元素为二氧化碳中碳元素,设混合气体质量为100克,则碳元素质量为24克,二氧化碳质量为,则氧气质量为12克,氧气和二氧化碳质量比为12:88=3:22;
故选C。
23.【答案】D
【解析】【分析】根据二氧化碳和一氧化碳中碳氧元素质量比分析。
【解答】二氧化碳中碳、氧元素质量比为3:8,一氧化碳中碳、氧元素质量比为3:4,现混合气体碳与氧元素质量比为3:5,则由一氧化碳和二氧化碳混合气体组成;
故答案为:D。
24.【答案】C
【解析】【分析】根据样品中氮元素质量与硝酸铵中氮元素质量相等及元素质量分数=相对原子质量×原子个数/相对分子质量分析。
【解答】含氮元素28%的硝酸铵中硝酸锓质量分数为;
故答案为:C。
25.【答案】B
【解析】【分析】根据一个三氧化硫分子比一个二氧化硫分子多一个氧原子,从而计算出一个氧原子质量,再利用题目中所给氧原子质量的标准计算相对分子质量分析。
【解答】 一个SO2分子的质量为n千克,一个SO3分子的质量为m千克 ,则一个氧原子的质量为m-n, 若以一个氧原子质量的 作为相对原子质量的标准,则SO2的相对分子质量为;
故答案为:B。
26.【答案】11;1
【解析】【分析】在化学物中,正负离子所带电荷数的代数和为零,然后根据“失去电子带正电荷,而得到电子带负电荷”推算出x、n的数值。
【解答】(1)化合物NaB所带的电荷数为零。根据“
与形成的化合物为
”可知,Na+带一个单位的正电荷,那么
肯定带一个单位的负电荷,即B-。根据“
与形成的化含物的化分式为 ”可知,二者所带的电荷数相同,电性相反,则
为
,即n=1;
(2)A+是A原子失去1个电子形成的,根据图片可知,A原子核外的电子数为:2+8+1=11。根据“质子数=核外电子数”可知,质子数x=11。
27.【答案】A-33n-16;+(3n+2);-n;R2On+2;2A-18n
【解析】【分析】根据相对分子质量为构成分子的各原子的相对原子质量之和,在化合物中正负化合价代数和为零,进行分析解答.
【解答】(1)某化合物的化学式HnRO2n+1,其相对分子质量为A,设R的相对原子质量为x,则:1×n+x+16×(2n+1)=A,
解得:x=A-33n-16;
即R的相对原子质量为:A-33n-16;
(2)氢元素显+1价,氧元素显-2价,设R元素的化合价是y,
根据在化合物中正负化合价代数和为零,
可得:(+1)×n+y+(-2)×(2n+1)=0,
解得:y=+(3n+2)价.
(3)氢元素显+1价,设原子团RO2n+1的化合价为z,
根据在化合物中正负化合价代数和为零,
可得:(+1)×n+z=0,
解得:z=-n价。
(4)设与氧元素组成化合物的化学式为RaOb,
根据正负化合价代数和为零得到:(3n+2)a+(-2)b=0,
解得:a:b=2:(3n+2);
则化学式为:R2O3n+2;
(5)该化合物的相对分子质量为:2(A-33n-16)+16×(3n+2)=2A-18n。
28.【答案】A;BCE;D;1:2;11:14;H2O
【解析】【分析】(1)只由一种物质组成纯净物,多种物质组成混合物;只由一种元素组成的纯净物叫单质,由两种或多种元素组成的纯净物叫化合物。
(2)根据计算出二氧化碳和一氧化碳的质量之比,再根据碳元素质量=物质质量×碳元素质量分数计算出两种物质中碳元素的质量之比;
(3)分子是保持物质化学性质的最小微粒。
【解答】(1)A:氧气和液氧都是氧气,只是状态不同,它们为只由一种氧元素组成的纯净物,则为单质;
B:氧气和臭氧为两种不同的物质,二者构成混合物;
C:一氧化碳和二氧化碳为两种不同的物质,二者构成混合物;
D:冰和水为同种物质,只是状态不同,因为它们都是由两种元素组成的纯净物,则为化合物;
E:过氧化氢和水是两种不同的物质,二者构成混合物。
那么所盛物质属于单质的是A,属于混合物的是BCE,属于化合物的是D。
(2)设C瓶中CO2和CO所含的氧元素的质量都是m,那么它们的质量之比为:;
则CO2和CO中碳元素的质量比:。
(3)冰是固态的水,分子为H2O,那么D瓶中冰保持化学性质的最小微粒为:H2O。
29.【答案】(1)C
(2)9:8;15%
【解析】【分析】(1)①同种元素,质子数相同,且核外电子数=质子数;中子数=相对原子质量-质子数;
②在元素周期表中,排序的依据就是质子数;
③根据两种铁元素的符号判断。
(2)将两种化合物的化学式适当变形,然后计算氧元素的质量比。用铁的质量分数÷铁元素在 Fe2O3 中的质量分数即可。
【解答】(1)A.Fe﹣57和Fe﹣54的质子数都是26,则它们的原子核外电子数也都是26,而中子数分别为:57-26=31,54-26=28,故A正确不合题意;
B.Fe﹣57和Fe﹣54的质子数都是26,即原子序数相同,故B正确不合题意;
C.Fe﹣57和Fe﹣54均属于铁元素,但是相对原子质量不相同,分别为57和54,故C错误符合题意。
故选C。
(2)铁元素的质量相同,即在分子中铁原子的个数相同,将二者的化学式变形为: 3Fe2O3、2Fe3O4 ,此时化合物中氧原子的个数比为:9:8,则氧元素的质量比为:9:8。
在赤铁矿中, Fe2O3 的含量为:。
30.【答案】m-33n+16
【解析】【分析】相对分子质量就是化学式中各个原子的相对原子质量的总和;
【解答】;
R=m-33n+16;
故答案为:m-33n+16;
31.【答案】(1)质子数(或“核电荷数”)
(2)H2O
(3)Mg(OH)2
【解析】【分析】(1)本题考查了元素种类的决定因素。根据已有的知识进行分析解答,元素的种类与原子的核内质子数有关,据此解答;(2)由两种元素组成的化合物中,其中一种元素是氧化物,这种化合物叫氧化物,根据氧化物的特点进行分析;(3)根据指针写出三种元素能组成的化合物。
【解答】(1)元素之间的根本区别是其核内的质子数(核电荷数)不同;
(2)由两种元素组成的化合物中,其中一种元素是氧化物的是H2O;
(3)时针、分针和秒针指的三种元素分别为Mg、O、H,可以组成化合物Mg(OH)2。
故答案为:(1)质子数(或“核电荷数”);(2)H2O;(3)Mg(OH)2。
32.【答案】化合物;+4;纯净物;+2
【解析】【分析】根据纯净物、混合物的定义分析,纯净物为一种物质组成的物质,混合物为多种物质组成的物质。根据单质、化合物定义分析,单质是由同种元素组成的纯净物,化合物为不同种元素组成的纯净物;根据元素化合价规律分析,单质中元素化合价为0,化合物中各元素化合价代数和为0,所以要计算化合物中某元素化合物时,先确定出其他元素的化合价,再根据化合价规律计算所求元素的化合价。
【解答】 二氧化硅为由两种元素组成的纯净物,属于化合物,硅元素的化合价为+4价; 硫代硫酸钠晶体是一种物质,属于纯净物,其中钠元素化合价为+1价,氧元素为-2价,设硫元素化合价为x,则(+1)2+2x+(-2)3=0,x=+2价;
故答案为:化合物;+4;纯净物;+2.
33.【答案】(1)85
(2)9∶8
(3)27
【解析】【分析】元素质量比=元素的相对原子质量*原子个数的比;
【解答】(1)通过计算可知,平均值为:(84.9克+85.1克+85.0克)÷3=85克;
(2)金属元素质量是45克,所以氧元素质量是85克-45克=40克,所以R元素和氧元素的质量比为9∶8;
(3)设R的相对原子质量为x,所以(2x)∶(3×16)=9∶8 所以x=27;
故答案为:(1)85;(2)9:8;(3)27.
34.【答案】(1)CO;
(2)分子;甲、丙
【解析】【分析】(1)根据微观示意图确定甲的分子构成,从而确定它的化学式;根据丁的化学式确定它的原子构成,从而画出对应的微观示意图;
(2)分子是保持物质化学性质的最小微粒;只由两种元素组成,其中一种为氧元素的化合物叫氧化物。
【解答】(1)甲的微观示意图为:,那么它的分子由一个碳原子和一个氧原子构成,化学式为CO。丁的化学式为H2,它的分子由两个氢原子构成,那么微观示意图为: 。
(2)能保持丙物质化学性质的微粒是分子。根据微观示意图可知,四种物质中,乙和丁只由一种元素组成,肯定不是氧化物;甲和丙都由两种元素组成,其中一种为氧元素,因此为氧化物。
35.【答案】(1)O3
(2)不变
(3)反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子就能对臭氧层产生巨大影响。
【解析】【分析】(1)根据臭氧的分子图片确定组成,据此写出化学式。
(2)根据化学变化的本质解答;
(3)根据图片,确定氯原子在反应中的循环情况对臭氧的影响即可。
【解答】(1)根据图片可知,每个臭氧分子由3个氧原子构成,即化学式为O3;
(2)根据图片可知,过氧化氯为反应物,而同时还是生成物,因此经过①②③后,反应物氯原子的个数不变。
(3)有科学家指出:“少量的氟里昂就能对臭氧层产生巨大的影响”,根据该模型说明理由:反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子就能对臭氧层产生巨大影响。
36.【答案】(1)相互化合的数目
(2)金属元素形成化合物时只能失去电子而不能得到电子;不成立;负
(3)一种元素有多种化合价;+4;一些元素只有一种化合价,一些元素有多种化合价
(4)-3;+5
【解析】【分析】根据元素化合价和原子最外层电子数的关系进行分析;
【举例及分析一】根据金属元素的最外层电子数一般少于4个,在化学反应中容易失去电子进行分析;根据题中非金属元素显示的化合价进行分析;根据非金属和金属形成的化合物是离子化合物进行分析;
【举例及分析二】根据化合价代数和为零进行分析;
【结论二】根据推测一、二中的结论进行分析;
【举例及分析三】根据化合价代数和为零,在计算硝酸铵中氮元素的化合价时,需要分解计算铵根离子、硝酸根离子中氮元素的化合价.
【解答】解:化学上用“化合价”来表示原子之间相互化合的数目;
【举例及分析一】金属元素的最外层电子数一般少于4个,在化学反应中容易失去电子,所以金属都显正价的可能原因为:金属元素形成化合物时只能失去电子而不能得到电子;H2O、SO2、CO2中H、O、S、C元素的化合价分别为+1、﹣2、+4、+4,说明推测二不成立;非金属和金属形成的化合物是离子化合物,金属是失去电子,非金属得到电子,所以金属元素与非金属元素形成化合物时,非金属元素显负价;
【举例及分析二】H2S、SO2、SO3、H2SO3等物质中S元素化合不同,S元素化合价分别为﹣2、+4、+6、+4价,推测二成立;
【结论二】推测一、二都有道理,通过上述举例分析及结合教材上所给元素的化合价,可知一些元素只有一种化合价,一些元素有多种化合价;
【举例及分析三】化合价代数和为零,在计算硝酸铵中氮元素的化合价时,需要分解计算铵根离子、硝酸根离子中氮元素的化合价,所以NH4NO3中N元素的化合价分别为﹣3、+5.
故答案为:相互化合的数目;
【举例及分析一】金属元素形成化合物时只能失去电子而不能得到电子;不成立;负;
【举例及分析二】+4;
【结论二】一些元素只有一种化合价,一些元素有多种化合价;
【举例及分析三】﹣3、+5.
37.【答案】(1)解:mFe=16毫升× ×12.5%×10%=0.4毫克。
(2)解:FeSO4中Fe%= ,mFeSO4= =1.4克× =3.8克。
(3)解:设152克硫酸亚铁中铁的含量相当于质量为x的氧化铁中铁的含量。Fe2O3中Fe%= =70%,152克× =x×70%,x=80克。
【解析】【分析】元素质量分数指某种元素在物质中所占的质量分数是元素质量与物质质量之比。 该题主要考查的是方程思想在元素质量计算中的应用;
【解答】(1)mFe=16毫升× ×12.5%×10%=0.4毫克;
(2)FeSO4中Fe%= ,mFeSO4= m (F e) F e % =1.4克× =3.8克;
(3)设152克硫酸亚铁中铁的含量相当于质量为x的氧化铁中铁的含量
Fe2O3中Fe%= 112 160 =70%
152克× =X×70%
x=80g。
38.【答案】(1)解:碳酸氢铵中氮元素的质量分数是 ×100%=17.7%
(2)解:因为24.1%>17.7%,所以为虚假广告。
(3)解:每袋该化肥中含氮元素的质量为
50千克×11.7%=5.85千克
该产品中碳酸氢铵的质量分数为11.7%÷17.7%×100%=66.1%。
【解析】【分析】(1)根据元素质量分数=相对原子质量×原子个数/相对分子质量分析;
(2)根据纯净物中氮元素质量分数与广告中的对比分析;
(3)根据元素质量=化合物质量×元素质量分数分析。
39.【答案】(1) 尿素中氮元素的质量分数是;
(2) 设 一千克尿素的含氮质量与质量为x的硝酸铵的含氮量相等
1kg47%=x
x=1.3kg;
(3) 取100元分别购买两种化肥
可购硝酸铵中含氮元素质量为
可购买尿素中含氮元素质量为,
所以买硝酸铵更经济;
【解析】【分析】(1)根据元素质量分数=相对原子质量原子个数/相对分子质量分析;
(2)根据元素质量=化合物质量×元素质量分数分析;
(3)根据相同的钱数购买氮元素质量多少来确定经济的肥料分析。
40.【答案】(1)中子
(2)+1
(3)解:重水中氘的质量分数=
100t海水中所含氘的质量=100t×0.02%×20%=0.004t=4kg
答:100t海水中所含的质量为4kg。
【解析】【分析】(1)具有相同质子数和不同中子数的原子成为同位素原子,据此分析解答;
(2)在化学式中,正负化合价的代数和为零,据此分析计算;
(3)首先根据化学式计算出重水中氘的质量分数,在用海水的质量×重水的质量分数×氘的质量分数计算出海水中含有氘的质量。
【解答】(1)根据图片可知,三种原子中 的个数不同,根据“同位素原子中子数不同”可知,它表示中子。
(2)在T2O中O元素的化合价为-2价,根据正负化合价代数和为零得到:2x+(-2)=0,解得:x=+1价。
(3)重水中氘的质量分数= ;
100t海水中所含氘的质量=100t×0.02%×20%=0.004t=4kg;
1 / 1
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
