2023年浙江省八年级下册科学期末考试专题练——解答题2(含解析)
文档属性
| 名称 | 2023年浙江省八年级下册科学期末考试专题练——解答题2(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 118.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-06-06 18:13:00 | ||
图片预览




文档简介
2023年浙江省八年级科学期末考试专题练——解答题1
1.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表。(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 O 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 。
(2)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由: , 。
(3)反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
2.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如表。
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 。
(2)结合表格分析,固体反应物的接触面积越 (选填“大”“小”)反应越快。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
3.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其化学式为C15H10N2O2)。请列式计算:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中各元素的质量比。
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量。
(3)多少克二甲苯烷二异氰酸酯中含氮元素的质量为56克?
4.某校课外活动小组,欲测定一待旅游开发的岩洞内空气中二氧化碳的体积分数(假设洞内空气中不含除二氧化碳外的其他酸性气体)。进行了如图实验:
(1)取样。他们准备从岩洞的底部取样,请你设计用广口瓶从洞中取回一瓶空气样品的方法: 。
(2)测定用150mL的注射器从广口瓶中抽取100mL气样,按如图所示的装置进行实验;若乙装置中NaOH溶液能吸收二氧化碳气体,且实验结束后,量筒内水的体积为99mL,此数据是 的体积数(用序号填写)。
A.二氧化碳
B.氮气和氧气的混合气体
C.空气中除二氧化碳外的所有气体
(3)计算:洞底空气中二氧化碳的体积分数为 。
(4)岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同的原因可能是 。
5.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其化学式为C15H10N2O2)。请列式计算:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中各元素质量比。
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量。
(3)500克二甲苯烷二异氰酸酯中含氮元素的质量为 g。
6.2022年北京冬奥会冰壶比赛引人入胜。冰壶是用苏格兰天然花岗岩制成的,苏格兰花岗岩主要由石英(SiO2)、长石等矿物组成。
(1)花岗岩属于 (填“纯净物”或“混合物”)。
(2)石英(SiO2)中硅元素与氧元素的质量比为 。(填最简比)
(3)SiO2中氧元素的质量分数为 (结果精确到 0.1%);6kg石英(SiO2)中含有Si元素的质量约为 kg。
7.初三(1)班学生将采集到的块状石灰石样品用水冲洗后晾干,称得样品质量为25.0g.该班甲、乙两组同学共利用这25.0g石灰石样品分别进行了如下实验.(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)
实验过程:甲组:取一定质量的块状石灰石样品于锥形瓶内,加入过量的10%的稀盐酸Mg,测定反应过程中锥形瓶中的药品质量变化.(如图a)
乙组:把剩余的块状石灰石样品研碎成粉末状,然后全部置于另一锥形瓶内,加入10%的稀盐酸Ng,测定反应过程中锥形瓶中药品的质量变化.(如图b)
两组同学经数据处理得到释放出二氧化碳的质量与反应时间的关系如图c.
问题讨论:
(1)甲、乙两组同学的实验中,甲组实验消耗的时间更短.
(2)两次实验中消耗的稀盐酸质量比甲:乙=1:3.
(3)求石灰石样品中碳酸钙的质量分数.
8.如图所示为某兴趣小组为学校办公楼空调设计的自动控制装置,R是热敏电阻,其阻值随温度变化关系如下表所示。已知继电器的线圈电阻R0=10Ω,左边电源电压为6V恒定不变。当继电器线圈中的电流大于或等于15mA时,继电器的衔铁被吸合,右边的空调电路正常工作。
温度t/℃ 0 5 10 15 20 25 30 35 40
电阻R/Ω 600 550 500 450 420 390 360 330 300
(1)这一自动控制装置的基本结构其实是一个 ;
(2)计算说明该空调的启动温度是多少?(要有计算过程)
(3)为了节省电能,将空调启动温度设定为30℃,计算控制电路中需要再串联多大的电阻?
(4)改变控制电路的电阻可以给空调设定不同的启动温度,除此之外,请你再提出一种方便可行的调节方案。
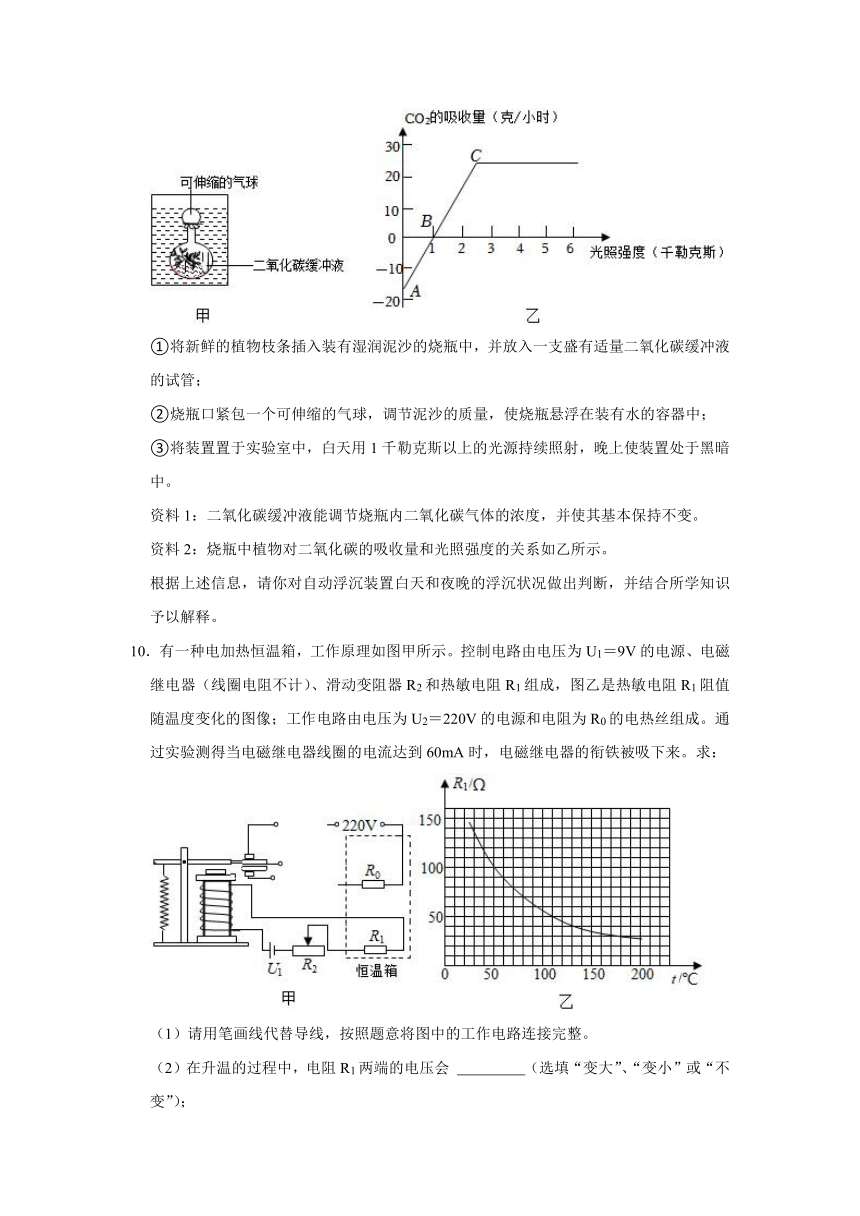
9.如图甲所示是一种自动浮沉的装置。其制作过程如下:
①将新鲜的植物枝条插入装有湿润泥沙的烧瓶中,并放入一支盛有适量二氧化碳缓冲液的试管;
②烧瓶口紧包一个可伸缩的气球,调节泥沙的质量,使烧瓶悬浮在装有水的容器中;
③将装置置于实验室中,白天用1千勒克斯以上的光源持续照射,晚上使装置处于黑暗中。
资料1:二氧化碳缓冲液能调节烧瓶内二氧化碳气体的浓度,并使其基本保持不变。
资料2:烧瓶中植物对二氧化碳的吸收量和光照强度的关系如乙所示。
根据上述信息,请你对自动浮沉装置白天和夜晚的浮沉状况做出判断,并结合所学知识予以解释。
10.有一种电加热恒温箱,工作原理如图甲所示。控制电路由电压为U1=9V的电源、电磁继电器(线圈电阻不计)、滑动变阻器R2和热敏电阻R1组成,图乙是热敏电阻R1阻值随温度变化的图像;工作电路由电压为U2=220V的电源和电阻为R0的电热丝组成。通过实验测得当电磁继电器线圈的电流达到60mA时,电磁继电器的衔铁被吸下来。求:
(1)请用笔画线代替导线,按照题意将图中的工作电路连接完整。
(2)在升温的过程中,电阻R1两端的电压会 (选填“变大”、“变小”或“不变”);
(3)要使恒温箱设定的温度值升高,应调节滑动变阻器R2的滑片,使其接入电路的阻值 (选填“变大”或“变小”)。
(4)当滑动变阻器R2接入电路中的电阻为50Ω时,恒温箱内的温度是多少?
参考答案与试题解析
1.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表。(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 O 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 电子天平读数不再改变 。
(2)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由: 2.40g , 等质量的碳酸钙完全反应生成的二氧化碳质量相等 。
(3)反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
【解答】解:
(1)判断反应是否结束就是看什么时间质量不再变化,所以对应的现象是电子天平读数不再改变时反应结束。
(2)由于质量相同的碳酸钙,不同状态影响的是反应速度而不影响生成物的质量,所以最终块状大理石与稀盐酸反应生成的二氧化碳的质量为2.40g。
(3)反应进行到18分钟时,生成的二氧化碳的质量为2.20g,设消耗的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.20g
x=5.00g
故答案为:
(1)电子天平读数不再改变。
(2)2.40g,等质量的碳酸钙完全反应生成的二氧化碳质量相等。
(3)5.00g。
2.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如表。
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 大理石碎屑生成的CO2质量在14分钟后不再变化 。
(2)结合表格分析,固体反应物的接触面积越 大 (选填“大”“小”)反应越快。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
【解答】解:(1)分析表格中的数据可知大理石碎屑生成的CO2质量在14分钟时为2.40g,16分钟时也是2.40g,18分钟时也为2.40g,说明在14分钟后反应已完成;故填:大理石碎屑生成的CO2质量在14分钟后不再变化;
(2)对比分析大理石碎屑生成的CO2质量随时间的变化情况和块状大理石生成的CO2质量随时间的变化情况可知相同时间内大理石碎屑生成的CO2质量比块状大理石生成的CO2质量多,并且14分钟后大理石碎屑就反应完了,而块状大理石在18分钟时还没有反应完,所以,固体反应物的接触面积越大反应速率越快,故填:大;
(3)分析表中数据可知18分钟时块状大理石生成二氧化碳的质量为2.20g,
设:反应进行到18分钟时,块状大理石中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.20g
x=5.00g
答:反应进行到18分钟时,块状大理石中碳酸钙的质量为5.00g。
3.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其化学式为C15H10N2O2)。请列式计算:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中各元素的质量比。
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量。
(3)多少克二甲苯烷二异氰酸酯中含氮元素的质量为56克?
【解答】解:(1)二甲苯烷二异氰酸酯(C15H10N2O2)中,碳、氢、氮、氧元素的质量比为:(15×12):(1×10):(14×2):(16×2)=90:5:14:16;故答案为:C:H:N:O=90:5:14:16;
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量为:15×12+1×10+14×2+16×2=250;故答案为:250;
(3)含56g氮元素需要二甲苯烷二异氰酸酯的质量为:56g500g;故答案为:500g。
4.某校课外活动小组,欲测定一待旅游开发的岩洞内空气中二氧化碳的体积分数(假设洞内空气中不含除二氧化碳外的其他酸性气体)。进行了如图实验:
(1)取样。他们准备从岩洞的底部取样,请你设计用广口瓶从洞中取回一瓶空气样品的方法: 将广口瓶装满水,盖上玻璃片,带进洞中,将水倒掉,擦干瓶内,盖上玻璃片即可 。
(2)测定用150mL的注射器从广口瓶中抽取100mL气样,按如图所示的装置进行实验;若乙装置中NaOH溶液能吸收二氧化碳气体,且实验结束后,量筒内水的体积为99mL,此数据是 C 的体积数(用序号填写)。
A.二氧化碳
B.氮气和氧气的混合气体
C.空气中除二氧化碳外的所有气体
(3)计算:洞底空气中二氧化碳的体积分数为 1% 。
(4)岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同的原因可能是 岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳 。
【解答】解:(1)为了防止把洞外的气体带到洞中,必须先将广口瓶装满水,盖上玻璃片后带进洞中,将水倒掉,因为二氧化碳能溶于水,为了减少实验误差,必须要将广口瓶内残留的水分擦干,然后再盖上玻璃片,即可;故填:将广口瓶装满水,盖上玻璃片,带进洞中,将水倒掉,擦干瓶内,盖上玻璃片即可;
(2)氢氧化钠是为了吸收气体中的CO2剩下的气体进入装置丙中,排水法收集,排开的水进入量筒内,所以量筒内的水相当于是空气中除CO2外的所有气体体积;故填:C;
(3)洞底空气中CO2的体积分数为1%;故填:1%;
(4)岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳,所以岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同;故填:岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳。
5.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其化学式为C15H10N2O2)。请列式计算:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中各元素质量比。
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量。
(3)500克二甲苯烷二异氰酸酯中含氮元素的质量为 56 g。
【解答】解:(1)二甲苯烷二异氰酸酯中C、H、N、O元素的质量之比为:(12×15):(1×10):(14×2):(16×2)=90:5:14:16;
答:二甲苯烷二异氰酸酯(C15H10N2O2)中C、H、N、O元素的质量之比为90:5:14:16;
(2)二甲苯烷二异氰酸酯的相对分子质量:12×15+1×10+14×2+16×2=250;
答:二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量是250;
(3)二甲苯烷二异氰酸酯中氮元素的质量分数:100%;
氮元素的质量为:500g56g。
故答案为:(1)C:H:N:O=90:5:14:16;(2)250;(3)56。
6.2022年北京冬奥会冰壶比赛引人入胜。冰壶是用苏格兰天然花岗岩制成的,苏格兰花岗岩主要由石英(SiO2)、长石等矿物组成。
(1)花岗岩属于 混合物 (填“纯净物”或“混合物”)。
(2)石英(SiO2)中硅元素与氧元素的质量比为 7:8 。(填最简比)
(3)SiO2中氧元素的质量分数为 53.3% (结果精确到 0.1%);6kg石英(SiO2)中含有Si元素的质量约为 2.8 kg。
【解答】解:(1)花岗岩中含有多种物质,属于混合物;
(2)SiO2中硅元素与氧元素的质量比为:28:(16×2)=7:8;
(3)SiO2中氧元素的质量分数为100%≈53.3%;6kg石英(SiO2)中含有Si元素的质量约为6kg100%=2.8kg。
故答案为:(1)混合物;(2)7:8; (3)53.3%;2.8。
7.初三(1)班学生将采集到的块状石灰石样品用水冲洗后晾干,称得样品质量为25.0g.该班甲、乙两组同学共利用这25.0g石灰石样品分别进行了如下实验.(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)
实验过程:甲组:取一定质量的块状石灰石样品于锥形瓶内,加入过量的10%的稀盐酸Mg,测定反应过程中锥形瓶中的药品质量变化.(如图a)
乙组:把剩余的块状石灰石样品研碎成粉末状,然后全部置于另一锥形瓶内,加入10%的稀盐酸Ng,测定反应过程中锥形瓶中药品的质量变化.(如图b)
两组同学经数据处理得到释放出二氧化碳的质量与反应时间的关系如图c.
问题讨论:
(1)甲、乙两组同学的实验中,甲组实验消耗的时间更短.
(2)两次实验中消耗的稀盐酸质量比甲:乙=1:3.
(3)求石灰石样品中碳酸钙的质量分数.
【解答】(1)解:根据图c可知甲组实验消耗的时间(约3分钟)比乙组(多于4分钟)更短.故填甲
(2)解:设甲组实验中消耗的盐酸的质量为x,乙组实验中消耗的盐酸的质量为 y,则
2HCl+CaCO3=H2O+CO2↑+CaCl2
71 44
x 2.2g 甲组
y 6.6g 乙组
所以══
故填 1:3.
(3)解:设每份样品中CaCO3的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x (2.2g+6.6g)
44x=100×(2.2g+6.6g)
x=20g
所以样品中CaCO3质量分数为:100%=80.0%(1分)
答:样品中CaCO3质量分数为80.0%(0.5分)
8.如图所示为某兴趣小组为学校办公楼空调设计的自动控制装置,R是热敏电阻,其阻值随温度变化关系如下表所示。已知继电器的线圈电阻R0=10Ω,左边电源电压为6V恒定不变。当继电器线圈中的电流大于或等于15mA时,继电器的衔铁被吸合,右边的空调电路正常工作。
温度t/℃ 0 5 10 15 20 25 30 35 40
电阻R/Ω 600 550 500 450 420 390 360 330 300
(1)这一自动控制装置的基本结构其实是一个 电磁继电器 ;
(2)计算说明该空调的启动温度是多少?(要有计算过程)
(3)为了节省电能,将空调启动温度设定为30℃,计算控制电路中需要再串联多大的电阻?
(4)改变控制电路的电阻可以给空调设定不同的启动温度,除此之外,请你再提出一种方便可行的调节方案。
【解答】解:
(1)由题意可知,该自动控制装置的基本结构其实是一个电磁继电器;
(2)电路启动时的总电阻:R总400Ω,
此时热敏电阻的阻值:R热=R总﹣R0=400Ω﹣10Ω=390Ω,对照表格数据可知,此时的启动温度是25℃。
(3)因为电路启动时的总电阻为400Ω,由表中数据可知,空调启动温度设定为30℃时,热敏电阻的阻值为360Ω,
则电路中还应串联的电阻:R′=R热=R总﹣R热′﹣R0=400Ω﹣360Ω﹣10Ω=30Ω。
(4)因为本装置启动的电流是一定的,因此,既可通过改变电阻来改变电流,可以通过将左边电源改为可调压电源来实现对其控制。
答:(1)电磁继电器;(2)空调的启动温度是25℃;(3)控制电路中需要再串联30Ω的电阻;(4)可以将左边电源改为可调压电源。
9.如图甲所示是一种自动浮沉的装置。其制作过程如下:
①将新鲜的植物枝条插入装有湿润泥沙的烧瓶中,并放入一支盛有适量二氧化碳缓冲液的试管;
②烧瓶口紧包一个可伸缩的气球,调节泥沙的质量,使烧瓶悬浮在装有水的容器中;
③将装置置于实验室中,白天用1千勒克斯以上的光源持续照射,晚上使装置处于黑暗中。
资料1:二氧化碳缓冲液能调节烧瓶内二氧化碳气体的浓度,并使其基本保持不变。
资料2:烧瓶中植物对二氧化碳的吸收量和光照强度的关系如乙所示。
根据上述信息,请你对自动浮沉装置白天和夜晚的浮沉状况做出判断,并结合所学知识予以解释。
【解答】答:白天光照强度大,温度较高,由乙图可知,吸收的二氧化碳多,烧瓶内气体浓度小,橡皮膜内凹一些,烧瓶排开水的体积减小,由公式F浮=ρ液gV排可知,浮力减小,烧瓶下沉;
晚上无光照,温度低,二氧化碳吸收较少,烧瓶内气体浓度大,橡皮膜外凸一些,烧瓶排开水的体积增大,由公式F浮=ρ液gV排可知,浮力增大,烧瓶上浮。
10.有一种电加热恒温箱,工作原理如图甲所示。控制电路由电压为U1=9V的电源、电磁继电器(线圈电阻不计)、滑动变阻器R2和热敏电阻R1组成,图乙是热敏电阻R1阻值随温度变化的图像;工作电路由电压为U2=220V的电源和电阻为R0的电热丝组成。通过实验测得当电磁继电器线圈的电流达到60mA时,电磁继电器的衔铁被吸下来。求:
(1)请用笔画线代替导线,按照题意将图中的工作电路连接完整。
(2)在升温的过程中,电阻R1两端的电压会 变小 (选填“变大”、“变小”或“不变”);
(3)要使恒温箱设定的温度值升高,应调节滑动变阻器R2的滑片,使其接入电路的阻值 变大 (选填“变大”或“变小”)。
(4)当滑动变阻器R2接入电路中的电阻为50Ω时,恒温箱内的温度是多少?
【解答】解:(1)由题意可知,要在恒温箱内的温度升高到一定温度时,热敏电阻的阻值减小到一定程度,电磁继电器线圈的电流达到60mA,衔铁被吸下来时,工作电路断开,由此可以确定工作电路的连接方式如下图所示。
(2)当温度升高时,R1的阻值在减小;控制电路中是滑动变阻器和热敏电阻串联,滑动变阻器的阻值不变,R1的阻值减小,导致了总电阻减小。
电源电压不变,所以电路中的电流增大,根据公式:U=IR可知,R2两端的电压U2增大,热敏电阻两端的电压U1=U源﹣U2,所以,U1在变小。
(3)恒温箱的温度值要调高,热敏电阻减小,此时要使控制电路中的电流不要增大,以防衔铁被吸下来,就要使滑动变阻器接入电路中的阻值变大。
(4)U源=9V、I=60mA=0.06A,
电路的总电阻:R总150Ω,
此时热敏电阻的阻值:R1=R总﹣R2=150Ω﹣50Ω=100Ω,
由图像知,热敏电阻的阻值为100Ω时,对应的温度为50℃。
故答案为:(1)图略;(2)变小; (3)变大; (4)当滑动变阻器R2接入电路中的电阻为50Ω时,恒温箱内的温度是50℃。
1.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表。(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 O 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 。
(2)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由: , 。
(3)反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
2.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如表。
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 。
(2)结合表格分析,固体反应物的接触面积越 (选填“大”“小”)反应越快。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
3.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其化学式为C15H10N2O2)。请列式计算:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中各元素的质量比。
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量。
(3)多少克二甲苯烷二异氰酸酯中含氮元素的质量为56克?
4.某校课外活动小组,欲测定一待旅游开发的岩洞内空气中二氧化碳的体积分数(假设洞内空气中不含除二氧化碳外的其他酸性气体)。进行了如图实验:
(1)取样。他们准备从岩洞的底部取样,请你设计用广口瓶从洞中取回一瓶空气样品的方法: 。
(2)测定用150mL的注射器从广口瓶中抽取100mL气样,按如图所示的装置进行实验;若乙装置中NaOH溶液能吸收二氧化碳气体,且实验结束后,量筒内水的体积为99mL,此数据是 的体积数(用序号填写)。
A.二氧化碳
B.氮气和氧气的混合气体
C.空气中除二氧化碳外的所有气体
(3)计算:洞底空气中二氧化碳的体积分数为 。
(4)岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同的原因可能是 。
5.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其化学式为C15H10N2O2)。请列式计算:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中各元素质量比。
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量。
(3)500克二甲苯烷二异氰酸酯中含氮元素的质量为 g。
6.2022年北京冬奥会冰壶比赛引人入胜。冰壶是用苏格兰天然花岗岩制成的,苏格兰花岗岩主要由石英(SiO2)、长石等矿物组成。
(1)花岗岩属于 (填“纯净物”或“混合物”)。
(2)石英(SiO2)中硅元素与氧元素的质量比为 。(填最简比)
(3)SiO2中氧元素的质量分数为 (结果精确到 0.1%);6kg石英(SiO2)中含有Si元素的质量约为 kg。
7.初三(1)班学生将采集到的块状石灰石样品用水冲洗后晾干,称得样品质量为25.0g.该班甲、乙两组同学共利用这25.0g石灰石样品分别进行了如下实验.(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)
实验过程:甲组:取一定质量的块状石灰石样品于锥形瓶内,加入过量的10%的稀盐酸Mg,测定反应过程中锥形瓶中的药品质量变化.(如图a)
乙组:把剩余的块状石灰石样品研碎成粉末状,然后全部置于另一锥形瓶内,加入10%的稀盐酸Ng,测定反应过程中锥形瓶中药品的质量变化.(如图b)
两组同学经数据处理得到释放出二氧化碳的质量与反应时间的关系如图c.
问题讨论:
(1)甲、乙两组同学的实验中,甲组实验消耗的时间更短.
(2)两次实验中消耗的稀盐酸质量比甲:乙=1:3.
(3)求石灰石样品中碳酸钙的质量分数.
8.如图所示为某兴趣小组为学校办公楼空调设计的自动控制装置,R是热敏电阻,其阻值随温度变化关系如下表所示。已知继电器的线圈电阻R0=10Ω,左边电源电压为6V恒定不变。当继电器线圈中的电流大于或等于15mA时,继电器的衔铁被吸合,右边的空调电路正常工作。
温度t/℃ 0 5 10 15 20 25 30 35 40
电阻R/Ω 600 550 500 450 420 390 360 330 300
(1)这一自动控制装置的基本结构其实是一个 ;
(2)计算说明该空调的启动温度是多少?(要有计算过程)
(3)为了节省电能,将空调启动温度设定为30℃,计算控制电路中需要再串联多大的电阻?
(4)改变控制电路的电阻可以给空调设定不同的启动温度,除此之外,请你再提出一种方便可行的调节方案。
9.如图甲所示是一种自动浮沉的装置。其制作过程如下:
①将新鲜的植物枝条插入装有湿润泥沙的烧瓶中,并放入一支盛有适量二氧化碳缓冲液的试管;
②烧瓶口紧包一个可伸缩的气球,调节泥沙的质量,使烧瓶悬浮在装有水的容器中;
③将装置置于实验室中,白天用1千勒克斯以上的光源持续照射,晚上使装置处于黑暗中。
资料1:二氧化碳缓冲液能调节烧瓶内二氧化碳气体的浓度,并使其基本保持不变。
资料2:烧瓶中植物对二氧化碳的吸收量和光照强度的关系如乙所示。
根据上述信息,请你对自动浮沉装置白天和夜晚的浮沉状况做出判断,并结合所学知识予以解释。
10.有一种电加热恒温箱,工作原理如图甲所示。控制电路由电压为U1=9V的电源、电磁继电器(线圈电阻不计)、滑动变阻器R2和热敏电阻R1组成,图乙是热敏电阻R1阻值随温度变化的图像;工作电路由电压为U2=220V的电源和电阻为R0的电热丝组成。通过实验测得当电磁继电器线圈的电流达到60mA时,电磁继电器的衔铁被吸下来。求:
(1)请用笔画线代替导线,按照题意将图中的工作电路连接完整。
(2)在升温的过程中,电阻R1两端的电压会 (选填“变大”、“变小”或“不变”);
(3)要使恒温箱设定的温度值升高,应调节滑动变阻器R2的滑片,使其接入电路的阻值 (选填“变大”或“变小”)。
(4)当滑动变阻器R2接入电路中的电阻为50Ω时,恒温箱内的温度是多少?
参考答案与试题解析
1.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表。(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 O 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 电子天平读数不再改变 。
(2)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由: 2.40g , 等质量的碳酸钙完全反应生成的二氧化碳质量相等 。
(3)反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
【解答】解:
(1)判断反应是否结束就是看什么时间质量不再变化,所以对应的现象是电子天平读数不再改变时反应结束。
(2)由于质量相同的碳酸钙,不同状态影响的是反应速度而不影响生成物的质量,所以最终块状大理石与稀盐酸反应生成的二氧化碳的质量为2.40g。
(3)反应进行到18分钟时,生成的二氧化碳的质量为2.20g,设消耗的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.20g
x=5.00g
故答案为:
(1)电子天平读数不再改变。
(2)2.40g,等质量的碳酸钙完全反应生成的二氧化碳质量相等。
(3)5.00g。
2.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如表。
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? 大理石碎屑生成的CO2质量在14分钟后不再变化 。
(2)结合表格分析,固体反应物的接触面积越 大 (选填“大”“小”)反应越快。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
【解答】解:(1)分析表格中的数据可知大理石碎屑生成的CO2质量在14分钟时为2.40g,16分钟时也是2.40g,18分钟时也为2.40g,说明在14分钟后反应已完成;故填:大理石碎屑生成的CO2质量在14分钟后不再变化;
(2)对比分析大理石碎屑生成的CO2质量随时间的变化情况和块状大理石生成的CO2质量随时间的变化情况可知相同时间内大理石碎屑生成的CO2质量比块状大理石生成的CO2质量多,并且14分钟后大理石碎屑就反应完了,而块状大理石在18分钟时还没有反应完,所以,固体反应物的接触面积越大反应速率越快,故填:大;
(3)分析表中数据可知18分钟时块状大理石生成二氧化碳的质量为2.20g,
设:反应进行到18分钟时,块状大理石中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.20g
x=5.00g
答:反应进行到18分钟时,块状大理石中碳酸钙的质量为5.00g。
3.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其化学式为C15H10N2O2)。请列式计算:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中各元素的质量比。
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量。
(3)多少克二甲苯烷二异氰酸酯中含氮元素的质量为56克?
【解答】解:(1)二甲苯烷二异氰酸酯(C15H10N2O2)中,碳、氢、氮、氧元素的质量比为:(15×12):(1×10):(14×2):(16×2)=90:5:14:16;故答案为:C:H:N:O=90:5:14:16;
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量为:15×12+1×10+14×2+16×2=250;故答案为:250;
(3)含56g氮元素需要二甲苯烷二异氰酸酯的质量为:56g500g;故答案为:500g。
4.某校课外活动小组,欲测定一待旅游开发的岩洞内空气中二氧化碳的体积分数(假设洞内空气中不含除二氧化碳外的其他酸性气体)。进行了如图实验:
(1)取样。他们准备从岩洞的底部取样,请你设计用广口瓶从洞中取回一瓶空气样品的方法: 将广口瓶装满水,盖上玻璃片,带进洞中,将水倒掉,擦干瓶内,盖上玻璃片即可 。
(2)测定用150mL的注射器从广口瓶中抽取100mL气样,按如图所示的装置进行实验;若乙装置中NaOH溶液能吸收二氧化碳气体,且实验结束后,量筒内水的体积为99mL,此数据是 C 的体积数(用序号填写)。
A.二氧化碳
B.氮气和氧气的混合气体
C.空气中除二氧化碳外的所有气体
(3)计算:洞底空气中二氧化碳的体积分数为 1% 。
(4)岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同的原因可能是 岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳 。
【解答】解:(1)为了防止把洞外的气体带到洞中,必须先将广口瓶装满水,盖上玻璃片后带进洞中,将水倒掉,因为二氧化碳能溶于水,为了减少实验误差,必须要将广口瓶内残留的水分擦干,然后再盖上玻璃片,即可;故填:将广口瓶装满水,盖上玻璃片,带进洞中,将水倒掉,擦干瓶内,盖上玻璃片即可;
(2)氢氧化钠是为了吸收气体中的CO2剩下的气体进入装置丙中,排水法收集,排开的水进入量筒内,所以量筒内的水相当于是空气中除CO2外的所有气体体积;故填:C;
(3)洞底空气中CO2的体积分数为1%;故填:1%;
(4)岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳,所以岩洞内空气中二氧化碳的体积分数和正常空气中二氧化碳的体积分数不同;故填:岩洞内的水中溶解有较多的碳酸氢钙,在压强突然变小时,水中的碳酸氢钙迅速分解释放出二氧化碳。
5.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其化学式为C15H10N2O2)。请列式计算:
(1)二甲苯烷二异氰酸酯(C15H10N2O2)中各元素质量比。
(2)二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量。
(3)500克二甲苯烷二异氰酸酯中含氮元素的质量为 56 g。
【解答】解:(1)二甲苯烷二异氰酸酯中C、H、N、O元素的质量之比为:(12×15):(1×10):(14×2):(16×2)=90:5:14:16;
答:二甲苯烷二异氰酸酯(C15H10N2O2)中C、H、N、O元素的质量之比为90:5:14:16;
(2)二甲苯烷二异氰酸酯的相对分子质量:12×15+1×10+14×2+16×2=250;
答:二甲苯烷二异氰酸酯(C15H10N2O2)的相对分子质量是250;
(3)二甲苯烷二异氰酸酯中氮元素的质量分数:100%;
氮元素的质量为:500g56g。
故答案为:(1)C:H:N:O=90:5:14:16;(2)250;(3)56。
6.2022年北京冬奥会冰壶比赛引人入胜。冰壶是用苏格兰天然花岗岩制成的,苏格兰花岗岩主要由石英(SiO2)、长石等矿物组成。
(1)花岗岩属于 混合物 (填“纯净物”或“混合物”)。
(2)石英(SiO2)中硅元素与氧元素的质量比为 7:8 。(填最简比)
(3)SiO2中氧元素的质量分数为 53.3% (结果精确到 0.1%);6kg石英(SiO2)中含有Si元素的质量约为 2.8 kg。
【解答】解:(1)花岗岩中含有多种物质,属于混合物;
(2)SiO2中硅元素与氧元素的质量比为:28:(16×2)=7:8;
(3)SiO2中氧元素的质量分数为100%≈53.3%;6kg石英(SiO2)中含有Si元素的质量约为6kg100%=2.8kg。
故答案为:(1)混合物;(2)7:8; (3)53.3%;2.8。
7.初三(1)班学生将采集到的块状石灰石样品用水冲洗后晾干,称得样品质量为25.0g.该班甲、乙两组同学共利用这25.0g石灰石样品分别进行了如下实验.(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)
实验过程:甲组:取一定质量的块状石灰石样品于锥形瓶内,加入过量的10%的稀盐酸Mg,测定反应过程中锥形瓶中的药品质量变化.(如图a)
乙组:把剩余的块状石灰石样品研碎成粉末状,然后全部置于另一锥形瓶内,加入10%的稀盐酸Ng,测定反应过程中锥形瓶中药品的质量变化.(如图b)
两组同学经数据处理得到释放出二氧化碳的质量与反应时间的关系如图c.
问题讨论:
(1)甲、乙两组同学的实验中,甲组实验消耗的时间更短.
(2)两次实验中消耗的稀盐酸质量比甲:乙=1:3.
(3)求石灰石样品中碳酸钙的质量分数.
【解答】(1)解:根据图c可知甲组实验消耗的时间(约3分钟)比乙组(多于4分钟)更短.故填甲
(2)解:设甲组实验中消耗的盐酸的质量为x,乙组实验中消耗的盐酸的质量为 y,则
2HCl+CaCO3=H2O+CO2↑+CaCl2
71 44
x 2.2g 甲组
y 6.6g 乙组
所以══
故填 1:3.
(3)解:设每份样品中CaCO3的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x (2.2g+6.6g)
44x=100×(2.2g+6.6g)
x=20g
所以样品中CaCO3质量分数为:100%=80.0%(1分)
答:样品中CaCO3质量分数为80.0%(0.5分)
8.如图所示为某兴趣小组为学校办公楼空调设计的自动控制装置,R是热敏电阻,其阻值随温度变化关系如下表所示。已知继电器的线圈电阻R0=10Ω,左边电源电压为6V恒定不变。当继电器线圈中的电流大于或等于15mA时,继电器的衔铁被吸合,右边的空调电路正常工作。
温度t/℃ 0 5 10 15 20 25 30 35 40
电阻R/Ω 600 550 500 450 420 390 360 330 300
(1)这一自动控制装置的基本结构其实是一个 电磁继电器 ;
(2)计算说明该空调的启动温度是多少?(要有计算过程)
(3)为了节省电能,将空调启动温度设定为30℃,计算控制电路中需要再串联多大的电阻?
(4)改变控制电路的电阻可以给空调设定不同的启动温度,除此之外,请你再提出一种方便可行的调节方案。
【解答】解:
(1)由题意可知,该自动控制装置的基本结构其实是一个电磁继电器;
(2)电路启动时的总电阻:R总400Ω,
此时热敏电阻的阻值:R热=R总﹣R0=400Ω﹣10Ω=390Ω,对照表格数据可知,此时的启动温度是25℃。
(3)因为电路启动时的总电阻为400Ω,由表中数据可知,空调启动温度设定为30℃时,热敏电阻的阻值为360Ω,
则电路中还应串联的电阻:R′=R热=R总﹣R热′﹣R0=400Ω﹣360Ω﹣10Ω=30Ω。
(4)因为本装置启动的电流是一定的,因此,既可通过改变电阻来改变电流,可以通过将左边电源改为可调压电源来实现对其控制。
答:(1)电磁继电器;(2)空调的启动温度是25℃;(3)控制电路中需要再串联30Ω的电阻;(4)可以将左边电源改为可调压电源。
9.如图甲所示是一种自动浮沉的装置。其制作过程如下:
①将新鲜的植物枝条插入装有湿润泥沙的烧瓶中,并放入一支盛有适量二氧化碳缓冲液的试管;
②烧瓶口紧包一个可伸缩的气球,调节泥沙的质量,使烧瓶悬浮在装有水的容器中;
③将装置置于实验室中,白天用1千勒克斯以上的光源持续照射,晚上使装置处于黑暗中。
资料1:二氧化碳缓冲液能调节烧瓶内二氧化碳气体的浓度,并使其基本保持不变。
资料2:烧瓶中植物对二氧化碳的吸收量和光照强度的关系如乙所示。
根据上述信息,请你对自动浮沉装置白天和夜晚的浮沉状况做出判断,并结合所学知识予以解释。
【解答】答:白天光照强度大,温度较高,由乙图可知,吸收的二氧化碳多,烧瓶内气体浓度小,橡皮膜内凹一些,烧瓶排开水的体积减小,由公式F浮=ρ液gV排可知,浮力减小,烧瓶下沉;
晚上无光照,温度低,二氧化碳吸收较少,烧瓶内气体浓度大,橡皮膜外凸一些,烧瓶排开水的体积增大,由公式F浮=ρ液gV排可知,浮力增大,烧瓶上浮。
10.有一种电加热恒温箱,工作原理如图甲所示。控制电路由电压为U1=9V的电源、电磁继电器(线圈电阻不计)、滑动变阻器R2和热敏电阻R1组成,图乙是热敏电阻R1阻值随温度变化的图像;工作电路由电压为U2=220V的电源和电阻为R0的电热丝组成。通过实验测得当电磁继电器线圈的电流达到60mA时,电磁继电器的衔铁被吸下来。求:
(1)请用笔画线代替导线,按照题意将图中的工作电路连接完整。
(2)在升温的过程中,电阻R1两端的电压会 变小 (选填“变大”、“变小”或“不变”);
(3)要使恒温箱设定的温度值升高,应调节滑动变阻器R2的滑片,使其接入电路的阻值 变大 (选填“变大”或“变小”)。
(4)当滑动变阻器R2接入电路中的电阻为50Ω时,恒温箱内的温度是多少?
【解答】解:(1)由题意可知,要在恒温箱内的温度升高到一定温度时,热敏电阻的阻值减小到一定程度,电磁继电器线圈的电流达到60mA,衔铁被吸下来时,工作电路断开,由此可以确定工作电路的连接方式如下图所示。
(2)当温度升高时,R1的阻值在减小;控制电路中是滑动变阻器和热敏电阻串联,滑动变阻器的阻值不变,R1的阻值减小,导致了总电阻减小。
电源电压不变,所以电路中的电流增大,根据公式:U=IR可知,R2两端的电压U2增大,热敏电阻两端的电压U1=U源﹣U2,所以,U1在变小。
(3)恒温箱的温度值要调高,热敏电阻减小,此时要使控制电路中的电流不要增大,以防衔铁被吸下来,就要使滑动变阻器接入电路中的阻值变大。
(4)U源=9V、I=60mA=0.06A,
电路的总电阻:R总150Ω,
此时热敏电阻的阻值:R1=R总﹣R2=150Ω﹣50Ω=100Ω,
由图像知,热敏电阻的阻值为100Ω时,对应的温度为50℃。
故答案为:(1)图略;(2)变小; (3)变大; (4)当滑动变阻器R2接入电路中的电阻为50Ω时,恒温箱内的温度是50℃。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
