【决胜期末】浙教版2022-2023学年第二学期八年级科学期末好题汇编(十七):质量守恒定律验证实验【word,含解析】
文档属性
| 名称 | 【决胜期末】浙教版2022-2023学年第二学期八年级科学期末好题汇编(十七):质量守恒定律验证实验【word,含解析】 |  | |
| 格式 | doc | ||
| 文件大小 | 247.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-06-06 18:35:19 | ||
图片预览

文档简介
1.定律是对自然现象或关系的描述,通常可用数学方式加以表达。在学习“质量守恒定律”时,小丽查阅到以下材料:
波义耳实验:在密闭的曲颈瓶中加热金属汞时,得到了金属灰(氧化汞)。冷却后打开容器,称量金属灰的质量,发现比原来金属质量增加了 罗蒙诺索夫重复了波义耳实验,他将金属铅装入容器后密封,称量。然后把容器放到火上加热,金属变成了黄色(氧化铅),冷却后再次称量,发现容器的总质量没有发生变化,该发现未引起科学家重视 拉瓦锡用锡和铅做了罗蒙诺索夫实验,也得到了同样的结论。他还做了许多实验并得出结论:在化学反应过程中物质质量是守恒的,并将此结论写成一个代数式。该结论得到当时科学家的普遍认同 廊道尔特和曼莱做了精确度极高的化学实验,反应前后质量之差小于0.0001g,在实验误差范围内,国际科学家一致承认质量守恒定律
1673年 1756年 1774年 1908、1912年
(1)玻义耳实验中,金属灰增加的质量是 。
(2)质量守恒定律的发现过程,带给我们的启示有 (填字母)。
A要善于总结前人的成果和经验
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
(3)受上述研究启发,小丽对相关实验进行了深入探究。在白磷燃烧前后质量测定实验中(如图)。气球的作用有 。
(4)小丽认为,蜡烛燃烧后剩下的固体质量比燃烧前少了,因此该现象不符合质量守恒定律。请你设计个能说服小丽的简明实验思路 。
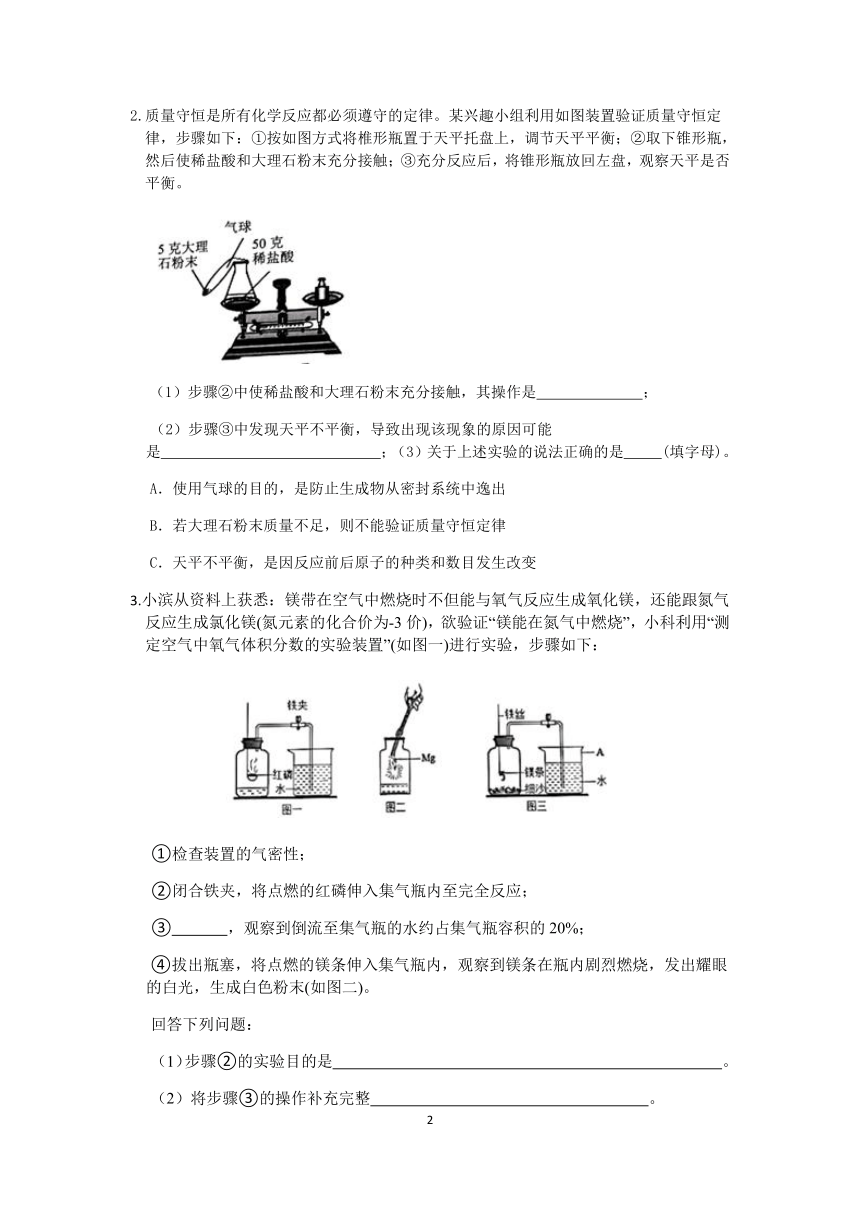
2.质量守恒是所有化学反应都必须遵守的定律。某兴趣小组利用如图装置验证质量守恒定律,步骤如下:①按如图方式将椎形瓶置于天平托盘上,调节天平平衡;②取下锥形瓶,然后使稀盐酸和大理石粉末充分接触;③充分反应后,将锥形瓶放回左盘,观察天平是否平衡。
(1)步骤②中使稀盐酸和大理石粉末充分接触,其操作是 ;
(2)步骤③中发现天平不平衡,导致出现该现象的原因可能是 ;(3)关于上述实验的说法正确的是 (填字母)。
A.使用气球的目的,是防止生成物从密封系统中逸出
B.若大理石粉末质量不足,则不能验证质量守恒定律
C.天平不平衡,是因反应前后原子的种类和数目发生改变
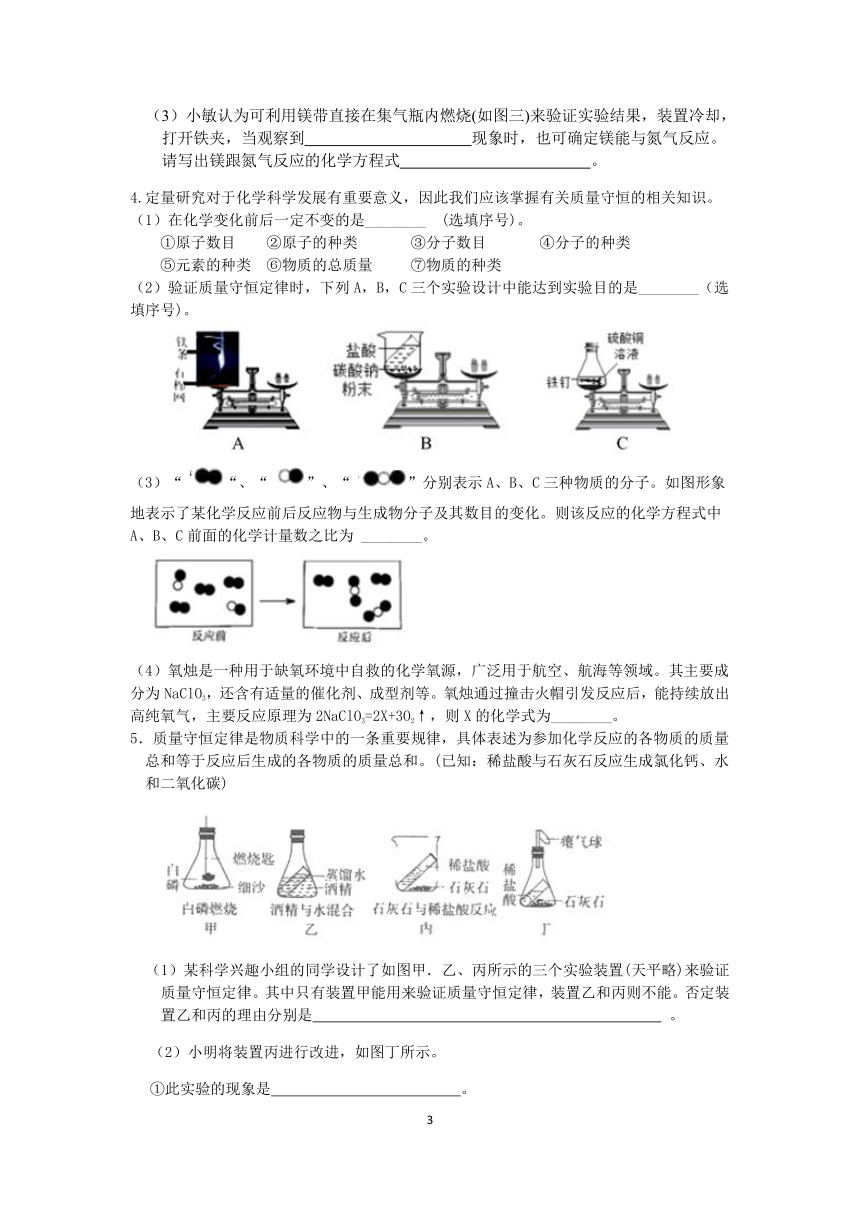
3.小滨从资料上获悉:镁带在空气中燃烧时不但能与氧气反应生成氧化镁,还能跟氮气反应生成氯化镁(氮元素的化合价为-3价),欲验证“镁能在氮气中燃烧”,小科利用“测定空气中氧气体积分数的实验装置”(如图一)进行实验,步骤如下:
①检查装置的气密性;
②闭合铁夹,将点燃的红磷伸入集气瓶内至完全反应;
③ ,观察到倒流至集气瓶的水约占集气瓶容积的20%;
④拔出瓶塞,将点燃的镁条伸入集气瓶内,观察到镁条在瓶内剧烈燃烧,发出耀眼的白光,生成白色粉末(如图二)。
回答下列问题:
(1)步骤②的实验目的是 。
(2)将步骤③的操作补充完整 。
(3)小敏认为可利用镁带直接在集气瓶内燃烧(如图三)来验证实验结果,装置冷却,打开铁夹,当观察到 现象时,也可确定镁能与氮气反应。请写出镁跟氮气反应的化学方程式 。
4.定量研究对于化学科学发展有重要意义,因此我们应该掌握有关质量守恒的相关知识。
(1)在化学变化前后一定不变的是________ (选填序号)。
①原子数目 ②原子的种类 ③分子数目 ④分子的种类
⑤元素的种类 ⑥物质的总质量 ⑦物质的种类
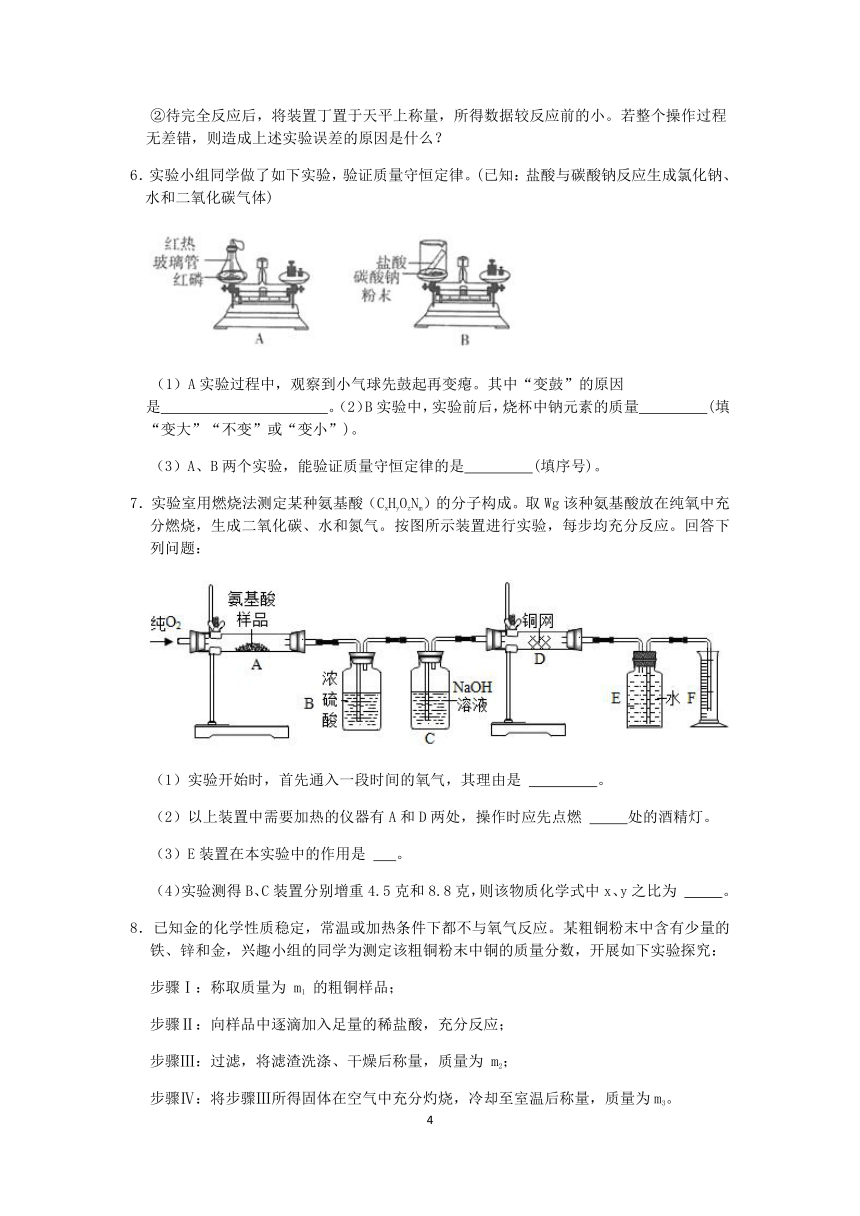
(2)验证质量守恒定律时,下列A,B,C三个实验设计中能达到实验目的是________(选填序号)。
(3)“ “、“ ”、“ ”分别表示A、B、C三种物质的分子。如图形象地表示了某化学反应前后反应物与生成物分子及其数目的变化。则该反应的化学方程式中A、B、C前面的化学计量数之比为 ________。
(4)氧烛是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域。其主要成分为NaClO3,还含有适量的催化剂、成型剂等。氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为2NaClO3=2X+3O2↑,则X的化学式为________。
5.质量守恒定律是物质科学中的一条重要规律,具体表述为参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。(已知:稀盐酸与石灰石反应生成氯化钙、水和二氧化碳)
(1)某科学兴趣小组的同学设计了如图甲.乙、丙所示的三个实验装置(天平略)来验证质量守恒定律。其中只有装置甲能用来验证质量守恒定律,装置乙和丙则不能。否定装置乙和丙的理由分别是 。
(2)小明将装置丙进行改进,如图丁所示。
①此实验的现象是 。
②待完全反应后,将装置丁置于天平上称量,所得数据较反应前的小。若整个操作过程无差错,则造成上述实验误差的原因是什么?
6.实验小组同学做了如下实验,验证质量守恒定律。(已知:盐酸与碳酸钠反应生成氯化钠、水和二氧化碳气体)
(1)A实验过程中,观察到小气球先鼓起再变瘪。其中“变鼓”的原因是 。(2)B实验中,实验前后,烧杯中钠元素的质量 (填“变大”“不变”或“变小”)。
(3)A、B两个实验,能验证质量守恒定律的是 (填序号)。
7.实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子构成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按图所示装置进行实验,每步均充分反应。回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是 。
(2)以上装置中需要加热的仪器有A和D两处,操作时应先点燃 处的酒精灯。
(3)E装置在本实验中的作用是 。
(4)实验测得B、C装置分别增重4.5克和8.8克,则该物质化学式中x、y之比为 。
8.已知金的化学性质稳定,常温或加热条件下都不与氧气反应。某粗铜粉末中含有少量的铁、锌和金,兴趣小组的同学为测定该粗铜粉末中铜的质量分数,开展如下实验探究:
步骤Ⅰ:称取质量为 m1 的粗铜样品;
步骤Ⅱ:向样品中逐滴加入足量的稀盐酸,充分反应;
步骤Ⅲ:过滤,将滤渣洗涤、干燥后称量,质量为 m2;
步骤Ⅳ:将步骤Ⅲ所得固体在空气中充分灼烧,冷却至室温后称量,质量为m3。
请回答下列问题:
(1)步骤Ⅱ的目的是 ;
(2)步骤Ⅳ中反应的化学方程式为 ;
(3)按此方法测得粗铜中铜的质量分数为 (用 m1、m2、m3 的代数式表示)。
答案及解析
1.解:(1)玻义耳实验中,金属灰增加的质量是参加反应的氧气质量。
故答案为:参加反应的氧气质量。
(2)质量守恒定律的发现过程,带给我们的启示有要善于总结前人的成果和经验、定量方法是科学研究的重要方法。
故答案为:AC。
(3)受上述研究启发,小丽对相关实验进行了深入探究。在白磷燃烧前后质量测定实验中(如图)。气球的作用有平衡装置内外压强;形成密封装置。
故答案为:平衡装置内外压强;形成密封装置。
(4)能说服小丽的简明实验思路:在密闭装置中完成蜡烛燃烧,并测量蜡烛燃烧前后整个装置的质量,比较两者的质量大小。
故答案为:在密闭装置中完成蜡烛燃烧,并测量蜡烛燃烧前后整个装置的质量,比较两者的质量大小。
2.(1)将气球中的大理石物末倒入锥形瓶中(2)气球受到浮力(或装置漏气)(3)A
【解析】1)步骤②中使稀盐酸和大理石粉末充分接触,其操作是:将气球中的大理石物末倒入锥形瓶中。
(2)步骤③中发现天平不平衡,导致出现该现象的原因可能是:气球受到浮力(或装置漏气)。
(3)A.使用气球的目的,是防止生成物从密封系统中逸出,故A正确;
B.若大理石粉末质量不足,则生成的二氧化碳的质量偏小,但是物质的总质量并没有发生改变,因此则能验证质量守恒定律,故B错误;
C.天平不平衡,是因反应前后气球受到的浮力大小不同,或者装置可能漏气,而原子的种类和数目保持不变,故C错误 故选A。
3.(1)将氧气全部耗尽,防止氧气在镁条燃烧时造成干扰(2)待整个装置完全冷却后,打开铁夹(3)进入集气瓶内的水的体积远远大于步骤③的数值;3Mg+N2 Mg3N2
【解析】(1)步骤②的实验目的是将氧气全部耗尽,防止氧气在镁条燃烧时造成干扰。
(2)将步骤③的操作补充完整:待整个装置完全冷却后,打开铁夹。
(3)小敏认为可利用镁带直接在集气瓶内燃烧(如图三)来验证实验结果,装置冷却,打开铁夹,当观察到进入集气瓶内的水的体积远远大于步骤③的数值时,也可确定镁能与氮气反应。
镁在氮气中点燃,生成氮化镁,方程式为: 3Mg+N2 Mg3N2 。
4.(1)①②⑤⑥ (2)C (3)1:2:2 (4)NaCl
【解析】(1)在化学变化中,分子是保持物质化学性质的最小微粒,本质是分子分解为原子,原子重新组合成分子的过程,据此判断。
(2)验证质量守恒定律,关键是反应前后托盘上物质的总质量保持不变;
(3)将反应前后同时存在的分子减去相同的数量,剩下的就是参加反应和生成的分子;
(4)根据质量守恒定律可知,反应前后原子的种类和数量保持不变,据此确定X的组成。
【解答】(1)在化学变化前后一定不变的是:原子的数目、种类、元素的种类和物质的总质量,故选①②⑤⑥;
(2)A中的镁条燃烧生成氧化镁,会以白烟的形式逸散到空气中,B中生成二氧化碳气体会消散到空气中,只有C中的锥形瓶是封闭容器,反应后总质量保持不变,因此验证质量守恒定律应选C。
(3)据图知:该反应的化学方程式为:A+2B=2C,A、B、C前面的化学计量数之比为1:2:2。
(4)根据方程式 2NaClO3=2X+3O2↑ 可知,2Na+2Cl+6O=2X+6O,那么2X=2NaCl,即,X=NaCl。
5.(1)装置乙中酒精与水不能发生化学反应 装置丙不是密封体系,生成的气体逸出
(2)锥形瓶内有大量的气泡产生,气球变大;气球变大后,受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小
【解析】(1) 装置乙中酒精与水不能发生化学反应,装置丙不是密封体系,生成的气体逸出,所以乙和丙都不能用来验证质量守恒定律;
(2)丁装置中石灰石与稀盐酸反应会产生二氧化碳气体,使得锥形瓶中压强增大,所以观察到的现象为锥形瓶内有大量的气泡产生,气球变大,因气球变大后,受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小 ;
6.(1)红磷燃烧,放热,瓶内气体温度升高,压强变大,大于外界大气压,气球鼓起
(2)不变(3)A
【解析】(1) 红磷燃烧,放热,瓶内气体温度升高,压强变大,大于外界大气压,使气球鼓起 ;
(2) B实验中,实验前后,烧杯中钠元素的质量不变;
(3)因B产生二氧化碳气体会逸散到空气中,不能验证质量守恒定律,A在密闭容器中进行可以验证质量守恒定律。
7.解:(1)空气中含有氮气、氧气、二氧化碳、水蒸气等,本实验的测定原理氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气,测定生成物的量,推断出该氨基酸的分子构成,所以实验开始时,首先通入一段时间的氧气,其理由排尽装置内的空气,防止干扰实验数据的测定。
(2)由实验装置可知,D装置作用是吸收没反应完的氧气,防止影响氮气体积的测定,所以要先点燃D装置的酒精灯,保证没有完全反应的氧气被全部除去。
(3)由实验装置可知,E装置在本实验中的作用是储存N2。
(4)B装置增重4.5g,则生成水的质量为4.5g,其中氢元素的质量为4.5g100%=0.5g,C装置增重8.8g,则生成二氧化碳的质量为8.8g,其中碳元素的质量为8.8g100%=2.4g,Wg该种氨基酸中含有2.4g碳元素和0.5g氢元素,所以x:y:2:5。
故答案为:
(1)排尽装置内的空气;
(2)D;
(3)储存N2;
(4)2:5。
8.解:(1)由于粗铜样品中含有的铁、锌能与稀盐酸反应,所以步骤Ⅱ的目的是完全除去粗铜粉末中铁和锌;
(2)步骤IV中在加热的条件下能与氧气反应生成了氧化铜,反应的化学方程式为:2Cu+O22CuO;
(3)由质量守恒定律可知,参加反应氧气的质量:m3﹣m2。
设铜的质量为x,
2Cu+O22CuO
128 32
x m3﹣m2
解得:x=4(m3﹣m2)
按此方法测得粗铜中铜的质量分数为:
故答案为:(1)完全除去粗铜粉末中铁和锌;;(2)2Cu+O22CuO;
(3)。
质量守恒定律验证实验
波义耳实验:在密闭的曲颈瓶中加热金属汞时,得到了金属灰(氧化汞)。冷却后打开容器,称量金属灰的质量,发现比原来金属质量增加了 罗蒙诺索夫重复了波义耳实验,他将金属铅装入容器后密封,称量。然后把容器放到火上加热,金属变成了黄色(氧化铅),冷却后再次称量,发现容器的总质量没有发生变化,该发现未引起科学家重视 拉瓦锡用锡和铅做了罗蒙诺索夫实验,也得到了同样的结论。他还做了许多实验并得出结论:在化学反应过程中物质质量是守恒的,并将此结论写成一个代数式。该结论得到当时科学家的普遍认同 廊道尔特和曼莱做了精确度极高的化学实验,反应前后质量之差小于0.0001g,在实验误差范围内,国际科学家一致承认质量守恒定律
1673年 1756年 1774年 1908、1912年
(1)玻义耳实验中,金属灰增加的质量是 。
(2)质量守恒定律的发现过程,带给我们的启示有 (填字母)。
A要善于总结前人的成果和经验
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
(3)受上述研究启发,小丽对相关实验进行了深入探究。在白磷燃烧前后质量测定实验中(如图)。气球的作用有 。
(4)小丽认为,蜡烛燃烧后剩下的固体质量比燃烧前少了,因此该现象不符合质量守恒定律。请你设计个能说服小丽的简明实验思路 。
2.质量守恒是所有化学反应都必须遵守的定律。某兴趣小组利用如图装置验证质量守恒定律,步骤如下:①按如图方式将椎形瓶置于天平托盘上,调节天平平衡;②取下锥形瓶,然后使稀盐酸和大理石粉末充分接触;③充分反应后,将锥形瓶放回左盘,观察天平是否平衡。
(1)步骤②中使稀盐酸和大理石粉末充分接触,其操作是 ;
(2)步骤③中发现天平不平衡,导致出现该现象的原因可能是 ;(3)关于上述实验的说法正确的是 (填字母)。
A.使用气球的目的,是防止生成物从密封系统中逸出
B.若大理石粉末质量不足,则不能验证质量守恒定律
C.天平不平衡,是因反应前后原子的种类和数目发生改变
3.小滨从资料上获悉:镁带在空气中燃烧时不但能与氧气反应生成氧化镁,还能跟氮气反应生成氯化镁(氮元素的化合价为-3价),欲验证“镁能在氮气中燃烧”,小科利用“测定空气中氧气体积分数的实验装置”(如图一)进行实验,步骤如下:
①检查装置的气密性;
②闭合铁夹,将点燃的红磷伸入集气瓶内至完全反应;
③ ,观察到倒流至集气瓶的水约占集气瓶容积的20%;
④拔出瓶塞,将点燃的镁条伸入集气瓶内,观察到镁条在瓶内剧烈燃烧,发出耀眼的白光,生成白色粉末(如图二)。
回答下列问题:
(1)步骤②的实验目的是 。
(2)将步骤③的操作补充完整 。
(3)小敏认为可利用镁带直接在集气瓶内燃烧(如图三)来验证实验结果,装置冷却,打开铁夹,当观察到 现象时,也可确定镁能与氮气反应。请写出镁跟氮气反应的化学方程式 。
4.定量研究对于化学科学发展有重要意义,因此我们应该掌握有关质量守恒的相关知识。
(1)在化学变化前后一定不变的是________ (选填序号)。
①原子数目 ②原子的种类 ③分子数目 ④分子的种类
⑤元素的种类 ⑥物质的总质量 ⑦物质的种类
(2)验证质量守恒定律时,下列A,B,C三个实验设计中能达到实验目的是________(选填序号)。
(3)“ “、“ ”、“ ”分别表示A、B、C三种物质的分子。如图形象地表示了某化学反应前后反应物与生成物分子及其数目的变化。则该反应的化学方程式中A、B、C前面的化学计量数之比为 ________。
(4)氧烛是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域。其主要成分为NaClO3,还含有适量的催化剂、成型剂等。氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为2NaClO3=2X+3O2↑,则X的化学式为________。
5.质量守恒定律是物质科学中的一条重要规律,具体表述为参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。(已知:稀盐酸与石灰石反应生成氯化钙、水和二氧化碳)
(1)某科学兴趣小组的同学设计了如图甲.乙、丙所示的三个实验装置(天平略)来验证质量守恒定律。其中只有装置甲能用来验证质量守恒定律,装置乙和丙则不能。否定装置乙和丙的理由分别是 。
(2)小明将装置丙进行改进,如图丁所示。
①此实验的现象是 。
②待完全反应后,将装置丁置于天平上称量,所得数据较反应前的小。若整个操作过程无差错,则造成上述实验误差的原因是什么?
6.实验小组同学做了如下实验,验证质量守恒定律。(已知:盐酸与碳酸钠反应生成氯化钠、水和二氧化碳气体)
(1)A实验过程中,观察到小气球先鼓起再变瘪。其中“变鼓”的原因是 。(2)B实验中,实验前后,烧杯中钠元素的质量 (填“变大”“不变”或“变小”)。
(3)A、B两个实验,能验证质量守恒定律的是 (填序号)。
7.实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子构成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按图所示装置进行实验,每步均充分反应。回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是 。
(2)以上装置中需要加热的仪器有A和D两处,操作时应先点燃 处的酒精灯。
(3)E装置在本实验中的作用是 。
(4)实验测得B、C装置分别增重4.5克和8.8克,则该物质化学式中x、y之比为 。
8.已知金的化学性质稳定,常温或加热条件下都不与氧气反应。某粗铜粉末中含有少量的铁、锌和金,兴趣小组的同学为测定该粗铜粉末中铜的质量分数,开展如下实验探究:
步骤Ⅰ:称取质量为 m1 的粗铜样品;
步骤Ⅱ:向样品中逐滴加入足量的稀盐酸,充分反应;
步骤Ⅲ:过滤,将滤渣洗涤、干燥后称量,质量为 m2;
步骤Ⅳ:将步骤Ⅲ所得固体在空气中充分灼烧,冷却至室温后称量,质量为m3。
请回答下列问题:
(1)步骤Ⅱ的目的是 ;
(2)步骤Ⅳ中反应的化学方程式为 ;
(3)按此方法测得粗铜中铜的质量分数为 (用 m1、m2、m3 的代数式表示)。
答案及解析
1.解:(1)玻义耳实验中,金属灰增加的质量是参加反应的氧气质量。
故答案为:参加反应的氧气质量。
(2)质量守恒定律的发现过程,带给我们的启示有要善于总结前人的成果和经验、定量方法是科学研究的重要方法。
故答案为:AC。
(3)受上述研究启发,小丽对相关实验进行了深入探究。在白磷燃烧前后质量测定实验中(如图)。气球的作用有平衡装置内外压强;形成密封装置。
故答案为:平衡装置内外压强;形成密封装置。
(4)能说服小丽的简明实验思路:在密闭装置中完成蜡烛燃烧,并测量蜡烛燃烧前后整个装置的质量,比较两者的质量大小。
故答案为:在密闭装置中完成蜡烛燃烧,并测量蜡烛燃烧前后整个装置的质量,比较两者的质量大小。
2.(1)将气球中的大理石物末倒入锥形瓶中(2)气球受到浮力(或装置漏气)(3)A
【解析】1)步骤②中使稀盐酸和大理石粉末充分接触,其操作是:将气球中的大理石物末倒入锥形瓶中。
(2)步骤③中发现天平不平衡,导致出现该现象的原因可能是:气球受到浮力(或装置漏气)。
(3)A.使用气球的目的,是防止生成物从密封系统中逸出,故A正确;
B.若大理石粉末质量不足,则生成的二氧化碳的质量偏小,但是物质的总质量并没有发生改变,因此则能验证质量守恒定律,故B错误;
C.天平不平衡,是因反应前后气球受到的浮力大小不同,或者装置可能漏气,而原子的种类和数目保持不变,故C错误 故选A。
3.(1)将氧气全部耗尽,防止氧气在镁条燃烧时造成干扰(2)待整个装置完全冷却后,打开铁夹(3)进入集气瓶内的水的体积远远大于步骤③的数值;3Mg+N2 Mg3N2
【解析】(1)步骤②的实验目的是将氧气全部耗尽,防止氧气在镁条燃烧时造成干扰。
(2)将步骤③的操作补充完整:待整个装置完全冷却后,打开铁夹。
(3)小敏认为可利用镁带直接在集气瓶内燃烧(如图三)来验证实验结果,装置冷却,打开铁夹,当观察到进入集气瓶内的水的体积远远大于步骤③的数值时,也可确定镁能与氮气反应。
镁在氮气中点燃,生成氮化镁,方程式为: 3Mg+N2 Mg3N2 。
4.(1)①②⑤⑥ (2)C (3)1:2:2 (4)NaCl
【解析】(1)在化学变化中,分子是保持物质化学性质的最小微粒,本质是分子分解为原子,原子重新组合成分子的过程,据此判断。
(2)验证质量守恒定律,关键是反应前后托盘上物质的总质量保持不变;
(3)将反应前后同时存在的分子减去相同的数量,剩下的就是参加反应和生成的分子;
(4)根据质量守恒定律可知,反应前后原子的种类和数量保持不变,据此确定X的组成。
【解答】(1)在化学变化前后一定不变的是:原子的数目、种类、元素的种类和物质的总质量,故选①②⑤⑥;
(2)A中的镁条燃烧生成氧化镁,会以白烟的形式逸散到空气中,B中生成二氧化碳气体会消散到空气中,只有C中的锥形瓶是封闭容器,反应后总质量保持不变,因此验证质量守恒定律应选C。
(3)据图知:该反应的化学方程式为:A+2B=2C,A、B、C前面的化学计量数之比为1:2:2。
(4)根据方程式 2NaClO3=2X+3O2↑ 可知,2Na+2Cl+6O=2X+6O,那么2X=2NaCl,即,X=NaCl。
5.(1)装置乙中酒精与水不能发生化学反应 装置丙不是密封体系,生成的气体逸出
(2)锥形瓶内有大量的气泡产生,气球变大;气球变大后,受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小
【解析】(1) 装置乙中酒精与水不能发生化学反应,装置丙不是密封体系,生成的气体逸出,所以乙和丙都不能用来验证质量守恒定律;
(2)丁装置中石灰石与稀盐酸反应会产生二氧化碳气体,使得锥形瓶中压强增大,所以观察到的现象为锥形瓶内有大量的气泡产生,气球变大,因气球变大后,受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小 ;
6.(1)红磷燃烧,放热,瓶内气体温度升高,压强变大,大于外界大气压,气球鼓起
(2)不变(3)A
【解析】(1) 红磷燃烧,放热,瓶内气体温度升高,压强变大,大于外界大气压,使气球鼓起 ;
(2) B实验中,实验前后,烧杯中钠元素的质量不变;
(3)因B产生二氧化碳气体会逸散到空气中,不能验证质量守恒定律,A在密闭容器中进行可以验证质量守恒定律。
7.解:(1)空气中含有氮气、氧气、二氧化碳、水蒸气等,本实验的测定原理氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气,测定生成物的量,推断出该氨基酸的分子构成,所以实验开始时,首先通入一段时间的氧气,其理由排尽装置内的空气,防止干扰实验数据的测定。
(2)由实验装置可知,D装置作用是吸收没反应完的氧气,防止影响氮气体积的测定,所以要先点燃D装置的酒精灯,保证没有完全反应的氧气被全部除去。
(3)由实验装置可知,E装置在本实验中的作用是储存N2。
(4)B装置增重4.5g,则生成水的质量为4.5g,其中氢元素的质量为4.5g100%=0.5g,C装置增重8.8g,则生成二氧化碳的质量为8.8g,其中碳元素的质量为8.8g100%=2.4g,Wg该种氨基酸中含有2.4g碳元素和0.5g氢元素,所以x:y:2:5。
故答案为:
(1)排尽装置内的空气;
(2)D;
(3)储存N2;
(4)2:5。
8.解:(1)由于粗铜样品中含有的铁、锌能与稀盐酸反应,所以步骤Ⅱ的目的是完全除去粗铜粉末中铁和锌;
(2)步骤IV中在加热的条件下能与氧气反应生成了氧化铜,反应的化学方程式为:2Cu+O22CuO;
(3)由质量守恒定律可知,参加反应氧气的质量:m3﹣m2。
设铜的质量为x,
2Cu+O22CuO
128 32
x m3﹣m2
解得:x=4(m3﹣m2)
按此方法测得粗铜中铜的质量分数为:
故答案为:(1)完全除去粗铜粉末中铁和锌;;(2)2Cu+O22CuO;
(3)。
质量守恒定律验证实验
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
