浙教版科学八年级下册期末专题复习:解答题二(含解析)
文档属性
| 名称 | 浙教版科学八年级下册期末专题复习:解答题二(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 156.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-06-11 11:01:07 | ||
图片预览


文档简介
浙教版科学八年级下册期末专题复习:解答题二
一 、解答题
1.近几年柯桥区进行老小区改造, 不少多层楼房安装了电梯。出于安全考虑, 电梯都设置超载自动报 警系统,其工作原理如图甲所示,电路由工作电路和控制电路组成。在工作电路中,当电梯没有超载 时, 触点 K 与触点 A 接触,闭合开关 S,电动机正常工作; 当电梯超载时,触点 K 与触点 B 接触, 电铃 发出报警铃声, 闭合开关 s,电动机不工作。在控制电路中,已知电源电压 U=6V,保护电阻 R1=100Ω, 电阻式压力传感器(压敏电阻) R2 的阻值随压力 F 大小变化如图乙所示,电梯底架自重和电磁铁线圈的
阻值都忽略不计。
(1) 控制电路电磁铁上端为 极(选填 “N”或 “S”),当人进入电梯后,压敏电阻 R2 受到的 压力 F 将增大, 其阻值 (选填“增大”、“不变”或“减小”)。
(2) 若电磁铁线圈电流达到 15mA 时,衔铁刚好被吸住,电铃发出警报声。请你设定该电梯最多乘坐 几人? (以每人 50kg 计算,且 g 取 10N/kg)
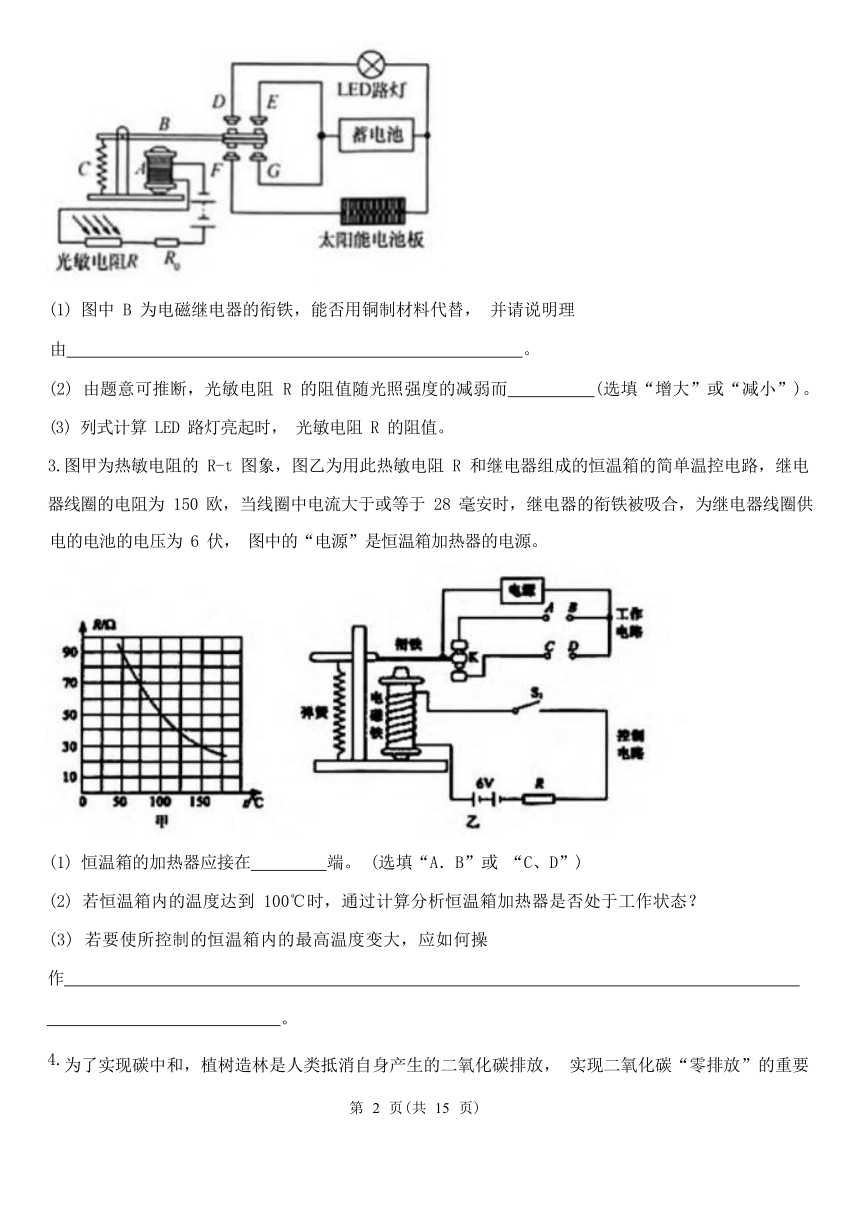
2.如图为利用太阳能给 LED 路灯供电的自动控制电路的原理示意图, 其中R 是光敏电阻。不计电磁铁 线圈电阻, 定值电阻 R0=40Ω,控制电路电源电压为 12V。白天,太阳能电池板将太阳能转化为电能, 贮存于蓄电池中。傍晚, 当光照强度减弱,使电磁铁中电流=0.1A 时, 控制电路会自动接通路灯电路, 由蓄电池给 LED 路灯供电。
第 1 页(共 15 页)
(1) 图中 B 为电磁继电器的衔铁,能否用铜制材料代替, 并请说明理
由 。
(2) 由题意可推断,光敏电阻 R 的阻值随光照强度的减弱而 (选填“增大”或“减小”)。 (3) 列式计算 LED 路灯亮起时, 光敏电阻 R 的阻值。
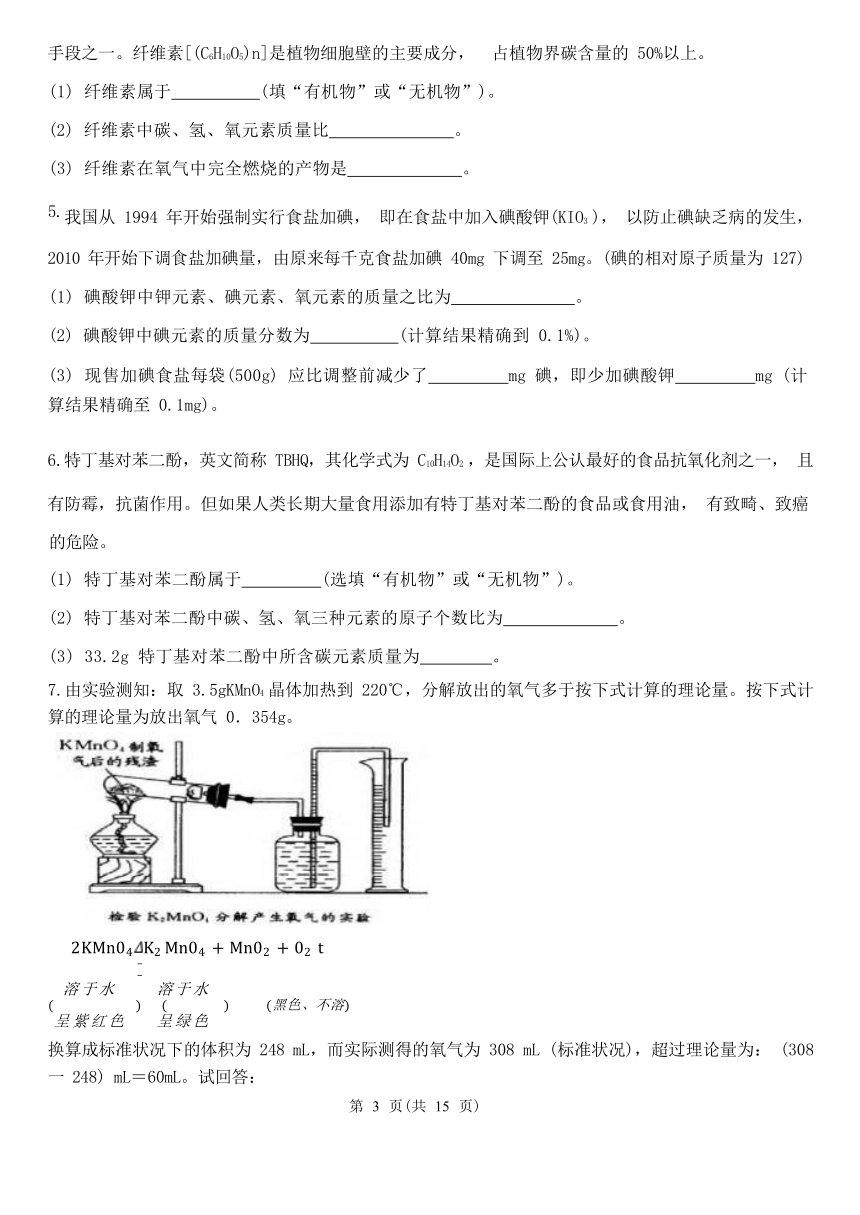
3.图甲为热敏电阻的 R-t 图象,图乙为用此热敏电阻 R 和继电器组成的恒温箱的简单温控电路,继电 器线圈的电阻为 150 欧,当线圈中电流大于或等于 28 毫安时,继电器的衔铁被吸合,为继电器线圈供
电的电池的电压为 6 伏, 图中的“电源”是恒温箱加热器的电源。
(1) 恒温箱的加热器应接在 端。 (选填“A.B”或 “C、D”)
(2) 若恒温箱内的温度达到 100℃时,通过计算分析恒温箱加热器是否处于工作状态?
(3) 若要使所控制的恒温箱内的最高温度变大,应如何操
作
。
4.为了实现碳中和,植树造林是人类抵消自身产生的二氧化碳排放, 实现二氧化碳“零排放”的重要
第 2 页(共 15 页)
手段之一。纤维素[(C6H10O5)n]是植物细胞壁的主要成分, 占植物界碳含量的 50%以上。
(1) 纤维素属于 (填“有机物”或“无机物”)。
(2) 纤维素中碳、氢、氧元素质量比 。
(3) 纤维素在氧气中完全燃烧的产物是 。
5.我国从 1994 年开始强制实行食盐加碘, 即在食盐中加入碘酸钾(KIO3 ), 以防止碘缺乏病的发生,
2010 年开始下调食盐加碘量,由原来每千克食盐加碘 40mg 下调至 25mg。(碘的相对原子质量为 127)
(1) 碘酸钾中钾元素、碘元素、氧元素的质量之比为 。
(2) 碘酸钾中碘元素的质量分数为 (计算结果精确到 0.1%)。
(3) 现售加碘食盐每袋(500g) 应比调整前减少了 mg 碘,即少加碘酸钾 mg (计 算结果精确至 0.1mg)。
6.特丁基对苯二酚,英文简称 TBHQ,其化学式为 C10H14O2 ,是国际上公认最好的食品抗氧化剂之一, 且
有防霉,抗菌作用。但如果人类长期大量食用添加有特丁基对苯二酚的食品或食用油, 有致畸、致癌 的危险。
(1) 特丁基对苯二酚属于 (选填“有机物”或“无机物”)。
(2) 特丁基对苯二酚中碳、氢、氧三种元素的原子个数比为 。
(3) 33.2g 特丁基对苯二酚中所含碳元素质量为 。
7.由实验测知:取 3.5gKMnO4 晶体加热到 220℃,分解放出的氧气多于按下式计算的理论量。按下式计 算的理论量为放出氧气 0.354g。
2KMn04K2 Mn04 + Mn02 + 02 t
_
_
溶于水 溶于水
( ) ( ) (黑色、不溶)
呈紫红色 呈绿色
换算成标准状况下的体积为 248 mL,而实际测得的氧气为 308 mL (标准状况),超过理论量为: (308 一 248) mL=60mL。试回答:
第 3 页(共 15 页)
(1)怎样用实验证明:超理论量的氧气不是来自 MnO2________
(2)怎样用实验证明超理论量的氧气是由 K2MnO4 分解产生的?(要求用 KMnO4 制取氧气后的残渣实验, 如所示。) ________
(3)怎样从“最后残渣”中分离出 MnO2 ?________ 8.温室大棚种植具有安全、卫生、提高产量等优点而被广泛采用。
(1) 一般要求温室棚内,晚上的温度低些来减弱呼吸作用。请写出植物进行呼吸作用的文字表达 式: 。
(2) 若图甲温室中只有绿色植物,在不通入 CO2 的情况下,每天只在 6:00~18:00 接受日光照射,请 在图乙的坐标上,用笔画出 6:00~24:00 该温室内 CO2 浓度的大致变化曲线(0:00~6:00 的曲线已经 绘出)。并说明理由。
9.如图是某胃药标签的部分内容. 小明同学测定该药品中 NaHCO3 含量的过程如下: 取 10 粒该药剂研碎 后放入烧杯中, 加入 50 克水后充分搅拌, 再向其中滴加稀盐酸至溶液的 pH=7 时(已知药品中的其它 成分既不溶于水,也不与稀盐酸反应),形成 NaCl 的不饱和溶液, 共消耗稀盐酸 11.5 克. 称得反应后 烧杯内物质的总质量为 64.3 克.
请计算:
(1) 反应完成后生成气体的质量为 .
(2) 反应后烧杯中溶液的质量和胃药中 NaHCO3 的质量分数. 10.小晨同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作。她的 具体做法是: 取 10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称
量,记录如下:
反应过程 反应前 反应后
第 4 页(共 15 页)
质量变化(不含容器质量) 34.3g 32.7g
若反应后, 双氧水分解完全且氧气全部逸出, 不计水分的蒸发,请完成下列问题: (1) 随着反应的进行, 小晨会发现反应的反应速度再逐渐减慢,原因
是 ;
(2) 反应得到氧气的质量是 g;
(3) 二氧化锰在反应后的质量是 g;
(4) 反应最后容器中水的质量是多少?
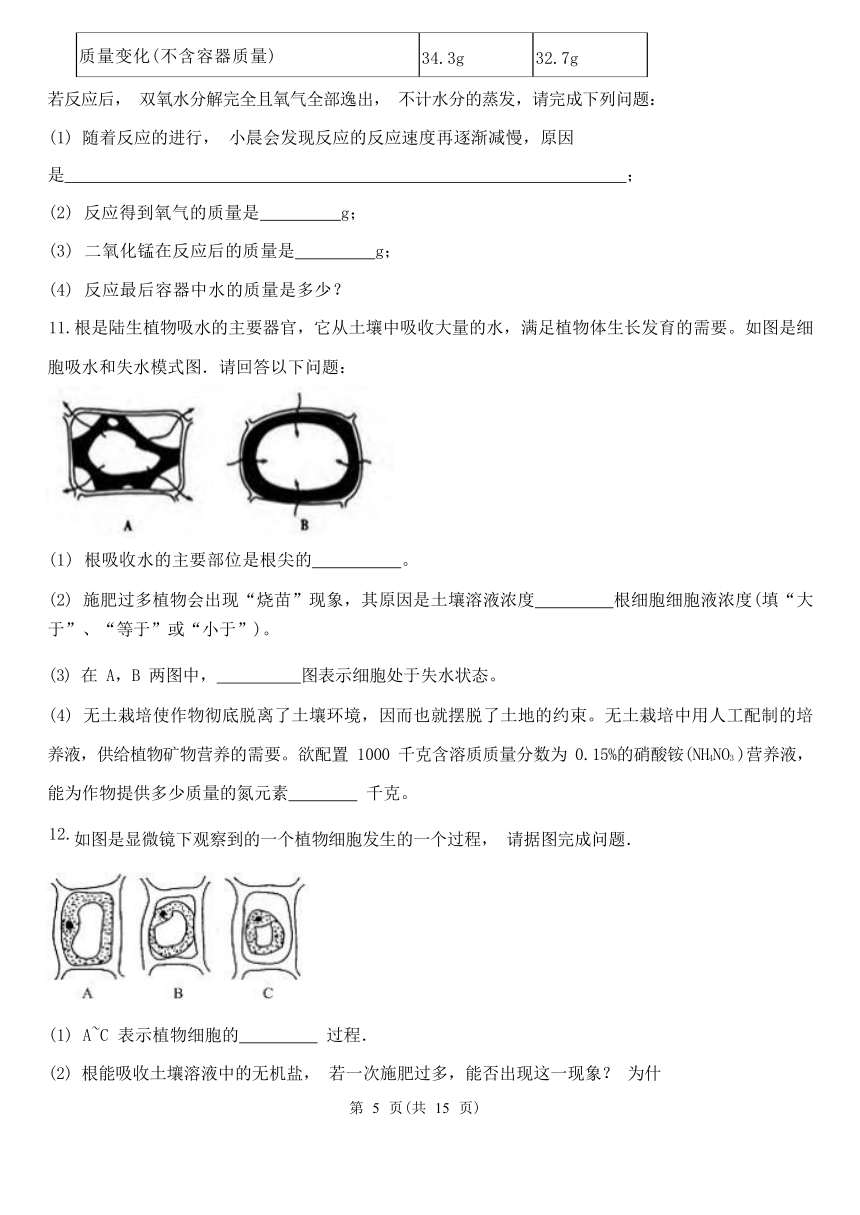
11.根是陆生植物吸水的主要器官,它从土壤中吸收大量的水,满足植物体生长发育的需要。如图是细
胞吸水和失水模式图.请回答以下问题:
(1) 根吸收水的主要部位是根尖的 。
(2) 施肥过多植物会出现“烧苗”现象,其原因是土壤溶液浓度 根细胞细胞液浓度(填“大 于”、“等于”或“小于”)。
(3) 在 A,B 两图中, 图表示细胞处于失水状态。
(4) 无土栽培使作物彻底脱离了土壤环境,因而也就摆脱了土地的约束。无土栽培中用人工配制的培 养液,供给植物矿物营养的需要。欲配置 1000 千克含溶质质量分数为 0.15%的硝酸铵(NH4NO3 )营养液, 能为作物提供多少质量的氮元素 千克。
12.如图是显微镜下观察到的一个植物细胞发生的一个过程, 请据图完成问题.
(1) A~C 表示植物细胞的 过程.
(2) 根能吸收土壤溶液中的无机盐, 若一次施肥过多,能否出现这一现象? 为什
第 5 页(共 15 页)
么? .
(3) 我们可采用田间挖深沟、田内浇透水的方法进行改良,这样做的目的
是 .若想在这样的地里种植作物,如种植玉米、小麦、水稻, 你认为种植什 么最好? ,理由是 . 13.某同学在探究植物枝条失水的速度与哪些环境因素有关时,设计了如图所示的实验装置。在风速等 条件相同的情况下进行实验,其结果如下表:
实验序号 环境条件 失水速度(克/时)
1 25 ℃、光照、潮湿 14
2 25 ℃、光照、干燥 32
3 25 ℃、黑暗、干燥 8
(1) 水的表面加一层油, 目的是 。
(2) 该实验装置中,锥形瓶上没有刻度, 如何较为准确地测量枝条每小时的失水质量?
。
(3) 比较 1 和 2 两组数据可以得出的结论是 。
第 6 页(共 15 页)
0.浙教版科学八年级下册期末专题复习:解答题二答案解析
一 、解答题
1. 【答案】(1) N;减小
(2) R 总= = =400Ω
R2=R 总-R1=400Ω-100Ω=300Ω
由图乙得 F=8000N
G 总=F 总=8000N
G 人=50Kg×10N/Kg=500N
n= G (G)人 (总) = N/人 (00N) =16 人
16-1=15 人
【解析】(1)根据安培定则判断电磁铁的极性。根据乙图确定压敏电阻 R2 的阻值随压力的变化规律。
(2) 首先根据 R总 = 计算出电流达到 15mA 时的总电阻,再根据 R2=R 总-R1=计算出压敏电阻 R2 的阻
值,接下来根据乙图确定此时压敏电阻受到的压力,再根据 G 总=F 总 计算出乘坐电梯的人的总重力,
最后根据 n = G (G)人 (总) 计算出可以乘坐的最多人数。
【解答】(1)电磁铁线圈上电流方向向右;右手握住螺线管, 弯曲的四指指尖向右,此时大拇指指向 上端, 则电磁铁的上端为 N 极。根据乙图可知,当人进入电梯后, 压敏电阻 R2 受到的压力 F 将增大, 其阻值减小。
2. 【答案】(1)不能, 因为电磁铁只能吸引铁钴镍等物质, 不能吸引铜
(2) 增大
(3) 当电流为 0.1A 时路灯亮起,
此时的总电阻为: R总 = UI总 = = 120;
光敏电阻的阻值: R=R 总-R0=120Ω-40Ω=80Ω。
【解析】(1)根据衔铁的工作原理和特点分析;
(2) 根据图片, 结合题目描述的过程,确定光照强度减弱时衔铁的位置,从而确定电磁铁磁场强度的 变化, 进而确定电流大小变化, 最终确定电阻的大小变化即可;
第 7 页(共 15 页)
(3) 当电流为 0.1A 时路灯亮起,首先根据R总 = UI总计算出总电阻,再根据 R=R 总-R0 计算出光敏电阻的 阻值。
【解答】(1)电磁继电器的主要结构为电磁铁,依靠对衔铁的吸引,从而实现对电路的控制,则衔铁 必须使用铁磁性材料,则:衔铁不能用铜制材料代替,理由为:因为电磁铁只能吸引铁钴镍等物质, 不能吸引铜。
(2)傍晚时, 光照强度减弱,此时路灯发光, 即衔铁与 DE 接触, 那么电磁铁的磁场减弱,通过它的 电流减小, 则光敏电阻的阻值增大。
(3) 当电流为 0.1A 时路灯亮起,
此时的总电阻为:R总 = UI总 = = 120;
光敏电阻的阻值:R=R 总-R0=120Ω-40Ω=80Ω。
3. (1) A.B 端
(2) 解: 若恒温箱内的温度达到 100℃时,查图甲可知 R=50 欧
则 R 总=50Ω+150Ω=200Ω,I=U/R 总=6V/200Ω=0.03A=30mA , 30mA>28mA,此时电磁铁磁性较大,吸引衔铁, 动触点与 CD 所在的电路接通,恒温箱加热器不处于工 作状态。
(3) 在控制电路中串联一个合适阻值的电阻; (或适当减小控制电路的电压; 适当减少电磁铁线圈匝 数;换一根强度较强的弹簧
【解析】(1)根据甲图确定热敏电阻随温度的变化规律, 再根据图乙确定温度升高到一定程度后电磁 铁的磁性变化, 确定衔铁的位置变化和工作状态, 最终确定加热器的位置。
(2)首先根据图甲确定 100℃时热敏电阻的阻值,再根据 R 总=R+R 线计算出总电阻,接下来根据I = R总 (U)计 算出此时的总电流, 最后与 28mA 进行比较, 从而确定恒温箱的工作状态。
(3) 当温度升高时, 只要保证电磁铁能够吸合即可,可从影响电磁铁磁场强弱的因素, 杠杆的平衡条 件等角度寻找解决方法。
(1) 根据甲图可知, 当温度升高时,热敏电阻的阻值减小,则通过电磁铁的电流增大,它的磁场增强, 将衔铁吸下来, 从而切断工作电路, 那么恒温箱的加热器应该接在 A.B 端;
(3) ①电磁铁吸合时需要的磁场强度相同。
第 8 页(共 15 页)
a.可以控制通过电磁铁的电流相同, 当总电压不变时,需要控制总电阻不变。当温度升高时,热敏电 阻的阻值减小, 那么此时要增大电路电阻,即可串联一个阻值合适的电阻。
b.可以控制通过电磁铁的电流相同, 当温度升高时,热敏电阻的阻值减小, 则总电阻减小, 根据 U=IR 可知, 此时可以减小控制电路的电压。 ②当温度升高时,电路的总电阻减小,而总电流增大,那么电磁铁的磁力增强。根据杠杆的平衡条件 F1L1=F2L2 可知,此时需要换一根强度更强的弹簧。
4. (1) 有机物
(2) 36:5:40
(3) CO2 和 H2O
(1) 根据含有碳元素的化合物为有机物分析;
(2) 根据元素质量比为相对原子质量×原子个数之比分析;
(3) 根据碳、氢、氧元素的化合物完全燃烧生成二氧化碳和水分析。
【解答】(1) 纤维素为含碳的化合物,属于有机物;
(2) 纤维素中碳、氢、氧元素质量比为(12×6) :10:(16×5)=36:5:40; (3) 由反应前后元素种类不变可知, 纤维素在氧气中完全燃烧的产物为 CO2 和 H2O ; 故答案为: (1) 有机物; (2) 36:5:40;(3) CO2 和 H2O 。
5. (1) 2:1
(2) 物理性质
(3) 29:45
(1) 在化学式中, 元素符号右下角的数字就是该原子的个数;
(2) 化学性质是物质在化学变化中表现出来的性质,如所属物质类别的化学通性:酸性、碱性、氧化
性、还原性、热稳定性及一些其它特性。
物理性质是不需要发生化学变化就表现出来的性质,如: 颜色、气味、状态、是否易融化、凝固、升 华、挥发, 还有些性质如熔点、沸点、硬度、导电性、导热性、延展性、溶解性、密度等。
(3) 根据化学式可知,一个丁酸乙酯分子和一个葡萄糖分子中都含有 6 个碳原子,那么碳原子的个数 相等, 其实就是二者的分子数相等, 然后根据“质量之比等于相对分子质量与个数的乘积之比”计算 即可。
第 9 页(共 15 页)
【解答】(1)根据化学式 C6H12O2 可知,丁酸乙酯中氢和碳的原子个数比为: 12:6=2:1.
(2) 丁酸乙酯作为溶剂,可以溶解多种有机物,这体现了它的物理性质。
(3) 根据化学式可知,一个丁酸乙酯分子和一个葡萄糖分子中都含有 6 个碳原子,那么碳原子的个数 相等, 其实就是二者的分子数相等。
丁酸乙酯和葡萄糖的质量比为: (12×6+1×12+16×2) ×n:(12×6+1×12+16×6) ×n=29:45。 6. (1) 有机物
(2) 5:7:1
(3) 24
(1) 根据含碳元素的化合物为有机物分析;
(2) 根据化学式右下角数字为原子个数比分析;
(3) 根据元素质量为物质质量×元素质量分数分析。
【解答】(1) 特丁基对苯二酚属于 有机物;
(2) 特丁基对苯二酚中碳、氢、氧的原子个数比为 10:14:2=5:7:1;
(3) 33.2g 特丁基对苯二酚中所含碳元素质量为33.2g × × 100% = 24g;
故答案为: (1) 有机物; (2) 5:7:1;(3) 24g。
7. (1)另取少量 MnO2 ;在酒精灯火焰上加热,插入带火星的木条,木条不复燃
(2)用酒精灯火焰集中加热“残渣”,又收集到一定体积的氧气
(3)将最后残渣加入适量的水溶解,过滤, 即可分离出 MnO2 8. (1) 有机物+氧气→二氧化碳+水+能量
(2) 植物的光合作用是吸收二氧化碳,释放氧气, 呼吸作用是吸收氧气,释放二氧化碳;在不通入二 氧化碳的情况下,装置乙在光照的条件下,二氧化碳的浓度会逐渐降低;在黑暗环境中,植物只进行 呼吸作用释放二氧化碳, 因此二氧化碳的浓度又会逐渐增加. 即在 6:00~24:00 时间段内,二氧化 碳在坐标上表现为先降低然后再升高.又因为装置内的一部分二氧化碳被植物通过光合作用合成了有 机物储存在植物体内,因此装置内的二氧化碳的总含量会逐渐减少;
第 10 页(共 15 页)
。
【解析】光合作用, 通常是指绿色植物(包括藻类)吸收光能,把二氧化碳和水合成富能有机物,同 时释放氧气的过程。呼吸作用指机体将来自环境的或细胞自己储存的有机营养物的分子(如糖类、脂 类、蛋白质等),通过一步步反应降解成较小的、简单的终产物(如二氧化碳、乳酸、乙醇等) 的过程。 (1) 植物进行呼吸作用是将有机物分解成二氧化碳和水, 并释放大量能量的过程; 即有机物+氧气→ 二氧化碳+水+能量;
(2) 植物的光合作用是吸收二氧化碳,释放氧气, 呼吸作用是吸收氧气,释放二氧化碳;在不通入二 氧化碳的情况下,装置乙在光照的条件下,二氧化碳的浓度会逐渐降低;在黑暗环境中,植物只进行 呼吸作用释放二氧化碳, 因此二氧化碳的浓度又会逐渐增加. 即在 6:00~24:00 时间段内,二氧化 碳在坐标上表现为先降低然后再升高.又因为装置内的一部分二氧化碳被植物通过光合作用合成了有
机物储存在植物体内,因此装置内的二氧化碳的总含量会逐渐减少;
故答案为: (1) 有机物+氧气→二氧化碳+水+能量; (2) 。
9. (1) 2.2g
(2) 解: 设参加反应的碳酸氢钠的质量为 x
NaHCO3+HCl=NaCl+H2O+CO2 ↑
第 11 页(共 15 页)
84
X
=
44
2.22g
x=4.2g
反应后烧杯中溶液的质量为 4.2g+50g+11.5g ﹣ 2.2g=63.5g.
胃药中 NaHCO3 的质量分数为×100%=84%.
答:反应后烧杯中溶液的质量为 63.5g;胃药中 NaHCO3 的质量分数为 84%.
【解析】(1)每粒 0.5g,10 粒该药剂的质量为 0.5g×10=5g,由质量守恒定律,生成二氧化碳气体的 质量为 5g+50g+11.5g ﹣ 64.3g=2.2g;
(2) 设参加反应的碳酸氢钠的质量为 x,
NaHCO3+HCl=NaCl+H2O+CO2 ↑
第 12 页(共 15 页)
84
X
=
44
2.2g
x=4.2g
反应后烧杯中溶液的质量为 4.2g+50g+11.5g ﹣ 2.2g=63.5g,
胃药中 NaHCO3 的质量分数为×100%=84%.
答: (1) 2.2g;(2) 反应后烧杯中溶液的质量为 63.5g;胃药中 NaHCO3 的质量分数为 84%.
碳酸氢钠与稀盐酸反应生成氯化钠、水和二氧化碳;由题意, 取 10 粒该药剂研碎后放入烧杯中, 加入 50 克水后充分搅拌,再向其中滴加稀盐酸至溶液的 pH=7 时, 形成 NaCl 的不饱和溶液, 共消耗稀盐酸 11.5 克, 称得反应后烧杯内物质的总质量为 64.3 克,烧杯内减少的质量即生成的二氧化碳的质量,据 此根据反应的化学方程式列式计算出参加反应碳酸氢钠的质量.
10. (1) 随着反应的进行, 过氧化氢的浓度会逐渐降低,所以反应速度会减慢
(2) 1.6
(3) 0.3
(4) 32.4g
【解析】(1)反应物的浓度会影响化学反应的速度,即浓度越大, 反应越快;
(2) 根据质量守恒定律可知,反应前后总质量的差就是生成氧气的质量;
(3) 根据过氧化氢分解的方程式,利用氧气的质量计算出参加反应的过氧化氢溶质的质量,再根据溶 质质量÷质量分数计算出参加反应的过氧化氢溶液的质量,最后根据反应前总质量减去溶液质量计算 二氧化锰的质量即可;
(4) 反应后水的质量等于反应后物质的总质量和二氧化锰质量的差。(1) 随着反应的进行, 小晨会发
现反应的反应速度在逐渐减慢, 原因是随着反应进行,过氧化氢浓度减小。
(2) 反应得到氧气的质量是: 34.3g-32.7g=1.6g,
(3) 设过氧化氢质量为 x,反应生成水的质量为 y,
MnO2
2H2 O2 = 2 H2 O + O2 ↑
68 36 32
x y 1.6g
(
=
;
)68 32
1.6g
解得: x=3.4g;,
过氧化氢溶液质量: 3.4g÷10%=34g,
二氧化锰在反应后的质量是: 34.3g-34g=0.3g。
(4) 反应最后容器中水的质量是:32.7g-0.3g=32.4g.
11. (1) 根毛区
(2) 大于
(3) A
(4) 0.525
【解析】此题考查的是根吸水的部位,施肥过多植物会出现"烧苗"的原因, 植物细胞失水或吸水的原 理,细胞膜的功能, 以及一定质量分数溶液的配制。 (1)植物吸收水和无机盐的主要器官是根。根尖根毛区, 细胞停止伸长, 并且开始分化, 表皮一部分向 外突起形成根毛。有大量的根毛,大大增加了根与土壤中水接触的面积,有利于吸水。而且根尖根毛 及其上根内部一部分细胞分化形成导管, 能输导水分和无机盐。因此根尖根毛区是根吸收水分和无机 盐的主要部位。
(2)植物细胞吸水和失水的原理是:细胞外部溶液的浓度大于细胞内部浓度时失水, 细胞外部溶液的浓 度小于细胞内部浓度时吸水。若一次性给农作物施肥过多,会使土壤溶液浓度过高,大于植物细胞溶 液的浓度, 植物细胞不能吸水, 反而会失水, 导致植物因失水而萎蔫, 造成"烧苗"现象。因此要合理 施肥。
(3)图 A 细胞壁与细胞膜分离,液泡变小, 因此表示细胞处于失水状态。
图 B 细胞壁和细胞膜紧密的贴在一起,液泡大,因此表示细胞吸水。
第 13 页(共 15 页)
(4) 硝酸铵(NH4NO3 ) 质量=1000 千克*0.15%=1.5 千克。
硝酸铵(NH4NO3 ) 中 N 元素质量分数= × 100% = 35%
N 元素质量=1.5 千克×35%=0.525 千克。
12. (1) 失水
(2) 能; 因为土壤溶液浓度大于细胞液浓度
(3) 降低土壤溶液的浓度;水稻;水稻需水多,不断浇水能降低土壤溶液浓度
【解析】植物细胞吸水和失水的原理是: 细胞外部溶液的浓度大于细胞内部浓度时失水,细胞外部溶 液的浓度小于细胞内部浓度时吸水.
解: (1)当植物细胞内外液体有浓度差时,植物细胞就会吸水或失水. 因此,当外界溶液浓度大于根 细胞的细胞液浓度时,根细胞失水. 由图可知:A ﹣ C 表示植物细胞的失水过程. (2)若一次性给农作 物施肥过多,会使土壤溶液浓度过高,大于植物细胞溶液的浓度, 植物细胞不能吸水, 反而会失水, 导致植物因失水而萎蔫, 造成“烧苗”现象. 因此要合理施肥.(3)盐碱地土壤溶液的浓度大接近根 毛细胞液的浓度.所以不利于根毛细胞吸水. 我们可采用田间挖深沟、田内浇透水的方法进行改良盐 碱地, 这样做的目的是降低土壤溶液的浓度. 若想在这样的地里种植作物, 如种植玉米、小麦、水稻, 我认为种植水稻最好,因为水稻吸水多, 不断浇水能降低土壤溶液浓度.
13. (1) 阻止水的蒸发
(2) 把整个装置放在天平上称量质量
(3) 其他条件相同时, 干燥的环境能加快蒸腾速率
【解析】蒸腾作用水分通过植物活体表面进行蒸发的过程称为蒸腾作用。气孔的张开和闭合可以调节 蒸发蒸腾作用, 使植物体内保持适量的水分。当气孔张开时蒸发蒸腾作用强烈、散失的水分多, 当气 孔闭合时蒸发蒸腾作用弱、散失的水分少。影响气孔的张开和闭合的外界条件有光照和温度,一般在 晴朗无风的夏天,土壤水分供应充足,蒸发蒸腾作用强烈,而在阴雨天气蒸发蒸腾作用比较弱。
(1)水的表面加油, 主要是为了防止水分的蒸发,使观察到的效果更明显.
(2)锥形瓶上没有刻度,若将锥形瓶实验前称重量,实验后再称重量,实验前的重量减实验后的重量即 是植物蒸腾作用散失的水分的重量.
(3)由 1 和 2 两组数据可知,温度、光照相同时, 空气湿度越小, 失水速度越大, 因此可以得出的结 论是: 其他条件相同时,干燥的环境能加快蒸腾速率 。
第 14 页(共 15 页)
第 15 页(共 15 页)
一 、解答题
1.近几年柯桥区进行老小区改造, 不少多层楼房安装了电梯。出于安全考虑, 电梯都设置超载自动报 警系统,其工作原理如图甲所示,电路由工作电路和控制电路组成。在工作电路中,当电梯没有超载 时, 触点 K 与触点 A 接触,闭合开关 S,电动机正常工作; 当电梯超载时,触点 K 与触点 B 接触, 电铃 发出报警铃声, 闭合开关 s,电动机不工作。在控制电路中,已知电源电压 U=6V,保护电阻 R1=100Ω, 电阻式压力传感器(压敏电阻) R2 的阻值随压力 F 大小变化如图乙所示,电梯底架自重和电磁铁线圈的
阻值都忽略不计。
(1) 控制电路电磁铁上端为 极(选填 “N”或 “S”),当人进入电梯后,压敏电阻 R2 受到的 压力 F 将增大, 其阻值 (选填“增大”、“不变”或“减小”)。
(2) 若电磁铁线圈电流达到 15mA 时,衔铁刚好被吸住,电铃发出警报声。请你设定该电梯最多乘坐 几人? (以每人 50kg 计算,且 g 取 10N/kg)
2.如图为利用太阳能给 LED 路灯供电的自动控制电路的原理示意图, 其中R 是光敏电阻。不计电磁铁 线圈电阻, 定值电阻 R0=40Ω,控制电路电源电压为 12V。白天,太阳能电池板将太阳能转化为电能, 贮存于蓄电池中。傍晚, 当光照强度减弱,使电磁铁中电流=0.1A 时, 控制电路会自动接通路灯电路, 由蓄电池给 LED 路灯供电。
第 1 页(共 15 页)
(1) 图中 B 为电磁继电器的衔铁,能否用铜制材料代替, 并请说明理
由 。
(2) 由题意可推断,光敏电阻 R 的阻值随光照强度的减弱而 (选填“增大”或“减小”)。 (3) 列式计算 LED 路灯亮起时, 光敏电阻 R 的阻值。
3.图甲为热敏电阻的 R-t 图象,图乙为用此热敏电阻 R 和继电器组成的恒温箱的简单温控电路,继电 器线圈的电阻为 150 欧,当线圈中电流大于或等于 28 毫安时,继电器的衔铁被吸合,为继电器线圈供
电的电池的电压为 6 伏, 图中的“电源”是恒温箱加热器的电源。
(1) 恒温箱的加热器应接在 端。 (选填“A.B”或 “C、D”)
(2) 若恒温箱内的温度达到 100℃时,通过计算分析恒温箱加热器是否处于工作状态?
(3) 若要使所控制的恒温箱内的最高温度变大,应如何操
作
。
4.为了实现碳中和,植树造林是人类抵消自身产生的二氧化碳排放, 实现二氧化碳“零排放”的重要
第 2 页(共 15 页)
手段之一。纤维素[(C6H10O5)n]是植物细胞壁的主要成分, 占植物界碳含量的 50%以上。
(1) 纤维素属于 (填“有机物”或“无机物”)。
(2) 纤维素中碳、氢、氧元素质量比 。
(3) 纤维素在氧气中完全燃烧的产物是 。
5.我国从 1994 年开始强制实行食盐加碘, 即在食盐中加入碘酸钾(KIO3 ), 以防止碘缺乏病的发生,
2010 年开始下调食盐加碘量,由原来每千克食盐加碘 40mg 下调至 25mg。(碘的相对原子质量为 127)
(1) 碘酸钾中钾元素、碘元素、氧元素的质量之比为 。
(2) 碘酸钾中碘元素的质量分数为 (计算结果精确到 0.1%)。
(3) 现售加碘食盐每袋(500g) 应比调整前减少了 mg 碘,即少加碘酸钾 mg (计 算结果精确至 0.1mg)。
6.特丁基对苯二酚,英文简称 TBHQ,其化学式为 C10H14O2 ,是国际上公认最好的食品抗氧化剂之一, 且
有防霉,抗菌作用。但如果人类长期大量食用添加有特丁基对苯二酚的食品或食用油, 有致畸、致癌 的危险。
(1) 特丁基对苯二酚属于 (选填“有机物”或“无机物”)。
(2) 特丁基对苯二酚中碳、氢、氧三种元素的原子个数比为 。
(3) 33.2g 特丁基对苯二酚中所含碳元素质量为 。
7.由实验测知:取 3.5gKMnO4 晶体加热到 220℃,分解放出的氧气多于按下式计算的理论量。按下式计 算的理论量为放出氧气 0.354g。
2KMn04K2 Mn04 + Mn02 + 02 t
_
_
溶于水 溶于水
( ) ( ) (黑色、不溶)
呈紫红色 呈绿色
换算成标准状况下的体积为 248 mL,而实际测得的氧气为 308 mL (标准状况),超过理论量为: (308 一 248) mL=60mL。试回答:
第 3 页(共 15 页)
(1)怎样用实验证明:超理论量的氧气不是来自 MnO2________
(2)怎样用实验证明超理论量的氧气是由 K2MnO4 分解产生的?(要求用 KMnO4 制取氧气后的残渣实验, 如所示。) ________
(3)怎样从“最后残渣”中分离出 MnO2 ?________ 8.温室大棚种植具有安全、卫生、提高产量等优点而被广泛采用。
(1) 一般要求温室棚内,晚上的温度低些来减弱呼吸作用。请写出植物进行呼吸作用的文字表达 式: 。
(2) 若图甲温室中只有绿色植物,在不通入 CO2 的情况下,每天只在 6:00~18:00 接受日光照射,请 在图乙的坐标上,用笔画出 6:00~24:00 该温室内 CO2 浓度的大致变化曲线(0:00~6:00 的曲线已经 绘出)。并说明理由。
9.如图是某胃药标签的部分内容. 小明同学测定该药品中 NaHCO3 含量的过程如下: 取 10 粒该药剂研碎 后放入烧杯中, 加入 50 克水后充分搅拌, 再向其中滴加稀盐酸至溶液的 pH=7 时(已知药品中的其它 成分既不溶于水,也不与稀盐酸反应),形成 NaCl 的不饱和溶液, 共消耗稀盐酸 11.5 克. 称得反应后 烧杯内物质的总质量为 64.3 克.
请计算:
(1) 反应完成后生成气体的质量为 .
(2) 反应后烧杯中溶液的质量和胃药中 NaHCO3 的质量分数. 10.小晨同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作。她的 具体做法是: 取 10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称
量,记录如下:
反应过程 反应前 反应后
第 4 页(共 15 页)
质量变化(不含容器质量) 34.3g 32.7g
若反应后, 双氧水分解完全且氧气全部逸出, 不计水分的蒸发,请完成下列问题: (1) 随着反应的进行, 小晨会发现反应的反应速度再逐渐减慢,原因
是 ;
(2) 反应得到氧气的质量是 g;
(3) 二氧化锰在反应后的质量是 g;
(4) 反应最后容器中水的质量是多少?
11.根是陆生植物吸水的主要器官,它从土壤中吸收大量的水,满足植物体生长发育的需要。如图是细
胞吸水和失水模式图.请回答以下问题:
(1) 根吸收水的主要部位是根尖的 。
(2) 施肥过多植物会出现“烧苗”现象,其原因是土壤溶液浓度 根细胞细胞液浓度(填“大 于”、“等于”或“小于”)。
(3) 在 A,B 两图中, 图表示细胞处于失水状态。
(4) 无土栽培使作物彻底脱离了土壤环境,因而也就摆脱了土地的约束。无土栽培中用人工配制的培 养液,供给植物矿物营养的需要。欲配置 1000 千克含溶质质量分数为 0.15%的硝酸铵(NH4NO3 )营养液, 能为作物提供多少质量的氮元素 千克。
12.如图是显微镜下观察到的一个植物细胞发生的一个过程, 请据图完成问题.
(1) A~C 表示植物细胞的 过程.
(2) 根能吸收土壤溶液中的无机盐, 若一次施肥过多,能否出现这一现象? 为什
第 5 页(共 15 页)
么? .
(3) 我们可采用田间挖深沟、田内浇透水的方法进行改良,这样做的目的
是 .若想在这样的地里种植作物,如种植玉米、小麦、水稻, 你认为种植什 么最好? ,理由是 . 13.某同学在探究植物枝条失水的速度与哪些环境因素有关时,设计了如图所示的实验装置。在风速等 条件相同的情况下进行实验,其结果如下表:
实验序号 环境条件 失水速度(克/时)
1 25 ℃、光照、潮湿 14
2 25 ℃、光照、干燥 32
3 25 ℃、黑暗、干燥 8
(1) 水的表面加一层油, 目的是 。
(2) 该实验装置中,锥形瓶上没有刻度, 如何较为准确地测量枝条每小时的失水质量?
。
(3) 比较 1 和 2 两组数据可以得出的结论是 。
第 6 页(共 15 页)
0.浙教版科学八年级下册期末专题复习:解答题二答案解析
一 、解答题
1. 【答案】(1) N;减小
(2) R 总= = =400Ω
R2=R 总-R1=400Ω-100Ω=300Ω
由图乙得 F=8000N
G 总=F 总=8000N
G 人=50Kg×10N/Kg=500N
n= G (G)人 (总) = N/人 (00N) =16 人
16-1=15 人
【解析】(1)根据安培定则判断电磁铁的极性。根据乙图确定压敏电阻 R2 的阻值随压力的变化规律。
(2) 首先根据 R总 = 计算出电流达到 15mA 时的总电阻,再根据 R2=R 总-R1=计算出压敏电阻 R2 的阻
值,接下来根据乙图确定此时压敏电阻受到的压力,再根据 G 总=F 总 计算出乘坐电梯的人的总重力,
最后根据 n = G (G)人 (总) 计算出可以乘坐的最多人数。
【解答】(1)电磁铁线圈上电流方向向右;右手握住螺线管, 弯曲的四指指尖向右,此时大拇指指向 上端, 则电磁铁的上端为 N 极。根据乙图可知,当人进入电梯后, 压敏电阻 R2 受到的压力 F 将增大, 其阻值减小。
2. 【答案】(1)不能, 因为电磁铁只能吸引铁钴镍等物质, 不能吸引铜
(2) 增大
(3) 当电流为 0.1A 时路灯亮起,
此时的总电阻为: R总 = UI总 = = 120;
光敏电阻的阻值: R=R 总-R0=120Ω-40Ω=80Ω。
【解析】(1)根据衔铁的工作原理和特点分析;
(2) 根据图片, 结合题目描述的过程,确定光照强度减弱时衔铁的位置,从而确定电磁铁磁场强度的 变化, 进而确定电流大小变化, 最终确定电阻的大小变化即可;
第 7 页(共 15 页)
(3) 当电流为 0.1A 时路灯亮起,首先根据R总 = UI总计算出总电阻,再根据 R=R 总-R0 计算出光敏电阻的 阻值。
【解答】(1)电磁继电器的主要结构为电磁铁,依靠对衔铁的吸引,从而实现对电路的控制,则衔铁 必须使用铁磁性材料,则:衔铁不能用铜制材料代替,理由为:因为电磁铁只能吸引铁钴镍等物质, 不能吸引铜。
(2)傍晚时, 光照强度减弱,此时路灯发光, 即衔铁与 DE 接触, 那么电磁铁的磁场减弱,通过它的 电流减小, 则光敏电阻的阻值增大。
(3) 当电流为 0.1A 时路灯亮起,
此时的总电阻为:R总 = UI总 = = 120;
光敏电阻的阻值:R=R 总-R0=120Ω-40Ω=80Ω。
3. (1) A.B 端
(2) 解: 若恒温箱内的温度达到 100℃时,查图甲可知 R=50 欧
则 R 总=50Ω+150Ω=200Ω,I=U/R 总=6V/200Ω=0.03A=30mA , 30mA>28mA,此时电磁铁磁性较大,吸引衔铁, 动触点与 CD 所在的电路接通,恒温箱加热器不处于工 作状态。
(3) 在控制电路中串联一个合适阻值的电阻; (或适当减小控制电路的电压; 适当减少电磁铁线圈匝 数;换一根强度较强的弹簧
【解析】(1)根据甲图确定热敏电阻随温度的变化规律, 再根据图乙确定温度升高到一定程度后电磁 铁的磁性变化, 确定衔铁的位置变化和工作状态, 最终确定加热器的位置。
(2)首先根据图甲确定 100℃时热敏电阻的阻值,再根据 R 总=R+R 线计算出总电阻,接下来根据I = R总 (U)计 算出此时的总电流, 最后与 28mA 进行比较, 从而确定恒温箱的工作状态。
(3) 当温度升高时, 只要保证电磁铁能够吸合即可,可从影响电磁铁磁场强弱的因素, 杠杆的平衡条 件等角度寻找解决方法。
(1) 根据甲图可知, 当温度升高时,热敏电阻的阻值减小,则通过电磁铁的电流增大,它的磁场增强, 将衔铁吸下来, 从而切断工作电路, 那么恒温箱的加热器应该接在 A.B 端;
(3) ①电磁铁吸合时需要的磁场强度相同。
第 8 页(共 15 页)
a.可以控制通过电磁铁的电流相同, 当总电压不变时,需要控制总电阻不变。当温度升高时,热敏电 阻的阻值减小, 那么此时要增大电路电阻,即可串联一个阻值合适的电阻。
b.可以控制通过电磁铁的电流相同, 当温度升高时,热敏电阻的阻值减小, 则总电阻减小, 根据 U=IR 可知, 此时可以减小控制电路的电压。 ②当温度升高时,电路的总电阻减小,而总电流增大,那么电磁铁的磁力增强。根据杠杆的平衡条件 F1L1=F2L2 可知,此时需要换一根强度更强的弹簧。
4. (1) 有机物
(2) 36:5:40
(3) CO2 和 H2O
(1) 根据含有碳元素的化合物为有机物分析;
(2) 根据元素质量比为相对原子质量×原子个数之比分析;
(3) 根据碳、氢、氧元素的化合物完全燃烧生成二氧化碳和水分析。
【解答】(1) 纤维素为含碳的化合物,属于有机物;
(2) 纤维素中碳、氢、氧元素质量比为(12×6) :10:(16×5)=36:5:40; (3) 由反应前后元素种类不变可知, 纤维素在氧气中完全燃烧的产物为 CO2 和 H2O ; 故答案为: (1) 有机物; (2) 36:5:40;(3) CO2 和 H2O 。
5. (1) 2:1
(2) 物理性质
(3) 29:45
(1) 在化学式中, 元素符号右下角的数字就是该原子的个数;
(2) 化学性质是物质在化学变化中表现出来的性质,如所属物质类别的化学通性:酸性、碱性、氧化
性、还原性、热稳定性及一些其它特性。
物理性质是不需要发生化学变化就表现出来的性质,如: 颜色、气味、状态、是否易融化、凝固、升 华、挥发, 还有些性质如熔点、沸点、硬度、导电性、导热性、延展性、溶解性、密度等。
(3) 根据化学式可知,一个丁酸乙酯分子和一个葡萄糖分子中都含有 6 个碳原子,那么碳原子的个数 相等, 其实就是二者的分子数相等, 然后根据“质量之比等于相对分子质量与个数的乘积之比”计算 即可。
第 9 页(共 15 页)
【解答】(1)根据化学式 C6H12O2 可知,丁酸乙酯中氢和碳的原子个数比为: 12:6=2:1.
(2) 丁酸乙酯作为溶剂,可以溶解多种有机物,这体现了它的物理性质。
(3) 根据化学式可知,一个丁酸乙酯分子和一个葡萄糖分子中都含有 6 个碳原子,那么碳原子的个数 相等, 其实就是二者的分子数相等。
丁酸乙酯和葡萄糖的质量比为: (12×6+1×12+16×2) ×n:(12×6+1×12+16×6) ×n=29:45。 6. (1) 有机物
(2) 5:7:1
(3) 24
(1) 根据含碳元素的化合物为有机物分析;
(2) 根据化学式右下角数字为原子个数比分析;
(3) 根据元素质量为物质质量×元素质量分数分析。
【解答】(1) 特丁基对苯二酚属于 有机物;
(2) 特丁基对苯二酚中碳、氢、氧的原子个数比为 10:14:2=5:7:1;
(3) 33.2g 特丁基对苯二酚中所含碳元素质量为33.2g × × 100% = 24g;
故答案为: (1) 有机物; (2) 5:7:1;(3) 24g。
7. (1)另取少量 MnO2 ;在酒精灯火焰上加热,插入带火星的木条,木条不复燃
(2)用酒精灯火焰集中加热“残渣”,又收集到一定体积的氧气
(3)将最后残渣加入适量的水溶解,过滤, 即可分离出 MnO2 8. (1) 有机物+氧气→二氧化碳+水+能量
(2) 植物的光合作用是吸收二氧化碳,释放氧气, 呼吸作用是吸收氧气,释放二氧化碳;在不通入二 氧化碳的情况下,装置乙在光照的条件下,二氧化碳的浓度会逐渐降低;在黑暗环境中,植物只进行 呼吸作用释放二氧化碳, 因此二氧化碳的浓度又会逐渐增加. 即在 6:00~24:00 时间段内,二氧化 碳在坐标上表现为先降低然后再升高.又因为装置内的一部分二氧化碳被植物通过光合作用合成了有 机物储存在植物体内,因此装置内的二氧化碳的总含量会逐渐减少;
第 10 页(共 15 页)
。
【解析】光合作用, 通常是指绿色植物(包括藻类)吸收光能,把二氧化碳和水合成富能有机物,同 时释放氧气的过程。呼吸作用指机体将来自环境的或细胞自己储存的有机营养物的分子(如糖类、脂 类、蛋白质等),通过一步步反应降解成较小的、简单的终产物(如二氧化碳、乳酸、乙醇等) 的过程。 (1) 植物进行呼吸作用是将有机物分解成二氧化碳和水, 并释放大量能量的过程; 即有机物+氧气→ 二氧化碳+水+能量;
(2) 植物的光合作用是吸收二氧化碳,释放氧气, 呼吸作用是吸收氧气,释放二氧化碳;在不通入二 氧化碳的情况下,装置乙在光照的条件下,二氧化碳的浓度会逐渐降低;在黑暗环境中,植物只进行 呼吸作用释放二氧化碳, 因此二氧化碳的浓度又会逐渐增加. 即在 6:00~24:00 时间段内,二氧化 碳在坐标上表现为先降低然后再升高.又因为装置内的一部分二氧化碳被植物通过光合作用合成了有
机物储存在植物体内,因此装置内的二氧化碳的总含量会逐渐减少;
故答案为: (1) 有机物+氧气→二氧化碳+水+能量; (2) 。
9. (1) 2.2g
(2) 解: 设参加反应的碳酸氢钠的质量为 x
NaHCO3+HCl=NaCl+H2O+CO2 ↑
第 11 页(共 15 页)
84
X
=
44
2.22g
x=4.2g
反应后烧杯中溶液的质量为 4.2g+50g+11.5g ﹣ 2.2g=63.5g.
胃药中 NaHCO3 的质量分数为×100%=84%.
答:反应后烧杯中溶液的质量为 63.5g;胃药中 NaHCO3 的质量分数为 84%.
【解析】(1)每粒 0.5g,10 粒该药剂的质量为 0.5g×10=5g,由质量守恒定律,生成二氧化碳气体的 质量为 5g+50g+11.5g ﹣ 64.3g=2.2g;
(2) 设参加反应的碳酸氢钠的质量为 x,
NaHCO3+HCl=NaCl+H2O+CO2 ↑
第 12 页(共 15 页)
84
X
=
44
2.2g
x=4.2g
反应后烧杯中溶液的质量为 4.2g+50g+11.5g ﹣ 2.2g=63.5g,
胃药中 NaHCO3 的质量分数为×100%=84%.
答: (1) 2.2g;(2) 反应后烧杯中溶液的质量为 63.5g;胃药中 NaHCO3 的质量分数为 84%.
碳酸氢钠与稀盐酸反应生成氯化钠、水和二氧化碳;由题意, 取 10 粒该药剂研碎后放入烧杯中, 加入 50 克水后充分搅拌,再向其中滴加稀盐酸至溶液的 pH=7 时, 形成 NaCl 的不饱和溶液, 共消耗稀盐酸 11.5 克, 称得反应后烧杯内物质的总质量为 64.3 克,烧杯内减少的质量即生成的二氧化碳的质量,据 此根据反应的化学方程式列式计算出参加反应碳酸氢钠的质量.
10. (1) 随着反应的进行, 过氧化氢的浓度会逐渐降低,所以反应速度会减慢
(2) 1.6
(3) 0.3
(4) 32.4g
【解析】(1)反应物的浓度会影响化学反应的速度,即浓度越大, 反应越快;
(2) 根据质量守恒定律可知,反应前后总质量的差就是生成氧气的质量;
(3) 根据过氧化氢分解的方程式,利用氧气的质量计算出参加反应的过氧化氢溶质的质量,再根据溶 质质量÷质量分数计算出参加反应的过氧化氢溶液的质量,最后根据反应前总质量减去溶液质量计算 二氧化锰的质量即可;
(4) 反应后水的质量等于反应后物质的总质量和二氧化锰质量的差。(1) 随着反应的进行, 小晨会发
现反应的反应速度在逐渐减慢, 原因是随着反应进行,过氧化氢浓度减小。
(2) 反应得到氧气的质量是: 34.3g-32.7g=1.6g,
(3) 设过氧化氢质量为 x,反应生成水的质量为 y,
MnO2
2H2 O2 = 2 H2 O + O2 ↑
68 36 32
x y 1.6g
(
=
;
)68 32
1.6g
解得: x=3.4g;,
过氧化氢溶液质量: 3.4g÷10%=34g,
二氧化锰在反应后的质量是: 34.3g-34g=0.3g。
(4) 反应最后容器中水的质量是:32.7g-0.3g=32.4g.
11. (1) 根毛区
(2) 大于
(3) A
(4) 0.525
【解析】此题考查的是根吸水的部位,施肥过多植物会出现"烧苗"的原因, 植物细胞失水或吸水的原 理,细胞膜的功能, 以及一定质量分数溶液的配制。 (1)植物吸收水和无机盐的主要器官是根。根尖根毛区, 细胞停止伸长, 并且开始分化, 表皮一部分向 外突起形成根毛。有大量的根毛,大大增加了根与土壤中水接触的面积,有利于吸水。而且根尖根毛 及其上根内部一部分细胞分化形成导管, 能输导水分和无机盐。因此根尖根毛区是根吸收水分和无机 盐的主要部位。
(2)植物细胞吸水和失水的原理是:细胞外部溶液的浓度大于细胞内部浓度时失水, 细胞外部溶液的浓 度小于细胞内部浓度时吸水。若一次性给农作物施肥过多,会使土壤溶液浓度过高,大于植物细胞溶 液的浓度, 植物细胞不能吸水, 反而会失水, 导致植物因失水而萎蔫, 造成"烧苗"现象。因此要合理 施肥。
(3)图 A 细胞壁与细胞膜分离,液泡变小, 因此表示细胞处于失水状态。
图 B 细胞壁和细胞膜紧密的贴在一起,液泡大,因此表示细胞吸水。
第 13 页(共 15 页)
(4) 硝酸铵(NH4NO3 ) 质量=1000 千克*0.15%=1.5 千克。
硝酸铵(NH4NO3 ) 中 N 元素质量分数= × 100% = 35%
N 元素质量=1.5 千克×35%=0.525 千克。
12. (1) 失水
(2) 能; 因为土壤溶液浓度大于细胞液浓度
(3) 降低土壤溶液的浓度;水稻;水稻需水多,不断浇水能降低土壤溶液浓度
【解析】植物细胞吸水和失水的原理是: 细胞外部溶液的浓度大于细胞内部浓度时失水,细胞外部溶 液的浓度小于细胞内部浓度时吸水.
解: (1)当植物细胞内外液体有浓度差时,植物细胞就会吸水或失水. 因此,当外界溶液浓度大于根 细胞的细胞液浓度时,根细胞失水. 由图可知:A ﹣ C 表示植物细胞的失水过程. (2)若一次性给农作 物施肥过多,会使土壤溶液浓度过高,大于植物细胞溶液的浓度, 植物细胞不能吸水, 反而会失水, 导致植物因失水而萎蔫, 造成“烧苗”现象. 因此要合理施肥.(3)盐碱地土壤溶液的浓度大接近根 毛细胞液的浓度.所以不利于根毛细胞吸水. 我们可采用田间挖深沟、田内浇透水的方法进行改良盐 碱地, 这样做的目的是降低土壤溶液的浓度. 若想在这样的地里种植作物, 如种植玉米、小麦、水稻, 我认为种植水稻最好,因为水稻吸水多, 不断浇水能降低土壤溶液浓度.
13. (1) 阻止水的蒸发
(2) 把整个装置放在天平上称量质量
(3) 其他条件相同时, 干燥的环境能加快蒸腾速率
【解析】蒸腾作用水分通过植物活体表面进行蒸发的过程称为蒸腾作用。气孔的张开和闭合可以调节 蒸发蒸腾作用, 使植物体内保持适量的水分。当气孔张开时蒸发蒸腾作用强烈、散失的水分多, 当气 孔闭合时蒸发蒸腾作用弱、散失的水分少。影响气孔的张开和闭合的外界条件有光照和温度,一般在 晴朗无风的夏天,土壤水分供应充足,蒸发蒸腾作用强烈,而在阴雨天气蒸发蒸腾作用比较弱。
(1)水的表面加油, 主要是为了防止水分的蒸发,使观察到的效果更明显.
(2)锥形瓶上没有刻度,若将锥形瓶实验前称重量,实验后再称重量,实验前的重量减实验后的重量即 是植物蒸腾作用散失的水分的重量.
(3)由 1 和 2 两组数据可知,温度、光照相同时, 空气湿度越小, 失水速度越大, 因此可以得出的结 论是: 其他条件相同时,干燥的环境能加快蒸腾速率 。
第 14 页(共 15 页)
第 15 页(共 15 页)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
