浙教版八下期末复习第三章计算题(含解析)
图片预览



文档简介
中小学教育资源及组卷应用平台
浙教版八下期末复习第三章计算题
1.在做氯酸钾分解制取氧气的实验中,某同学误把高锰酸钾当二氧化锰加入反应,反应前混合物的总质量为12.96g,加热混合物到质量不再减少,反应后混合物的质量为8.8g,将反应后的固体溶入水中,过滤,干燥得到二氧化锰的质量为0.87g。
(1)求制取氧气的质量。
(2)反应前高锰酸钾的质量为多少?
(3)求反应后固体混合物中氯化钾的质量分数。
2.“化学氧自救呼吸器”是一种在缺氧环境中通过制氧剂临时供氧的装置。制氧剂的主要成分是超氧化钾(KO2),产生氧气的主要原理是超氧化钾与人体呼出的水汽反应,其化学方程式为4KO2+2H2O=4KOH+3O2↑。制氧剂中其他成分不能生成氧气。21cnjy.com
(1)小明设计化学氧自救呼吸器时,为确定制氧剂的用量,除了查阅人体每分钟呼吸次数外,还需了解哪些与人体呼吸相关的数据 。(列举一个)
(2)若该呼吸器需为使用者提供48g氧气,则至少需要含超氧化钾80%的制氧剂多少克
(3)小明设计了如图甲、乙两种化学氧自救呼吸器,其内部气体路径如图所示。你认为哪种方案更合理 说明理由: 。
3.某同学去我市的某风景区游玩时,取回了若干块矿石样品,他采用了以下的方法对样品中碳酸钙的质量分数进行检测:取这种石灰石样品6克,把40克稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。
加入稀盐酸的次序 1 2 3 4
加入稀盐酸的质量(克) 10 10 10 10
剩余固体的质量(克) 4.0 m 1.2 1.2
求:
(1)6克石灰石样品中含有的杂质为 克。
(2)m= 。
(3)样品中碳酸钙的质量分数是多少?
(4)所用稀盐酸的质量分数是多少?
4.小科用如图所示的装置来测量某石灰石样品中碳酸钙的质量分数,注射器水平放置,夹持装置未画出。他在试管中加入1 g石灰石样品和足量的稀盐酸(石灰石中其他成分不与稀盐酸反应产生气体),快速用连有注射器的橡皮塞塞紧试管口,实验结果如下表。(忽略活塞与筒壁之间的摩擦及温度变化对实验的影响)
反应时间/min 0 1 2 3 4
活塞对应的刻度/mL 0 98 152 176 176
(1)实验中判断石灰石和盐酸反应完全的依据是 。
(2)本实验条件下二氧化碳的密度约为2 g/L,请利用表格中的数据,根据化学方程式计算该石灰石样品中碳酸钙的质量分数。21教育网
5.学校八年级科学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水,杂质中不含钙元素)。有关实验数据如下表:
反 应 前 反 应 后
实验数据 烧杯和稀盐酸的质量 石灰石样品的质量 烧杯和剩余物的总质量
150g 12.5g 158.1g
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为 g。
(2)该石灰石中碳酸钙的质量分数。
(3)反应中生成氯化钙的质量是多少克?(写出计算过程)
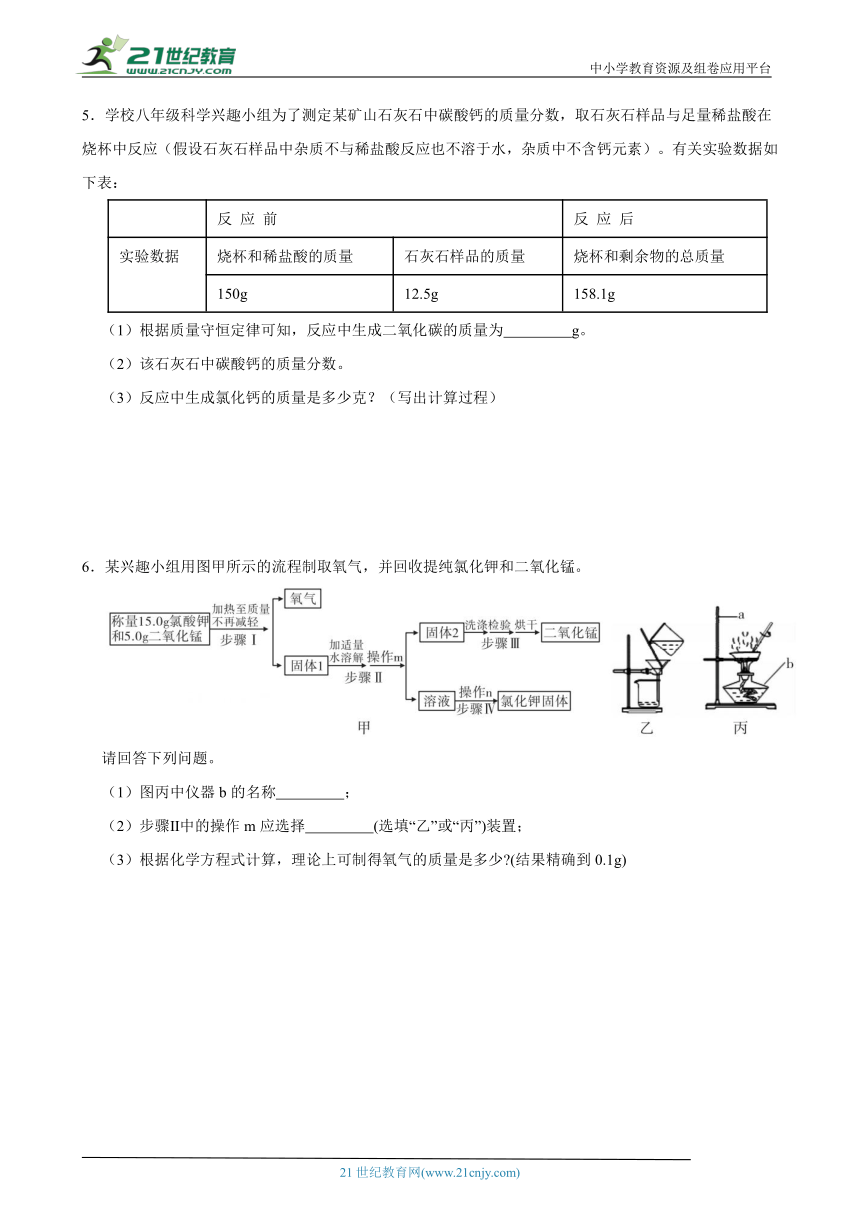
6.某兴趣小组用图甲所示的流程制取氧气,并回收提纯氯化钾和二氧化锰。
请回答下列问题。
(1)图丙中仪器b的名称 ;
(2)步骤Ⅱ中的操作m应选择 (选填“乙”或“丙”)装置;
(3)根据化学方程式计算,理论上可制得氧气的质量是多少 (结果精确到0.1g)
7.某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。请计算:
21·cn·jy·com
序号 加入稀盐酸的质量/g 剩余固体的质量/g
第1次 20 11
第2次 20 6
第3次 20 2.8
第4次 20 a
(1)上表中a的数值为 ;
(2)样品中碳酸钙的质量分数是 ;
(3)求盐酸中溶质的质量分数。
8.常见的制氧剂有氯酸钠(NaClO3)、过氧化钙(CaO2) 和超氧化钾(KO2)等,这些制氧剂在一定条件下都可用来制取氧气,其反应原理分别为:2NaClO3 2NaCl+3O2↑,2CaO+2H2O=Ca(OH)2+O2↑,4KO2+2H2O=4KOH+3O2↑。
(1)以上三种制氧剂中属于氧化物的有
(2)3.6克过氧化钙(CaO2)中含氧元素的质量为 克。
(3)若要制取相等质量的氧气,需要氯酸钠和超氧化钾的质量比为 。
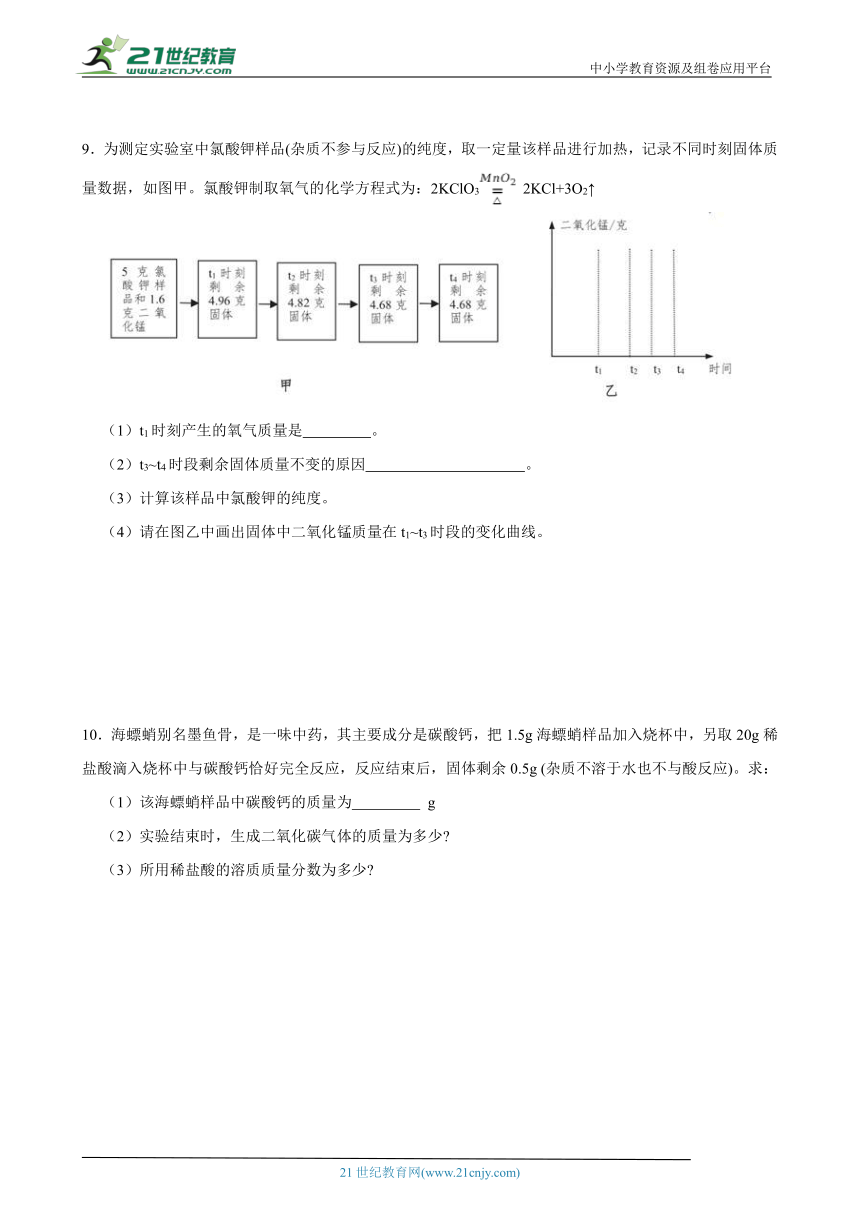
9.为测定实验室中氯酸钾样品(杂质不参与反应)的纯度,取一定量该样品进行加热,记录不同时刻固体质量数据,如图甲。氯酸钾制取氧气的化学方程式为:2KClO3 2KCl+3O2↑
(1)t1时刻产生的氧气质量是 。
(2)t3~t4时段剩余固体质量不变的原因 。
(3)计算该样品中氯酸钾的纯度。
(4)请在图乙中画出固体中二氧化锰质量在t1~t3时段的变化曲线。
10.海螵蛸别名墨鱼骨,是一味中药,其主要成分是碳酸钙,把1.5g海螵蛸样品加入烧杯中,另取20g稀盐酸滴入烧杯中与碳酸钙恰好完全反应,反应结束后,固体剩余0.5g (杂质不溶于水也不与酸反应)。求:
(1)该海螵蛸样品中碳酸钙的质量为 g
(2)实验结束时,生成二氧化碳气体的质量为多少
(3)所用稀盐酸的溶质质量分数为多少
11.钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。提示:食醋的主要成分是醋酸(HAc),醋酸和碳酸
钙反应的化学方程式为: 2HAc+CaCO3=CaAc2+H2O+CO2↑。该实验中浓硫酸的作用是吸收逸出的水蒸气, 鱼骨中其它成分与食醋反应生成的气体可忽略不计。
(1)该实验中仪器a的名称是 。
(2)计算鱼骨中碳酸钙的质量分数。
(3)生活中用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明。
12.某品牌钙片的部分信息:①钙片主要成分为碳酸钙;②每片钙片的质量为1克.科学学习小组同学用该品牌钙片做了如下实验:把100克稀盐酸分成五等份,分次将稀盐酸添加到放有10片钙片的烧杯中,充分反应(钙片中其它成分不溶于水且不与盐酸反应)。得到的实验数据见下表。
实验次数 1 2 3 4 5
加入稀盐酸的质量/克 20 20 20 20 20
剩余固体的质量/克 8.0 6.0 4.0 2.5 2.5
回答下列问题:
(1)CaCO3中碳元素的化合价为 .
(2)10片钙片中CaCO3的质量为 .
(3)实验中所用稀盐酸的溶质质量分数为多大?
13.鸡蛋壳的主要成分是碳酸钙。某科学兴趣小组取25g鸡蛋壳于烧杯中,缓慢加入稀盐酸(杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图所示。请根据要求回答问题:
(1)实验时当观察到 现象时,说明鸡蛋壳已完全反应;
(2)鸡蛋壳完全反应后,求产生CO2的质量;
(3)当鸡蛋壳恰好完全反应时,求所得溶液的溶质质量分数。
14.石头纸是一种介于纸张和塑料之间的环保新型材料,主要成分为碳酸钙。为测定其中碳酸钙的含量,课外活动小组的同学进行了实验,实验数据见下表(假设纸张其它成分既不溶于水,也不与稀盐酸反应):
烧杯序号 ① ② ③ ④ ⑤
加入样品的质量/克 10 10 10 10 10
加入稀盐酸的质量/克 10 20 30 40 50
充分反应后生成气体的质量/克 0.88 x 2.64 3.08 3.08
(1)表格中x的值为 ;
(2)10克样品中碳酸钙的质量为 克;
(3)求实验中所使用的稀盐酸溶质质量分数。
15.某品牌钙片的部分信息:①钙片主要成分为碳酸钙;②每片钙片质量为1克。小应用该品牌钙片做了如下实验:把100克稀盐酸分成五等份,分次将稀盐酸添加到放有5片钙片的烧杯中,充分反应(钙片中其它成分不溶于水且不与盐酸反应)。得到的实验数据见下表。
21·世纪*教育网
实验次数 1 2 3 4 5
加入稀盐酸的质量/克 20 20 20 20 20
剩余固体的质量/克 4.0 3.0 2.0 1.1 1.1
回答下列问题:
(1)5片钙片中所含碳酸钙的总质量为 克;
(2)计算该实验中所用稀盐酸的溶质质量分数。(写出计算过程)
16.2022年两会上“碳达峰”“碳中和”首次被写入政府工作报告。“碳中和”已经成为影响中国未来发展的重要国家战略。实现碳中和,一是 要减排即减少二氧化碳的排放,二是要发展增汇技术即二氧化碳的吸收技术。
2-1-c-n-j-y
资料一:浙江大学研发了“二氧化碳烟气微藻减排技术”,用微型藻类吸收二氧化碳实现固碳。
资料二: 2020年1月,李灿院士领先的全球首套千吨级“液态太阳燃料合成示范项目”在兰州试车成功。
微型藻类吸收二氧化碳该技术,本质是利用微藻的 作用实现固碳。自然界中的淀粉一般也是通过绿色植物的该生理活动合成,请写出该生理活动的文字表达式__________________________
。
(2)“液态太阳燃料合成示范项目”简单流程如图,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。据图分析,甲醇合成时,利用氢能合成甲醇的反应物为 ;若碳元素全部来自于二氧化碳,则3.2吨甲醇(CH3OH)与 吨二氧化碳含碳量相当。
【来源:21·世纪·教育·网】
(3)碳中和需要每一个人的努力,请你例举一条生产、生活中减少碳排放的措施 。
17.“化学氧自救呼吸器”是一种在缺氧环境中通过制氧剂临时供氧的装置。制氧剂的主要成分是超氧化钾(KO2),产生氧气的主要原理是超氧化钾与人体呼出的水汽反应,其化学方程式为4KO2+2H2O=4待填+3O2↑。制氧剂中其它成分不能生成氧气。【出处:21教育名师】
(1)化学方程式待填处,应填上的化学式为 。
(2)小应设计化学氧自救呼吸器时,为确定制氧剂的用量,除了查阅人体每分钟t次数外,还需了解哪些与人体呼吸相关的数据? 。(例举一个)21*cnjy*com
(3)若该呼吸器需为使用者提供96克氧气,则至少需要含KO280%的制氧剂多少克?
18.某研究性学习小组为测定当地矿山石灰石中碳酸钙的质量分数,取来了一些样品,并用稀盐酸200g,平均分成4份进行4次实验(样品中其他杂质不与稀盐酸反应),结果见下表,回答下列问题:
实验次数 1 2 3 4
加入样品质量(g) 5 10 15 20
生成CO2质量(g) 1.76 3.52 4.4 M
(1)实验过程中,通过观察 现象可判断反应结束。
(2)表中的M数值是 g。
(3)这种石灰石中碳酸钙的质量分数是多少?(要求写出计算过程)
19.二氧化碳是主要的温室气体。大气中二氧化碳的浓度升高,会导致温室效应,进而对全球自然生态系统产生影响,如气候异常、海平面升高、冰川退缩等。
21教育名师原创作品
我国向国际社会作出郑重承诺,二氧化碳排放量力争于2030年前达到峰值,努力争取在2060年前实现碳中和(如图甲),树立了大国形象,彰显了大国担当。回答下列问题:
(1)如图乙所示的实验装置模拟二氧化碳产生温室效应,左侧集气瓶中盛放空气,右侧集气瓶中盛放二氧化碳气体。如果观察到 现象,可以证明二氧化碳是可以产生温室效应的气体。
(2)图丙是自然界中碳氧循环的示意图, 结合图丙分析当前大气中二氧化碳含量上升的主要原因是 。“碳中和”是指二氧化碳的排放总量和减少总量相当,下列做法不符合“碳中和”理念的是: (填序号) 。
A.骑行共享单车,倡导绿色出行 B.践行光盘行动,杜绝铺张浪费
C.推广火力发电,满足用电需求 D.开展植树造林,优化生态环境
(3)2022年4月28日我国科学家在国际学术期刊《自然催化》上发表成果——实现二氧化碳到葡萄糖的合成,开辟了一条二氧化碳转化的新途径。假设二氧化碳合成葡萄糖碳元素的转化率为100%,合成3.6kg葡萄糖(分子式C6H12O6)可以吸收 kg二氧化碳。
20.为测试学生的实验和计算能力,老师准备了一瓶没有贴标签的过氧化氢溶液,同学们取部分溶液进行了如下实验,请结合实验回答下列问题:
(1)产生氧气的质量为 g。
(2)计算该过氧化氢溶液中溶质的质量分数。
答案解析部分
1.(1)根据质量守恒定律可知,制取氧气的质量为:12.96g-8.8g=4.16g;
(2)设反应前高锰酸钾的质量为x,生成锰酸钾质量的y,
2KMnO4K2MnO4+MnO2+O2↑,
316 197 87
x y 0.87g
;
解得:x=3.16g,y=1.97g。www.21-cn-jy.com
(3)反应后固体混合物中氯化钾的质量分数为:。
2.(1)呼出气体中的水蒸气含量(或每次呼吸耗氧量,合理即可)
(2)设得到48g氧气需要超氧化钾的质量为x。
4KO2+2H2O=4KOH+ 3O2↑
284 96
X 48g
=
x=142g
需要制氧剂的质量为=177.5g。
答:至少需要含超氧化钾80%的制氧剂的质量为177.5g
(3)甲合理;水汽能快速与制氧剂接触,且呼气和吸气时水汽都有机会与制氧剂反应,水汽利用率高(或乙合理,理由能充分支持观点即可)
【解答】(1)为了确定超氧化钾的用量,需确定化学方程式其余一个量的多少,例如水蒸气的量或所需的氧气量。
(3)在甲图中不管是吸气还是呼气,其水蒸气都会与制氧剂接触,故选甲。
3.(1)1.2
(2)2.0
(3)碳酸钙的质量为:6.0g-1.2g=4.8g,故其质量分数为:×100%=80%
(4)设10g稀盐酸中溶质的量为x,则:
解得:x=1.46g.
所以盐酸的质量分数为: ×100%=14.6%.
【解答】(1)由表中数据可知,加入10克稀盐酸完全反应,消耗碳酸钙质量为2.0克,则m=2.0,第3次加入盐酸,固体质量减少0.8g,说明碳酸钙完全反应,剩余1.2克固体为样品中的杂质。
(2)m=2.0;
故答案为:(1)1.2;(2)2.0;(3)80%;(4)14.6%。
4.(1)活塞对应的刻度不变(或活塞不再移动,或没有气泡产生,或气体体积不再增加等,合理即可)
(2)176 mL=0.176 L,反应生成CO2的质量为2 g/L×0.176 L=0.352 g。
设样品中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 0.352 g
= x=0.8 g
碳酸钙的质量分数为×100%=80%。
答:该石灰石样品中碳酸钙的质量分数为80%
【解答】(1)实验中判断石灰石和盐酸反应完全的依据是:活塞对应的刻度不变(或活塞不再移动,或没有气泡产生,或气体体积不再增加等)。
5.(1)4.4
(2)设该石灰石样品中碳酸钙的质量为x. CaCO3+2HCl═CaCl2+H2O+CO2↑ 100 44 x 4.4g 解得:x=10.0g 此石灰石中碳酸钙的质量分数为:。
(3)设生成的氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
111 44
y 4.4g
解得:y=11.1g
则生成的氯化钙的质量为11.1g。
【解答】(1)根据质量守恒定律,二氧化碳的质量为:150g+12.5g-158.1g=4.4g;
6.(1)酒精灯
(2)乙
(3)设制得氧气的质量为x
2KClO3 2KCl+ 3O2↑
245 96
15克 x
x=5.9克
【解答】(1)图丙中仪器b的名称酒精灯;
(2)固体1中为反应产物氯化钾和二氧化锰,加入适量的水后,氯化钾溶于水,而二氧化锰不溶于水,此时可通过过滤操作将二者分离,因此步骤II中的操作m为过滤,选择器材乙。
7.(1)2.8
(2)82.5%
(3)由试题分析20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应
解:设第一次参与反应的HCl质量为x,
CaCO3+ 2HCl=CaCl2+H2O+CO2↑
100 73
5g x
解得:x=3.65g
盐酸中溶质的质量分数为: ×100%=18.25%
【解答】(1)根据第1次和第2次数据可知,当碳酸钙没有完全反应时,每加入20g稀盐酸,固体质量减小:11g-6g=5g。第3次加入20g稀盐酸后,固体质量的减小量为:6g-2.8g=3.2g<5g,这说明样品中的碳酸钙已经完全反应。因此,第4次再加入20g稀盐酸时,固体的质量不会减小,即a=2.8g。
(2)根据表格可知,参加反应的碳酸钙的质量为:16g-2.8g=13.2g;
则样品中碳酸钙的质量分数为:。
8.(1)过氧化钙(CaO2)、 超氧化钾(KO2)
(2)1.6
(3)213:284
【解答】(1)氯酸钠(NaClO3)由三种元素组成,肯定不是氧化物。过氧化钙(CaO2) 和超氧化钾(KO2)由两种元素组成,其中一种为氧元素,则二者为氧化物。
(2)3.6克过氧化钙(CaO2)中含氧元素的质量为:;
(3)设生成氧气的质量为m时消耗氯酸钠的质量为x,
2NaClO3 2NaCl+3O2↑ ;
213 96
x m
;
解得:x=;
设消耗超氧化钾的质量为y,
4KO2+2H2O=4KOH+3O2↑ ;
284 96;
y m;
;
解得:y=;
则需要氯酸钠和超氧化钾的质量之比为;
9.(1)1.64克
(2)氯酸钾已完全分解
(3)解:设5克样品中含有氯酸钾的质量为x,
由图甲可知,氯酸钾完全分解生成的氧气质量m=5克+1克-4.68克=1.92克 .
2KClO3 2KCl+ 3O2↑
245 96
x 1.92克
x=4.9克
氯酸钾的质量分数=4.9克/5克X100%= =98%
(4)
【解答】(1)根据图甲可知,t1时刻生成氧气的质量为:5g+1.6g-4.96g=1.64g;
(2)t3~t4时段剩余固体质量不变的原因是:氯酸钾已完全分解;
(4)在反应过程中,二氧化锰为催化剂,它的质量和化学性质保持不变,如下图所示:
10.(1)1
(2)解:设生成二氧化碳的质量为X
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
1g x
x=0.44g
(3)解:设参加反应的HCl质量为y
CaCO3+ 2HCl=CaCl2+H2O+CO2↑
100 73
1g y
y=0.73g
HCl%= =3.65%
【解答】(1)该海螵蛸样品中碳酸钙的质量为:1.5g-0.5g=1g。
11.(1)分液漏斗
(2)解:产生二氧化碳的质量:820克-819.89克=0.11克
设20克鱼骨中碳酸钙的质量为m。
CaCO3+2HAc=CaAc2+H2O+ CO2↑
100 44
m 0.11克
m=0.25克
碳酸钙的质量分数:
答:鱼骨中碳酸钙的质量分数为1.25%
(3)酸钙在鱼骨中含量很低,鱼骨较硬可能不仅仅是碳酸钙的原因(或“用醋去除鱼刺中的碳酸钙需要的时间很长,且醋在咽停留的时间很短”) 2·1·c·n·j·y
【解答】(1)根据图片可知,该实验中仪器a的名称是分液漏斗。
(3)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。理由是:碳酸钙在鱼骨中含量很低,鱼骨较硬可能不仅仅是碳酸钙的原因(或“用醋去除鱼刺中的碳酸钙需要的时间很长,且醋在咽停留的时间很短”)。
12.(1)+4
(2)7.5克
(3)解:设20克稀盐酸中含有溶质x
参加反应的碳酸钙的质量为1克×10-8克=2克
CaCO3+ 2HCl=CaCl2+H2O+ CO2 ↑
100 73
2克 x
x=1.46克
HCl%= ×100%=7.3%
答:实验中所用稀盐酸的溶质质量分数为7.3%
【解答】(1)在化学式 CaCO3 中,Ca的化合价为+2,O的化合价为-2,根据正负化合价代数和为零得到:(+2)+x+(-2)×3=0,解得:x=+4.、
(2)根据表格可知,当碳酸钙完全反应后,剩余固体的质量为2.5g,那么10片钙片中CaCO3的质量为:10g-2.5g=7.5g。www-2-1-cnjy-com
13.(1)鸡蛋壳表面不再产生气泡
(2)解:设产生CO2的质量为x
CaCO3+2HCl=CaCl2+ CO2↑+H2O
100 44
20g x
x=8.8g
(3)解:设所得溶液的溶质质量为y
CaCO3+2HCl= CaCl2+CO2↑+H2O
100 111
20 y
y=22.2g
CaCl2%= =11.1%
【解答】(1)实验时当观察到鸡蛋壳表面不再产生气泡现象时,说明鸡蛋壳已完全反应。
14.(1)1.76g
(2)7g
(3)以实验①为例可知,0.88g稀盐酸完全反应生成0.88g二氧化碳气体,
设参加反应的HCl的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑;
73 44
y 0.88g;
;
解得:y=1.46g;
则稀盐酸的溶质质量分数:。21*cnjy*com
【解答】(1)根据实验①和③可知,在碳酸钙完全反应前,每加入10g稀盐酸生成二氧化碳的质量为0.88g,则实验②中加入20g稀盐酸时生成二氧化碳的质量:x=0.88g×2=1.76g;
(2)根据表格可知,10g样品最终生成二氧化碳的质量为3.08g,
设参加反应的碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
x 3.08g;
;
解得:x=7g;
15.(1)3.9
(2)根据第1组数据可知,当加入稀盐酸20g时参加反应的碳酸钙的质量:5g-4g=1g;
设20g稀盐酸中氯化氢质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73
1g x
;
解得:x=0.73g,
该实验中所用稀盐酸的溶质质量分数是:。
【解答】(1)5片钙片中所含碳酸钙的总质量为:5g-1.1g=3.9g。
16.(1)光合作用;二氧化碳+水有机物(储存能量)+氧气
(2)氢气和二氧化碳;4.4
(3)少开私家车
【解答】(1)微型藻类吸收二氧化碳该技术,本质是利用微藻的光合作用实现固碳。自然界中的淀粉一般也是通过绿色植物的该生理活动合成,文字表达式为:二氧化碳+水有机物(储存能量)+氧气
(2)据图分析,甲醇合成时,利用氢能合成甲醇的反应物为氢气和二氧化碳。
3.2吨甲醇(CH3OH)含有碳元素质量:
则二氧化碳含碳量:
(3)从减少碳排放出发,比如:少开私家车。
17.(1)KOH
(2)人体呼出气体中水蒸气含量,或者每次呼吸消耗氧气的质量等
(3)设得到96克氧气,需要参加反应的超氧化钾的质量为x,
4KO2+2H2O═4KOH+3O2↑
284 96
x 48克
;
解得:x=284克,
所以需要含超氧化钾80%的制氧剂质量为:。
【解答】(1)根据方程式4KO2+2H2O=4x+3O2↑得到:4K+10O+4H=4X+6O,解得:4X=4K+4O+4H,则X=KOH;
(2)制氧剂需要与水反应,所以除了查阅人体每分钟呼吸次数外,还需了解那些与人体呼出气体中水蒸气含量,或者每次呼吸消耗氧气的质量等;
18.(1)不再产生气泡的现象
(2)4.4
(3)由表格数据可知,5g样品中的碳酸钙完全反应能生成1.76g二氧化碳。
设参加反应的碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1.76g
解得:x=4;
这种石灰石中碳酸钙的质量分数是:。
【解答】(1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,则在实验过程中,会看到不断有气泡产生。如果观察到不再产生气泡的现象,可判断反应结束。
(2)表格数据分析可知,向50g稀盐酸中加入5g样品,生成1.76g二氧化碳,向50g稀盐酸中加入10g样品,生成3.52g二氧化碳,则向50g稀盐酸中加入15g样品产生的二氧化碳气体应该为:1.76g×3=5.28g,而实际产生4.4g,说明样品有剩余,而稀盐酸已经完全反应,则表中的M数值是4.4。
19.(1)食用油b侧液面高度低于a侧液面高度
(2)C
(3)5.28
【解答】(1)温度越高,气体压强越大,当能观察到食用油b侧液面高度低于a侧液面高度,可以证明二氧化碳是可以产生温室效应的气体。
(2) 结合图丙分析当前大气中二氧化碳含量上升的主要原因是化石燃料的燃烧。
A:骑行共享单车,倡导绿色出行,符合“碳中和”理念。
B:践行光盘行动,杜绝铺张浪费,符合“碳中和”理念。
C:推广火力发电,满足用电需求,不符合“碳中和”理念。
D:开展植树造林,优化生态环境,符合“碳中和”理念。
故选C。
(3) 6CO2+6H2OC6H12O6+6O2
264 180
x 3.6kg
x=5.28kg
合成3.6kg葡萄糖(分子式C6H12O6)可以吸收5.28kg二氧化碳。
20.(1)0.8
(2)设过氧化氢溶液的溶质质量分数为x,
;
68 32
50gx 0.8g;
;
解得:x=3.4%。
【解答】(1)产生氧气的质量:50g+5g-54.2g=0.8g;
(2)设过氧化氢溶液的溶质质量分数为x,
;
68 32
50gx 0.8g;
;
解得:x=3.4%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
浙教版八下期末复习第三章计算题
1.在做氯酸钾分解制取氧气的实验中,某同学误把高锰酸钾当二氧化锰加入反应,反应前混合物的总质量为12.96g,加热混合物到质量不再减少,反应后混合物的质量为8.8g,将反应后的固体溶入水中,过滤,干燥得到二氧化锰的质量为0.87g。
(1)求制取氧气的质量。
(2)反应前高锰酸钾的质量为多少?
(3)求反应后固体混合物中氯化钾的质量分数。
2.“化学氧自救呼吸器”是一种在缺氧环境中通过制氧剂临时供氧的装置。制氧剂的主要成分是超氧化钾(KO2),产生氧气的主要原理是超氧化钾与人体呼出的水汽反应,其化学方程式为4KO2+2H2O=4KOH+3O2↑。制氧剂中其他成分不能生成氧气。21cnjy.com
(1)小明设计化学氧自救呼吸器时,为确定制氧剂的用量,除了查阅人体每分钟呼吸次数外,还需了解哪些与人体呼吸相关的数据 。(列举一个)
(2)若该呼吸器需为使用者提供48g氧气,则至少需要含超氧化钾80%的制氧剂多少克
(3)小明设计了如图甲、乙两种化学氧自救呼吸器,其内部气体路径如图所示。你认为哪种方案更合理 说明理由: 。
3.某同学去我市的某风景区游玩时,取回了若干块矿石样品,他采用了以下的方法对样品中碳酸钙的质量分数进行检测:取这种石灰石样品6克,把40克稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。
加入稀盐酸的次序 1 2 3 4
加入稀盐酸的质量(克) 10 10 10 10
剩余固体的质量(克) 4.0 m 1.2 1.2
求:
(1)6克石灰石样品中含有的杂质为 克。
(2)m= 。
(3)样品中碳酸钙的质量分数是多少?
(4)所用稀盐酸的质量分数是多少?
4.小科用如图所示的装置来测量某石灰石样品中碳酸钙的质量分数,注射器水平放置,夹持装置未画出。他在试管中加入1 g石灰石样品和足量的稀盐酸(石灰石中其他成分不与稀盐酸反应产生气体),快速用连有注射器的橡皮塞塞紧试管口,实验结果如下表。(忽略活塞与筒壁之间的摩擦及温度变化对实验的影响)
反应时间/min 0 1 2 3 4
活塞对应的刻度/mL 0 98 152 176 176
(1)实验中判断石灰石和盐酸反应完全的依据是 。
(2)本实验条件下二氧化碳的密度约为2 g/L,请利用表格中的数据,根据化学方程式计算该石灰石样品中碳酸钙的质量分数。21教育网
5.学校八年级科学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水,杂质中不含钙元素)。有关实验数据如下表:
反 应 前 反 应 后
实验数据 烧杯和稀盐酸的质量 石灰石样品的质量 烧杯和剩余物的总质量
150g 12.5g 158.1g
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为 g。
(2)该石灰石中碳酸钙的质量分数。
(3)反应中生成氯化钙的质量是多少克?(写出计算过程)
6.某兴趣小组用图甲所示的流程制取氧气,并回收提纯氯化钾和二氧化锰。
请回答下列问题。
(1)图丙中仪器b的名称 ;
(2)步骤Ⅱ中的操作m应选择 (选填“乙”或“丙”)装置;
(3)根据化学方程式计算,理论上可制得氧气的质量是多少 (结果精确到0.1g)
7.某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。请计算:
21·cn·jy·com
序号 加入稀盐酸的质量/g 剩余固体的质量/g
第1次 20 11
第2次 20 6
第3次 20 2.8
第4次 20 a
(1)上表中a的数值为 ;
(2)样品中碳酸钙的质量分数是 ;
(3)求盐酸中溶质的质量分数。
8.常见的制氧剂有氯酸钠(NaClO3)、过氧化钙(CaO2) 和超氧化钾(KO2)等,这些制氧剂在一定条件下都可用来制取氧气,其反应原理分别为:2NaClO3 2NaCl+3O2↑,2CaO+2H2O=Ca(OH)2+O2↑,4KO2+2H2O=4KOH+3O2↑。
(1)以上三种制氧剂中属于氧化物的有
(2)3.6克过氧化钙(CaO2)中含氧元素的质量为 克。
(3)若要制取相等质量的氧气,需要氯酸钠和超氧化钾的质量比为 。
9.为测定实验室中氯酸钾样品(杂质不参与反应)的纯度,取一定量该样品进行加热,记录不同时刻固体质量数据,如图甲。氯酸钾制取氧气的化学方程式为:2KClO3 2KCl+3O2↑
(1)t1时刻产生的氧气质量是 。
(2)t3~t4时段剩余固体质量不变的原因 。
(3)计算该样品中氯酸钾的纯度。
(4)请在图乙中画出固体中二氧化锰质量在t1~t3时段的变化曲线。
10.海螵蛸别名墨鱼骨,是一味中药,其主要成分是碳酸钙,把1.5g海螵蛸样品加入烧杯中,另取20g稀盐酸滴入烧杯中与碳酸钙恰好完全反应,反应结束后,固体剩余0.5g (杂质不溶于水也不与酸反应)。求:
(1)该海螵蛸样品中碳酸钙的质量为 g
(2)实验结束时,生成二氧化碳气体的质量为多少
(3)所用稀盐酸的溶质质量分数为多少
11.钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。提示:食醋的主要成分是醋酸(HAc),醋酸和碳酸
钙反应的化学方程式为: 2HAc+CaCO3=CaAc2+H2O+CO2↑。该实验中浓硫酸的作用是吸收逸出的水蒸气, 鱼骨中其它成分与食醋反应生成的气体可忽略不计。
(1)该实验中仪器a的名称是 。
(2)计算鱼骨中碳酸钙的质量分数。
(3)生活中用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明。
12.某品牌钙片的部分信息:①钙片主要成分为碳酸钙;②每片钙片的质量为1克.科学学习小组同学用该品牌钙片做了如下实验:把100克稀盐酸分成五等份,分次将稀盐酸添加到放有10片钙片的烧杯中,充分反应(钙片中其它成分不溶于水且不与盐酸反应)。得到的实验数据见下表。
实验次数 1 2 3 4 5
加入稀盐酸的质量/克 20 20 20 20 20
剩余固体的质量/克 8.0 6.0 4.0 2.5 2.5
回答下列问题:
(1)CaCO3中碳元素的化合价为 .
(2)10片钙片中CaCO3的质量为 .
(3)实验中所用稀盐酸的溶质质量分数为多大?
13.鸡蛋壳的主要成分是碳酸钙。某科学兴趣小组取25g鸡蛋壳于烧杯中,缓慢加入稀盐酸(杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图所示。请根据要求回答问题:
(1)实验时当观察到 现象时,说明鸡蛋壳已完全反应;
(2)鸡蛋壳完全反应后,求产生CO2的质量;
(3)当鸡蛋壳恰好完全反应时,求所得溶液的溶质质量分数。
14.石头纸是一种介于纸张和塑料之间的环保新型材料,主要成分为碳酸钙。为测定其中碳酸钙的含量,课外活动小组的同学进行了实验,实验数据见下表(假设纸张其它成分既不溶于水,也不与稀盐酸反应):
烧杯序号 ① ② ③ ④ ⑤
加入样品的质量/克 10 10 10 10 10
加入稀盐酸的质量/克 10 20 30 40 50
充分反应后生成气体的质量/克 0.88 x 2.64 3.08 3.08
(1)表格中x的值为 ;
(2)10克样品中碳酸钙的质量为 克;
(3)求实验中所使用的稀盐酸溶质质量分数。
15.某品牌钙片的部分信息:①钙片主要成分为碳酸钙;②每片钙片质量为1克。小应用该品牌钙片做了如下实验:把100克稀盐酸分成五等份,分次将稀盐酸添加到放有5片钙片的烧杯中,充分反应(钙片中其它成分不溶于水且不与盐酸反应)。得到的实验数据见下表。
21·世纪*教育网
实验次数 1 2 3 4 5
加入稀盐酸的质量/克 20 20 20 20 20
剩余固体的质量/克 4.0 3.0 2.0 1.1 1.1
回答下列问题:
(1)5片钙片中所含碳酸钙的总质量为 克;
(2)计算该实验中所用稀盐酸的溶质质量分数。(写出计算过程)
16.2022年两会上“碳达峰”“碳中和”首次被写入政府工作报告。“碳中和”已经成为影响中国未来发展的重要国家战略。实现碳中和,一是 要减排即减少二氧化碳的排放,二是要发展增汇技术即二氧化碳的吸收技术。
2-1-c-n-j-y
资料一:浙江大学研发了“二氧化碳烟气微藻减排技术”,用微型藻类吸收二氧化碳实现固碳。
资料二: 2020年1月,李灿院士领先的全球首套千吨级“液态太阳燃料合成示范项目”在兰州试车成功。
微型藻类吸收二氧化碳该技术,本质是利用微藻的 作用实现固碳。自然界中的淀粉一般也是通过绿色植物的该生理活动合成,请写出该生理活动的文字表达式__________________________
。
(2)“液态太阳燃料合成示范项目”简单流程如图,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。据图分析,甲醇合成时,利用氢能合成甲醇的反应物为 ;若碳元素全部来自于二氧化碳,则3.2吨甲醇(CH3OH)与 吨二氧化碳含碳量相当。
【来源:21·世纪·教育·网】
(3)碳中和需要每一个人的努力,请你例举一条生产、生活中减少碳排放的措施 。
17.“化学氧自救呼吸器”是一种在缺氧环境中通过制氧剂临时供氧的装置。制氧剂的主要成分是超氧化钾(KO2),产生氧气的主要原理是超氧化钾与人体呼出的水汽反应,其化学方程式为4KO2+2H2O=4待填+3O2↑。制氧剂中其它成分不能生成氧气。【出处:21教育名师】
(1)化学方程式待填处,应填上的化学式为 。
(2)小应设计化学氧自救呼吸器时,为确定制氧剂的用量,除了查阅人体每分钟t次数外,还需了解哪些与人体呼吸相关的数据? 。(例举一个)21*cnjy*com
(3)若该呼吸器需为使用者提供96克氧气,则至少需要含KO280%的制氧剂多少克?
18.某研究性学习小组为测定当地矿山石灰石中碳酸钙的质量分数,取来了一些样品,并用稀盐酸200g,平均分成4份进行4次实验(样品中其他杂质不与稀盐酸反应),结果见下表,回答下列问题:
实验次数 1 2 3 4
加入样品质量(g) 5 10 15 20
生成CO2质量(g) 1.76 3.52 4.4 M
(1)实验过程中,通过观察 现象可判断反应结束。
(2)表中的M数值是 g。
(3)这种石灰石中碳酸钙的质量分数是多少?(要求写出计算过程)
19.二氧化碳是主要的温室气体。大气中二氧化碳的浓度升高,会导致温室效应,进而对全球自然生态系统产生影响,如气候异常、海平面升高、冰川退缩等。
21教育名师原创作品
我国向国际社会作出郑重承诺,二氧化碳排放量力争于2030年前达到峰值,努力争取在2060年前实现碳中和(如图甲),树立了大国形象,彰显了大国担当。回答下列问题:
(1)如图乙所示的实验装置模拟二氧化碳产生温室效应,左侧集气瓶中盛放空气,右侧集气瓶中盛放二氧化碳气体。如果观察到 现象,可以证明二氧化碳是可以产生温室效应的气体。
(2)图丙是自然界中碳氧循环的示意图, 结合图丙分析当前大气中二氧化碳含量上升的主要原因是 。“碳中和”是指二氧化碳的排放总量和减少总量相当,下列做法不符合“碳中和”理念的是: (填序号) 。
A.骑行共享单车,倡导绿色出行 B.践行光盘行动,杜绝铺张浪费
C.推广火力发电,满足用电需求 D.开展植树造林,优化生态环境
(3)2022年4月28日我国科学家在国际学术期刊《自然催化》上发表成果——实现二氧化碳到葡萄糖的合成,开辟了一条二氧化碳转化的新途径。假设二氧化碳合成葡萄糖碳元素的转化率为100%,合成3.6kg葡萄糖(分子式C6H12O6)可以吸收 kg二氧化碳。
20.为测试学生的实验和计算能力,老师准备了一瓶没有贴标签的过氧化氢溶液,同学们取部分溶液进行了如下实验,请结合实验回答下列问题:
(1)产生氧气的质量为 g。
(2)计算该过氧化氢溶液中溶质的质量分数。
答案解析部分
1.(1)根据质量守恒定律可知,制取氧气的质量为:12.96g-8.8g=4.16g;
(2)设反应前高锰酸钾的质量为x,生成锰酸钾质量的y,
2KMnO4K2MnO4+MnO2+O2↑,
316 197 87
x y 0.87g
;
解得:x=3.16g,y=1.97g。www.21-cn-jy.com
(3)反应后固体混合物中氯化钾的质量分数为:。
2.(1)呼出气体中的水蒸气含量(或每次呼吸耗氧量,合理即可)
(2)设得到48g氧气需要超氧化钾的质量为x。
4KO2+2H2O=4KOH+ 3O2↑
284 96
X 48g
=
x=142g
需要制氧剂的质量为=177.5g。
答:至少需要含超氧化钾80%的制氧剂的质量为177.5g
(3)甲合理;水汽能快速与制氧剂接触,且呼气和吸气时水汽都有机会与制氧剂反应,水汽利用率高(或乙合理,理由能充分支持观点即可)
【解答】(1)为了确定超氧化钾的用量,需确定化学方程式其余一个量的多少,例如水蒸气的量或所需的氧气量。
(3)在甲图中不管是吸气还是呼气,其水蒸气都会与制氧剂接触,故选甲。
3.(1)1.2
(2)2.0
(3)碳酸钙的质量为:6.0g-1.2g=4.8g,故其质量分数为:×100%=80%
(4)设10g稀盐酸中溶质的量为x,则:
解得:x=1.46g.
所以盐酸的质量分数为: ×100%=14.6%.
【解答】(1)由表中数据可知,加入10克稀盐酸完全反应,消耗碳酸钙质量为2.0克,则m=2.0,第3次加入盐酸,固体质量减少0.8g,说明碳酸钙完全反应,剩余1.2克固体为样品中的杂质。
(2)m=2.0;
故答案为:(1)1.2;(2)2.0;(3)80%;(4)14.6%。
4.(1)活塞对应的刻度不变(或活塞不再移动,或没有气泡产生,或气体体积不再增加等,合理即可)
(2)176 mL=0.176 L,反应生成CO2的质量为2 g/L×0.176 L=0.352 g。
设样品中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 0.352 g
= x=0.8 g
碳酸钙的质量分数为×100%=80%。
答:该石灰石样品中碳酸钙的质量分数为80%
【解答】(1)实验中判断石灰石和盐酸反应完全的依据是:活塞对应的刻度不变(或活塞不再移动,或没有气泡产生,或气体体积不再增加等)。
5.(1)4.4
(2)设该石灰石样品中碳酸钙的质量为x. CaCO3+2HCl═CaCl2+H2O+CO2↑ 100 44 x 4.4g 解得:x=10.0g 此石灰石中碳酸钙的质量分数为:。
(3)设生成的氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
111 44
y 4.4g
解得:y=11.1g
则生成的氯化钙的质量为11.1g。
【解答】(1)根据质量守恒定律,二氧化碳的质量为:150g+12.5g-158.1g=4.4g;
6.(1)酒精灯
(2)乙
(3)设制得氧气的质量为x
2KClO3 2KCl+ 3O2↑
245 96
15克 x
x=5.9克
【解答】(1)图丙中仪器b的名称酒精灯;
(2)固体1中为反应产物氯化钾和二氧化锰,加入适量的水后,氯化钾溶于水,而二氧化锰不溶于水,此时可通过过滤操作将二者分离,因此步骤II中的操作m为过滤,选择器材乙。
7.(1)2.8
(2)82.5%
(3)由试题分析20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应
解:设第一次参与反应的HCl质量为x,
CaCO3+ 2HCl=CaCl2+H2O+CO2↑
100 73
5g x
解得:x=3.65g
盐酸中溶质的质量分数为: ×100%=18.25%
【解答】(1)根据第1次和第2次数据可知,当碳酸钙没有完全反应时,每加入20g稀盐酸,固体质量减小:11g-6g=5g。第3次加入20g稀盐酸后,固体质量的减小量为:6g-2.8g=3.2g<5g,这说明样品中的碳酸钙已经完全反应。因此,第4次再加入20g稀盐酸时,固体的质量不会减小,即a=2.8g。
(2)根据表格可知,参加反应的碳酸钙的质量为:16g-2.8g=13.2g;
则样品中碳酸钙的质量分数为:。
8.(1)过氧化钙(CaO2)、 超氧化钾(KO2)
(2)1.6
(3)213:284
【解答】(1)氯酸钠(NaClO3)由三种元素组成,肯定不是氧化物。过氧化钙(CaO2) 和超氧化钾(KO2)由两种元素组成,其中一种为氧元素,则二者为氧化物。
(2)3.6克过氧化钙(CaO2)中含氧元素的质量为:;
(3)设生成氧气的质量为m时消耗氯酸钠的质量为x,
2NaClO3 2NaCl+3O2↑ ;
213 96
x m
;
解得:x=;
设消耗超氧化钾的质量为y,
4KO2+2H2O=4KOH+3O2↑ ;
284 96;
y m;
;
解得:y=;
则需要氯酸钠和超氧化钾的质量之比为;
9.(1)1.64克
(2)氯酸钾已完全分解
(3)解:设5克样品中含有氯酸钾的质量为x,
由图甲可知,氯酸钾完全分解生成的氧气质量m=5克+1克-4.68克=1.92克 .
2KClO3 2KCl+ 3O2↑
245 96
x 1.92克
x=4.9克
氯酸钾的质量分数=4.9克/5克X100%= =98%
(4)
【解答】(1)根据图甲可知,t1时刻生成氧气的质量为:5g+1.6g-4.96g=1.64g;
(2)t3~t4时段剩余固体质量不变的原因是:氯酸钾已完全分解;
(4)在反应过程中,二氧化锰为催化剂,它的质量和化学性质保持不变,如下图所示:
10.(1)1
(2)解:设生成二氧化碳的质量为X
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
1g x
x=0.44g
(3)解:设参加反应的HCl质量为y
CaCO3+ 2HCl=CaCl2+H2O+CO2↑
100 73
1g y
y=0.73g
HCl%= =3.65%
【解答】(1)该海螵蛸样品中碳酸钙的质量为:1.5g-0.5g=1g。
11.(1)分液漏斗
(2)解:产生二氧化碳的质量:820克-819.89克=0.11克
设20克鱼骨中碳酸钙的质量为m。
CaCO3+2HAc=CaAc2+H2O+ CO2↑
100 44
m 0.11克
m=0.25克
碳酸钙的质量分数:
答:鱼骨中碳酸钙的质量分数为1.25%
(3)酸钙在鱼骨中含量很低,鱼骨较硬可能不仅仅是碳酸钙的原因(或“用醋去除鱼刺中的碳酸钙需要的时间很长,且醋在咽停留的时间很短”) 2·1·c·n·j·y
【解答】(1)根据图片可知,该实验中仪器a的名称是分液漏斗。
(3)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。理由是:碳酸钙在鱼骨中含量很低,鱼骨较硬可能不仅仅是碳酸钙的原因(或“用醋去除鱼刺中的碳酸钙需要的时间很长,且醋在咽停留的时间很短”)。
12.(1)+4
(2)7.5克
(3)解:设20克稀盐酸中含有溶质x
参加反应的碳酸钙的质量为1克×10-8克=2克
CaCO3+ 2HCl=CaCl2+H2O+ CO2 ↑
100 73
2克 x
x=1.46克
HCl%= ×100%=7.3%
答:实验中所用稀盐酸的溶质质量分数为7.3%
【解答】(1)在化学式 CaCO3 中,Ca的化合价为+2,O的化合价为-2,根据正负化合价代数和为零得到:(+2)+x+(-2)×3=0,解得:x=+4.、
(2)根据表格可知,当碳酸钙完全反应后,剩余固体的质量为2.5g,那么10片钙片中CaCO3的质量为:10g-2.5g=7.5g。www-2-1-cnjy-com
13.(1)鸡蛋壳表面不再产生气泡
(2)解:设产生CO2的质量为x
CaCO3+2HCl=CaCl2+ CO2↑+H2O
100 44
20g x
x=8.8g
(3)解:设所得溶液的溶质质量为y
CaCO3+2HCl= CaCl2+CO2↑+H2O
100 111
20 y
y=22.2g
CaCl2%= =11.1%
【解答】(1)实验时当观察到鸡蛋壳表面不再产生气泡现象时,说明鸡蛋壳已完全反应。
14.(1)1.76g
(2)7g
(3)以实验①为例可知,0.88g稀盐酸完全反应生成0.88g二氧化碳气体,
设参加反应的HCl的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑;
73 44
y 0.88g;
;
解得:y=1.46g;
则稀盐酸的溶质质量分数:。21*cnjy*com
【解答】(1)根据实验①和③可知,在碳酸钙完全反应前,每加入10g稀盐酸生成二氧化碳的质量为0.88g,则实验②中加入20g稀盐酸时生成二氧化碳的质量:x=0.88g×2=1.76g;
(2)根据表格可知,10g样品最终生成二氧化碳的质量为3.08g,
设参加反应的碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
x 3.08g;
;
解得:x=7g;
15.(1)3.9
(2)根据第1组数据可知,当加入稀盐酸20g时参加反应的碳酸钙的质量:5g-4g=1g;
设20g稀盐酸中氯化氢质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73
1g x
;
解得:x=0.73g,
该实验中所用稀盐酸的溶质质量分数是:。
【解答】(1)5片钙片中所含碳酸钙的总质量为:5g-1.1g=3.9g。
16.(1)光合作用;二氧化碳+水有机物(储存能量)+氧气
(2)氢气和二氧化碳;4.4
(3)少开私家车
【解答】(1)微型藻类吸收二氧化碳该技术,本质是利用微藻的光合作用实现固碳。自然界中的淀粉一般也是通过绿色植物的该生理活动合成,文字表达式为:二氧化碳+水有机物(储存能量)+氧气
(2)据图分析,甲醇合成时,利用氢能合成甲醇的反应物为氢气和二氧化碳。
3.2吨甲醇(CH3OH)含有碳元素质量:
则二氧化碳含碳量:
(3)从减少碳排放出发,比如:少开私家车。
17.(1)KOH
(2)人体呼出气体中水蒸气含量,或者每次呼吸消耗氧气的质量等
(3)设得到96克氧气,需要参加反应的超氧化钾的质量为x,
4KO2+2H2O═4KOH+3O2↑
284 96
x 48克
;
解得:x=284克,
所以需要含超氧化钾80%的制氧剂质量为:。
【解答】(1)根据方程式4KO2+2H2O=4x+3O2↑得到:4K+10O+4H=4X+6O,解得:4X=4K+4O+4H,则X=KOH;
(2)制氧剂需要与水反应,所以除了查阅人体每分钟呼吸次数外,还需了解那些与人体呼出气体中水蒸气含量,或者每次呼吸消耗氧气的质量等;
18.(1)不再产生气泡的现象
(2)4.4
(3)由表格数据可知,5g样品中的碳酸钙完全反应能生成1.76g二氧化碳。
设参加反应的碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1.76g
解得:x=4;
这种石灰石中碳酸钙的质量分数是:。
【解答】(1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,则在实验过程中,会看到不断有气泡产生。如果观察到不再产生气泡的现象,可判断反应结束。
(2)表格数据分析可知,向50g稀盐酸中加入5g样品,生成1.76g二氧化碳,向50g稀盐酸中加入10g样品,生成3.52g二氧化碳,则向50g稀盐酸中加入15g样品产生的二氧化碳气体应该为:1.76g×3=5.28g,而实际产生4.4g,说明样品有剩余,而稀盐酸已经完全反应,则表中的M数值是4.4。
19.(1)食用油b侧液面高度低于a侧液面高度
(2)C
(3)5.28
【解答】(1)温度越高,气体压强越大,当能观察到食用油b侧液面高度低于a侧液面高度,可以证明二氧化碳是可以产生温室效应的气体。
(2) 结合图丙分析当前大气中二氧化碳含量上升的主要原因是化石燃料的燃烧。
A:骑行共享单车,倡导绿色出行,符合“碳中和”理念。
B:践行光盘行动,杜绝铺张浪费,符合“碳中和”理念。
C:推广火力发电,满足用电需求,不符合“碳中和”理念。
D:开展植树造林,优化生态环境,符合“碳中和”理念。
故选C。
(3) 6CO2+6H2OC6H12O6+6O2
264 180
x 3.6kg
x=5.28kg
合成3.6kg葡萄糖(分子式C6H12O6)可以吸收5.28kg二氧化碳。
20.(1)0.8
(2)设过氧化氢溶液的溶质质量分数为x,
;
68 32
50gx 0.8g;
;
解得:x=3.4%。
【解答】(1)产生氧气的质量:50g+5g-54.2g=0.8g;
(2)设过氧化氢溶液的溶质质量分数为x,
;
68 32
50gx 0.8g;
;
解得:x=3.4%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
