2023年浙教版八年级下册期末解答题专练(含解析)
文档属性
| 名称 | 2023年浙教版八年级下册期末解答题专练(含解析) | 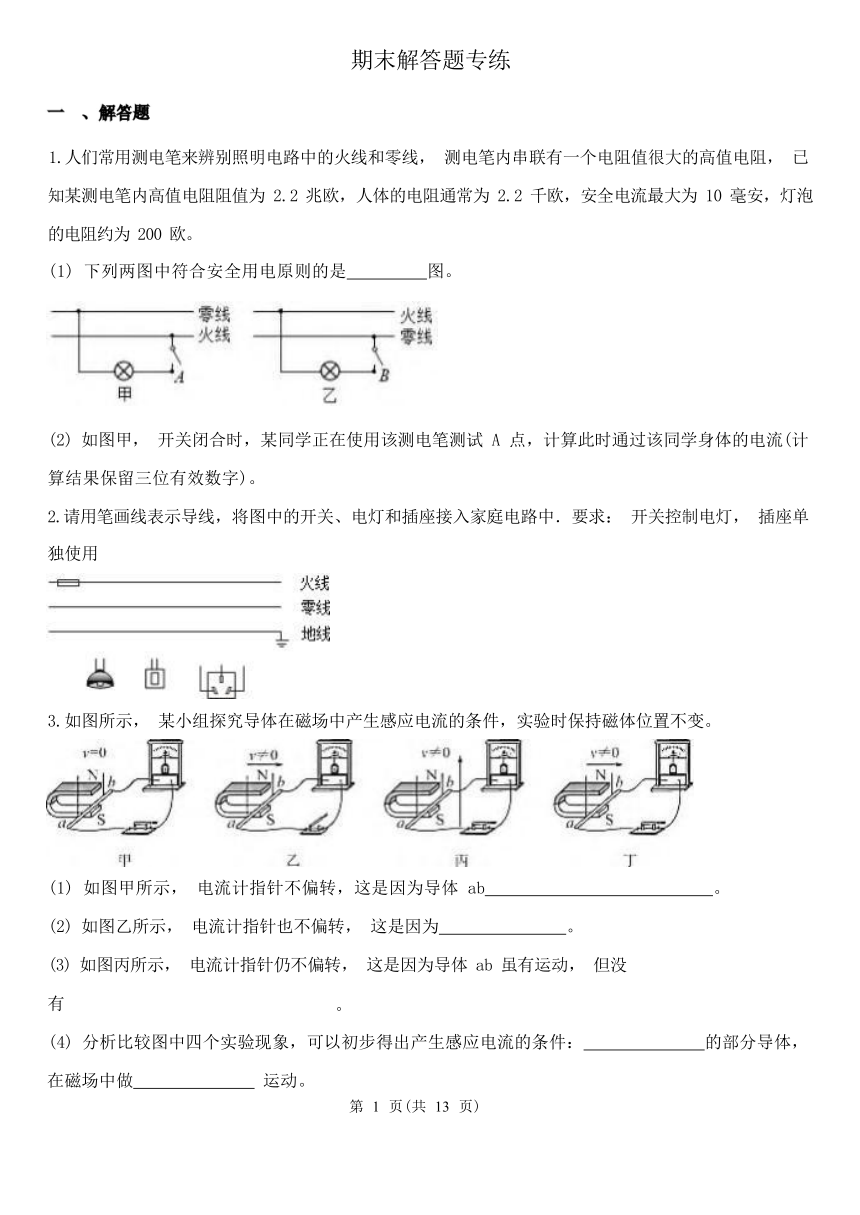 | |
| 格式 | docx | ||
| 文件大小 | 129.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-06-16 23:19:44 | ||
图片预览





文档简介
期末解答题专练
一 、解答题
1.人们常用测电笔来辨别照明电路中的火线和零线, 测电笔内串联有一个电阻值很大的高值电阻, 已 知某测电笔内高值电阻阻值为 2.2 兆欧,人体的电阻通常为 2.2 千欧,安全电流最大为 10 毫安,灯泡 的电阻约为 200 欧。
(1) 下列两图中符合安全用电原则的是 图。
(2) 如图甲, 开关闭合时,某同学正在使用该测电笔测试 A 点,计算此时通过该同学身体的电流(计 算结果保留三位有效数字)。 2.请用笔画线表示导线,将图中的开关、电灯和插座接入家庭电路中.要求: 开关控制电灯, 插座单
独使用
3.如图所示, 某小组探究导体在磁场中产生感应电流的条件,实验时保持磁体位置不变。
(1) 如图甲所示, 电流计指针不偏转,这是因为导体 ab 。
(2) 如图乙所示, 电流计指针也不偏转, 这是因为 。
(3) 如图丙所示, 电流计指针仍不偏转, 这是因为导体 ab 虽有运动, 但没
(
有
)。
(4) 分析比较图中四个实验现象,可以初步得出产生感应电流的条件: 的部分导体,
在磁场中做 运动。
第 1 页(共 13 页)
4.今年 3 月 22 ﹣ 28 日是第 28 届“中国水周”,其主题为“节约水资源,保障水安全.”
(1) 下列关于水的说法中,不正确的有________ (填序号).
①水是由氢元素和氧元素组成的化合物
②清澈、透明的泉水是纯净物
③合理施用农药、化肥, 以减少水体污染
④将活性炭放入硬水中可使其软化
⑤洗菜、洗衣后的水用来浇花、冲洗厕所
(2) 自然界中的水一般要净化后才能使用.吸附、过滤、蒸馏等三种净化水的操作中, 单一操作相对
净化程度最高的是________ .
(3) 如图表示自来水消毒过程中发生的一个反应的微观过程:
(○表示氧原子;●表示氢原子;表示氯原子)
①写出上述物质中单质的化学式:________ ;
②物质 D 中氯元素的化合价为 ________ .
5. “84”消毒液是常用的杀菌消毒剂, 下面是“84”消毒液的产品说明书。
产品品名 “84”消毒液
主要原料 次氯酸钠(NaClO),有效含氯量大于等于 5%
主要作用 瓜、餐具、厨房用品;白色衣物及物体表面; 肝炎、病毒性感冒及肺炎患者的污染物
产品规格 500g
(1) NaClO 中钠、氯、氧三种元素的原子个数比是 。
(2) NaClO 中氯元素的化合价为 。
(3) 计算NaClO 中氯元素的质量分数。 (写出计算过程)
(4) 该消毒液中至少含有次氯酸钠的质量是多少? (写出计算过程, 结果精确到 0.1) 6.请根据题目条件进行计算:
(1) X、Y 两元素的相对原子质量之比为 7∶2 ,X 与 Y 形成的化合物中, X、Y 两元素的质量之比
为 21∶8 ,则该化合物的化学式可表示为 。
第 2 页(共 13 页)
(2) 已知 X、Y 两元素的相对原子质量之比是 2∶1,由这两种元素形成的化合物中,X、Y 的质量之 比是 2∶3,其中 X 的化合价为+a 。则在化合物中 Y 的化合价为 。
(3) 已知有 Na2S、Na2SO3、Na2SO4 三种物质的混合物 100g,测得硫的质量分数为 32%,则混合 物中 含氧元素的质量为 .
7.黄铜是铜和锌的合金,取一定质量的黄铜样品放入烧杯中,缓慢滴加足量盐酸溶液,合金和盐酸反 应情况如图(提示: 铜不与稀盐酸溶液反应, 锌与盐酸反应的化学方程式为 Zn+H2SO4═ZnSO4+H2 ↑ ),
实验数据如表:
反 应 前 反 应 后
实验 数据 盐酸溶液 的质量 烧杯和黄铜样品 的质量 烧杯和剩余物 的质量
50.0g 63.0g 112.9g
求
(1) 生成氢气的质量 M 为 克.
(2) 所用盐酸溶液的溶质质量分数为多少?
8.某氢氧化钙粉末中含有碳酸钙杂质. 现取样品 15g 于锥形瓶中并加适量水搅拌得悬浊液,然后向锥
形瓶中滴加稀盐酸, 充分反应, 测得加入稀盐酸的质量与反应生成气体的质量关系如图所示.
(1) 生成二氧化碳的质量是 g;
(2) 加入 60g 稀盐酸后所得溶液中含有的溶质是 、 (填化学式);
(3) 计算样品中碳酸钙的质量分数(写出计算过程,结果精确到 0.1%). 第 3 页(共 13 页)
9.燃烧散煤有大量 SO2 产生,对大气造成严重污染.为了减少空气污染,青岛市已颁布地方法规,规定 在市区内禁止燃用散煤, 推广使用型煤.
(1) 制作型煤时,要在煤中加入适量熟石灰,以消除燃煤时二氧化硫的污染.请用化学方程式解释其 原因: ________.
(2) 除上述方法外,请举出两例你所了解的减少空气污染的方法或措施:①________;②________.
10.同学在实验室发现一瓶久置的盐酸,为测定该盐酸的实际浓度,她进行了如图实验.往装有 50g 该 盐酸的烧杯中不断滴加溶质质量分数为 20%的氢氧化钠溶液, 同时测定溶液 pH 值, 当所得溶液 pH 恰好 为 7 时,共用去 40g 氢氧化钠溶液.
(1) 反应过程中用玻璃棒搅拌的主要作用是 .
(2) 请计算该盐酸的溶质质量分数.
11.如图是显微镜下观察到的一个植物细胞发生的一个过程, 请据图完成问题.
(1) A~C 表示植物细胞的 过程.
(2) 根能吸收土壤溶液中的无机盐, 若一次施肥过多,能否出现这一现象? 为什 么? .
(3) 我们可采用田间挖深沟、田内浇透水的方法进行改良,这样做的目的
是 .若想在这样的地里种植作物,如种植玉米、小麦、水稻, 你认为种植什 么最好? ,理由是 .
12.松材线虫病是危害松属植物的一种毁灭性流行病。病原线虫从松树的伤口进入,寄生在树脂道中,
大量繁殖后遍及全株, 造成水分输送受阻、蒸腾作用降低、树脂合成急剧减少。目前, 防治松材线虫 主要措施是给松树“注射”一种有效成份是苦参碱的免疫激活剂。注药方法是在松树树干基部斜钻出 一个小孔, 在小孔上插入药剂瓶(如图), 依靠树体自身的输导功能将药液运输到树体各个部位, 达到 防治松材线虫病的目的。
第 4 页(共 13 页)
(1)松树适应性强、分布广,是我国山林植被的主要树种。从生态系统的成分看, 松树属于__________。
(2)为保证药剂输送到树体各个部位,小孔深度至少要到达松树茎结构中的____________________。该 施药技术与大面积喷洒农药相比, 优点___________________________________________________。目 前在公园、景区等病虫害防治中得到广泛应用。
(3)已知每瓶药剂的质量是 50 克,苦参碱的质量分数为 0.3% 。欲利用质量分数 30%的苦参碱原液, 配 制这样的免疫激活剂 50000 瓶,需要原液的质量是多少
13.袁隆平院士(图甲) 是中国杂交水稻事业的开创者和领导者, 被誉为“杂交水稻之父”,为我国粮 食生产和农业科学的发展作出了杰出贡献。缅怀袁老最好的方式是——“珍惜每一粒粮食”。
下表为常规水稻和杂交水稻的对比。
类 别 常规水稻 杂交水稻
定 义 通过选育、提纯、保持亲本品种的特 征和特性不变, 可以留种且后代不分 离 选用两个在遗传上有一定差异, 同时它们的优良性状又 能互补的水稻品种, 进行杂交, 生产具有杂种优势的第 一代
产 量 一般较低(<300kg/亩) 一般较高(>700kg/亩)
品 质 质软, 粘而腻 质地硬,粘性小
特 点 不需要年年换种,但需要提纯复壮, 抗性差 生长旺盛, 根系发达,穗大粒多,抗逆性强等
第 5 页(共 13 页)
(1) 请根据表一的内容写出支持种植杂交水稻的一个理由: 。
(2) 据乙图, 水和无机盐在水稻体内运输途径可以用文字表示为: 根中导管→ →叶中 导管。
(3) 乐乐把丙装置放在晴朗的室外环境, 测得密闭玻璃钟罩内一天的氧气和二氧化碳浓度变化如图丁 所示。已知空气中含氧量相对较高时,人会觉得更舒适。那么据图分析,你建议人们到田埂、公园等 绿色植物较多的地方散步、游玩的时间应在 时左右。
第 6 页(共 13 页)
0.期末解答题专练答案解析
一 、解答题
1. 【答案】(1)甲
(2) 照明电路电压 U=220V,高值电阻 R=2.2MΩ,人通常的电阻为 2.2kΩ,灯泡的电
阻约为 200Ω。某同学使用测电笔测试 A 点时,通过该同学身体的电流:
I = = ≈ 9.99 × 10 5A
(3)如图乙,开关断开时,灯泡不发光,当用手接触 B 点时,通过人体的电流为多大(计算结果保留三 位有效数字)?会不会造成触电事故?
如图乙,开关断开时,灯泡不发光, 当用手接触 B 点时, 通过人体的电流为:
I ′ = = ≈ 0.0917A = 91.7mA
因为 91.7mA>10mA,所以会造成触电事故
【解析】(1)根据家庭电路安全用电的知识解答;
(2) 根据甲图可知,当人接触 A 点时,测电笔与人体串联。首先根据 R 总=R1+R2 计算出总电阻, 然后根 据I总 = R (U)总 (总)计算出通过该同学的电流即可。
(3) 如图乙,开关断开时,灯泡不发光,当用手接触 B 点时,人体与灯泡串联。首先根据 R 总'=R1'+R2' 计算出总电阻, 然后根据I总′ = R (U)总′ (总)计算出通过该同学的电流,最后与安全电流 10mA 进行比较即可。 【解答】(1)在家庭电路中,为了保证断开开关后用电器上不带电,因此开关必须接在火线和用电器
之间, 故选甲。
2.解:
【解析】解:(1) 灯泡接法:火线进入开关,再进入灯泡顶端的金属点,零线直接接入灯泡的螺旋套, 这样在断开开关能切断火线,接触灯泡不会发生触电事故.既能控制灯泡, 又能更安全.
(2) 三孔插座的接法: 上孔接地线; 左孔接零线; 右孔接火线
第 7 页(共 13 页)
(1) 灯泡的接法: 火线进入开关,再进入灯泡顶端的金属点; 零线直接接入灯泡的螺旋套.
(2) 三孔插座的接法: 上孔接地线; 左孔接零线; 右孔接火线.
3. (1) 静止未做切割磁感线运动
(2) 电路未闭合
(3) 竖直运动未做切割磁感线运动
(4) 闭合电路;切割磁感线
【解析】闭合电路的一部分导体在磁场中做切割磁感线的运动时, 导体中就会产生电流,这种现象叫 电磁感应现象。
(1) 由甲图可知,导体的运动速度为零, 没有运动,不会切割磁感线, 所以没有电流; 故答案为: 静 止未做切割磁感线运动;
(2) 由乙图可知, 电路的开关没有闭合, 所以电流表指针不可能偏转; 故答案为: 电路未闭合;
(3) 由丙图可知, 导体是竖直方向运动与磁场方向相同, 不可能切割磁感线,所以没有电流产生;故 答案为:竖直运动未做切割磁感线运动;
(4) 由上述的三个实验可知, 第一要形成闭合回路,第二要切割磁感线; 故答案为:闭合电路;切割 磁感线;
故答案为:(1) 静止未做切割磁感线运动;(2) 电路未闭合;(3) 竖直运动未做切割磁感线运动;(4) 切割磁感线。
4.②④ 蒸馏 Cl2 +1 价
【解析】
【详解】
(1)
①根据水的化学式可知水是由氢元素和氧元素组成的化合物, 该说法正确;
②泉水溶解有可溶性的物质,属于混合物,该说法不正确;
③合理施用农药、化肥, 以减少水体污染,该说法正确; 第 8 页(共 13 页)
④活性炭具有吸附性,只能吸附异味和色素, 不能吸收钙镁离子, 所以活性炭不能软化硬水,该说法 不正确;
⑤洗菜、洗衣后的水用来浇花、冲洗厕所,一水两用,可节约用水,该说法正确; 故填: ②④;
(2) 吸附、过滤只能除去水中的不溶性杂质, 不能除去水中可溶性的杂质, 蒸馏可以除去水中可溶性 的杂质得到纯水,故填: 蒸馏;
(3)
①由图可知 B 中只含有氯元素一种元素, 属于单质,根据 B 的分子构成可知 B 的化学式故填:Cl2;
②由图示可知 D 的化学式为 HClO,氢元素显+1价, 氧元素显-2 价, 根据化合物中各元素化合价的代数
和为零,设 HClO 中 Cl 的化合价为 x,则(+1) +x+ (﹣ 2) =0,解得 x=+1,故填: +1 价。 5. (1) 1:1:1
(2) +1
(3) 解: NaClO 中氯元素的质量分数为 ×100%≈47.7%。
答: NaClO 中氯元素的质量分数为 47.7%。
(4) 解: 该消毒液中至少含有氯元素的质量为 500 g×5%=25 g,
次氯酸钠的质量为 25g÷( ×100%)≈52.5 g
答:该消毒液中至少含有次氯酸钠的质量为 52.5 g。
【解析】(1)在化学式中,元素符号右下角的数字就是该原子的个数;
(2) 在化学式中, 正负化合价的代数和为零,据此列方程计算;
(3) 元素的质量分数= 相对原式 (子)量 (质)量×n × 100%;
(4) 首先用“消毒液质量×含氯量”计算出其中氯元素的质量,再根据“次氯酸钠质量=
氯元素的质量分 (氯元素质量)数 ”计算出次氯酸钠的质量。
【解答】(1)根据化学式 NaClO 可知,次氯酸钠中钠、氯和氧三种元素的原子个数比为:1:1:1.
(2) 在化学式NaClO 中, Na 的化合价为+1,O 的化合价为-2,根据“正负化合价的代数和为零”得 到: (+1) +x+ (-2) =0,解得: x=+1。
6. (1) X3Y4
第 9 页(共 13 页)
(2) -a/3
(3) 22g
(1) 元素的质量之比等于相对原子质量与个数的乘积之比,据此计算两种原子的个数即可; (2)元素的质量之比等于相对原子质量与个数的乘积之比,据此计算两种原子的个数,并写出化学式, 最后根据“化学式中正负化合价代数和为零”计算 Y 的化合价。
(3) 根据化学式可知,无论三种物质怎样混合,其中硫和钠的原子个数之比不变, 据此计算出它们的 质量分数之比, 并计算出钠的质量分数, 最后根据三种元素质量分数之和等于 1 计算其中氧元素的质 量分数,并乘以混合物的质量即可。
【解答】(1)设化合物的化学式为 XaYb,
根据“元素的质量之比等于相对原子质量与个数的乘积之比”得到,
则它们的质量之比: 7a:2b=21:8;
解得: a:b=3:4.
那么该化合物的化学式为:X3Y4。
(2) 设化合物的化学式为 XnYm,
根据“元素的质量之比等于相对原子质量与个数的乘积之比”得到,
则它们的质量之比: 2n:1m=2:3;
解得: n:m=1:3.
那么该化合物的化学式为:XY3。
X 的化合价为+a,根据正负化合价代数和为零得到:(+a) +3x=0;
解得: Y 的化合价为 。
(3) 根据化学式可知, 钠原子和硫原子的个数之比为 2:1;
那么钠和硫元素质量之比:(23×2):(32×1) =23:16;
则钠和硫的质量分数之比为: 23:16;
钠元素的质量分数为:32% × = 46%;
则氧元素的质量分数为: 1-32%-46%=22%;
那么氧元素的质量: 100g×22%=22g。
7. (1) 0.1
第 10 页(共 13 页)
(2) 解: 设氯化氢的质量为 x
Zn+ 2HCl=ZnCl2+ H2 ↑
73 2
x 0.1g
73 2
X = 0.1g
x=3.65g
所用盐酸溶液的溶质质量分数为 × 100% =10%.
答:所用盐酸溶液的溶质质量分数为 10%
【解析】(1)根据质量守恒定律计算生成氢气的质量. (2)根据氢气的质量结合方程式计算氯化氢的 质量, 进一步计算所用盐酸溶液的溶质质量分数.
解: (1)根据质量守恒定律,生成氢气的质量为 50.0g+63.0g ﹣ 112.9g=0.1g;故填:0.1; 8. (1) 2.2
(2) CaCl2 ;HCl
(3) 解: 设样品中碳酸钙的质量分数为 x,
CaCO3+2HCl═CaCl2+H2O+CO2 ↑
100 44
15g×x 2.2g
100 44
15gX = 2.2g
解之得:x=33.3%
答:样品中碳酸钙的质量分数为 33.3%.
【解析】(1)由题目中图可以看出: 当加入稀盐酸的质量为 45g 时,石灰石中的碳酸钙完全反应且生 成二氧化碳的质量为 2.2g;故答案为:2.2;
(2) 由图示可知, 加入 60g 稀盐酸后盐酸过量,故溶液中含有的溶质是氯化钙和氯化氢; 故答案为: CaCl2 ;HCl;
(3) 设样品中碳酸钙的质量分数为 x,
CaCO3+2HCl═CaCl2+H2O+CO2 ↑
第 11 页(共 13 页)
100 44
15g×x 2.g
100 44
15g = 2.2g
解之得:x=33.3%
答:样品中碳酸钙的质量分数为 33.3%.
(1) 由题目中图可以看出:当加入稀盐酸的质量为 45g 时,石灰石中的碳酸钙完全反应且生成二氧化 碳的质量为 2.2g;
(2) 由图示可知, 加入 60g 稀盐酸后盐酸过量, 故溶液中含有的溶质是氯化钙和氯化氢;
(3) 根据二氧化碳的质量,利用化学方程式, 通过计算可求得样品中碳酸钙的质量分数.
9. (1) (2) 开发新能源, 使用清洁能源; 工厂废气先处理后排放.
10. (1) 加快稀盐酸和氢氧化钠的反应速率
(2) 解: 设稀盐酸中氯化氢质量为 x,
第 12 页(共 13 页)
NaOH+
40
40g×20%
40 36.5
(
=
)40g×20%
x=7.3g,
HCl═NaCl+H2O,
36.5
x
,
该盐酸的溶质质量分数为: ÷100%=14.6%,
答:该盐酸的溶质质量分数为 14.6%. 【解析】反应物接触越充分,反应速率越快; 氢氧化钠和稀盐酸反应生成氯化钠和水, 根据反应的化学方程式及其提供的数据可以计算该盐酸的溶 质质量分数.
解: (1)反应过程中用玻璃棒搅拌的主要作用是加快稀盐酸和氢氧化钠的反应速率.
故填: 加快稀盐酸和氢氧化钠的反应速率.
11. (1) 失水
(2) 能; 因为土壤溶液浓度大于细胞液浓度
(3) 降低土壤溶液的浓度;水稻;水稻需水多,不断浇水能降低土壤溶液浓度
【解析】植物细胞吸水和失水的原理是: 细胞外部溶液的浓度大于细胞内部浓度时失水,细胞外部溶 液的浓度小于细胞内部浓度时吸水.
解: (1)当植物细胞内外液体有浓度差时,植物细胞就会吸水或失水. 因此,当外界溶液浓度大于根 细胞的细胞液浓度时,根细胞失水. 由图可知:A ﹣ C 表示植物细胞的失水过程. (2)若一次性给农作 物施肥过多,会使土壤溶液浓度过高,大于植物细胞溶液的浓度, 植物细胞不能吸水, 反而会失水, 导致植物因失水而萎蔫, 造成“烧苗”现象. 因此要合理施肥.(3)盐碱地土壤溶液的浓度大接近根 毛细胞液的浓度.所以不利于根毛细胞吸水. 我们可采用田间挖深沟、田内浇透水的方法进行改良盐 碱地, 这样做的目的是降低土壤溶液的浓度. 若想在这样的地里种植作物, 如种植玉米、小麦、水稻, 我认为种植水稻最好,因为水稻吸水多, 不断浇水能降低土壤溶液浓度.
12. (1) 生产者(2)木质部(或输导组织) 减少了农药使用量, 减少了对环境的污染(3) 25kg
【详解】
生态系统的组成、结构与功能 植物体对无机盐的吸收、运输过程 溶质的质量分数 (1) 松树能够利用光能制造有机物, 属于生产者, 其他动物属于消费者。
(2) 导管位于木质部, 从下往上运输水分和无机盐,因此为保证药剂输送到树体各个部位, 小
孔深度至少要到达松树茎结构中的木质部。该施药技术与大面积喷洒农药相比,最大的优点在于减少 了农药使用量, 减少了对环境的污染。
(3) 设需要原液的质量为 m,
m×30%=50g×0.03%×5000,m=25000g=25kg。
答:需要原液的质量为 25kg。
13. (1) 产量高(合理即可)
(2) 茎中导管
(3) 18
【解析】杂交水稻的特点是产量很高, 杂交水稻比常规水稻产量高,是遗传物质变化引起的变异,可
以遗传给后代, 是遗传的变异。
(1) 支持种植杂交水稻的一个理由: 产量高。
(2) 据乙图, 水和无机盐在水稻体内运输途径可以用文字表示为: 根中导管→茎中导管→叶中导管。
(3) 据图分析,人们到田埂、公园等绿色植物较多的地方散步、游玩的时间应在 18 时左右,此时氧
气含量最高,氧气充足, 是人体吸入氧气适宜的时间。
故答案为: (1) 产量高(2)茎中导管(3) 18
第 13 页(共 13 页)
一 、解答题
1.人们常用测电笔来辨别照明电路中的火线和零线, 测电笔内串联有一个电阻值很大的高值电阻, 已 知某测电笔内高值电阻阻值为 2.2 兆欧,人体的电阻通常为 2.2 千欧,安全电流最大为 10 毫安,灯泡 的电阻约为 200 欧。
(1) 下列两图中符合安全用电原则的是 图。
(2) 如图甲, 开关闭合时,某同学正在使用该测电笔测试 A 点,计算此时通过该同学身体的电流(计 算结果保留三位有效数字)。 2.请用笔画线表示导线,将图中的开关、电灯和插座接入家庭电路中.要求: 开关控制电灯, 插座单
独使用
3.如图所示, 某小组探究导体在磁场中产生感应电流的条件,实验时保持磁体位置不变。
(1) 如图甲所示, 电流计指针不偏转,这是因为导体 ab 。
(2) 如图乙所示, 电流计指针也不偏转, 这是因为 。
(3) 如图丙所示, 电流计指针仍不偏转, 这是因为导体 ab 虽有运动, 但没
(
有
)。
(4) 分析比较图中四个实验现象,可以初步得出产生感应电流的条件: 的部分导体,
在磁场中做 运动。
第 1 页(共 13 页)
4.今年 3 月 22 ﹣ 28 日是第 28 届“中国水周”,其主题为“节约水资源,保障水安全.”
(1) 下列关于水的说法中,不正确的有________ (填序号).
①水是由氢元素和氧元素组成的化合物
②清澈、透明的泉水是纯净物
③合理施用农药、化肥, 以减少水体污染
④将活性炭放入硬水中可使其软化
⑤洗菜、洗衣后的水用来浇花、冲洗厕所
(2) 自然界中的水一般要净化后才能使用.吸附、过滤、蒸馏等三种净化水的操作中, 单一操作相对
净化程度最高的是________ .
(3) 如图表示自来水消毒过程中发生的一个反应的微观过程:
(○表示氧原子;●表示氢原子;表示氯原子)
①写出上述物质中单质的化学式:________ ;
②物质 D 中氯元素的化合价为 ________ .
5. “84”消毒液是常用的杀菌消毒剂, 下面是“84”消毒液的产品说明书。
产品品名 “84”消毒液
主要原料 次氯酸钠(NaClO),有效含氯量大于等于 5%
主要作用 瓜、餐具、厨房用品;白色衣物及物体表面; 肝炎、病毒性感冒及肺炎患者的污染物
产品规格 500g
(1) NaClO 中钠、氯、氧三种元素的原子个数比是 。
(2) NaClO 中氯元素的化合价为 。
(3) 计算NaClO 中氯元素的质量分数。 (写出计算过程)
(4) 该消毒液中至少含有次氯酸钠的质量是多少? (写出计算过程, 结果精确到 0.1) 6.请根据题目条件进行计算:
(1) X、Y 两元素的相对原子质量之比为 7∶2 ,X 与 Y 形成的化合物中, X、Y 两元素的质量之比
为 21∶8 ,则该化合物的化学式可表示为 。
第 2 页(共 13 页)
(2) 已知 X、Y 两元素的相对原子质量之比是 2∶1,由这两种元素形成的化合物中,X、Y 的质量之 比是 2∶3,其中 X 的化合价为+a 。则在化合物中 Y 的化合价为 。
(3) 已知有 Na2S、Na2SO3、Na2SO4 三种物质的混合物 100g,测得硫的质量分数为 32%,则混合 物中 含氧元素的质量为 .
7.黄铜是铜和锌的合金,取一定质量的黄铜样品放入烧杯中,缓慢滴加足量盐酸溶液,合金和盐酸反 应情况如图(提示: 铜不与稀盐酸溶液反应, 锌与盐酸反应的化学方程式为 Zn+H2SO4═ZnSO4+H2 ↑ ),
实验数据如表:
反 应 前 反 应 后
实验 数据 盐酸溶液 的质量 烧杯和黄铜样品 的质量 烧杯和剩余物 的质量
50.0g 63.0g 112.9g
求
(1) 生成氢气的质量 M 为 克.
(2) 所用盐酸溶液的溶质质量分数为多少?
8.某氢氧化钙粉末中含有碳酸钙杂质. 现取样品 15g 于锥形瓶中并加适量水搅拌得悬浊液,然后向锥
形瓶中滴加稀盐酸, 充分反应, 测得加入稀盐酸的质量与反应生成气体的质量关系如图所示.
(1) 生成二氧化碳的质量是 g;
(2) 加入 60g 稀盐酸后所得溶液中含有的溶质是 、 (填化学式);
(3) 计算样品中碳酸钙的质量分数(写出计算过程,结果精确到 0.1%). 第 3 页(共 13 页)
9.燃烧散煤有大量 SO2 产生,对大气造成严重污染.为了减少空气污染,青岛市已颁布地方法规,规定 在市区内禁止燃用散煤, 推广使用型煤.
(1) 制作型煤时,要在煤中加入适量熟石灰,以消除燃煤时二氧化硫的污染.请用化学方程式解释其 原因: ________.
(2) 除上述方法外,请举出两例你所了解的减少空气污染的方法或措施:①________;②________.
10.同学在实验室发现一瓶久置的盐酸,为测定该盐酸的实际浓度,她进行了如图实验.往装有 50g 该 盐酸的烧杯中不断滴加溶质质量分数为 20%的氢氧化钠溶液, 同时测定溶液 pH 值, 当所得溶液 pH 恰好 为 7 时,共用去 40g 氢氧化钠溶液.
(1) 反应过程中用玻璃棒搅拌的主要作用是 .
(2) 请计算该盐酸的溶质质量分数.
11.如图是显微镜下观察到的一个植物细胞发生的一个过程, 请据图完成问题.
(1) A~C 表示植物细胞的 过程.
(2) 根能吸收土壤溶液中的无机盐, 若一次施肥过多,能否出现这一现象? 为什 么? .
(3) 我们可采用田间挖深沟、田内浇透水的方法进行改良,这样做的目的
是 .若想在这样的地里种植作物,如种植玉米、小麦、水稻, 你认为种植什 么最好? ,理由是 .
12.松材线虫病是危害松属植物的一种毁灭性流行病。病原线虫从松树的伤口进入,寄生在树脂道中,
大量繁殖后遍及全株, 造成水分输送受阻、蒸腾作用降低、树脂合成急剧减少。目前, 防治松材线虫 主要措施是给松树“注射”一种有效成份是苦参碱的免疫激活剂。注药方法是在松树树干基部斜钻出 一个小孔, 在小孔上插入药剂瓶(如图), 依靠树体自身的输导功能将药液运输到树体各个部位, 达到 防治松材线虫病的目的。
第 4 页(共 13 页)
(1)松树适应性强、分布广,是我国山林植被的主要树种。从生态系统的成分看, 松树属于__________。
(2)为保证药剂输送到树体各个部位,小孔深度至少要到达松树茎结构中的____________________。该 施药技术与大面积喷洒农药相比, 优点___________________________________________________。目 前在公园、景区等病虫害防治中得到广泛应用。
(3)已知每瓶药剂的质量是 50 克,苦参碱的质量分数为 0.3% 。欲利用质量分数 30%的苦参碱原液, 配 制这样的免疫激活剂 50000 瓶,需要原液的质量是多少
13.袁隆平院士(图甲) 是中国杂交水稻事业的开创者和领导者, 被誉为“杂交水稻之父”,为我国粮 食生产和农业科学的发展作出了杰出贡献。缅怀袁老最好的方式是——“珍惜每一粒粮食”。
下表为常规水稻和杂交水稻的对比。
类 别 常规水稻 杂交水稻
定 义 通过选育、提纯、保持亲本品种的特 征和特性不变, 可以留种且后代不分 离 选用两个在遗传上有一定差异, 同时它们的优良性状又 能互补的水稻品种, 进行杂交, 生产具有杂种优势的第 一代
产 量 一般较低(<300kg/亩) 一般较高(>700kg/亩)
品 质 质软, 粘而腻 质地硬,粘性小
特 点 不需要年年换种,但需要提纯复壮, 抗性差 生长旺盛, 根系发达,穗大粒多,抗逆性强等
第 5 页(共 13 页)
(1) 请根据表一的内容写出支持种植杂交水稻的一个理由: 。
(2) 据乙图, 水和无机盐在水稻体内运输途径可以用文字表示为: 根中导管→ →叶中 导管。
(3) 乐乐把丙装置放在晴朗的室外环境, 测得密闭玻璃钟罩内一天的氧气和二氧化碳浓度变化如图丁 所示。已知空气中含氧量相对较高时,人会觉得更舒适。那么据图分析,你建议人们到田埂、公园等 绿色植物较多的地方散步、游玩的时间应在 时左右。
第 6 页(共 13 页)
0.期末解答题专练答案解析
一 、解答题
1. 【答案】(1)甲
(2) 照明电路电压 U=220V,高值电阻 R=2.2MΩ,人通常的电阻为 2.2kΩ,灯泡的电
阻约为 200Ω。某同学使用测电笔测试 A 点时,通过该同学身体的电流:
I = = ≈ 9.99 × 10 5A
(3)如图乙,开关断开时,灯泡不发光,当用手接触 B 点时,通过人体的电流为多大(计算结果保留三 位有效数字)?会不会造成触电事故?
如图乙,开关断开时,灯泡不发光, 当用手接触 B 点时, 通过人体的电流为:
I ′ = = ≈ 0.0917A = 91.7mA
因为 91.7mA>10mA,所以会造成触电事故
【解析】(1)根据家庭电路安全用电的知识解答;
(2) 根据甲图可知,当人接触 A 点时,测电笔与人体串联。首先根据 R 总=R1+R2 计算出总电阻, 然后根 据I总 = R (U)总 (总)计算出通过该同学的电流即可。
(3) 如图乙,开关断开时,灯泡不发光,当用手接触 B 点时,人体与灯泡串联。首先根据 R 总'=R1'+R2' 计算出总电阻, 然后根据I总′ = R (U)总′ (总)计算出通过该同学的电流,最后与安全电流 10mA 进行比较即可。 【解答】(1)在家庭电路中,为了保证断开开关后用电器上不带电,因此开关必须接在火线和用电器
之间, 故选甲。
2.解:
【解析】解:(1) 灯泡接法:火线进入开关,再进入灯泡顶端的金属点,零线直接接入灯泡的螺旋套, 这样在断开开关能切断火线,接触灯泡不会发生触电事故.既能控制灯泡, 又能更安全.
(2) 三孔插座的接法: 上孔接地线; 左孔接零线; 右孔接火线
第 7 页(共 13 页)
(1) 灯泡的接法: 火线进入开关,再进入灯泡顶端的金属点; 零线直接接入灯泡的螺旋套.
(2) 三孔插座的接法: 上孔接地线; 左孔接零线; 右孔接火线.
3. (1) 静止未做切割磁感线运动
(2) 电路未闭合
(3) 竖直运动未做切割磁感线运动
(4) 闭合电路;切割磁感线
【解析】闭合电路的一部分导体在磁场中做切割磁感线的运动时, 导体中就会产生电流,这种现象叫 电磁感应现象。
(1) 由甲图可知,导体的运动速度为零, 没有运动,不会切割磁感线, 所以没有电流; 故答案为: 静 止未做切割磁感线运动;
(2) 由乙图可知, 电路的开关没有闭合, 所以电流表指针不可能偏转; 故答案为: 电路未闭合;
(3) 由丙图可知, 导体是竖直方向运动与磁场方向相同, 不可能切割磁感线,所以没有电流产生;故 答案为:竖直运动未做切割磁感线运动;
(4) 由上述的三个实验可知, 第一要形成闭合回路,第二要切割磁感线; 故答案为:闭合电路;切割 磁感线;
故答案为:(1) 静止未做切割磁感线运动;(2) 电路未闭合;(3) 竖直运动未做切割磁感线运动;(4) 切割磁感线。
4.②④ 蒸馏 Cl2 +1 价
【解析】
【详解】
(1)
①根据水的化学式可知水是由氢元素和氧元素组成的化合物, 该说法正确;
②泉水溶解有可溶性的物质,属于混合物,该说法不正确;
③合理施用农药、化肥, 以减少水体污染,该说法正确; 第 8 页(共 13 页)
④活性炭具有吸附性,只能吸附异味和色素, 不能吸收钙镁离子, 所以活性炭不能软化硬水,该说法 不正确;
⑤洗菜、洗衣后的水用来浇花、冲洗厕所,一水两用,可节约用水,该说法正确; 故填: ②④;
(2) 吸附、过滤只能除去水中的不溶性杂质, 不能除去水中可溶性的杂质, 蒸馏可以除去水中可溶性 的杂质得到纯水,故填: 蒸馏;
(3)
①由图可知 B 中只含有氯元素一种元素, 属于单质,根据 B 的分子构成可知 B 的化学式故填:Cl2;
②由图示可知 D 的化学式为 HClO,氢元素显+1价, 氧元素显-2 价, 根据化合物中各元素化合价的代数
和为零,设 HClO 中 Cl 的化合价为 x,则(+1) +x+ (﹣ 2) =0,解得 x=+1,故填: +1 价。 5. (1) 1:1:1
(2) +1
(3) 解: NaClO 中氯元素的质量分数为 ×100%≈47.7%。
答: NaClO 中氯元素的质量分数为 47.7%。
(4) 解: 该消毒液中至少含有氯元素的质量为 500 g×5%=25 g,
次氯酸钠的质量为 25g÷( ×100%)≈52.5 g
答:该消毒液中至少含有次氯酸钠的质量为 52.5 g。
【解析】(1)在化学式中,元素符号右下角的数字就是该原子的个数;
(2) 在化学式中, 正负化合价的代数和为零,据此列方程计算;
(3) 元素的质量分数= 相对原式 (子)量 (质)量×n × 100%;
(4) 首先用“消毒液质量×含氯量”计算出其中氯元素的质量,再根据“次氯酸钠质量=
氯元素的质量分 (氯元素质量)数 ”计算出次氯酸钠的质量。
【解答】(1)根据化学式 NaClO 可知,次氯酸钠中钠、氯和氧三种元素的原子个数比为:1:1:1.
(2) 在化学式NaClO 中, Na 的化合价为+1,O 的化合价为-2,根据“正负化合价的代数和为零”得 到: (+1) +x+ (-2) =0,解得: x=+1。
6. (1) X3Y4
第 9 页(共 13 页)
(2) -a/3
(3) 22g
(1) 元素的质量之比等于相对原子质量与个数的乘积之比,据此计算两种原子的个数即可; (2)元素的质量之比等于相对原子质量与个数的乘积之比,据此计算两种原子的个数,并写出化学式, 最后根据“化学式中正负化合价代数和为零”计算 Y 的化合价。
(3) 根据化学式可知,无论三种物质怎样混合,其中硫和钠的原子个数之比不变, 据此计算出它们的 质量分数之比, 并计算出钠的质量分数, 最后根据三种元素质量分数之和等于 1 计算其中氧元素的质 量分数,并乘以混合物的质量即可。
【解答】(1)设化合物的化学式为 XaYb,
根据“元素的质量之比等于相对原子质量与个数的乘积之比”得到,
则它们的质量之比: 7a:2b=21:8;
解得: a:b=3:4.
那么该化合物的化学式为:X3Y4。
(2) 设化合物的化学式为 XnYm,
根据“元素的质量之比等于相对原子质量与个数的乘积之比”得到,
则它们的质量之比: 2n:1m=2:3;
解得: n:m=1:3.
那么该化合物的化学式为:XY3。
X 的化合价为+a,根据正负化合价代数和为零得到:(+a) +3x=0;
解得: Y 的化合价为 。
(3) 根据化学式可知, 钠原子和硫原子的个数之比为 2:1;
那么钠和硫元素质量之比:(23×2):(32×1) =23:16;
则钠和硫的质量分数之比为: 23:16;
钠元素的质量分数为:32% × = 46%;
则氧元素的质量分数为: 1-32%-46%=22%;
那么氧元素的质量: 100g×22%=22g。
7. (1) 0.1
第 10 页(共 13 页)
(2) 解: 设氯化氢的质量为 x
Zn+ 2HCl=ZnCl2+ H2 ↑
73 2
x 0.1g
73 2
X = 0.1g
x=3.65g
所用盐酸溶液的溶质质量分数为 × 100% =10%.
答:所用盐酸溶液的溶质质量分数为 10%
【解析】(1)根据质量守恒定律计算生成氢气的质量. (2)根据氢气的质量结合方程式计算氯化氢的 质量, 进一步计算所用盐酸溶液的溶质质量分数.
解: (1)根据质量守恒定律,生成氢气的质量为 50.0g+63.0g ﹣ 112.9g=0.1g;故填:0.1; 8. (1) 2.2
(2) CaCl2 ;HCl
(3) 解: 设样品中碳酸钙的质量分数为 x,
CaCO3+2HCl═CaCl2+H2O+CO2 ↑
100 44
15g×x 2.2g
100 44
15gX = 2.2g
解之得:x=33.3%
答:样品中碳酸钙的质量分数为 33.3%.
【解析】(1)由题目中图可以看出: 当加入稀盐酸的质量为 45g 时,石灰石中的碳酸钙完全反应且生 成二氧化碳的质量为 2.2g;故答案为:2.2;
(2) 由图示可知, 加入 60g 稀盐酸后盐酸过量,故溶液中含有的溶质是氯化钙和氯化氢; 故答案为: CaCl2 ;HCl;
(3) 设样品中碳酸钙的质量分数为 x,
CaCO3+2HCl═CaCl2+H2O+CO2 ↑
第 11 页(共 13 页)
100 44
15g×x 2.g
100 44
15g = 2.2g
解之得:x=33.3%
答:样品中碳酸钙的质量分数为 33.3%.
(1) 由题目中图可以看出:当加入稀盐酸的质量为 45g 时,石灰石中的碳酸钙完全反应且生成二氧化 碳的质量为 2.2g;
(2) 由图示可知, 加入 60g 稀盐酸后盐酸过量, 故溶液中含有的溶质是氯化钙和氯化氢;
(3) 根据二氧化碳的质量,利用化学方程式, 通过计算可求得样品中碳酸钙的质量分数.
9. (1) (2) 开发新能源, 使用清洁能源; 工厂废气先处理后排放.
10. (1) 加快稀盐酸和氢氧化钠的反应速率
(2) 解: 设稀盐酸中氯化氢质量为 x,
第 12 页(共 13 页)
NaOH+
40
40g×20%
40 36.5
(
=
)40g×20%
x=7.3g,
HCl═NaCl+H2O,
36.5
x
,
该盐酸的溶质质量分数为: ÷100%=14.6%,
答:该盐酸的溶质质量分数为 14.6%. 【解析】反应物接触越充分,反应速率越快; 氢氧化钠和稀盐酸反应生成氯化钠和水, 根据反应的化学方程式及其提供的数据可以计算该盐酸的溶 质质量分数.
解: (1)反应过程中用玻璃棒搅拌的主要作用是加快稀盐酸和氢氧化钠的反应速率.
故填: 加快稀盐酸和氢氧化钠的反应速率.
11. (1) 失水
(2) 能; 因为土壤溶液浓度大于细胞液浓度
(3) 降低土壤溶液的浓度;水稻;水稻需水多,不断浇水能降低土壤溶液浓度
【解析】植物细胞吸水和失水的原理是: 细胞外部溶液的浓度大于细胞内部浓度时失水,细胞外部溶 液的浓度小于细胞内部浓度时吸水.
解: (1)当植物细胞内外液体有浓度差时,植物细胞就会吸水或失水. 因此,当外界溶液浓度大于根 细胞的细胞液浓度时,根细胞失水. 由图可知:A ﹣ C 表示植物细胞的失水过程. (2)若一次性给农作 物施肥过多,会使土壤溶液浓度过高,大于植物细胞溶液的浓度, 植物细胞不能吸水, 反而会失水, 导致植物因失水而萎蔫, 造成“烧苗”现象. 因此要合理施肥.(3)盐碱地土壤溶液的浓度大接近根 毛细胞液的浓度.所以不利于根毛细胞吸水. 我们可采用田间挖深沟、田内浇透水的方法进行改良盐 碱地, 这样做的目的是降低土壤溶液的浓度. 若想在这样的地里种植作物, 如种植玉米、小麦、水稻, 我认为种植水稻最好,因为水稻吸水多, 不断浇水能降低土壤溶液浓度.
12. (1) 生产者(2)木质部(或输导组织) 减少了农药使用量, 减少了对环境的污染(3) 25kg
【详解】
生态系统的组成、结构与功能 植物体对无机盐的吸收、运输过程 溶质的质量分数 (1) 松树能够利用光能制造有机物, 属于生产者, 其他动物属于消费者。
(2) 导管位于木质部, 从下往上运输水分和无机盐,因此为保证药剂输送到树体各个部位, 小
孔深度至少要到达松树茎结构中的木质部。该施药技术与大面积喷洒农药相比,最大的优点在于减少 了农药使用量, 减少了对环境的污染。
(3) 设需要原液的质量为 m,
m×30%=50g×0.03%×5000,m=25000g=25kg。
答:需要原液的质量为 25kg。
13. (1) 产量高(合理即可)
(2) 茎中导管
(3) 18
【解析】杂交水稻的特点是产量很高, 杂交水稻比常规水稻产量高,是遗传物质变化引起的变异,可
以遗传给后代, 是遗传的变异。
(1) 支持种植杂交水稻的一个理由: 产量高。
(2) 据乙图, 水和无机盐在水稻体内运输途径可以用文字表示为: 根中导管→茎中导管→叶中导管。
(3) 据图分析,人们到田埂、公园等绿色植物较多的地方散步、游玩的时间应在 18 时左右,此时氧
气含量最高,氧气充足, 是人体吸入氧气适宜的时间。
故答案为: (1) 产量高(2)茎中导管(3) 18
第 13 页(共 13 页)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
