化学沪教版九年级下册同步精练:6.3 物质的溶解性(含解析)
文档属性
| 名称 | 化学沪教版九年级下册同步精练:6.3 物质的溶解性(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 66.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-17 23:58:06 | ||
图片预览




文档简介
第3节 物质的溶解性
一、单选题
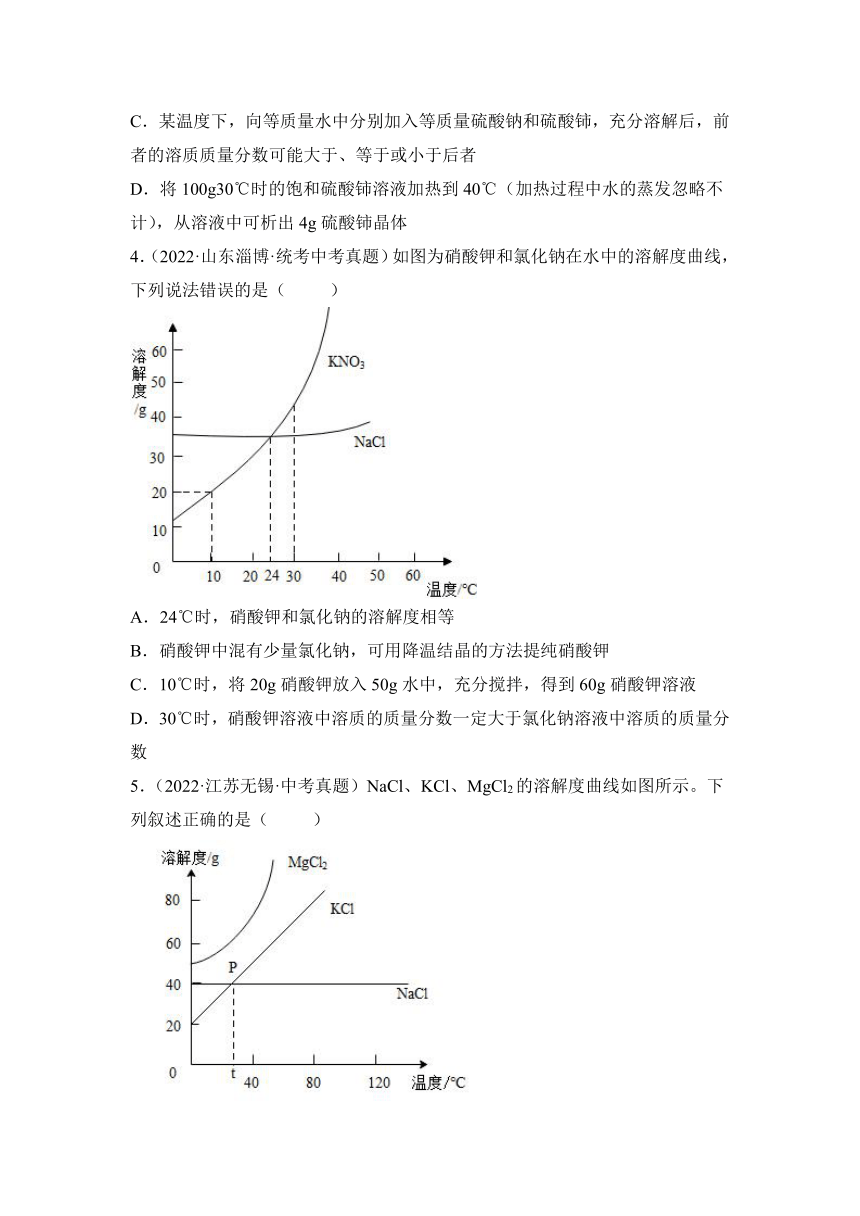
1.(2022·内蒙古呼伦贝尔·统考中考真题)图甲是M、N两种固体的溶解度曲线。20℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙;升温到40℃时,现象如图丙。下列说法正确的是( )
A.烧杯a中加入的固体为N
B.20℃时,烧杯a中为饱和溶液,b中为不饱和溶液
C.40℃时,烧杯a、b中均为不饱和溶液
D.40℃时,烧杯a、b中溶液的溶质质量分数不相等
2.(2022·湖南衡阳·统考中考真题)下列关于溶液的说法正确的是( )
A.溶液是具有均一性、稳定性的混合物
B.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C.打开汽水瓶盖后有气泡冒出,主要是因为温度升高,气体溶解度减小
D.溶液都是无色透明的液体
3.(2022·江苏常州·统考中考真题)下表是两种硫酸盐在不同温度时的溶解度:
温度/°C 0 10 20 30 40 50 60 70 80
溶解度/g 硫酸钠 4.9 9.1 19.5 40.8 48.8 46.2 45.3 44.3 43.7
硫酸铈 24.1 20.0 17.2 14.0 10.0 8.9 8.3 7.1 6.0
下列说法正确的是( )
A.随温度升高,物质的溶解度只可能不断增大或不断减小
B.在0-80℃间的任何温度下,硫酸钠和硫酸铈的溶解度均不相等
C.某温度下,向等质量水中分别加入等质量硫酸钠和硫酸铈,充分溶解后,前者的溶质质量分数可能大于、等于或小于后者
D.将100g30℃时的饱和硫酸铈溶液加热到40℃(加热过程中水的蒸发忽略不计),从溶液中可析出4g硫酸铈晶体
4.(2022·山东淄博·统考中考真题)如图为硝酸钾和氯化钠在水中的溶解度曲线,下列说法错误的是( )
A.24℃时,硝酸钾和氯化钠的溶解度相等
B.硝酸钾中混有少量氯化钠,可用降温结晶的方法提纯硝酸钾
C.10℃时,将20g硝酸钾放入50g水中,充分搅拌,得到60g硝酸钾溶液
D.30℃时,硝酸钾溶液中溶质的质量分数一定大于氯化钠溶液中溶质的质量分数
5.(2022·江苏无锡·中考真题)NaCl、KCl、MgCl2的溶解度曲线如图所示。下列叙述正确的是( )
A.80℃时,KCl的溶解度比NaCl小
B.t℃时,NaCl和KCl的溶解度相同
C.t℃时,KCl饱和溶液的质量分数为40%
D.NaCl中含有少量MgCl2,可以采用降温结晶的方法提纯NaCl
二、填空题
6.(2022·江苏淮安·中考真题)硝酸钾、硝酸钠、氯化钠的溶解度曲线如图所示。回答下列问题:
(1)氯化钠以离子形式分散在水中,氯化钠中带正电荷的离子是____________(填离子符号)。
(2)60℃时,硝酸钾的溶解度是____________g。
(3)20℃时,将40g硝酸钠加入50g水中,形成____________溶液(填“饱和”或“不饱和”)。
(4)60℃时,将等质量的硝酸钾和氯化钠的饱和溶液分别降温至20℃。下列判断正确的是 。
A.析出晶体质量:硝酸钾>氯化钠
B.所得溶液中溶剂质量:硝酸钾>氯化钠
C.所得溶液中溶质质量分数:硝酸钾>氯化钠
7.(2022·辽宁鞍山·统考中考真题)A、B、C三种固体物质的溶解度曲线如下图所示。请回答下列问题:
(1)P点的含义是____________。
(2)t2℃时,70gA物质的饱和溶液中溶质的质量是____________g。
(3)将C物质的不饱和溶液转化为饱和溶液,可采用的方法是______________。(写出一种方法即可)。
(4)将t1℃时等质量的A、B、C三种物质的饱和溶液分别升温到t2℃(忽略水分的蒸发),所得溶液的质量大小关系是____________(用“>”、“<”或“=”表示)。
8.(2022·湖南湘西·中考真题)M、N、P三种物质的溶解度曲线如图所示,请回答下列问题:
(1)溶解度随温度的升高而减小的物质是________;
(2)t2℃时三种物质的溶解度大小关系是________;
(3)t1℃时把40g物质M投入80g水中,充分搅拌后得到的溶液是________(填“饱和”或“不饱和”)溶液。
第3节 物质的溶解性
一、单选题
1.(2022·内蒙古呼伦贝尔·统考中考真题)图甲是M、N两种固体的溶解度曲线。20℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙;升温到40℃时,现象如图丙。下列说法正确的是( )
A.烧杯a中加入的固体为N
B.20℃时,烧杯a中为饱和溶液,b中为不饱和溶液
C.40℃时,烧杯a、b中均为不饱和溶液
D.40℃时,烧杯a、b中溶液的溶质质量分数不相等
【答案】C
【详解】A、乙中烧杯a中底部有固体剩余,烧杯b中底部没有固体剩余,说明a中物质的溶解度小于b中物质的溶解度,故a烧杯中加入的固体是M,b中加入的固体是N,故A不符合题意;
B、因为并不知道加入溶质的具体质量,烧杯a有不溶物所以一定是饱和溶液,但是b不能确定溶液是否饱和,故B不符合题意;
C、由图像可知,温度升高两种物质溶解度增大,由图乙知b在20℃时可能是饱和溶液,升温到40℃后b一定是不饱和溶液,且40℃时M的溶解度大于N,b已经是不饱和溶液,由于所加入溶质质量相同,所以a一定是不饱和溶液,故C符合题意;
D、如图可知,在35℃时,M和N溶解度相等,如果刚好加入的35℃状态下溶解度大小质量的溶质,40℃时,两溶液溶质质量相同,溶剂的质量相等,则质量分数相等,故D不符合题意;
故选C。
【点睛】结合溶解度曲线进行判断溶液的性质,难度较大。
2.(2022·湖南衡阳·统考中考真题)下列关于溶液的说法正确的是( )
A.溶液是具有均一性、稳定性的混合物
B.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C.打开汽水瓶盖后有气泡冒出,主要是因为温度升高,气体溶解度减小
D.溶液都是无色透明的液体
【答案】A
【详解】A、溶液是由溶质和溶剂混合而成的均一、稳定的混合物,符合题意;
B、饱和溶液不一定是浓溶液,是常温下,氢氧化钙的饱和溶液是稀溶液,不饱和溶液不一定是稀溶液,如常温下,硝酸钾的饱和溶液是浓溶液,不符合题意;
C、打开汽水瓶盖后有气泡冒出,主要是因为压强减小,气体的溶解度减小,不符合题意;
D、溶液是透明的,但是不一定是无色的,如硫酸铜溶液是蓝色的,不符合题意。
故选A。
3.(2022·江苏常州·统考中考真题)下表是两种硫酸盐在不同温度时的溶解度:
温度/°C 0 10 20 30 40 50 60 70 80
溶解度/g 硫酸钠 4.9 9.1 19.5 40.8 48.8 46.2 45.3 44.3 43.7
硫酸铈 24.1 20.0 17.2 14.0 10.0 8.9 8.3 7.1 6.0
下列说法正确的是( )
A.随温度升高,物质的溶解度只可能不断增大或不断减小
B.在0-80℃间的任何温度下,硫酸钠和硫酸铈的溶解度均不相等
C.某温度下,向等质量水中分别加入等质量硫酸钠和硫酸铈,充分溶解后,前者的溶质质量分数可能大于、等于或小于后者
D.将100g30℃时的饱和硫酸铈溶液加热到40℃(加热过程中水的蒸发忽略不计),从溶液中可析出4g硫酸铈晶体
【答案】C
【详解】A、由表格数据可知,在0-40℃范围内,硫酸钠的溶解度随温度升高而增大,40℃-80℃范围内,硫酸钠的溶解度随温度升高而减小;而在0-80范围内,硫酸铈的溶解度随温度升高而减小,故A说法错误;
B、由表格数据可知,在10℃-20℃之间时,硫酸钠的溶解度在9.1g-19.5g之间,而此温度范围内,硫酸铈的溶解度在17.2g-20.0g之间,所以在10-20℃之间,硫酸钠和硫酸铈的溶解度可能相等,范围在17.2g-19.5g之间,故B说法错误;
C、某温度下,向等质量水中分别加入等质量硫酸钠和硫酸铈,充分溶解后,由于无法确定是否是饱和溶液,所以无法确定其溶质质量分数,故前者的溶质质量分数可能大于、等于或小于后者,故C说法正确;
D、由表格数据可知,30℃时,硫酸铈的溶解度为14.0g,即100g水中最多溶解溶质为14.0g,所以100g30℃时的饱和硫酸铈溶液中溶质为,溶剂质量为100g-12g=88g,将其加热到40℃(加热过程中水的蒸发忽略不计),40℃时,硫酸铈的溶解度为10.0g,此温度下88g水中溶质质量为,所以从溶液中可析出12g-8.8g=3.2g≠4g硫酸铈晶体,故D说法错误。
故选C。
4.(2022·山东淄博·统考中考真题)如图为硝酸钾和氯化钠在水中的溶解度曲线,下列说法错误的是( )
A.24℃时,硝酸钾和氯化钠的溶解度相等
B.硝酸钾中混有少量氯化钠,可用降温结晶的方法提纯硝酸钾
C.10℃时,将20g硝酸钾放入50g水中,充分搅拌,得到60g硝酸钾溶液
D.30℃时,硝酸钾溶液中溶质的质量分数一定大于氯化钠溶液中溶质的质量分数
【答案】D
【详解】A、由溶解度曲线可知24℃时,硝酸钾和氯化钠的溶解度曲线有交点,故二者溶解度相等。故对。
B、硝酸钾溶解度收温度变化影响较大,氯化钠溶解度受温度变化影响较小,故硝酸钾中混有少量氯化钠,可用降温结晶的方法提纯硝酸钾。故对。
C、10℃时,硝酸钾的溶解度为20g。故将20g硝酸钾放入50g水中,充分搅拌可溶解10g,得到60g硝酸钾溶液。故对。
D、30℃时,硝酸钾溶液中溶质的质量分数不一定大于氯化钠溶液中溶质的质量分数,因为没有指明溶液是否是饱和溶液,故错。
故选D。
5.(2022·江苏无锡·中考真题)NaCl、KCl、MgCl2的溶解度曲线如图所示。下列叙述正确的是( )
A.80℃时,KCl的溶解度比NaCl小
B.t℃时,NaCl和KCl的溶解度相同
C.t℃时,KCl饱和溶液的质量分数为40%
D.NaCl中含有少量MgCl2,可以采用降温结晶的方法提纯NaCl
【答案】B
【详解】A.从图中可以看到, 80℃时氯化钾的溶解度曲线在氯化钠溶解度曲线的上方,所以KCl的溶解度比NaCl大,错误;
B. t℃时氯化钠和氯化钾的溶解度曲线相交于一点,所以NaCl和KCl的溶解度相同,正确;
C. t℃时氯化钾的溶解度为40g,则饱和溶液的溶质质量分数为,错误。
D. 氯化钠、氯化镁的溶解度均随温度的升高而升高。氯化钠溶解度受温度影响不大,氯化镁溶解度受温度影响较大,所以NaCl中含有少量MgCl2,可以采用蒸发结晶的方法提纯氯化钠,错误;
故选:B。
二、填空题
6.(2022·江苏淮安·中考真题)硝酸钾、硝酸钠、氯化钠的溶解度曲线如图所示。回答下列问题:
(1)氯化钠以离子形式分散在水中,氯化钠中带正电荷的离子是____________(填离子符号)。
(2)60℃时,硝酸钾的溶解度是____________g。
(3)20℃时,将40g硝酸钠加入50g水中,形成____________溶液(填“饱和”或“不饱和”)。
(4)60℃时,将等质量的硝酸钾和氯化钠的饱和溶液分别降温至20℃。下列判断正确的是 。
A.析出晶体质量:硝酸钾>氯化钠
B.所得溶液中溶剂质量:硝酸钾>氯化钠
C.所得溶液中溶质质量分数:硝酸钾>氯化钠
【答案】(1)Na+
(2)110
(3)不饱和
(4)A
【详解】(1)氯化钠是由钠离子和氯离子构成的,钠离子带正电荷,表示为:Na+;
(2)根据图像可知,60℃时,硝酸钾的溶解度是110g;
(3)20℃时,硝酸钠的溶解度为88g,即100g水最多溶解88g硝酸钠,则50g水最多溶解44g硝酸钠,因此,将40g硝酸钠加入50g水中,能全部溶解,形成的是不饱和溶液;
(4)A、硝酸钾的溶解度受温度影响变化较大,降低温度就会析出大量的晶体,故A正确;
B、60℃时,硝酸钾的溶解度大于氯化钠,则等质量的硝酸钾和氯化钠的饱和溶液中所含水的质量:硝酸钾<氯化钠,降温后,水的量不会发生改变,故B错误;
C、降温到20℃,两种溶液仍为饱和溶液,此温度下,氯化钠的溶解度大于硝酸钾,所以溶液中溶质质量分数:硝酸钾<氯化钠,故C错误;
故选A。
7.(2022·辽宁鞍山·统考中考真题)A、B、C三种固体物质的溶解度曲线如下图所示。请回答下列问题:
(1)P点的含义是____________。
(2)t2℃时,70gA物质的饱和溶液中溶质的质量是____________g。
(3)将C物质的不饱和溶液转化为饱和溶液,可采用的方法是______________。(写出一种方法即可)。
(4)将t1℃时等质量的A、B、C三种物质的饱和溶液分别升温到t2℃(忽略水分的蒸发),所得溶液的质量大小关系是____________(用“>”、“<”或“=”表示)。
【答案】(1)在t1℃时,A、C两物质的溶解度相等
(2)20
(3)升高温度或恒温蒸发溶剂或增加溶质C
(4)B=A>C
【详解】(1)根据溶解度曲线可知,在t1℃时,A物质溶解度曲线与C物质溶解度曲线相交于P点,即P点的含义是在t1℃时,A、C两物质的溶解度相等;
(2)根据溶解度曲线可知,t2℃时,A物质的溶解度为40g,即100g的水中最多溶解40gA物质形成饱和溶液,当溶剂质量为100g,溶质质量为40g,饱和溶液的质量为140g,即当t2℃时,70gA物质的饱和溶液中溶质的质量是20g,溶剂质量是50g;
(3)根据溶解度曲线可知,C物质的溶解度随着温度的升高而降低,则将C物质的不饱和溶液转化为饱和溶液,可采用的方法是升高温度或者恒温蒸发溶剂或者增加溶质C;
(4)根据溶解度曲线可知,t1℃时,B物质的溶解度最大,A、C物质的溶解度相等,升高温度,A、B物质的溶解度增大,且A、B两物质均由饱和溶液变为不饱和溶液,无晶体析出,升温后,A、B的溶液质量相等,而C物质的溶解度减小,且C溶液中析出晶体,C的溶液质量减小,则将t1℃时等质量的A、B、C三种物质的饱和溶液分别升温到t2℃(忽略水分的蒸发),所得溶液的质量大小关系是B=A>C。
8.(2022·湖南湘西·中考真题)M、N、P三种物质的溶解度曲线如图所示,请回答下列问题:
(1)溶解度随温度的升高而减小的物质是________;
(2)t2℃时三种物质的溶解度大小关系是________;
(3)t1℃时把40g物质M投入80g水中,充分搅拌后得到的溶液是________(填“饱和”或“不饱和”)溶液。
【答案】(1)P
(2)N>M>P
(3)饱和
【详解】(1)根据溶解度曲线可知,溶解度随温度的升高而减小的物质是物质P(呈下降趋势);
(2)根据溶解度曲线可知t2℃时,溶解度最大的是N,最小的是P,所以此时三种物质的溶解度大小关系是N>M>P;
(3)t1℃时,物质M溶解度为40g,即100g水中最多溶解40g物质M,所以80g水不能完全溶解40g物质M,所以充分搅拌后得到的溶液是饱和溶液。
一、单选题
1.(2022·内蒙古呼伦贝尔·统考中考真题)图甲是M、N两种固体的溶解度曲线。20℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙;升温到40℃时,现象如图丙。下列说法正确的是( )
A.烧杯a中加入的固体为N
B.20℃时,烧杯a中为饱和溶液,b中为不饱和溶液
C.40℃时,烧杯a、b中均为不饱和溶液
D.40℃时,烧杯a、b中溶液的溶质质量分数不相等
2.(2022·湖南衡阳·统考中考真题)下列关于溶液的说法正确的是( )
A.溶液是具有均一性、稳定性的混合物
B.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C.打开汽水瓶盖后有气泡冒出,主要是因为温度升高,气体溶解度减小
D.溶液都是无色透明的液体
3.(2022·江苏常州·统考中考真题)下表是两种硫酸盐在不同温度时的溶解度:
温度/°C 0 10 20 30 40 50 60 70 80
溶解度/g 硫酸钠 4.9 9.1 19.5 40.8 48.8 46.2 45.3 44.3 43.7
硫酸铈 24.1 20.0 17.2 14.0 10.0 8.9 8.3 7.1 6.0
下列说法正确的是( )
A.随温度升高,物质的溶解度只可能不断增大或不断减小
B.在0-80℃间的任何温度下,硫酸钠和硫酸铈的溶解度均不相等
C.某温度下,向等质量水中分别加入等质量硫酸钠和硫酸铈,充分溶解后,前者的溶质质量分数可能大于、等于或小于后者
D.将100g30℃时的饱和硫酸铈溶液加热到40℃(加热过程中水的蒸发忽略不计),从溶液中可析出4g硫酸铈晶体
4.(2022·山东淄博·统考中考真题)如图为硝酸钾和氯化钠在水中的溶解度曲线,下列说法错误的是( )
A.24℃时,硝酸钾和氯化钠的溶解度相等
B.硝酸钾中混有少量氯化钠,可用降温结晶的方法提纯硝酸钾
C.10℃时,将20g硝酸钾放入50g水中,充分搅拌,得到60g硝酸钾溶液
D.30℃时,硝酸钾溶液中溶质的质量分数一定大于氯化钠溶液中溶质的质量分数
5.(2022·江苏无锡·中考真题)NaCl、KCl、MgCl2的溶解度曲线如图所示。下列叙述正确的是( )
A.80℃时,KCl的溶解度比NaCl小
B.t℃时,NaCl和KCl的溶解度相同
C.t℃时,KCl饱和溶液的质量分数为40%
D.NaCl中含有少量MgCl2,可以采用降温结晶的方法提纯NaCl
二、填空题
6.(2022·江苏淮安·中考真题)硝酸钾、硝酸钠、氯化钠的溶解度曲线如图所示。回答下列问题:
(1)氯化钠以离子形式分散在水中,氯化钠中带正电荷的离子是____________(填离子符号)。
(2)60℃时,硝酸钾的溶解度是____________g。
(3)20℃时,将40g硝酸钠加入50g水中,形成____________溶液(填“饱和”或“不饱和”)。
(4)60℃时,将等质量的硝酸钾和氯化钠的饱和溶液分别降温至20℃。下列判断正确的是 。
A.析出晶体质量:硝酸钾>氯化钠
B.所得溶液中溶剂质量:硝酸钾>氯化钠
C.所得溶液中溶质质量分数:硝酸钾>氯化钠
7.(2022·辽宁鞍山·统考中考真题)A、B、C三种固体物质的溶解度曲线如下图所示。请回答下列问题:
(1)P点的含义是____________。
(2)t2℃时,70gA物质的饱和溶液中溶质的质量是____________g。
(3)将C物质的不饱和溶液转化为饱和溶液,可采用的方法是______________。(写出一种方法即可)。
(4)将t1℃时等质量的A、B、C三种物质的饱和溶液分别升温到t2℃(忽略水分的蒸发),所得溶液的质量大小关系是____________(用“>”、“<”或“=”表示)。
8.(2022·湖南湘西·中考真题)M、N、P三种物质的溶解度曲线如图所示,请回答下列问题:
(1)溶解度随温度的升高而减小的物质是________;
(2)t2℃时三种物质的溶解度大小关系是________;
(3)t1℃时把40g物质M投入80g水中,充分搅拌后得到的溶液是________(填“饱和”或“不饱和”)溶液。
第3节 物质的溶解性
一、单选题
1.(2022·内蒙古呼伦贝尔·统考中考真题)图甲是M、N两种固体的溶解度曲线。20℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙;升温到40℃时,现象如图丙。下列说法正确的是( )
A.烧杯a中加入的固体为N
B.20℃时,烧杯a中为饱和溶液,b中为不饱和溶液
C.40℃时,烧杯a、b中均为不饱和溶液
D.40℃时,烧杯a、b中溶液的溶质质量分数不相等
【答案】C
【详解】A、乙中烧杯a中底部有固体剩余,烧杯b中底部没有固体剩余,说明a中物质的溶解度小于b中物质的溶解度,故a烧杯中加入的固体是M,b中加入的固体是N,故A不符合题意;
B、因为并不知道加入溶质的具体质量,烧杯a有不溶物所以一定是饱和溶液,但是b不能确定溶液是否饱和,故B不符合题意;
C、由图像可知,温度升高两种物质溶解度增大,由图乙知b在20℃时可能是饱和溶液,升温到40℃后b一定是不饱和溶液,且40℃时M的溶解度大于N,b已经是不饱和溶液,由于所加入溶质质量相同,所以a一定是不饱和溶液,故C符合题意;
D、如图可知,在35℃时,M和N溶解度相等,如果刚好加入的35℃状态下溶解度大小质量的溶质,40℃时,两溶液溶质质量相同,溶剂的质量相等,则质量分数相等,故D不符合题意;
故选C。
【点睛】结合溶解度曲线进行判断溶液的性质,难度较大。
2.(2022·湖南衡阳·统考中考真题)下列关于溶液的说法正确的是( )
A.溶液是具有均一性、稳定性的混合物
B.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C.打开汽水瓶盖后有气泡冒出,主要是因为温度升高,气体溶解度减小
D.溶液都是无色透明的液体
【答案】A
【详解】A、溶液是由溶质和溶剂混合而成的均一、稳定的混合物,符合题意;
B、饱和溶液不一定是浓溶液,是常温下,氢氧化钙的饱和溶液是稀溶液,不饱和溶液不一定是稀溶液,如常温下,硝酸钾的饱和溶液是浓溶液,不符合题意;
C、打开汽水瓶盖后有气泡冒出,主要是因为压强减小,气体的溶解度减小,不符合题意;
D、溶液是透明的,但是不一定是无色的,如硫酸铜溶液是蓝色的,不符合题意。
故选A。
3.(2022·江苏常州·统考中考真题)下表是两种硫酸盐在不同温度时的溶解度:
温度/°C 0 10 20 30 40 50 60 70 80
溶解度/g 硫酸钠 4.9 9.1 19.5 40.8 48.8 46.2 45.3 44.3 43.7
硫酸铈 24.1 20.0 17.2 14.0 10.0 8.9 8.3 7.1 6.0
下列说法正确的是( )
A.随温度升高,物质的溶解度只可能不断增大或不断减小
B.在0-80℃间的任何温度下,硫酸钠和硫酸铈的溶解度均不相等
C.某温度下,向等质量水中分别加入等质量硫酸钠和硫酸铈,充分溶解后,前者的溶质质量分数可能大于、等于或小于后者
D.将100g30℃时的饱和硫酸铈溶液加热到40℃(加热过程中水的蒸发忽略不计),从溶液中可析出4g硫酸铈晶体
【答案】C
【详解】A、由表格数据可知,在0-40℃范围内,硫酸钠的溶解度随温度升高而增大,40℃-80℃范围内,硫酸钠的溶解度随温度升高而减小;而在0-80范围内,硫酸铈的溶解度随温度升高而减小,故A说法错误;
B、由表格数据可知,在10℃-20℃之间时,硫酸钠的溶解度在9.1g-19.5g之间,而此温度范围内,硫酸铈的溶解度在17.2g-20.0g之间,所以在10-20℃之间,硫酸钠和硫酸铈的溶解度可能相等,范围在17.2g-19.5g之间,故B说法错误;
C、某温度下,向等质量水中分别加入等质量硫酸钠和硫酸铈,充分溶解后,由于无法确定是否是饱和溶液,所以无法确定其溶质质量分数,故前者的溶质质量分数可能大于、等于或小于后者,故C说法正确;
D、由表格数据可知,30℃时,硫酸铈的溶解度为14.0g,即100g水中最多溶解溶质为14.0g,所以100g30℃时的饱和硫酸铈溶液中溶质为,溶剂质量为100g-12g=88g,将其加热到40℃(加热过程中水的蒸发忽略不计),40℃时,硫酸铈的溶解度为10.0g,此温度下88g水中溶质质量为,所以从溶液中可析出12g-8.8g=3.2g≠4g硫酸铈晶体,故D说法错误。
故选C。
4.(2022·山东淄博·统考中考真题)如图为硝酸钾和氯化钠在水中的溶解度曲线,下列说法错误的是( )
A.24℃时,硝酸钾和氯化钠的溶解度相等
B.硝酸钾中混有少量氯化钠,可用降温结晶的方法提纯硝酸钾
C.10℃时,将20g硝酸钾放入50g水中,充分搅拌,得到60g硝酸钾溶液
D.30℃时,硝酸钾溶液中溶质的质量分数一定大于氯化钠溶液中溶质的质量分数
【答案】D
【详解】A、由溶解度曲线可知24℃时,硝酸钾和氯化钠的溶解度曲线有交点,故二者溶解度相等。故对。
B、硝酸钾溶解度收温度变化影响较大,氯化钠溶解度受温度变化影响较小,故硝酸钾中混有少量氯化钠,可用降温结晶的方法提纯硝酸钾。故对。
C、10℃时,硝酸钾的溶解度为20g。故将20g硝酸钾放入50g水中,充分搅拌可溶解10g,得到60g硝酸钾溶液。故对。
D、30℃时,硝酸钾溶液中溶质的质量分数不一定大于氯化钠溶液中溶质的质量分数,因为没有指明溶液是否是饱和溶液,故错。
故选D。
5.(2022·江苏无锡·中考真题)NaCl、KCl、MgCl2的溶解度曲线如图所示。下列叙述正确的是( )
A.80℃时,KCl的溶解度比NaCl小
B.t℃时,NaCl和KCl的溶解度相同
C.t℃时,KCl饱和溶液的质量分数为40%
D.NaCl中含有少量MgCl2,可以采用降温结晶的方法提纯NaCl
【答案】B
【详解】A.从图中可以看到, 80℃时氯化钾的溶解度曲线在氯化钠溶解度曲线的上方,所以KCl的溶解度比NaCl大,错误;
B. t℃时氯化钠和氯化钾的溶解度曲线相交于一点,所以NaCl和KCl的溶解度相同,正确;
C. t℃时氯化钾的溶解度为40g,则饱和溶液的溶质质量分数为,错误。
D. 氯化钠、氯化镁的溶解度均随温度的升高而升高。氯化钠溶解度受温度影响不大,氯化镁溶解度受温度影响较大,所以NaCl中含有少量MgCl2,可以采用蒸发结晶的方法提纯氯化钠,错误;
故选:B。
二、填空题
6.(2022·江苏淮安·中考真题)硝酸钾、硝酸钠、氯化钠的溶解度曲线如图所示。回答下列问题:
(1)氯化钠以离子形式分散在水中,氯化钠中带正电荷的离子是____________(填离子符号)。
(2)60℃时,硝酸钾的溶解度是____________g。
(3)20℃时,将40g硝酸钠加入50g水中,形成____________溶液(填“饱和”或“不饱和”)。
(4)60℃时,将等质量的硝酸钾和氯化钠的饱和溶液分别降温至20℃。下列判断正确的是 。
A.析出晶体质量:硝酸钾>氯化钠
B.所得溶液中溶剂质量:硝酸钾>氯化钠
C.所得溶液中溶质质量分数:硝酸钾>氯化钠
【答案】(1)Na+
(2)110
(3)不饱和
(4)A
【详解】(1)氯化钠是由钠离子和氯离子构成的,钠离子带正电荷,表示为:Na+;
(2)根据图像可知,60℃时,硝酸钾的溶解度是110g;
(3)20℃时,硝酸钠的溶解度为88g,即100g水最多溶解88g硝酸钠,则50g水最多溶解44g硝酸钠,因此,将40g硝酸钠加入50g水中,能全部溶解,形成的是不饱和溶液;
(4)A、硝酸钾的溶解度受温度影响变化较大,降低温度就会析出大量的晶体,故A正确;
B、60℃时,硝酸钾的溶解度大于氯化钠,则等质量的硝酸钾和氯化钠的饱和溶液中所含水的质量:硝酸钾<氯化钠,降温后,水的量不会发生改变,故B错误;
C、降温到20℃,两种溶液仍为饱和溶液,此温度下,氯化钠的溶解度大于硝酸钾,所以溶液中溶质质量分数:硝酸钾<氯化钠,故C错误;
故选A。
7.(2022·辽宁鞍山·统考中考真题)A、B、C三种固体物质的溶解度曲线如下图所示。请回答下列问题:
(1)P点的含义是____________。
(2)t2℃时,70gA物质的饱和溶液中溶质的质量是____________g。
(3)将C物质的不饱和溶液转化为饱和溶液,可采用的方法是______________。(写出一种方法即可)。
(4)将t1℃时等质量的A、B、C三种物质的饱和溶液分别升温到t2℃(忽略水分的蒸发),所得溶液的质量大小关系是____________(用“>”、“<”或“=”表示)。
【答案】(1)在t1℃时,A、C两物质的溶解度相等
(2)20
(3)升高温度或恒温蒸发溶剂或增加溶质C
(4)B=A>C
【详解】(1)根据溶解度曲线可知,在t1℃时,A物质溶解度曲线与C物质溶解度曲线相交于P点,即P点的含义是在t1℃时,A、C两物质的溶解度相等;
(2)根据溶解度曲线可知,t2℃时,A物质的溶解度为40g,即100g的水中最多溶解40gA物质形成饱和溶液,当溶剂质量为100g,溶质质量为40g,饱和溶液的质量为140g,即当t2℃时,70gA物质的饱和溶液中溶质的质量是20g,溶剂质量是50g;
(3)根据溶解度曲线可知,C物质的溶解度随着温度的升高而降低,则将C物质的不饱和溶液转化为饱和溶液,可采用的方法是升高温度或者恒温蒸发溶剂或者增加溶质C;
(4)根据溶解度曲线可知,t1℃时,B物质的溶解度最大,A、C物质的溶解度相等,升高温度,A、B物质的溶解度增大,且A、B两物质均由饱和溶液变为不饱和溶液,无晶体析出,升温后,A、B的溶液质量相等,而C物质的溶解度减小,且C溶液中析出晶体,C的溶液质量减小,则将t1℃时等质量的A、B、C三种物质的饱和溶液分别升温到t2℃(忽略水分的蒸发),所得溶液的质量大小关系是B=A>C。
8.(2022·湖南湘西·中考真题)M、N、P三种物质的溶解度曲线如图所示,请回答下列问题:
(1)溶解度随温度的升高而减小的物质是________;
(2)t2℃时三种物质的溶解度大小关系是________;
(3)t1℃时把40g物质M投入80g水中,充分搅拌后得到的溶液是________(填“饱和”或“不饱和”)溶液。
【答案】(1)P
(2)N>M>P
(3)饱和
【详解】(1)根据溶解度曲线可知,溶解度随温度的升高而减小的物质是物质P(呈下降趋势);
(2)根据溶解度曲线可知t2℃时,溶解度最大的是N,最小的是P,所以此时三种物质的溶解度大小关系是N>M>P;
(3)t1℃时,物质M溶解度为40g,即100g水中最多溶解40g物质M,所以80g水不能完全溶解40g物质M,所以充分搅拌后得到的溶液是饱和溶液。
