原子结构1
图片预览







文档简介
课件29张PPT。复习提问 是保持物质化学性质的最小微粒.
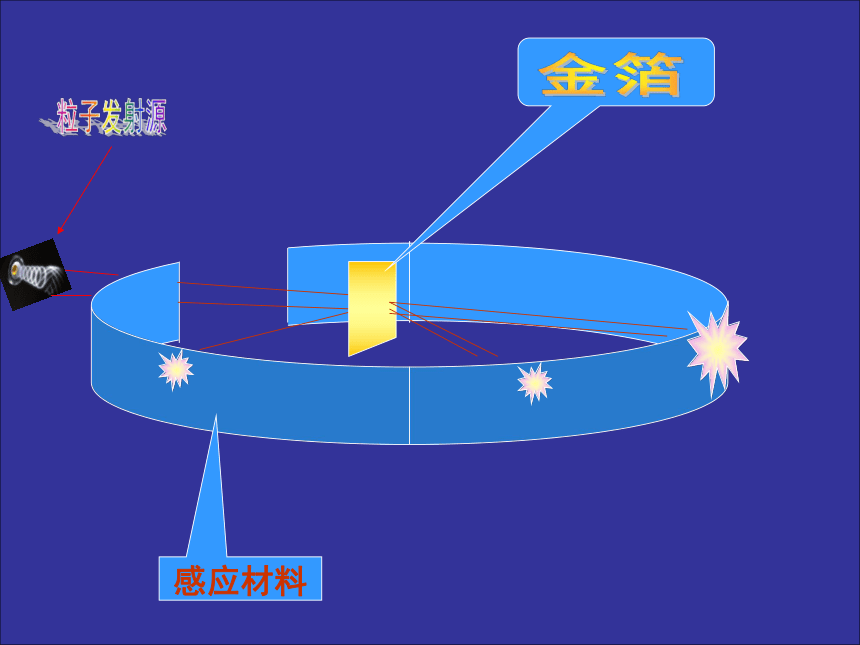
是化学反应中的最小微粒. 分子原子ks5u精品课件第一节 原子结构原子结构的认识历程(了解) 1. 公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。 2.道尔顿原子模型 ( 1803 年):原子是组成物质的基本的粒子,它们是坚实的、不可再分的实心球。 3.汤姆生原子模型 ( 1904 年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。 淮阳中学 葛新义感应材料粒子发射源金箔体积很小相对质量为4的带正电粒子现象:
1、大部分α粒子穿过薄的金箔
2、极少数α粒子好象打在坚硬的东西上,完全 反弹回来。
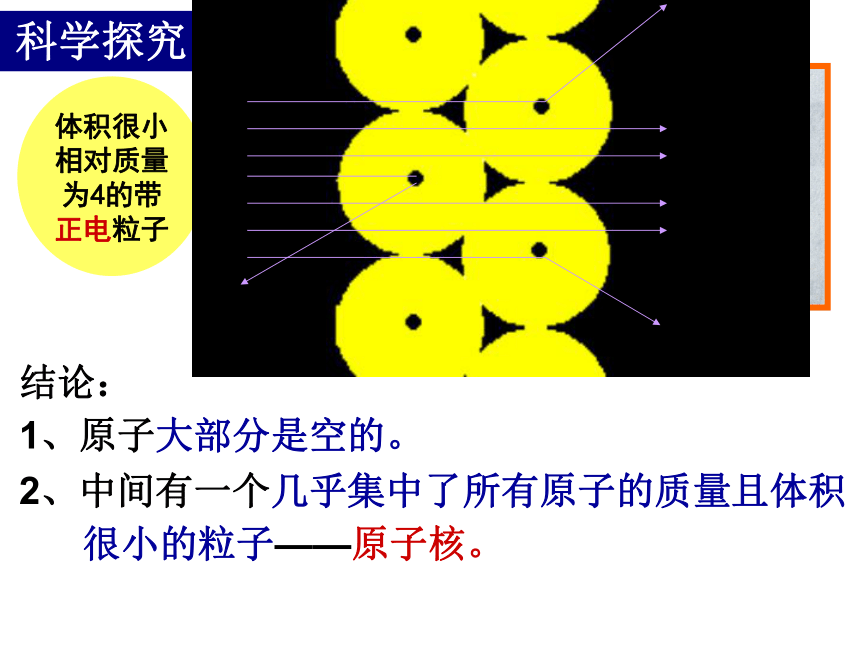
3、少数α粒子穿过薄的金箔时,发生了偏转。科学探究结论:
1、原子大部分是空的。2、中间有一个几乎集中了所有原子的质量且体积
很小的粒子——原子核。
卢瑟福核式结构1.原子由原子核和核外电子构成。
2.原子核带正电荷,位于原子的中心;
3.电子带负电荷,在原子核周围空间做高速运动。4.卢瑟福原子模型 ( 1911 年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。 1. 原子核的构成一、原子核 核素注:相对质量是指该微粒质量与12C原子(原子核内有6个质子和6个中子的碳原子)质量的1/12(1.661×10-27 kg )相比较所得的数值。0.0005484
1.007
1.008
回忆初中:相对原子质量是怎么计算的?
质子数(Z)+中子数(N)=质量数(A)质量关系:质量数(A)=质子数(Z)+中子数(N)几个数量关系电性关系:
中性原子:核电荷数(Z)=核内质子数=核外电子数
阴离子:核外电子数=核内质子数+所带电荷数
质子数<核外电子数
阳离子:核外电子数=核内质子数-所带电荷数
质子数>核外电子数思考:1、原子的相对原子质量与原子的质量数
是什么关系?相对原子质量
≈质量数 表示原子组成的一种方法课堂练习:
1、请用符号表示下列原子:
①质子数为a,中子数为b的X原子
②质子数和中子数都为9的氟原子
③中子数为2的氢原子
④中子数分别为8、9、10的氧原子
⑤质量数分别为35、37的氯原子
1. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
( 11, 11 )
2. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?
( 33 )
3.某元素的阳离子Rn+,核外共用x个电子,原子的质量数为A,则该元素原子里的中子数为( )
(A)A-x-n (B)A-x+n
(C)A+x-n (D)A+x+n
Aa——代表质量数;
b——代表质子数即核
电荷数;
c——代表离子的所带电荷数;
d——代表化合价
e——代表原子个数a b c d e各代表什么请看下列表示 P 4 迁移?应用 生物体在生命存续期间保留的一种碳原子─14(6C)会在其死亡后衰变,测量考古遗址中发现的遗物里碳─14的数量,可以推断出它的存在年代。请你利用所学知识分析,碳─14原子与作为相对原子质量标准的碳─12原子( 6C)在原子结构上有什么异同。 14 12观察思考科学家发现有三种原子:氕(1H),氘(1H),氚(1H),请观察原子符号即课本图1-1-3,回答下列问题:1.氕,氘,氚的原子结构有什么异同?
2.它们是同一种元素吗?1231.元素的种类是由什么决定的?2.同种元素原子的中子数也相同吗?思考
元素:具有相同核电荷数(质子数)的同
一类原子的总称。
2、核素 氢元素的三种核素(原子)核素:具有一定数目质子和一定数目中子的一种原子称为核素。1111102322、核素核素:具有一定数目质子和一定数目
中子的一种原子同位素:质子数相同而中子数不同的同一种元素的不同核素(原子)互称为同位素三者关系:核素核素 ……元素(同位素)同位素性质:
同位素的化学性质相同,物理性质有一定差别。
应用:
①金属探伤 ②消除静电 ③治疗肿瘤 ④示踪原子,跟踪研究化学反应
⑤作核燃料 ⑥用14C考古 ⑦环保治污等
?
课堂练习:
1、至今已发现110多种元素,是否核素也只有110多种?
2、下列各组中属于同位素的是( ),属于同素异形体的是( )
A 147N、146C B 4018Ar、4020Ca
C O2、O3 D 3517Cl、3717Cl
E、Fe、Fe2+、Fe3+
3、3919K的中子数为 。其中:
(1)表示核素的符号共( )种。
(2)互为同位素的是( )和( )。
(3)质量数相等,但不能互称同位素的是()。
学以致用8小结:1、研究原子的
方法:假说与模型3、三个概念:元素、核素、同位素 质量数(A)=质子数(Z)+中子数(N)核电荷数=质子数=核外电子数
原子 ﹛两个关系小结
是化学反应中的最小微粒. 分子原子ks5u精品课件第一节 原子结构原子结构的认识历程(了解) 1. 公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。 2.道尔顿原子模型 ( 1803 年):原子是组成物质的基本的粒子,它们是坚实的、不可再分的实心球。 3.汤姆生原子模型 ( 1904 年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。 淮阳中学 葛新义感应材料粒子发射源金箔体积很小相对质量为4的带正电粒子现象:
1、大部分α粒子穿过薄的金箔
2、极少数α粒子好象打在坚硬的东西上,完全 反弹回来。
3、少数α粒子穿过薄的金箔时,发生了偏转。科学探究结论:
1、原子大部分是空的。2、中间有一个几乎集中了所有原子的质量且体积
很小的粒子——原子核。
卢瑟福核式结构1.原子由原子核和核外电子构成。
2.原子核带正电荷,位于原子的中心;
3.电子带负电荷,在原子核周围空间做高速运动。4.卢瑟福原子模型 ( 1911 年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。 1. 原子核的构成一、原子核 核素注:相对质量是指该微粒质量与12C原子(原子核内有6个质子和6个中子的碳原子)质量的1/12(1.661×10-27 kg )相比较所得的数值。0.0005484
1.007
1.008
回忆初中:相对原子质量是怎么计算的?
质子数(Z)+中子数(N)=质量数(A)质量关系:质量数(A)=质子数(Z)+中子数(N)几个数量关系电性关系:
中性原子:核电荷数(Z)=核内质子数=核外电子数
阴离子:核外电子数=核内质子数+所带电荷数
质子数<核外电子数
阳离子:核外电子数=核内质子数-所带电荷数
质子数>核外电子数思考:1、原子的相对原子质量与原子的质量数
是什么关系?相对原子质量
≈质量数 表示原子组成的一种方法课堂练习:
1、请用符号表示下列原子:
①质子数为a,中子数为b的X原子
②质子数和中子数都为9的氟原子
③中子数为2的氢原子
④中子数分别为8、9、10的氧原子
⑤质量数分别为35、37的氯原子
1. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
( 11, 11 )
2. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?
( 33 )
3.某元素的阳离子Rn+,核外共用x个电子,原子的质量数为A,则该元素原子里的中子数为( )
(A)A-x-n (B)A-x+n
(C)A+x-n (D)A+x+n
Aa——代表质量数;
b——代表质子数即核
电荷数;
c——代表离子的所带电荷数;
d——代表化合价
e——代表原子个数a b c d e各代表什么请看下列表示 P 4 迁移?应用 生物体在生命存续期间保留的一种碳原子─14(6C)会在其死亡后衰变,测量考古遗址中发现的遗物里碳─14的数量,可以推断出它的存在年代。请你利用所学知识分析,碳─14原子与作为相对原子质量标准的碳─12原子( 6C)在原子结构上有什么异同。 14 12观察思考科学家发现有三种原子:氕(1H),氘(1H),氚(1H),请观察原子符号即课本图1-1-3,回答下列问题:1.氕,氘,氚的原子结构有什么异同?
2.它们是同一种元素吗?1231.元素的种类是由什么决定的?2.同种元素原子的中子数也相同吗?思考
元素:具有相同核电荷数(质子数)的同
一类原子的总称。
2、核素 氢元素的三种核素(原子)核素:具有一定数目质子和一定数目中子的一种原子称为核素。1111102322、核素核素:具有一定数目质子和一定数目
中子的一种原子同位素:质子数相同而中子数不同的同一种元素的不同核素(原子)互称为同位素三者关系:核素核素 ……元素(同位素)同位素性质:
同位素的化学性质相同,物理性质有一定差别。
应用:
①金属探伤 ②消除静电 ③治疗肿瘤 ④示踪原子,跟踪研究化学反应
⑤作核燃料 ⑥用14C考古 ⑦环保治污等
?
课堂练习:
1、至今已发现110多种元素,是否核素也只有110多种?
2、下列各组中属于同位素的是( ),属于同素异形体的是( )
A 147N、146C B 4018Ar、4020Ca
C O2、O3 D 3517Cl、3717Cl
E、Fe、Fe2+、Fe3+
3、3919K的中子数为 。其中:
(1)表示核素的符号共( )种。
(2)互为同位素的是( )和( )。
(3)质量数相等,但不能互称同位素的是()。
学以致用8小结:1、研究原子的
方法:假说与模型3、三个概念:元素、核素、同位素 质量数(A)=质子数(Z)+中子数(N)核电荷数=质子数=核外电子数
原子 ﹛两个关系小结
