【名师原创】2015年沪教版九年级下册精品备课课件:62 溶液组成的表示(共29张PPT)
文档属性
| 名称 | 【名师原创】2015年沪教版九年级下册精品备课课件:62 溶液组成的表示(共29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 923.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-01-22 15:48:30 | ||
图片预览








文档简介
课件29张PPT。第6章 溶解现象第2节 溶液组成的表示第6章 溶解现象问 题 导 学新 知 预 习一 、溶液的组成1.所有的溶液都是由______和_____组成的,被溶解的物质叫作_____,溶解溶质的物质叫作_____。溶质可以是_____、_____,也可以是_____。水是最常用的溶剂,酒精、汽油等也可作为溶剂。
2.溶液里的溶质可以是_____(填“一种”或“多种”,下同),也可以是_____,而溶剂只能是____。第6章 溶解现象溶质溶剂溶质溶剂固体液体气体一种多种一种第6章 溶解现象3.溶液质量=_____质量+_____质量。
[提示] 溶液的质量可以通过溶液的体积和密度进行计算:
溶液的质量(g)=溶液的体积(cm3)×溶液的密度(g/cm3)
m(溶液)=V(溶液)×ρ(溶液)溶质溶剂二、溶液浓度的表示 ________与_________之比叫作溶液的溶质质量分数。溶质质量分数越大,说明溶液中溶质的相对含量______。
计算公式:
溶质的质量分数(w)=________×100%
[注意] (1)溶质质量分数的数学表达式中,溶质质量和溶液质量的单位必须统一。
(2)这里溶质的质量指的是溶解的那部分溶质的质量,未溶解部分的不能计算在内。第6章 溶解现象溶质质量溶液质量越大三、有关溶液稀释问题的计算特点:加水稀释前后__________不变。
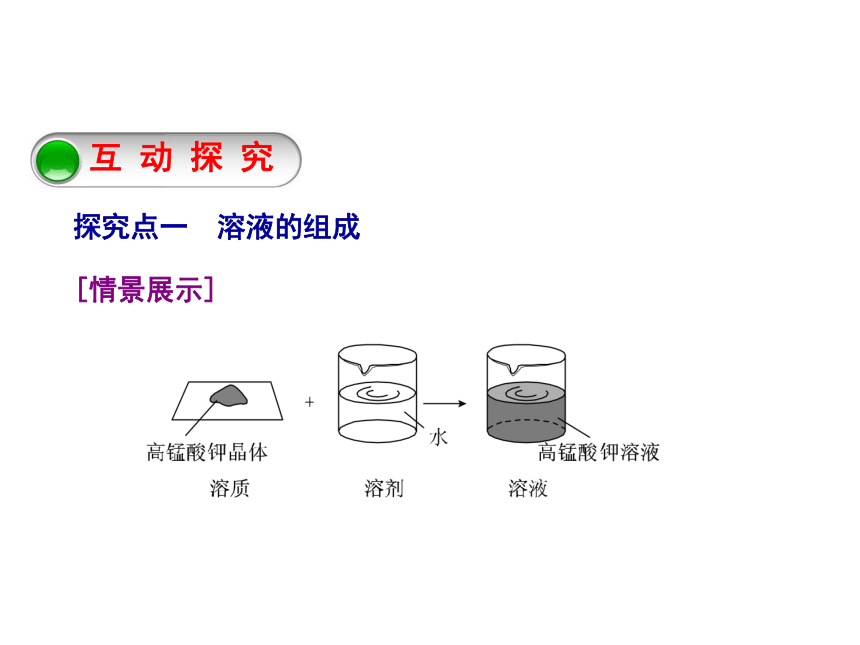
公式:浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数。第6章 溶解现象溶质质量互 动 探 究探究点一 溶液的组成 [情景展示]第6章 溶解现象[问题探究] 由上图可知,高锰酸钾溶液是由什么组成的?如何判断溶液中的溶质和溶剂?[思考交流]第6章 溶解现象[归纳提升](1) 根据名称,一般溶质在前、溶剂在后,水作溶剂时一般省略不写。
(2) 若是固体或气体与液体相互溶解成为溶液,一般习惯将固体或气体看作溶质,液体看作溶剂。
(3) 若是由两种液体组成的溶液,一般习惯把量多的看作溶剂,量少的看作溶质。
(4) 物质溶解于水形成溶液时,无论水量的多少,水都是溶剂。
(5) 对于由于发生化学反应后所得溶液中溶质的判断,要根据生成的新物质来确定。第6章 溶解现象[课堂速记]第6章 溶解现象[应用示例]例1 下列常见的医用溶液中,溶剂不是水的是( )
A.葡萄糖注射液
B.生理盐水
C.消毒酒精
D.碘酒 第6章 溶解现象[解析] D 选项A、B、C中溶剂都是水;只有碘酒是碘的酒精溶液,溶剂是酒精。 [方法点拨] 水是最常用的溶剂,通常不指明溶剂的溶液,指的是水溶液。汽油、酒精也可以作为溶剂,如汽油能溶解油脂,酒精能溶解碘。溶质在被分散前的状态可以是固体(氯化钠、硝酸钾等)、液体(酒精、硫酸)、气体(氯化氢、二氧化碳)。溶于水后的溶质以分子或离子形式存在。第6章 溶解现象探究点二 溶液浓度的表示[情景展示]第6章 溶解现象演示实验:在两杯等量的水中分别加入一勺糖和两勺糖,搅拌使其完全溶解。 [问题探究]你能判断两只烧杯内糖水的浓度吗?依据是什么? [思考交流]第6章 溶解现象[归纳提升] (1)要反映某溶液浓度的大小,可以用溶质的质量分数即溶质的质量与溶液的质量之比来表示。溶质的质量分数越大,表示溶液的浓度越大。
(2)溶液中溶质的质量分数计算
公式:溶质的质量分数= ×100%= ×100%
公式变形:m(溶质)=m(溶液)×溶质质量分数第6章 溶解现象[课堂速记]第6章 溶解现象公式理解:溶质质量分数的含义表示每100份质量的某溶质的溶液所含溶质的质量。例如,某硝酸钾溶液的溶质质量分数是10%,表示每100份质量的硝酸钾溶液含10份质量的硝酸钾。 例2 下列关于溶质质量分数为5%的食盐溶液说法正确的是( )
A.每100 g水中溶解5 g食盐
B.食盐和水的质量比为1∶20
C.每100 g食盐溶液中溶有5 g食盐
D.食盐和溶液的质量比为1∶21[应用示例]第6章 溶解现象 C [方法点拨] 溶质质量分数的含义表示每100份质量的某溶质的溶液所含溶质的质量。例如,某硝酸钾溶液的溶质质量分数是10%,表示每100份质量的硝酸钾溶液含10份质量的硝酸钾。第6章 溶解现象探究点三 有关溶液稀释问题的计算[情景展示]第6章 溶解现象向一定量的98%的浓硫酸中加入一定量的水,或加入一定溶质质量分数的稀硫酸可得到另一种溶质质量分数的硫酸溶液。[问题探究] 用50 g 98%的浓硫酸稀释成24.5%的稀硫酸,需加水的质量为多少?如果用49%的稀硫酸,所需水的质量又是多少呢?[思考交流]第6章 溶解现象[归纳提升]溶液稀释前后溶液质量改变,浓度改变,溶质质量不发生改变,常据此找等量关系。第6章 溶解现象[应用示例]例3 某医院要用含溶质质量分数为20%(密度为1.1 g/cm3)的过氧乙酸溶液配制成溶质质量分数为0.4%(密度为1.0 g/cm3)的消毒液15 L,请问需要20%的过氧乙酸溶液多少毫升?水多少毫升? 第6章 溶解现象[答案] 解:设需要20%的过氧乙酸溶液的质量为x。
15 L≈15000 mL
15000 mL×1.0 g/mL=15000 g
x×20%=15000 g×0.4%
x=300 g
20%过氧乙酸溶液的体积=300 g ÷ 1.1 g/mL≈272.7 mL
水的体积=(15000 g-300 g) ÷1.0 g/mL=14700 mL [解析] 解答本题的关键是溶液稀释前后,溶质的质量不变。
第6章 溶解现象 [方法点拨] 有关溶液稀释的计算主要依据两个不变:溶液中溶质的质量保持不变,稀释或浓缩前后总质量不变。考查浓硫酸或浓盐酸的稀释,计算时还应当考虑质量、密度、体积三者的换算问题以及不同质量单位的换算问题。课 堂 小 结第6章 溶解现象当 堂 检 测知识点? 溶液的组成1.组成溶液的溶质( )
A.只能是固体
B.只能是液体
C.只能是气体
D.可能是固体、液体、气体[解析] D 氢氧化钠溶液中溶质是固体;酒精溶液中溶质是液体;盐酸中溶质是气体。 第6章 溶解现象2.将2 g氯化钠和3 g硝酸钾(相互不反应)加入到100 g水中,充分搅拌,完全溶解后,所得溶液的质量是( )
A.102 g B.103 g
C.105 g D.5 g第6章 溶解现象[解析] C 2 g+3 g+100 g=105 g。溶液由溶质和溶剂组成,溶质可以是一种,也可以是多种。知识点? 溶液浓度的表示3.向100 g溶质质量分数为20%的硝酸钾溶液中加入100 g水,所得溶液的溶质质量分数是( )
A.5% B.10%
C.20% D.40%[解析] B第6章 溶解现象 4.有100 g 10%的盐酸溶液,要使其溶质质量分数增大一倍,应采取的方法是( )
A.把溶液的量倒掉一半
B.溶质的质量增大一倍
C.将100 g 10%的盐酸与200 g 25%的盐酸混合
D.蒸发掉溶剂的质量是原溶液质量的一半第6章 溶解现象第6章 溶解现象[解析] C 溶液具有均一性,把溶液的量倒掉一半,其溶质质量分数不变,故A错误;根据溶质质量分数= ×100%可知,溶质的质量增大一倍,因溶液的质量也增加,因此溶质质量分数增大不到一倍,故B错误;将100 g 10%的盐酸与200 g 25%的盐酸混合,溶质质量分数为 ×100%=20%,故C正确;蒸发时先挥发出来的是氯化氢气体,故D错误。
2.溶液里的溶质可以是_____(填“一种”或“多种”,下同),也可以是_____,而溶剂只能是____。第6章 溶解现象溶质溶剂溶质溶剂固体液体气体一种多种一种第6章 溶解现象3.溶液质量=_____质量+_____质量。
[提示] 溶液的质量可以通过溶液的体积和密度进行计算:
溶液的质量(g)=溶液的体积(cm3)×溶液的密度(g/cm3)
m(溶液)=V(溶液)×ρ(溶液)溶质溶剂二、溶液浓度的表示 ________与_________之比叫作溶液的溶质质量分数。溶质质量分数越大,说明溶液中溶质的相对含量______。
计算公式:
溶质的质量分数(w)=________×100%
[注意] (1)溶质质量分数的数学表达式中,溶质质量和溶液质量的单位必须统一。
(2)这里溶质的质量指的是溶解的那部分溶质的质量,未溶解部分的不能计算在内。第6章 溶解现象溶质质量溶液质量越大三、有关溶液稀释问题的计算特点:加水稀释前后__________不变。
公式:浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数。第6章 溶解现象溶质质量互 动 探 究探究点一 溶液的组成 [情景展示]第6章 溶解现象[问题探究] 由上图可知,高锰酸钾溶液是由什么组成的?如何判断溶液中的溶质和溶剂?[思考交流]第6章 溶解现象[归纳提升](1) 根据名称,一般溶质在前、溶剂在后,水作溶剂时一般省略不写。
(2) 若是固体或气体与液体相互溶解成为溶液,一般习惯将固体或气体看作溶质,液体看作溶剂。
(3) 若是由两种液体组成的溶液,一般习惯把量多的看作溶剂,量少的看作溶质。
(4) 物质溶解于水形成溶液时,无论水量的多少,水都是溶剂。
(5) 对于由于发生化学反应后所得溶液中溶质的判断,要根据生成的新物质来确定。第6章 溶解现象[课堂速记]第6章 溶解现象[应用示例]例1 下列常见的医用溶液中,溶剂不是水的是( )
A.葡萄糖注射液
B.生理盐水
C.消毒酒精
D.碘酒 第6章 溶解现象[解析] D 选项A、B、C中溶剂都是水;只有碘酒是碘的酒精溶液,溶剂是酒精。 [方法点拨] 水是最常用的溶剂,通常不指明溶剂的溶液,指的是水溶液。汽油、酒精也可以作为溶剂,如汽油能溶解油脂,酒精能溶解碘。溶质在被分散前的状态可以是固体(氯化钠、硝酸钾等)、液体(酒精、硫酸)、气体(氯化氢、二氧化碳)。溶于水后的溶质以分子或离子形式存在。第6章 溶解现象探究点二 溶液浓度的表示[情景展示]第6章 溶解现象演示实验:在两杯等量的水中分别加入一勺糖和两勺糖,搅拌使其完全溶解。 [问题探究]你能判断两只烧杯内糖水的浓度吗?依据是什么? [思考交流]第6章 溶解现象[归纳提升] (1)要反映某溶液浓度的大小,可以用溶质的质量分数即溶质的质量与溶液的质量之比来表示。溶质的质量分数越大,表示溶液的浓度越大。
(2)溶液中溶质的质量分数计算
公式:溶质的质量分数= ×100%= ×100%
公式变形:m(溶质)=m(溶液)×溶质质量分数第6章 溶解现象[课堂速记]第6章 溶解现象公式理解:溶质质量分数的含义表示每100份质量的某溶质的溶液所含溶质的质量。例如,某硝酸钾溶液的溶质质量分数是10%,表示每100份质量的硝酸钾溶液含10份质量的硝酸钾。 例2 下列关于溶质质量分数为5%的食盐溶液说法正确的是( )
A.每100 g水中溶解5 g食盐
B.食盐和水的质量比为1∶20
C.每100 g食盐溶液中溶有5 g食盐
D.食盐和溶液的质量比为1∶21[应用示例]第6章 溶解现象 C [方法点拨] 溶质质量分数的含义表示每100份质量的某溶质的溶液所含溶质的质量。例如,某硝酸钾溶液的溶质质量分数是10%,表示每100份质量的硝酸钾溶液含10份质量的硝酸钾。第6章 溶解现象探究点三 有关溶液稀释问题的计算[情景展示]第6章 溶解现象向一定量的98%的浓硫酸中加入一定量的水,或加入一定溶质质量分数的稀硫酸可得到另一种溶质质量分数的硫酸溶液。[问题探究] 用50 g 98%的浓硫酸稀释成24.5%的稀硫酸,需加水的质量为多少?如果用49%的稀硫酸,所需水的质量又是多少呢?[思考交流]第6章 溶解现象[归纳提升]溶液稀释前后溶液质量改变,浓度改变,溶质质量不发生改变,常据此找等量关系。第6章 溶解现象[应用示例]例3 某医院要用含溶质质量分数为20%(密度为1.1 g/cm3)的过氧乙酸溶液配制成溶质质量分数为0.4%(密度为1.0 g/cm3)的消毒液15 L,请问需要20%的过氧乙酸溶液多少毫升?水多少毫升? 第6章 溶解现象[答案] 解:设需要20%的过氧乙酸溶液的质量为x。
15 L≈15000 mL
15000 mL×1.0 g/mL=15000 g
x×20%=15000 g×0.4%
x=300 g
20%过氧乙酸溶液的体积=300 g ÷ 1.1 g/mL≈272.7 mL
水的体积=(15000 g-300 g) ÷1.0 g/mL=14700 mL [解析] 解答本题的关键是溶液稀释前后,溶质的质量不变。
第6章 溶解现象 [方法点拨] 有关溶液稀释的计算主要依据两个不变:溶液中溶质的质量保持不变,稀释或浓缩前后总质量不变。考查浓硫酸或浓盐酸的稀释,计算时还应当考虑质量、密度、体积三者的换算问题以及不同质量单位的换算问题。课 堂 小 结第6章 溶解现象当 堂 检 测知识点? 溶液的组成1.组成溶液的溶质( )
A.只能是固体
B.只能是液体
C.只能是气体
D.可能是固体、液体、气体[解析] D 氢氧化钠溶液中溶质是固体;酒精溶液中溶质是液体;盐酸中溶质是气体。 第6章 溶解现象2.将2 g氯化钠和3 g硝酸钾(相互不反应)加入到100 g水中,充分搅拌,完全溶解后,所得溶液的质量是( )
A.102 g B.103 g
C.105 g D.5 g第6章 溶解现象[解析] C 2 g+3 g+100 g=105 g。溶液由溶质和溶剂组成,溶质可以是一种,也可以是多种。知识点? 溶液浓度的表示3.向100 g溶质质量分数为20%的硝酸钾溶液中加入100 g水,所得溶液的溶质质量分数是( )
A.5% B.10%
C.20% D.40%[解析] B第6章 溶解现象 4.有100 g 10%的盐酸溶液,要使其溶质质量分数增大一倍,应采取的方法是( )
A.把溶液的量倒掉一半
B.溶质的质量增大一倍
C.将100 g 10%的盐酸与200 g 25%的盐酸混合
D.蒸发掉溶剂的质量是原溶液质量的一半第6章 溶解现象第6章 溶解现象[解析] C 溶液具有均一性,把溶液的量倒掉一半,其溶质质量分数不变,故A错误;根据溶质质量分数= ×100%可知,溶质的质量增大一倍,因溶液的质量也增加,因此溶质质量分数增大不到一倍,故B错误;将100 g 10%的盐酸与200 g 25%的盐酸混合,溶质质量分数为 ×100%=20%,故C正确;蒸发时先挥发出来的是氯化氢气体,故D错误。
