沪教版九年级下册第6章 溶解现象2023年单元测试卷(含解析)
文档属性
| 名称 | 沪教版九年级下册第6章 溶解现象2023年单元测试卷(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 140.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 21:01:24 | ||
图片预览



文档简介
沪教版九年级下册《第6章 溶解现象》2023年单元测试卷
一、选择题
1.一种物质溶解于另一种物质时,分散的微粒是( )
A.固体小颗粒 B.细小的液滴 C.分子或离子 D.只有分子
2.下列物质相混合能得到溶液的是( )
A.氯化氢气体通入水中
B.汽油和水混合
C.二氧化碳通入澄清石灰水中
D.冰和水的混合物
3.下列操作能将物质完全分散成分子的是( )
A.在研钵里用杵研磨粒状胆矾
B.将蔗糖溶于水
C.把植物油滴入水中用力振荡
D.加热高锰酸钾
4.下列关于溶液的说法:
①溶质只能是固体;
②溶剂一定是水;
③一种溶液只含一种溶质;
④溶液是无色的纯净物;
⑤溶液一定是液体。
其中错误的是( )
A.①③④ B.①②③④⑤ C.②③④ D.①②③
5.有些溶液能导电是因为溶液中存在着( )
A.自由移动的分子 B.自由移动的原子
C.自由移动的离子 D.自由移动的电子
6.20%的蔗糖溶液中溶质、溶剂、溶液之间的质量比是( )
A.1:4:5 B.5:4:1 C.4:1:5 D.20:80:100
7.已知60℃硝酸钾的溶解度为110克,在该温度下将60克硝酸钾放入50克水中,充分搅拌,则所得溶液中溶质的质量分数约为( )
A.24.0% B.52.4% C.31.6% D.40.0%
8.取70g某温度下的氯化钾饱和溶液,将其恒温蒸发:10g水,析出4g氯化钾固体,则剩余溶液中所含溶质质量为( )
A.16 g B.20g C.10g D.56 g
9.现有20℃时的硝酸钾饱和溶液100g,在下列情况下能改变溶液的溶质质量分数的是( )
A.恒温蒸发掉20g水 B.恒温加入少量的硝酸钾
C.降温到10℃ D.升温到25℃
10.用氯化钠固体配制溶质的质量分数一定的氯化钠溶液必须使用的一组仪器是( )
①天平 ②烧杯 ③玻璃棒 ④蒸发皿 ⑤量筒 ⑥水槽 ⑦漏斗 ⑧铁架台.
A.①②③④ B.①②③⑤ C.①②⑥⑦ D.①②⑦⑧
11.将mg硝酸钾的不饱和溶液恒温蒸发水分至有晶体析出,在此变化过程中溶液里溶质质量分数(a%)与时间(t)的关系正确的是( )
A. B.
C. D.
12.下列有关溶液(固体溶质)的叙述,正确的是( )
A.某物质的饱和溶液变为不饱和溶液,溶质的质量分数一定变小
B.在一定温度下,同一物质的饱和溶液一定比不饱和溶液溶质的质量分数大
C.任何物质的饱和溶液,当温度降低时一定会析出溶质
D.饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定变小
13.下列各组物质,只用水就可以鉴别的是( )
A.固体:氯化钠、碳酸钙、高锰酸钾
B.气体:氢气、氧气、二氧化碳
C.液体:豆油、酒精、菜油
D.固体:氯化钠、氯化钙、氯化镁
14.室温时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质的质量分数为40%)另一瓶为溶质质量分数为10%的溶液。下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.略降低温度 D.室温时,蒸发少量水
二、填空题
15.用“>”“<”“=”填空
(1)50mL酒精与50mL水混合后体积 100mL
(2)50℃时熟石灰的溶解度 20℃时熟石灰的溶解度
(3)20℃时40g氯化钠加入100g水中,充分搅拌,形成溶液的质量 140g.(20℃时氯化钠的溶解度为36g)
(4)20℃时KNO3的溶解度为31.6g,则20℃时其饱和溶液的溶质质量分数 31.6%.
三、实验题
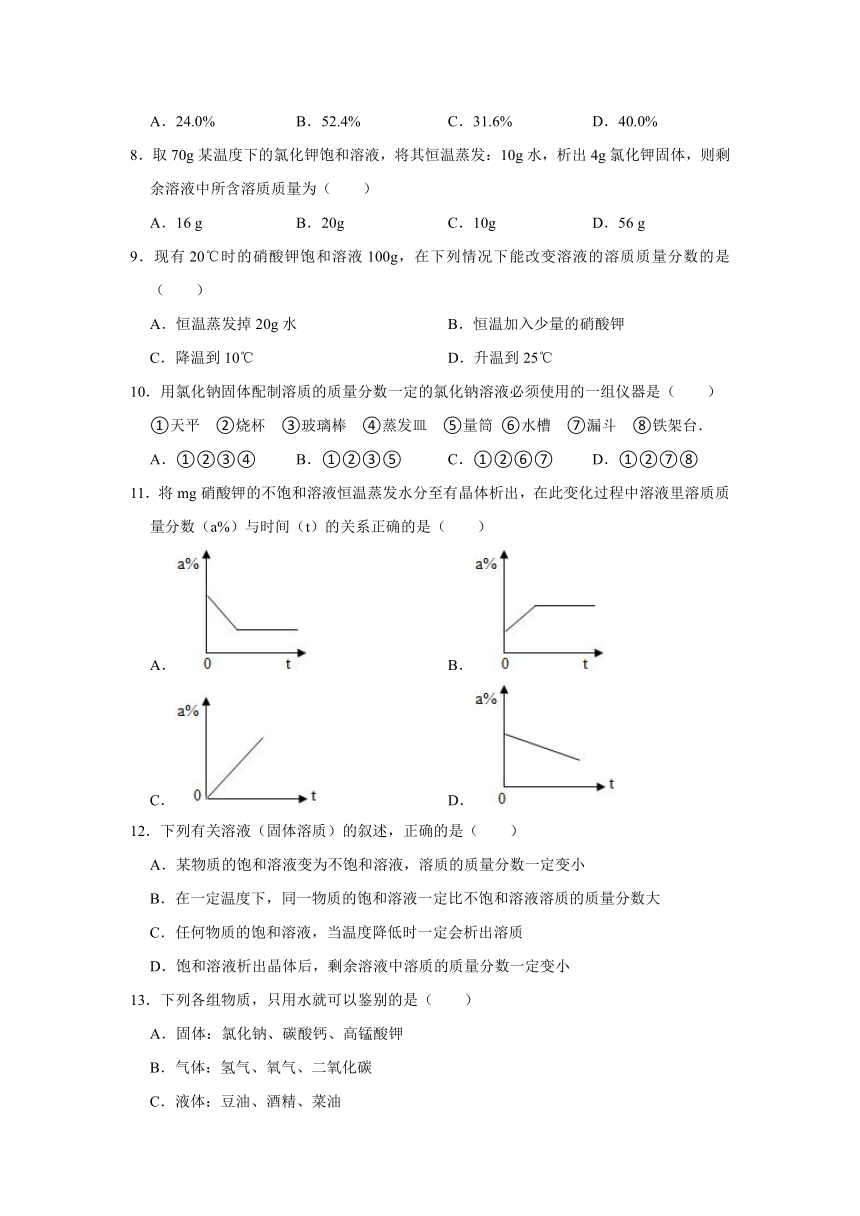
16.为了探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组同学进行如下两组实验。(提示:本实验所用汽油与KMnO4、碘均不发生化学反应)
【实验1】KMnO4晶体在不同溶剂中的溶解实验
根据实验步骤、实验操作图示填写相关实验现象。
实验步骤 实验操作图示 实验操作及现象
步骤1 振荡后静置:(1)A试管中晶体全部溶解,溶液呈 色;B试管中晶体不溶解,汽油不变色。
步骤2 将步骤1中A试管内溶液倒入B试管中,振荡后静置:(2)B试管中观察到的现象为 。
【实验2]碘在不同溶剂中的溶解实验
根据实验操作图示回答相关问题。
实验操作图示 实验结论或解释
(3)由图2所示现象可知:碘 (选填“不”、“微”或“易”)溶于水(4)图3所示试管中液体分层。上层紫红色溶液的名称是 。说明碘在汽油中的溶解性比在水中 (选填“强”或“弱”)
【反思与应用】
(5)①碘易溶于酒精。若【实验2】中汽油用酒精代替,振荡后静置,最终所得液体 (选填“分层”或“不分层”)。
②“从稀碘水中提取碘”是“海带提碘”工艺中的一个重要步骤,其原理类似【实验2]中第二步操作。工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是 。
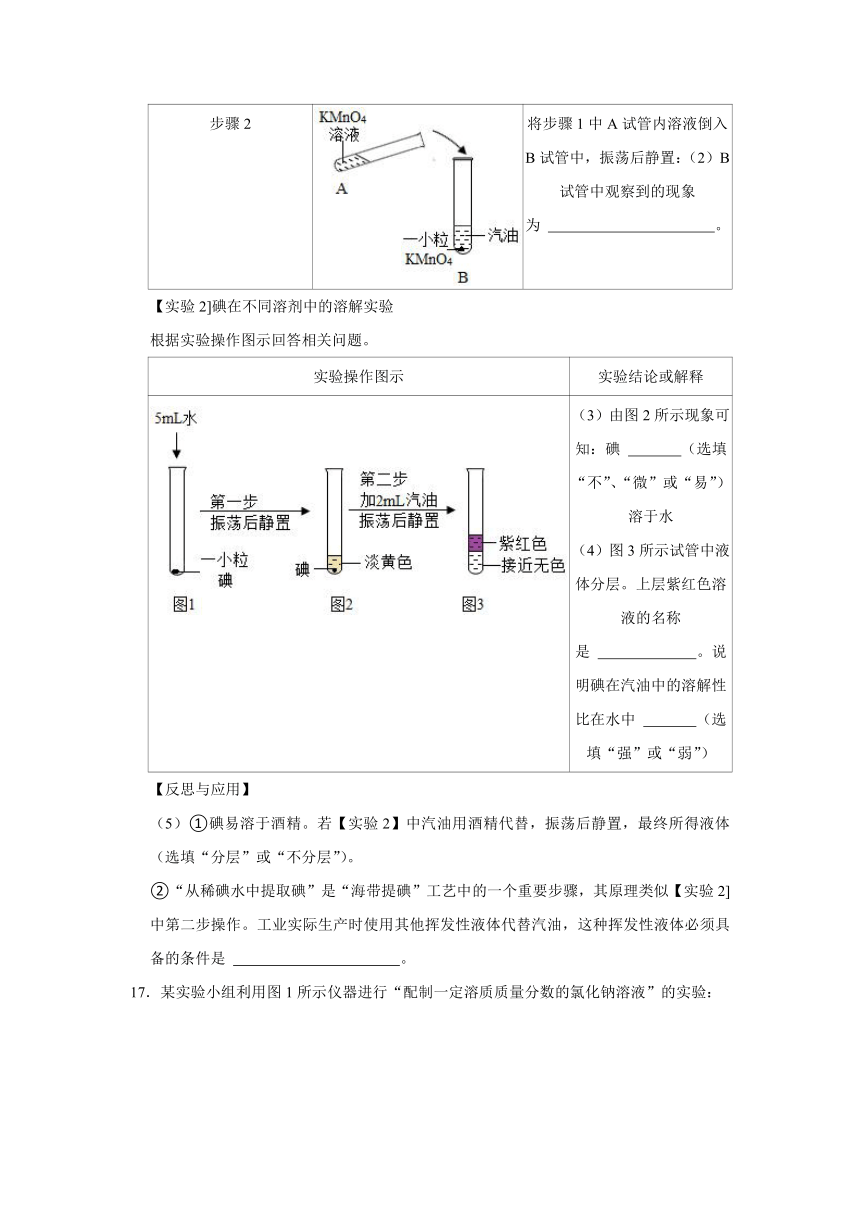
17.某实验小组利用图1所示仪器进行“配制一定溶质质量分数的氯化钠溶液”的实验:
(1)图1中仪器a的名称是 。
(2)完成此实验正确的操作顺序是 (填序号)。
①溶解
②把配好的溶液装入试剂瓶
③称量、量取
④计算
(3)按实验要求,图1中还缺少的玻璃仪器是 (填名称)。
(4)小婧按图2的操作称取氯化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是 ;她称取的氯化钠实际质量为 g。
(5)小民所取蒸馏水的体积如图3所示,则该实验小组原计划配制的氯化钠溶液溶质的质量分数为 (水的密度约为1g/cm3)。
四、计算题
18.某校化学课外活动小组的同学需要一些硫酸做化学实验。现有一瓶未开启的浓硫酸,标签如图所示。请阅读标签上的说明,并通过计算回答下列问题。
化学纯硫酸化学式H2SO4溶质质量分数98.0%密度1.84g/mL体积500mL
若需要配制368.0g19.6%的稀硫酸,应取该浓硫酸多少毫升?加水多少毫升?(计算结果均保留一位小数)
五、解答题
19.在室温条件下,对100mL氯化钠饱和溶液进行如图所示操作:
(1)最终甲、乙两烧杯中溶液一定是饱和溶液的是 。
(2)乙烧杯中溶液在加50mL水的过程中,下列这些量逐渐减小的是 。
①溶质质量
②溶液的浓度
③溶剂的质量
④溶液的密度
20.根据如图氯化钠的溶解度曲线,完成下列问题.
(1)A点所示溶液为某温度下氯化钠的 (选填“饱和”或“不饱和”)溶液.
(2)将C点所示的溶液升高温度到40℃(忽略水的蒸发),
此时溶液中溶质质量分数将 (选填“变大”或“变小”或“不变”).
(3)B点代表20℃时氯化钠的溶解度为36.0g,若将满足B点指标的溶液恒温蒸发10g水,会有 g氯化钠晶体析出.
21.根据氯化钠和硝酸钾的溶解度表,回答下列问题:
10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 70℃
氯化钠 35.8g 36.0g 36.3g 36.6g 37.0g 37.3g 37.8g
硝酸钾 20.9g 31.6g 45.8g 63.9g 85.5g 110g 138g
(1)写出氯化钠和硝酸钾具有相同溶解度时的温度范围(限表中相邻两个温度之间) 。
(2)在50℃时,100g水中加入90g硝酸钾,充分搅拌所得溶液质量为 克。
(3)在10℃时,氯化钠饱和溶液溶质的质量分数 硝酸钾饱和溶液溶质的质量分数。(填“大于”、“等于”或“小于”)
22.已知20℃时,溶质质量分数为20%的某物质,溶液蒸发掉一定量的水后,恰好得到饱和溶液的质量为210g,已知在该温度下,该物质的溶解度为40g,求蒸发掉水的质量.
沪教版九年级下册《第6章 溶解现象》2023年单元测试卷(1)
参考答案与试题解析
一、选择题
1.【分析】根据溶液中溶质分散到溶剂中的形式进行分析。
【解答】解:溶液中的溶质是以分子或离子的形式分散到溶剂中,形成均一、稳定的混合物。
故选:C。
2.【分析】本题考查溶液的概念,在一定条件下溶质分散到溶剂中形成的是均一稳定的混合物。
【解答】解:A、氯化氢气体通入水中,形成均一、稳定的混合物,属于溶液,故A正确;
B、汽油和水混合,形成不均一、不稳定的乳浊液,故B错;
C、二氧化碳通入澄清石灰水中,生成碳酸钙沉淀,形成不均、不稳定的悬浊液,故C错;
D、冰和水的混合物是由一种物质组成,属于纯净物,不属于溶液,故D错。
故选:A。
3.【分析】可以根据具体的操作方法方面进行分析、判断,从而得出正确的结论,将物质完全分散成分子,则物质需要充分分散.
【解答】解:A、在研钵里用杵研磨粒状胆矾使胆矾变为粉末状,不能将物质完全分散成分子。
B、将蔗糖溶于是溶解,水能将蔗糖完全分散成分子。
C、把植物油滴入水中用力振荡形成乳浊液,不能将物质完全分散成分子。
D、加热高锰酸钾是化学反应,生成锰酸钾、二氧化锰和氧气,不能将物质完全分散成分子。
故选:B。
4.【分析】溶液是由至少两种物质组成的均一、稳定的混合物,被分散的物质(溶质)以分子或更小的质点分散于另一物质(溶剂)中。溶液是混合物。
【解答】解:①溶质可以是固体,也可以是液体或气体,故①错;
②碘酒中溶剂是酒精,故②错;
③溶液中溶质可以有一种或多种,故③错;
④溶液是由至少两种物质组成的均一、稳定的混合物,溶液可以有颜色,例如硫酸铜溶液是蓝色,故④错;
⑤溶液可以是固体、液体或气体,故⑤错。
故选:B。
5.【分析】根据溶液导电的原理来分析。
【解答】解:有些溶液能导电是因为溶液中存在着自由移动的离子,接通电源后离子作定向移动;故答案为:C。
6.【分析】根据溶质质量分数的概念来推算:溶质质量除以溶液质量.
【解答】解:
把20看成溶质,100看成溶液,所以溶剂质量为:100﹣20=80,所以溶质、溶剂、溶液之间的质量比是:20:80:100=1:4:5
故选:A。
7.【分析】根据溶解度的概念:每100克水中最多溶解溶质的量.
已知60℃硝酸钾的溶解度为110g,那么可以推知60℃时50克水可以溶解硝酸钾是110g的为55克.现在将60g硝酸钾放入50g水中,显然不可能完全溶解,进行分析解答本题.
【解答】解:已知60℃硝酸钾的溶解度为110g,那么可以推知60℃时50克水可以溶解硝酸钾是110g的为55克。
现在将60g硝酸钾放入50g水中,显然不可能完全溶解,
所以得到的溶液中溶质的质量分数=×100%=×100%≈52.4%;
故选:B。
8.【分析】根据题干中“某温度下的氯化钾饱和溶液”可知,恒温蒸发10g水中最多可溶解4g氯化钾固体;也就是14克该溶液中溶质为4g;根据题意可知:“恒温蒸发10g水,析出4g氯化钾固体”后,剩余饱和溶液的质量为70﹣14=56g,设剩余溶液中溶质的质量为X;最后根据比例关系:=,可计算出x.
【解答】解:由题意“70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体”,则剩余饱和溶液的质量=70﹣10﹣4=56g,设该剩余溶液的溶质的质量为X,由因为“10g水,析出4g氯化钾固体”可知14克该饱和溶液中溶质4克氯化钾固体;根据题意列出如下比例关系:
=
X=16g
故选:A。
9.【分析】饱和溶液中溶质的质量分数可用溶解度来表示,溶质的质量分数=×100%
而同种物质的溶解度只受温度影响,所以当温度不变时,即使蒸发水分,溶质的质量分数也是不变的.所以要使溶质的质量分数改变可用改变温度的方法或加入溶剂的方法.
【解答】解:A、饱和硝酸钾溶液当恒温蒸发水时,因温度没变所以溶解度也没变,故溶质的质量分数不变。
B、恒温向饱和硝酸钾溶液中加硝酸钾时,因溶液饱和所以不再溶解,所以溶质质量分数不变。
C、降低温度可以导致硝酸钾的溶解度降低,从而导致原来20℃饱和溶液会析出硝酸钾,使溶液变稀溶质质量分数变小;
D、当升高温度时,饱和溶液会变为不饱和溶液,但溶液中溶质和溶剂没有变化,所以溶质的质量分数不变。
故选:C。
10.【分析】配制溶液的步骤是计算、称量、溶解,然后由实验步骤分析所需要的仪器.
【解答】解:用氯化钠固体配制溶质的质量分数一定的氯化钠溶液,称量时要用到天平,量取水用到量筒,溶解用到玻璃棒和烧杯;
故选:B。
11.【分析】分析恒温蒸发过程中,不饱和溶液组成的变化,判断变化过程中溶液的溶质质量分数的变化随加蒸发时间的变化情况。将mg硝酸钾的不饱和溶液恒温蒸发水分,直至有晶体析出。在此变化过程中,溶液中溶质质量分数a%并不是从零开始的,随着时间的增加,其溶质质量分数会越来越大,直到有晶体析出、溶液达到饱和时,溶质质量分数达到最大且不再发生改变。
【解答】解:A、溶液中溶质质量分数a%,随着时间的增加,其溶质质量分数会越来越大,而不是减少,故A错误;
B、溶液中溶质质量分数a%,随着时间的增加,其溶质质量分数会越来越大,溶液达到饱和时,溶质质量分数达到最大且不再发生改变,故B正确;
C、溶液中溶质质量分数a%并不是从零开始的,故C错误;
D、溶液中溶质质量分数a%,随着时间的增加,其溶质质量分数会越来越大,而不是减少,故D错误。
故选:B。
12.【分析】饱和溶液是指在一定条件下不能继续溶解某种溶质的溶液,当外界情况发生改变时,饱和溶液会随着出现一些改变:变成不饱和溶液或者析出晶体仍为饱和溶液.
【解答】解:A、饱和溶液变成不饱和溶液有三种方法,一是增加溶剂,二是减少溶液中的溶质,这两种方法都会使溶液的溶质质量分数变小。但第三种方法是改变温度,改变温度时,溶液的组成不变,溶质质量、溶剂质量、溶液质量、溶液的溶质质量分数都不改变,只是通过升高或降低温度改变了溶液的饱和状态。所以溶质的质量分数不是一定会变小,叙述不正确;
B、一定温度下,同一溶质在溶剂中溶解到不能再继续溶解时的溶液称为饱和溶液,因此,对此溶质而言在此温度下,溶液的溶质质量分数达到最大值,大于同温度下同一溶质所形成的任何不饱和溶液的溶质质量分数。叙述正确;
C、饱和溶液降温是否析出晶体取决于该溶液中溶质的溶解度与温度的关系,如果溶质的溶解度随温度升高而减小,降温时溶质的溶解性变大,使饱和溶液变成还能继续溶解该溶质的不饱和溶液,而不是析出晶体。所以叙述不正确;
D、使饱和溶液析出晶体的方法有改变温度、蒸发溶剂等,当改变温度时,溶质析出溶液的溶质质量分数变小,但当恒温蒸发水时,由于溶剂的减少而使饱和溶液析出晶体,但析出晶体后的溶液仍为该温度下的饱和溶液,析出晶体前后溶液的溶质质量分数是不变的。所以叙述错误。
故选:B。
13.【分析】通过每组物质溶于水后的不同现象区分鉴别并判断.
【解答】A、氯化钠可溶于水形成无色溶液,碳酸钙不溶于水,高锰酸钾溶于水溶液为紫红色,能区分故A正确
B、三种气体的物理性质有所不同,但通入水后无明显现象,不能区分故B不正确
C、豆油菜油不能溶于水,酒精能溶于水,不能区分故C不正确
D、三种物质均能溶于水,且都无现象,不能区分故D不正确
故选:A。
14.【分析】(1)在一定的温度下,在一定的溶剂里,不能再溶解某种溶质的溶液就是该种物质的饱和溶液;还能继续溶解的溶液,称为该物质的不饱和溶液;
(2)要想说明溶液是否饱和,必须在温度一定、溶剂的量一定的情况下。
(3)判断溶液是否饱和,可以采用加入少量该溶质看是否溶解。
【解答】解:
A、而各加入少量水振荡,没有现象,所以不能区分这两种溶液,故A错误。
B、向硝酸钾的饱和溶液中各加入少量硝酸钾晶体,振荡。晶体不溶解,而向硝酸钾的不饱和溶液中各加入少量硝酸钾晶体,振荡。晶体溶解。故B正确。
C、硝酸钾的饱和溶液在降低温度时会有晶体析出,不饱和溶液的不会析出晶体,故C正确。
D、蒸发少量水饱和的溶液会有晶体析出,不饱和的不会析出晶体,故D正确。
故选:A。
二、填空题
15.【分析】分子间有间隔,所以将两种溶液混合时,所得溶液的体积,小于两溶液体积之和.氢氧化钙的溶解度随温度的升高而降低.在溶液中增加溶剂时,所加的溶质不一定全部溶解.
【解答】解:(1)分子间有间隔,所以50mL酒精与50mL水混合后体积小于100mL.
(2)熟石灰的溶解度随温度的升高而降低.
(3)20℃时氯化钠的溶解度为36g,所以40g氯化钠加入100g水中,只能溶解36g氯化钠.
(4)饱和溶液中溶质的质量分数可用溶解度表示,所以20℃时硝酸钾的饱和溶液的溶质质量分数为:×100%小于31.6%.
故答案为:
(1)<;
(2)<;
(3)<;
(4)<.
三、实验题
16.【分析】(1)根据高锰酸钾在水中及汽油中的解性分析;
(2)根据汽油的密度比水小结合(1)分析;
(3)根据实验的现象得出结论;
(4)根据溶液命名的方法及实验对比得出结论;
(5)①根据酒精可以和水相互溶解分析现象;
②根据实验的目的结合实验现象回答。
【解答】解:(1)高锰酸钾易溶于水,呈紫(紫红、红)色;故填:紫(紫红、红);
(2)由于高锰酸钾不易溶液汽油,且汽油的密度比水小,因此二者混合后会出现液体分层,上层为无色,下层为紫红色现象,有因为溶液没有达到饱和,因此剩下的高锰酸钾颗粒会继续溶解;故填:液体分层,上层为无色,下层为紫红色,试管底部无固体残留;
(3)由图2所示现象溶液为淡黄色可知碘能溶于水,对比图3可知碘并不是易溶于水,因此用微溶来描述;故填:微;
(4)碘溶于汽油,因此得到的是碘的汽油溶液;根据图2和图3的对比说明碘在汽油中的溶解性比在水中强;故填:碘的汽油溶液;强;
(5)①酒精可以和水相互溶解,因此用酒精代替汽油,就不会出现分层现象;故填:不分层;
②对比碘在酒精和汽油中的溶解及酒精溶于水的现象,可知选择的挥发性液体必须与水相互不溶解,且碘在这种液体中的溶解度远大于在水中的溶解度。这样通过明显的分层现象而得到分离提纯;故填:与水不互溶,碘在这种液体中的溶解度远大于在水中的溶解度。
17.【分析】(1)依据实验图示写出仪器名称;
(2)依据一定溶质质量分数溶液配制的实验步骤分析;
(3)依据一定溶质质量分数溶液配制所需仪器分析;
(4)依据图二信息分析;
(5)依据题中信息计算出该实验小组原计划配制的氯化钠溶液中溶质的质量分数。
【解答】解:(1)分析实验图示可知a为烧杯,b为托盘天平,故答案为:烧杯;
(2)一定溶质质量分数溶液配制的实验步骤是,计算、称量、量取、溶解、装瓶,则完成此实验正确的操作顺序是④③①②,故答案为:④③①②;
(3)一定溶质质量分数溶液配制所需仪器是托盘天平、烧杯、玻璃棒、量筒、胶头滴管、药匙等,则按实验要求,图1中还缺少的玻璃仪器是玻璃棒,故答案为:玻璃棒;
(4)分析图二信息可知,操作中的错误是药品与砝码放反了,她称取的氯化钠实际质量为15.0g﹣3.0g=12.0g,故答案为:药品与砝码放反了;12.0; (5)该实验小组原计划称量氯化钠的质量为18.0g,水的质量为82.0mL×1g/mL=82.0g配制的氯化钠溶液中溶质的质量分数×100%=18.0%,故答案为:18.0%。
四、计算题
18.【分析】根据溶质一定,利用溶质质量分数公式即可计算出应取该浓硫酸的质量,然后根据“体积=质量÷密度”即可计算出应取该浓硫酸的体积,进而计算出水的质量和体积。
【解答】解:需要浓硫酸的质量为:368.0g×19.6%÷98.0%=73.6g;
浓硫酸的体积为:73.6g÷1.84g∕mL=40.0mL;
加水质量为:368.0g﹣73.6g=294.4g,其体积为:294.4g÷1g∕mL=294.4mL。
答:应该取浓硫酸40.0mL;加水294.4mL。
五、解答题
19.【分析】(1)由图所示操作可知,最终甲烧杯中的溶液为原溶液是饱和溶液,乙烧杯中的溶液加入了水是不饱和溶液。
(2)由图所示操作可知,最终甲、乙两烧杯中溶液中溶质质量相同,溶质质量分数不同即甲大乙小,溶剂的质量不同即甲小乙大,温度不变的情况下,溶解度不变,氯化钠密度比水的密度大,溶质质量分数变小,密度变小。
【解答】解:(1)由图所示操作可知,最终甲烧杯中的溶液为原溶液是饱和溶液,乙烧杯中的溶液加入了水是不饱和溶液。故填:甲。
(2)由图所示操作可知,最终甲、乙两烧杯中溶液中溶质质量相同,溶质质量分数不同即甲大乙小,溶剂的质量不同即甲小乙大,温度不变的情况下,溶解度不变,氯化钠密度比水的密度大,溶质质量分数变小,密度变小。故填:②④。
20.【分析】根据题目信息和溶解度曲线可知:氯化钠固体物质的溶解度,都是随温度升高而增大,A点所示溶液为某温度下氯化钠的不饱和溶液;将C点所示的溶液升高温度到40℃,溶液会由饱和变为不饱和溶液,溶质的质量分数不变;20℃时,氯化钠的溶解度为36.0g,设恒温蒸发10g水析出晶体的质量为x,,x=3.6g.
【解答】解:(1)氯化钠固体物质的溶解度,都是随温度升高而增大,A点所示溶液为某温度下氯化钠的不饱和溶液,故答案为:不饱和;
(2)将C点所示的溶液升高温度到40℃,溶液会由饱和变为不饱和溶液,溶质的质量分数不变;故答案为:不变;
(3)20℃时,氯化钠的溶解度为36.0g,设恒温蒸发10g水析出晶体的质量为x,,x=3.6g;故答案为:3.6;
21.【分析】(1)根据在20~30℃时,氯化钠和硝酸钾的溶解度分别为36.0g﹣36.3g、31.6g﹣45.8g,进行分析解答。
(2)根据50℃时,硝酸钾的溶解度为85.5g,进行分析解答。
(3)根据饱和溶液中溶质质量分数=×100%,进行分析解答。
【解答】解:(1)由表中的数据可知,在20~30℃时,氯化钠和硝酸钾的溶解度分别为36.0g﹣36.3g、31.6g﹣45.8g,故20~30℃温度范围内氯化钠、硝酸钾两种物质的溶解度相等。
(2)50℃时,硝酸钾的溶解度为85.5g,100g水中加入90g硝酸钾,最多能溶解85.5g,充分搅拌所得溶液质量为100g+85.5g=185.5g。
(3)饱和溶液中溶质质量分数=×100%,在10℃时,氯化钠的溶解度小于硝酸钾的溶解度,则在10℃时,氯化钠饱和溶液溶质的质量分数大于硝酸钾饱和溶液溶质的质量分数。
故答案为:(1)20~30℃;(2)185.5;(3)大于。
22.【分析】已知20℃时,溶质质量分数为20%的某物质,溶液蒸发掉一定量的水后,恰好得到饱和溶液的质量为210g,由该温度下,该物质的溶解度为40g,可以计算出该饱和溶液中溶质的质量,进而可计算出蒸发掉水的质量.
【解答】解:20℃时,溶质质量分数为20%的某物质,溶液蒸发掉一定量的水后,恰好得到饱和溶液的质量为210g,由该温度下,该物质的溶解度为40g,设得到饱和溶液中溶质的质量为210g×100%=60g.
蒸发前后,溶质的质量不变,设蒸发掉水的质量为x,则(210g+x)×20%=60g,x=90g.
答:蒸发掉水的质量为90g.
一、选择题
1.一种物质溶解于另一种物质时,分散的微粒是( )
A.固体小颗粒 B.细小的液滴 C.分子或离子 D.只有分子
2.下列物质相混合能得到溶液的是( )
A.氯化氢气体通入水中
B.汽油和水混合
C.二氧化碳通入澄清石灰水中
D.冰和水的混合物
3.下列操作能将物质完全分散成分子的是( )
A.在研钵里用杵研磨粒状胆矾
B.将蔗糖溶于水
C.把植物油滴入水中用力振荡
D.加热高锰酸钾
4.下列关于溶液的说法:
①溶质只能是固体;
②溶剂一定是水;
③一种溶液只含一种溶质;
④溶液是无色的纯净物;
⑤溶液一定是液体。
其中错误的是( )
A.①③④ B.①②③④⑤ C.②③④ D.①②③
5.有些溶液能导电是因为溶液中存在着( )
A.自由移动的分子 B.自由移动的原子
C.自由移动的离子 D.自由移动的电子
6.20%的蔗糖溶液中溶质、溶剂、溶液之间的质量比是( )
A.1:4:5 B.5:4:1 C.4:1:5 D.20:80:100
7.已知60℃硝酸钾的溶解度为110克,在该温度下将60克硝酸钾放入50克水中,充分搅拌,则所得溶液中溶质的质量分数约为( )
A.24.0% B.52.4% C.31.6% D.40.0%
8.取70g某温度下的氯化钾饱和溶液,将其恒温蒸发:10g水,析出4g氯化钾固体,则剩余溶液中所含溶质质量为( )
A.16 g B.20g C.10g D.56 g
9.现有20℃时的硝酸钾饱和溶液100g,在下列情况下能改变溶液的溶质质量分数的是( )
A.恒温蒸发掉20g水 B.恒温加入少量的硝酸钾
C.降温到10℃ D.升温到25℃
10.用氯化钠固体配制溶质的质量分数一定的氯化钠溶液必须使用的一组仪器是( )
①天平 ②烧杯 ③玻璃棒 ④蒸发皿 ⑤量筒 ⑥水槽 ⑦漏斗 ⑧铁架台.
A.①②③④ B.①②③⑤ C.①②⑥⑦ D.①②⑦⑧
11.将mg硝酸钾的不饱和溶液恒温蒸发水分至有晶体析出,在此变化过程中溶液里溶质质量分数(a%)与时间(t)的关系正确的是( )
A. B.
C. D.
12.下列有关溶液(固体溶质)的叙述,正确的是( )
A.某物质的饱和溶液变为不饱和溶液,溶质的质量分数一定变小
B.在一定温度下,同一物质的饱和溶液一定比不饱和溶液溶质的质量分数大
C.任何物质的饱和溶液,当温度降低时一定会析出溶质
D.饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定变小
13.下列各组物质,只用水就可以鉴别的是( )
A.固体:氯化钠、碳酸钙、高锰酸钾
B.气体:氢气、氧气、二氧化碳
C.液体:豆油、酒精、菜油
D.固体:氯化钠、氯化钙、氯化镁
14.室温时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质的质量分数为40%)另一瓶为溶质质量分数为10%的溶液。下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.略降低温度 D.室温时,蒸发少量水
二、填空题
15.用“>”“<”“=”填空
(1)50mL酒精与50mL水混合后体积 100mL
(2)50℃时熟石灰的溶解度 20℃时熟石灰的溶解度
(3)20℃时40g氯化钠加入100g水中,充分搅拌,形成溶液的质量 140g.(20℃时氯化钠的溶解度为36g)
(4)20℃时KNO3的溶解度为31.6g,则20℃时其饱和溶液的溶质质量分数 31.6%.
三、实验题
16.为了探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组同学进行如下两组实验。(提示:本实验所用汽油与KMnO4、碘均不发生化学反应)
【实验1】KMnO4晶体在不同溶剂中的溶解实验
根据实验步骤、实验操作图示填写相关实验现象。
实验步骤 实验操作图示 实验操作及现象
步骤1 振荡后静置:(1)A试管中晶体全部溶解,溶液呈 色;B试管中晶体不溶解,汽油不变色。
步骤2 将步骤1中A试管内溶液倒入B试管中,振荡后静置:(2)B试管中观察到的现象为 。
【实验2]碘在不同溶剂中的溶解实验
根据实验操作图示回答相关问题。
实验操作图示 实验结论或解释
(3)由图2所示现象可知:碘 (选填“不”、“微”或“易”)溶于水(4)图3所示试管中液体分层。上层紫红色溶液的名称是 。说明碘在汽油中的溶解性比在水中 (选填“强”或“弱”)
【反思与应用】
(5)①碘易溶于酒精。若【实验2】中汽油用酒精代替,振荡后静置,最终所得液体 (选填“分层”或“不分层”)。
②“从稀碘水中提取碘”是“海带提碘”工艺中的一个重要步骤,其原理类似【实验2]中第二步操作。工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是 。
17.某实验小组利用图1所示仪器进行“配制一定溶质质量分数的氯化钠溶液”的实验:
(1)图1中仪器a的名称是 。
(2)完成此实验正确的操作顺序是 (填序号)。
①溶解
②把配好的溶液装入试剂瓶
③称量、量取
④计算
(3)按实验要求,图1中还缺少的玻璃仪器是 (填名称)。
(4)小婧按图2的操作称取氯化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是 ;她称取的氯化钠实际质量为 g。
(5)小民所取蒸馏水的体积如图3所示,则该实验小组原计划配制的氯化钠溶液溶质的质量分数为 (水的密度约为1g/cm3)。
四、计算题
18.某校化学课外活动小组的同学需要一些硫酸做化学实验。现有一瓶未开启的浓硫酸,标签如图所示。请阅读标签上的说明,并通过计算回答下列问题。
化学纯硫酸化学式H2SO4溶质质量分数98.0%密度1.84g/mL体积500mL
若需要配制368.0g19.6%的稀硫酸,应取该浓硫酸多少毫升?加水多少毫升?(计算结果均保留一位小数)
五、解答题
19.在室温条件下,对100mL氯化钠饱和溶液进行如图所示操作:
(1)最终甲、乙两烧杯中溶液一定是饱和溶液的是 。
(2)乙烧杯中溶液在加50mL水的过程中,下列这些量逐渐减小的是 。
①溶质质量
②溶液的浓度
③溶剂的质量
④溶液的密度
20.根据如图氯化钠的溶解度曲线,完成下列问题.
(1)A点所示溶液为某温度下氯化钠的 (选填“饱和”或“不饱和”)溶液.
(2)将C点所示的溶液升高温度到40℃(忽略水的蒸发),
此时溶液中溶质质量分数将 (选填“变大”或“变小”或“不变”).
(3)B点代表20℃时氯化钠的溶解度为36.0g,若将满足B点指标的溶液恒温蒸发10g水,会有 g氯化钠晶体析出.
21.根据氯化钠和硝酸钾的溶解度表,回答下列问题:
10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 70℃
氯化钠 35.8g 36.0g 36.3g 36.6g 37.0g 37.3g 37.8g
硝酸钾 20.9g 31.6g 45.8g 63.9g 85.5g 110g 138g
(1)写出氯化钠和硝酸钾具有相同溶解度时的温度范围(限表中相邻两个温度之间) 。
(2)在50℃时,100g水中加入90g硝酸钾,充分搅拌所得溶液质量为 克。
(3)在10℃时,氯化钠饱和溶液溶质的质量分数 硝酸钾饱和溶液溶质的质量分数。(填“大于”、“等于”或“小于”)
22.已知20℃时,溶质质量分数为20%的某物质,溶液蒸发掉一定量的水后,恰好得到饱和溶液的质量为210g,已知在该温度下,该物质的溶解度为40g,求蒸发掉水的质量.
沪教版九年级下册《第6章 溶解现象》2023年单元测试卷(1)
参考答案与试题解析
一、选择题
1.【分析】根据溶液中溶质分散到溶剂中的形式进行分析。
【解答】解:溶液中的溶质是以分子或离子的形式分散到溶剂中,形成均一、稳定的混合物。
故选:C。
2.【分析】本题考查溶液的概念,在一定条件下溶质分散到溶剂中形成的是均一稳定的混合物。
【解答】解:A、氯化氢气体通入水中,形成均一、稳定的混合物,属于溶液,故A正确;
B、汽油和水混合,形成不均一、不稳定的乳浊液,故B错;
C、二氧化碳通入澄清石灰水中,生成碳酸钙沉淀,形成不均、不稳定的悬浊液,故C错;
D、冰和水的混合物是由一种物质组成,属于纯净物,不属于溶液,故D错。
故选:A。
3.【分析】可以根据具体的操作方法方面进行分析、判断,从而得出正确的结论,将物质完全分散成分子,则物质需要充分分散.
【解答】解:A、在研钵里用杵研磨粒状胆矾使胆矾变为粉末状,不能将物质完全分散成分子。
B、将蔗糖溶于是溶解,水能将蔗糖完全分散成分子。
C、把植物油滴入水中用力振荡形成乳浊液,不能将物质完全分散成分子。
D、加热高锰酸钾是化学反应,生成锰酸钾、二氧化锰和氧气,不能将物质完全分散成分子。
故选:B。
4.【分析】溶液是由至少两种物质组成的均一、稳定的混合物,被分散的物质(溶质)以分子或更小的质点分散于另一物质(溶剂)中。溶液是混合物。
【解答】解:①溶质可以是固体,也可以是液体或气体,故①错;
②碘酒中溶剂是酒精,故②错;
③溶液中溶质可以有一种或多种,故③错;
④溶液是由至少两种物质组成的均一、稳定的混合物,溶液可以有颜色,例如硫酸铜溶液是蓝色,故④错;
⑤溶液可以是固体、液体或气体,故⑤错。
故选:B。
5.【分析】根据溶液导电的原理来分析。
【解答】解:有些溶液能导电是因为溶液中存在着自由移动的离子,接通电源后离子作定向移动;故答案为:C。
6.【分析】根据溶质质量分数的概念来推算:溶质质量除以溶液质量.
【解答】解:
把20看成溶质,100看成溶液,所以溶剂质量为:100﹣20=80,所以溶质、溶剂、溶液之间的质量比是:20:80:100=1:4:5
故选:A。
7.【分析】根据溶解度的概念:每100克水中最多溶解溶质的量.
已知60℃硝酸钾的溶解度为110g,那么可以推知60℃时50克水可以溶解硝酸钾是110g的为55克.现在将60g硝酸钾放入50g水中,显然不可能完全溶解,进行分析解答本题.
【解答】解:已知60℃硝酸钾的溶解度为110g,那么可以推知60℃时50克水可以溶解硝酸钾是110g的为55克。
现在将60g硝酸钾放入50g水中,显然不可能完全溶解,
所以得到的溶液中溶质的质量分数=×100%=×100%≈52.4%;
故选:B。
8.【分析】根据题干中“某温度下的氯化钾饱和溶液”可知,恒温蒸发10g水中最多可溶解4g氯化钾固体;也就是14克该溶液中溶质为4g;根据题意可知:“恒温蒸发10g水,析出4g氯化钾固体”后,剩余饱和溶液的质量为70﹣14=56g,设剩余溶液中溶质的质量为X;最后根据比例关系:=,可计算出x.
【解答】解:由题意“70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体”,则剩余饱和溶液的质量=70﹣10﹣4=56g,设该剩余溶液的溶质的质量为X,由因为“10g水,析出4g氯化钾固体”可知14克该饱和溶液中溶质4克氯化钾固体;根据题意列出如下比例关系:
=
X=16g
故选:A。
9.【分析】饱和溶液中溶质的质量分数可用溶解度来表示,溶质的质量分数=×100%
而同种物质的溶解度只受温度影响,所以当温度不变时,即使蒸发水分,溶质的质量分数也是不变的.所以要使溶质的质量分数改变可用改变温度的方法或加入溶剂的方法.
【解答】解:A、饱和硝酸钾溶液当恒温蒸发水时,因温度没变所以溶解度也没变,故溶质的质量分数不变。
B、恒温向饱和硝酸钾溶液中加硝酸钾时,因溶液饱和所以不再溶解,所以溶质质量分数不变。
C、降低温度可以导致硝酸钾的溶解度降低,从而导致原来20℃饱和溶液会析出硝酸钾,使溶液变稀溶质质量分数变小;
D、当升高温度时,饱和溶液会变为不饱和溶液,但溶液中溶质和溶剂没有变化,所以溶质的质量分数不变。
故选:C。
10.【分析】配制溶液的步骤是计算、称量、溶解,然后由实验步骤分析所需要的仪器.
【解答】解:用氯化钠固体配制溶质的质量分数一定的氯化钠溶液,称量时要用到天平,量取水用到量筒,溶解用到玻璃棒和烧杯;
故选:B。
11.【分析】分析恒温蒸发过程中,不饱和溶液组成的变化,判断变化过程中溶液的溶质质量分数的变化随加蒸发时间的变化情况。将mg硝酸钾的不饱和溶液恒温蒸发水分,直至有晶体析出。在此变化过程中,溶液中溶质质量分数a%并不是从零开始的,随着时间的增加,其溶质质量分数会越来越大,直到有晶体析出、溶液达到饱和时,溶质质量分数达到最大且不再发生改变。
【解答】解:A、溶液中溶质质量分数a%,随着时间的增加,其溶质质量分数会越来越大,而不是减少,故A错误;
B、溶液中溶质质量分数a%,随着时间的增加,其溶质质量分数会越来越大,溶液达到饱和时,溶质质量分数达到最大且不再发生改变,故B正确;
C、溶液中溶质质量分数a%并不是从零开始的,故C错误;
D、溶液中溶质质量分数a%,随着时间的增加,其溶质质量分数会越来越大,而不是减少,故D错误。
故选:B。
12.【分析】饱和溶液是指在一定条件下不能继续溶解某种溶质的溶液,当外界情况发生改变时,饱和溶液会随着出现一些改变:变成不饱和溶液或者析出晶体仍为饱和溶液.
【解答】解:A、饱和溶液变成不饱和溶液有三种方法,一是增加溶剂,二是减少溶液中的溶质,这两种方法都会使溶液的溶质质量分数变小。但第三种方法是改变温度,改变温度时,溶液的组成不变,溶质质量、溶剂质量、溶液质量、溶液的溶质质量分数都不改变,只是通过升高或降低温度改变了溶液的饱和状态。所以溶质的质量分数不是一定会变小,叙述不正确;
B、一定温度下,同一溶质在溶剂中溶解到不能再继续溶解时的溶液称为饱和溶液,因此,对此溶质而言在此温度下,溶液的溶质质量分数达到最大值,大于同温度下同一溶质所形成的任何不饱和溶液的溶质质量分数。叙述正确;
C、饱和溶液降温是否析出晶体取决于该溶液中溶质的溶解度与温度的关系,如果溶质的溶解度随温度升高而减小,降温时溶质的溶解性变大,使饱和溶液变成还能继续溶解该溶质的不饱和溶液,而不是析出晶体。所以叙述不正确;
D、使饱和溶液析出晶体的方法有改变温度、蒸发溶剂等,当改变温度时,溶质析出溶液的溶质质量分数变小,但当恒温蒸发水时,由于溶剂的减少而使饱和溶液析出晶体,但析出晶体后的溶液仍为该温度下的饱和溶液,析出晶体前后溶液的溶质质量分数是不变的。所以叙述错误。
故选:B。
13.【分析】通过每组物质溶于水后的不同现象区分鉴别并判断.
【解答】A、氯化钠可溶于水形成无色溶液,碳酸钙不溶于水,高锰酸钾溶于水溶液为紫红色,能区分故A正确
B、三种气体的物理性质有所不同,但通入水后无明显现象,不能区分故B不正确
C、豆油菜油不能溶于水,酒精能溶于水,不能区分故C不正确
D、三种物质均能溶于水,且都无现象,不能区分故D不正确
故选:A。
14.【分析】(1)在一定的温度下,在一定的溶剂里,不能再溶解某种溶质的溶液就是该种物质的饱和溶液;还能继续溶解的溶液,称为该物质的不饱和溶液;
(2)要想说明溶液是否饱和,必须在温度一定、溶剂的量一定的情况下。
(3)判断溶液是否饱和,可以采用加入少量该溶质看是否溶解。
【解答】解:
A、而各加入少量水振荡,没有现象,所以不能区分这两种溶液,故A错误。
B、向硝酸钾的饱和溶液中各加入少量硝酸钾晶体,振荡。晶体不溶解,而向硝酸钾的不饱和溶液中各加入少量硝酸钾晶体,振荡。晶体溶解。故B正确。
C、硝酸钾的饱和溶液在降低温度时会有晶体析出,不饱和溶液的不会析出晶体,故C正确。
D、蒸发少量水饱和的溶液会有晶体析出,不饱和的不会析出晶体,故D正确。
故选:A。
二、填空题
15.【分析】分子间有间隔,所以将两种溶液混合时,所得溶液的体积,小于两溶液体积之和.氢氧化钙的溶解度随温度的升高而降低.在溶液中增加溶剂时,所加的溶质不一定全部溶解.
【解答】解:(1)分子间有间隔,所以50mL酒精与50mL水混合后体积小于100mL.
(2)熟石灰的溶解度随温度的升高而降低.
(3)20℃时氯化钠的溶解度为36g,所以40g氯化钠加入100g水中,只能溶解36g氯化钠.
(4)饱和溶液中溶质的质量分数可用溶解度表示,所以20℃时硝酸钾的饱和溶液的溶质质量分数为:×100%小于31.6%.
故答案为:
(1)<;
(2)<;
(3)<;
(4)<.
三、实验题
16.【分析】(1)根据高锰酸钾在水中及汽油中的解性分析;
(2)根据汽油的密度比水小结合(1)分析;
(3)根据实验的现象得出结论;
(4)根据溶液命名的方法及实验对比得出结论;
(5)①根据酒精可以和水相互溶解分析现象;
②根据实验的目的结合实验现象回答。
【解答】解:(1)高锰酸钾易溶于水,呈紫(紫红、红)色;故填:紫(紫红、红);
(2)由于高锰酸钾不易溶液汽油,且汽油的密度比水小,因此二者混合后会出现液体分层,上层为无色,下层为紫红色现象,有因为溶液没有达到饱和,因此剩下的高锰酸钾颗粒会继续溶解;故填:液体分层,上层为无色,下层为紫红色,试管底部无固体残留;
(3)由图2所示现象溶液为淡黄色可知碘能溶于水,对比图3可知碘并不是易溶于水,因此用微溶来描述;故填:微;
(4)碘溶于汽油,因此得到的是碘的汽油溶液;根据图2和图3的对比说明碘在汽油中的溶解性比在水中强;故填:碘的汽油溶液;强;
(5)①酒精可以和水相互溶解,因此用酒精代替汽油,就不会出现分层现象;故填:不分层;
②对比碘在酒精和汽油中的溶解及酒精溶于水的现象,可知选择的挥发性液体必须与水相互不溶解,且碘在这种液体中的溶解度远大于在水中的溶解度。这样通过明显的分层现象而得到分离提纯;故填:与水不互溶,碘在这种液体中的溶解度远大于在水中的溶解度。
17.【分析】(1)依据实验图示写出仪器名称;
(2)依据一定溶质质量分数溶液配制的实验步骤分析;
(3)依据一定溶质质量分数溶液配制所需仪器分析;
(4)依据图二信息分析;
(5)依据题中信息计算出该实验小组原计划配制的氯化钠溶液中溶质的质量分数。
【解答】解:(1)分析实验图示可知a为烧杯,b为托盘天平,故答案为:烧杯;
(2)一定溶质质量分数溶液配制的实验步骤是,计算、称量、量取、溶解、装瓶,则完成此实验正确的操作顺序是④③①②,故答案为:④③①②;
(3)一定溶质质量分数溶液配制所需仪器是托盘天平、烧杯、玻璃棒、量筒、胶头滴管、药匙等,则按实验要求,图1中还缺少的玻璃仪器是玻璃棒,故答案为:玻璃棒;
(4)分析图二信息可知,操作中的错误是药品与砝码放反了,她称取的氯化钠实际质量为15.0g﹣3.0g=12.0g,故答案为:药品与砝码放反了;12.0; (5)该实验小组原计划称量氯化钠的质量为18.0g,水的质量为82.0mL×1g/mL=82.0g配制的氯化钠溶液中溶质的质量分数×100%=18.0%,故答案为:18.0%。
四、计算题
18.【分析】根据溶质一定,利用溶质质量分数公式即可计算出应取该浓硫酸的质量,然后根据“体积=质量÷密度”即可计算出应取该浓硫酸的体积,进而计算出水的质量和体积。
【解答】解:需要浓硫酸的质量为:368.0g×19.6%÷98.0%=73.6g;
浓硫酸的体积为:73.6g÷1.84g∕mL=40.0mL;
加水质量为:368.0g﹣73.6g=294.4g,其体积为:294.4g÷1g∕mL=294.4mL。
答:应该取浓硫酸40.0mL;加水294.4mL。
五、解答题
19.【分析】(1)由图所示操作可知,最终甲烧杯中的溶液为原溶液是饱和溶液,乙烧杯中的溶液加入了水是不饱和溶液。
(2)由图所示操作可知,最终甲、乙两烧杯中溶液中溶质质量相同,溶质质量分数不同即甲大乙小,溶剂的质量不同即甲小乙大,温度不变的情况下,溶解度不变,氯化钠密度比水的密度大,溶质质量分数变小,密度变小。
【解答】解:(1)由图所示操作可知,最终甲烧杯中的溶液为原溶液是饱和溶液,乙烧杯中的溶液加入了水是不饱和溶液。故填:甲。
(2)由图所示操作可知,最终甲、乙两烧杯中溶液中溶质质量相同,溶质质量分数不同即甲大乙小,溶剂的质量不同即甲小乙大,温度不变的情况下,溶解度不变,氯化钠密度比水的密度大,溶质质量分数变小,密度变小。故填:②④。
20.【分析】根据题目信息和溶解度曲线可知:氯化钠固体物质的溶解度,都是随温度升高而增大,A点所示溶液为某温度下氯化钠的不饱和溶液;将C点所示的溶液升高温度到40℃,溶液会由饱和变为不饱和溶液,溶质的质量分数不变;20℃时,氯化钠的溶解度为36.0g,设恒温蒸发10g水析出晶体的质量为x,,x=3.6g.
【解答】解:(1)氯化钠固体物质的溶解度,都是随温度升高而增大,A点所示溶液为某温度下氯化钠的不饱和溶液,故答案为:不饱和;
(2)将C点所示的溶液升高温度到40℃,溶液会由饱和变为不饱和溶液,溶质的质量分数不变;故答案为:不变;
(3)20℃时,氯化钠的溶解度为36.0g,设恒温蒸发10g水析出晶体的质量为x,,x=3.6g;故答案为:3.6;
21.【分析】(1)根据在20~30℃时,氯化钠和硝酸钾的溶解度分别为36.0g﹣36.3g、31.6g﹣45.8g,进行分析解答。
(2)根据50℃时,硝酸钾的溶解度为85.5g,进行分析解答。
(3)根据饱和溶液中溶质质量分数=×100%,进行分析解答。
【解答】解:(1)由表中的数据可知,在20~30℃时,氯化钠和硝酸钾的溶解度分别为36.0g﹣36.3g、31.6g﹣45.8g,故20~30℃温度范围内氯化钠、硝酸钾两种物质的溶解度相等。
(2)50℃时,硝酸钾的溶解度为85.5g,100g水中加入90g硝酸钾,最多能溶解85.5g,充分搅拌所得溶液质量为100g+85.5g=185.5g。
(3)饱和溶液中溶质质量分数=×100%,在10℃时,氯化钠的溶解度小于硝酸钾的溶解度,则在10℃时,氯化钠饱和溶液溶质的质量分数大于硝酸钾饱和溶液溶质的质量分数。
故答案为:(1)20~30℃;(2)185.5;(3)大于。
22.【分析】已知20℃时,溶质质量分数为20%的某物质,溶液蒸发掉一定量的水后,恰好得到饱和溶液的质量为210g,由该温度下,该物质的溶解度为40g,可以计算出该饱和溶液中溶质的质量,进而可计算出蒸发掉水的质量.
【解答】解:20℃时,溶质质量分数为20%的某物质,溶液蒸发掉一定量的水后,恰好得到饱和溶液的质量为210g,由该温度下,该物质的溶解度为40g,设得到饱和溶液中溶质的质量为210g×100%=60g.
蒸发前后,溶质的质量不变,设蒸发掉水的质量为x,则(210g+x)×20%=60g,x=90g.
答:蒸发掉水的质量为90g.
