2024沪教版化学九年级下学期课时练--期末素养综合测试(一)
文档属性
| 名称 | 2024沪教版化学九年级下学期课时练--期末素养综合测试(一) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 17:01:44 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024沪教版化学九年级下学期
期末素养综合测试(一)
满分120分,限时100分钟
一、选择题(每小题3分,共36分)
1.(2023河南中考)庄稼一枝花,全靠肥当家。碳酸氢铵(化学式为NH4HCO3)属于 ( )
A.复合肥 B.磷肥
C.钾肥 D.氮肥
2.【新独家原创】2023年7月16日,我国东航在上海正式接收第二架国产C919大型客机,标志着东航商业运营C919大型客机正在提速。下列飞机使用的化学材料中,属于有机合成材料的是 ( )
A.玻璃钢 B.钛合金
C.合成橡胶 D.玻璃
3.【新素材·清洁环保】(2023江苏徐州二模改编)一城青山半城湖,徐州发展既要金山银山,又要绿水青山。下列说法正确的是 ( )
A.废旧金属的回收利用可以节约资源,减少污染
B.欢度节日时,大量燃放烟花爆竹
C.露天烧垃圾是科学方便的垃圾处理方式
D.农业上过量使用农药和化肥可提高农作物产量
4.(2023内蒙古赤峰中考)库水经净化后,成为自来水走进千家万户。下面是人们生活用水的四个情景,其中描述错误的是 ( )
A.为长辈沏茶:茶叶悬浮水中形成的混合物是溶液
B.帮妈妈洗碗:向水中加入的洗洁精可以乳化油污
C.给花草浇水:水是植物进行光合作用的原料之一
D.给鱼缸换水:水中生物靠溶解在水中的氧气呼吸
5.(2023河北魏县一模)青少年正处于身体发育阶段,应关注营养与健康。下列说法错误的是 ( )
A.常喝牛奶可以补充钙元素 B.霉变大米洗净、煮熟后可以食用
C.合理摄入油脂有益身体健康 D.食用蔬菜可以补充维生素
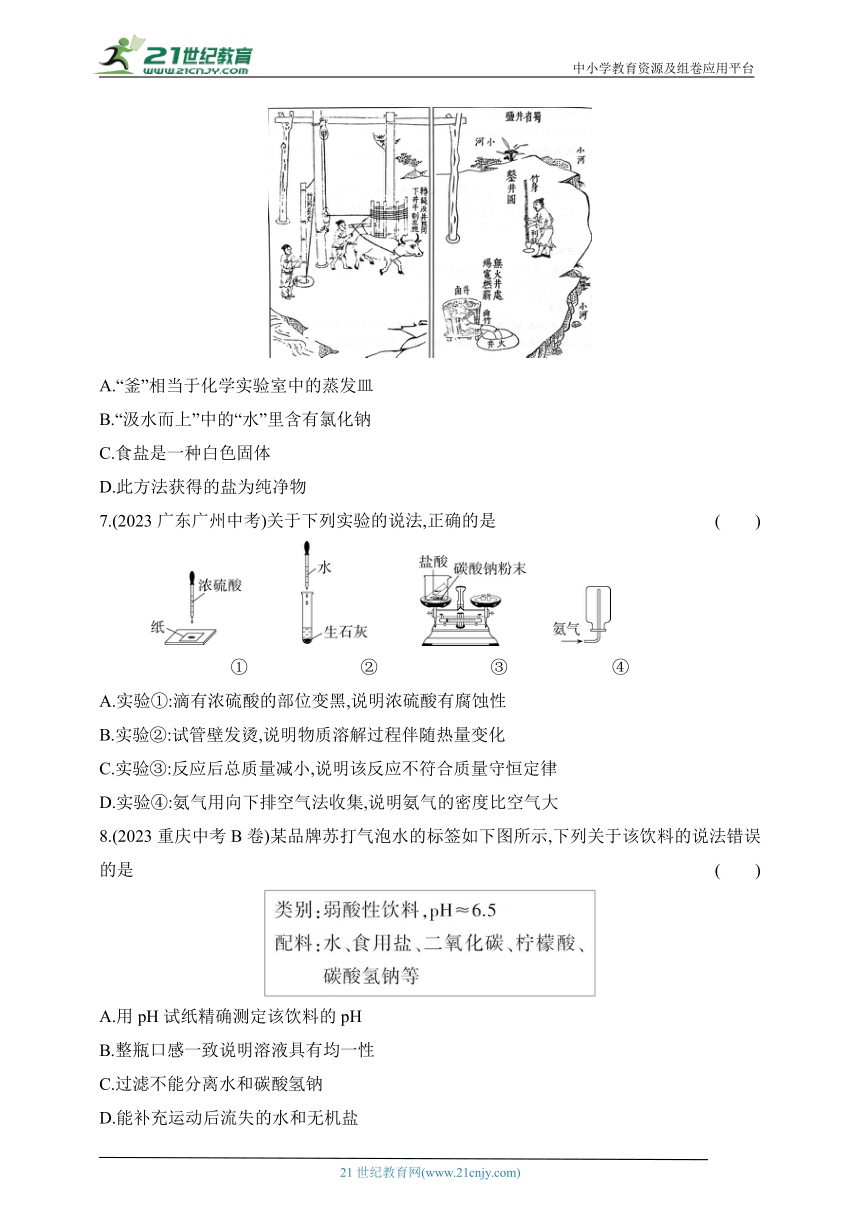
6.【新素材·传统工艺】(2023云南昆明三模)《天工开物》中记载了我省古代劳动人民制盐的过程:“凡滇、蜀两省,远离海滨……多可造井取盐……牛拽盘转,辘轳绞,汲水而上。入于釜中煎炼,顷刻结盐,色成至白。”下列说法不正确的是 ( )
A.“釜”相当于化学实验室中的蒸发皿
B.“汲水而上”中的“水”里含有氯化钠
C.食盐是一种白色固体
D.此方法获得的盐为纯净物
7.(2023广东广州中考)关于下列实验的说法,正确的是 ( )
① ② ③ ④
A.实验①:滴有浓硫酸的部位变黑,说明浓硫酸有腐蚀性
B.实验②:试管壁发烫,说明物质溶解过程伴随热量变化
C.实验③:反应后总质量减小,说明该反应不符合质量守恒定律
D.实验④:氨气用向下排空气法收集,说明氨气的密度比空气大
8.(2023重庆中考B卷)某品牌苏打气泡水的标签如下图所示,下列关于该饮料的说法错误的是 ( )
A.用pH试纸精确测定该饮料的pH
B.整瓶口感一致说明溶液具有均一性
C.过滤不能分离水和碳酸氢钠
D.能补充运动后流失的水和无机盐
9.(2023江苏徐州二模)下列鉴别方法、现象、结论均正确的是 ( )
选项 鉴别对象 方法、现象、结论
A 硬水和软水 取样,分别滴加肥皂水,振荡,泡沫多,浮渣少的为硬水
B 羊毛线和棉纱线 取样,分别灼烧,有烧焦羽毛气味的是棉纱线
C 淀粉和葡萄糖 取样,分别滴加碘水,呈现蓝色的是淀粉
D 氢氧化钠和硝酸铵 取样,加水溶解,用手触摸烧杯壁,发烫的是硝酸铵
10.(2023广西中考)甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法一定正确的是 ( )
A.t3 ℃时,等质量的甲、乙、丙的溶液降温到t1 ℃时,析出晶体最多的是甲的溶液
B.t2 ℃时,将25 g乙加入50 g水中,再降温到t1 ℃,所得溶液的溶质质量分数约为33.3%
C.t1 ℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙
D.t1 ℃时,甲、乙、丙的饱和溶液中,所含溶质的质量大小关系为乙>甲=丙
11.(2023江苏兴化一模)下列各组物质的溶液,不另加试剂不能鉴别的一组是 ( )
A.MgCl2、NaOH、Cu(NO3)2、NaNO3
B.CuCl2、Na2SO4、Ba(OH)2、MgCl2
C.AgNO3、HCl、Na2CO3、CaCl2
D.NaOH、FeCl3、HCl、NaCl
12.(2023江苏镇江月考)烧杯中盛有4.0 g MgO,向其中逐滴滴加100.0 g稀硫酸,然后再在溶液中滴加Ba(OH)2溶液,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法正确的是 ( )
A.a点对应的溶液中有2种溶质
B.b点对应的固体中有Mg(OH)2和BaSO4
C.m=31.43
D.H2SO4在原溶液中的溶质质量分数约为9.8%
二、填空题(共42分)
13.[含评分说明](2023江苏常州天宁调研)(4分)请选择下列相应物质的序号填空。
①聚乙烯 ②聚氯乙烯 ③小苏打
④稀盐酸 ⑤熟石灰
(1)能用于改良酸性土壤的是 。
(2)常用于制作食品保鲜膜的是 。
(3)胃里含有的能助消化的物质是 。
(4)常用于厨房中烘焙糕点的是 。
14.[含评分说明]【新素材·清洁环保】(2023辽宁抚顺本溪辽阳中考)(4分)《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转变。如图是不同年份中世界能源占比结构图,请回答下列问题。
(1)比较2015、2030、2050年能源结构,化石能源占比日益减少的是 。
(2)天然气是比较清洁的能源,其主要成分燃烧的化学方程式为 。
(3)人们正在利用和开发的新能源有
(写一种)。
(4)减少CO2排放已成为全球共识。下列做法符合低碳理念的是
(填字母)。
A.随手关灯
B.节约用纸
C.多使用一次性木筷
15.(2023天津中考)(12分)溶液与人类的生产、生活密切相关。
(1)厨房中的下列物质分别放入水中,能形成溶液的是 (填字母)。
A.白糖 B.花生油 C.面粉
(2)如图为硝酸钾和氯化钠的溶解度曲线示意图。
①t1 ℃时,将40 g硝酸钾加入100 g水中,充分搅拌,形成
(填“饱和”或“不饱和”)溶液;
②P点表示t1 ℃时,硝酸钾的溶解度 (填“大于”“等于”或“小于”)氯化钠的溶解度;
③将t2 ℃时一定质量的硝酸钾饱和溶液降温到t1 ℃,所得溶液的溶质质量分数 (填“增大”“不变”或“减小”)。
(3)在实验室配制一定溶质质量分数的氯化钠溶液,需要用到的玻璃仪器有:试剂瓶、烧杯、 、量筒、胶头滴管。
(4)20 ℃时,向40 g溶质质量分数为20%的氯化钠溶液中加入68 g 水,若得到该温度下氯化钠的饱和溶液,至少需要再加入 g氯化钠固体。(20 ℃时,氯化钠的溶解度为36 g)
16.[含评分说明]【学科素养·科学思维】(2023新疆中考)(14分)盐酸和碳酸钠是重要的化工产品,也是实验室中重要的化学试剂。
(1)增大压强,HCl由气态变为液态,原因是分子的 发生了改变。
(2)碳酸钠俗称 ,属于 (填“酸”“碱”或“盐”),广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
(3)在盐酸中加入一定量碳酸钠固体充分反应。
①此反应的现象是 。
②如图表示该反应前后溶液中存在的主要离子,用pH试纸测定反应后溶液的酸碱度,pH (填“>”“=”或“<”)7。反应后的图中R代表的离子是 。
(4)下列物质中能与盐酸发生反应的是 (填字母)。
A.Pb B.NaHCO3 C.KOH
D.NaNO3 E.Al2O3
17.[含评分说明]【模型法解题】(2023江苏扬州中考节选)(8分)以工业副产品石膏(主要成分是CaSO4)为原料可制备CaCO3。CaCO3有球霰石、方解石等多种形态,其中球霰石广泛应用于油墨、生物材料等领域。
(1)制备CaCO3时,将石膏与水配成悬浊液,再向其中通入NH3、CO2(不考虑石膏中杂质的反应)。
①配制悬浊液时,保持温度不变,为使石膏充分分散在水中,可采取的措施是 、 。
②制备时温度不宜过高,原因是
。
③制备可看作是(NH4)2CO3与CaSO4发生复分解反应,(NH4)2CO3与CaSO4反应生成CaCO3的化学方程式为
。理论上参加反应的CO2与NH3的质量比为 。
(2)反应生成的CaCO3中球霰石与方解石的质量分数与反应时间的关系如图1所示。由图示信息得出的结论是
。
(3)反应时加入某表面活性剂可增加产物中球霰石的含量。该表面活性剂一端带正电荷,另一端为排斥水分子的疏水基团,可与球霰石形成两种吸附作用,如图2所示。
①两种吸附分别为离子对吸附和离子交换吸附。离子对吸附:球霰石表面的C带负电,表面活性剂通过带正电的一端吸附于球霰石表面;离子交换吸附:球霰石表面的Ca2+带正电,表面活性剂中带正电的一端可取代球霰石表面的Ca2+,并吸附于球霰石表面。图2中表示离子对吸附的是 (填“A”或“B”)。
②有研究认为,球霰石转化为方解石经历了球霰石溶解、再沉淀为方解石的过程。表面活性剂能增加产物中球霰石的含量,原因是 。
三、实验探究题(共14分)
18.[含评分说明](2023山东烟台中考)(14分)欲证明“CO2与NaOH能发生化学反应”,
图1
某化学兴趣小组进行了以下探究实验(实验装置中夹持仪器、电脑均已略去)。
实验一:小亮同学按图1所示装置进行实验。
实验前U形管两端液面相平。将NaOH溶液滴入试管中,待反应后恢复到室温,U形管中的液面左高右低。
(1)小亮同学根据U形管中液面高度变化得出结论:CO2与NaOH发生了化学反应,该反应的化学方程式是 。
(2)小明认为仅凭U形管中液面高度变化,不足以得出“CO2与NaOH发生了化学反应”的结论,理由是
。
实验二:为获得充足的证据,兴趣小组设计了图2所示装置进行实验探究,并利用压强传感器测定实验过程中三颈瓶内压强的变化。
图2
按图2所示,打开压强传感器,观察到三颈瓶内初始压强为101 kPa,将滴有酚酞试液的适量氢氧化钠溶液快速推入瓶内,振荡充分反应。待压强不再减小后,再将适量的稀盐酸快速推入瓶内,振荡充分反应。待压强不再增大后,将两个注射器活塞先后拉回原位(不进行活塞操作时,活塞不能自主移动)。瓶内压强变化如图3所示。
(3)滴有酚酞试液的NaOH溶液呈 色。
(4)向瓶内推入适量稀盐酸后,能证明CO2与NaOH已发生了反应的现象是 ,产生此现象的反应的化学方程式是 。
(5)图3中, (填序号)的压强比初始压强低,说明瓶内的水能吸收CO2。
①CD段 ②DE段 ③MN段
(6)图3中,DE段压强远低于MN段压强,能够说明
。
四、计算题(共8分)
19.[含评分说明](2023江苏徐州二模)(8分)化学兴趣小组的同学为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液于烧杯中,向烧杯中不断滴加MgSO4溶液,边滴加边搅拌,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,当加入80克MgSO4溶液时,两者恰好完全反应。请回答:
(1)恰好完全反应时生成沉淀的质量为 克。
(2)原BaCl2溶液的溶质质量分数是多少 (写出计算过程)
答案全解全析
1.D 碳酸氢铵(化学式为NH4HCO3)中含有氮元素,属于氮肥。
2.C 玻璃钢是由玻璃纤维和合成材料复合而成的,属于复合材料;钛合金属于金属材料;合成橡胶属于有机合成材料;玻璃属于无机材料。
3.A 大量燃放烟花爆竹会产生有害气体和烟尘,污染空气,B错误;露天烧垃圾会产生大量的烟尘和有害气体,加重空气污染,C错误;农业上过量使用农药和化肥会造成水体污染、土壤污染,D错误。
4.A 茶叶不溶于水,茶叶悬浮在水中形成的混合物是悬浊液,A不正确。
5.B 霉变的大米中含有黄曲霉毒素,黄曲霉毒素有毒,洗净煮熟后也不能食用,故B不正确。
6.D 由“入于釜中煎炼,顷刻结盐”可知,该操作过程相当于蒸发结晶,则“釜”相当于化学实验室中的蒸发皿,A正确;“汲水而上”中的“水”里含有氯化钠,B正确;食盐是一种白色固体,C正确;此方法获得的盐还含有很多可溶性杂质,属于混合物,D错误。
7.A 生石灰和水反应放热,不能说明物质溶解过程放热,B错误;一切化学反应均遵守质量守恒定律,实验③中反应后总质量减小,是因为碳酸钠和盐酸反应生成的二氧化碳气体从烧杯中逸出,C错误;向下排空气法适用于收集密度比空气小的气体,D错误。
8.A pH试纸只能粗略测定溶液的pH,A错误;溶液具有均一性,因此整瓶口感一致,B正确;碳酸氢钠可溶于水,过滤不能分离水和碳酸氢钠,故C正确;饮料中含有食用盐、水、碳酸氢钠等,可以补充运动后流失的水和无机盐,D正确。
9.C 取样,分别滴加肥皂水,振荡,泡沫少、浮渣多的为硬水,反之则为软水,A错误;取样,分别灼烧,有烧焦羽毛气味的是羊毛线,有烧纸气味的是棉纱线,B错误;氢氧化钠溶于水放热,硝酸铵溶于水吸热,取样,加水溶解,用手触摸烧杯壁,发烫的是氢氧化钠,发凉的是硝酸铵,D错误。
10.C 由于没有指明t3 ℃时甲、乙、丙溶液是否饱和,故将等质量的甲、乙、丙的溶液降温到t1 ℃,析出晶体质量的多少无法判断,故A错误;t2 ℃时,乙的溶解度为50 g,将25 g乙加入50 g水中,恰好形成饱和溶液,所得溶液的溶质质量分数为×100%≈33.3%,乙物质的溶解度随温度的降低而减小,将所得溶液降温到t1 ℃,有晶体析出,所得溶液的溶质质量分数小于33.3%,故B错误;t1 ℃时,甲、乙、丙三种物质的溶解度大小关系为乙>甲=丙,t1 ℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙,故C正确;由于没有指明t1 ℃时甲、乙、丙饱和溶液的质量,因此t1 ℃时,甲、乙、丙的饱和溶液中,无法比较所含溶质的质量大小关系,故D错误。
11.B 首先鉴别出蓝色的氯化铜溶液,当加入剩余的三种物质后,产生蓝色沉淀的为氢氧化钡溶液,将氢氧化钡溶液加入剩余的两种物质中,均产生白色沉淀,不能区分硫酸钠和氯化镁。
12.C a点发生的反应为MgO+H2SO4 MgSO4+H2O,a点滴加的硫酸全部反应,此时溶液中的溶质只有硫酸镁,A错误;b点是剩余的硫酸与氢氧化钡反应生成硫酸钡和水,且到c点时硫酸才消耗完,因此b点对应固体为硫酸钡,B错误;cd段,硫酸镁与氢氧化钡反应生成氢氧化镁沉淀和硫酸钡沉淀,由质量守恒定律可知,整个反应过程中镁元素的质量不变,为4.0 g×=2.4 g,则氢氧化镁的质量为2.4 g÷=5.8 g,cd段生成硫酸钡的质量为×233=23.3 g,m=2.33+5.8+23.3=31.43,C正确;硫酸中溶质的质量为2.33 g×+4.0 g×=10.78 g,所以H2SO4在原溶液中的溶质质量分数为×100%=10.78%,D错误。
13.(1)⑤ (2)① (3)④ (4)③
【评分说明】书写化学式或名称均不给分。
解析 (1)熟石灰是一种碱,能与酸性物质反应,能用于改良酸性土壤。(2)聚乙烯无毒,常用于制作食品保鲜膜。(3)胃里含有的能助消化的物质是稀盐酸。(4)小苏打受热时会分解产生二氧化碳气体,常用于厨房中烘焙糕点。
14.(1)煤炭、石油 (2)CH4+2O2 CO2+2H2O (3)太阳能(合理即可) (4)AB
【评分说明】(1)错写、漏写均不给分。(2)化学方程式未标注条件或未配平或误标“↑”均不给分。(3)“太阳能”“风能”“地热能”等合理答案均给分。(4)错选、漏选均不给分。
解析 (2)天然气的主要成分是甲烷,甲烷与氧气在点燃条件下反应生成二氧化碳和水。(3)目前人们正在利用和开发的新能源有太阳能、核能、风能、地热能、潮汐能、生物质能等。(4)随手关灯和节约用纸均符合低碳理念;多使用一次性木筷不符合低碳理念。
15.(1)A (2)①饱和 ②等于 ③减小 (3)玻璃棒 (4)28
解析 (1)白糖易溶于水,放入水中能形成溶液。(2)①t1 ℃时,硝酸钾的溶解度小于40 g,则t1 ℃时,将40 g硝酸钾加入100 g水中,充分搅拌,形成饱和溶液。②P点是硝酸钾和氯化钠溶解度曲线的交点,P点表示t1 ℃时,硝酸钾的溶解度等于氯化钠的溶解度。③将t2 ℃时一定质量的硝酸钾饱和溶液降温到t1 ℃,硝酸钾的溶解度减小,其溶液会析出硝酸钾晶体,故所得溶液的溶质质量分数减小。(4)设至少需要再加入氯化钠固体的质量为x,,则x=28 g,即至少需要再加入28 g氯化钠固体。
16.(1)间隔 (2)纯碱(或苏打) 盐 (3)①固体逐渐溶解,有气泡产生 ②< Na+ (4)ABCE
【评分说明】(1)填“间隔”“间隙”均给分。(2)填“纯碱”或“苏打”均给分。(4)错选、漏选均不给分。
解析 (2)碳酸钠俗称纯碱或苏打,由金属阳离子和酸根阴离子构成,属于盐。(3)①碳酸钠和稀盐酸反应会生成二氧化碳气体,故现象为固体逐渐溶解,有气泡产生。②根据图示,反应后的溶液中盐酸有剩余,则溶液显酸性,则pH<7;氯化钠由钠离子和氯离子构成,所以反应后的图中R代表的离子是Na+。(4)Pb能和稀盐酸反应生成氯化铅和氢气;NaHCO3和稀盐酸反应生成氯化钠、水和二氧化碳;KOH与稀盐酸反应生成氯化钾和水;NaNO3和稀盐酸互相交换成分无沉淀、气体或水生成,不能发生反应;Al2O3和稀盐酸反应生成氯化铝和水。
17.(1)①粉碎石膏 搅拌(合理即可) ②温度过高,氨气和二氧化碳的溶解度小,影响产率 ③(NH4)2CO3+CaSO4 CaCO3↓+(NH4)2SO4 22∶17 (2)在一定条件下,随着反应时间的增加,碳酸钙的球霰石形态会转化为方解石形态(合理即可) (3)①A ②表面活性剂通过两种吸附作用覆盖在球霰石表面,阻碍球霰石的溶解(合理即可)
【评分说明】(1)①答案合理均给分。③化学方程式中化学式书写错误、未标注“↓”均不给分,。(2)表述合理均给分。(3)②表述合理均给分。
解析 (1)②制备时温度不宜过高,原因是氨气和二氧化碳的溶解度随温度的升高而减小,影响产率。③碳酸铵与硫酸钙反应生成碳酸钙和硫酸铵;氨气、二氧化碳和水反应生成碳酸铵,化学方程式为2NH3+CO2+H2O (NH4)2CO3,即理论上参加反应的二氧化碳与氨气的质量比为44∶(17×2)=22∶17。(2)由题图1可知,在一定条件下,随着反应的进行,方解石的质量分数逐渐增大,球霰石的质量分数逐渐减小,故可得出结论:在一定条件下,随着反应时间的增加,碳酸钙的球霰石形态会转化为方解石形态。(3)①由题干信息可知,离子对吸附是表面活性剂通过带正电的一端吸附于球霰石表面,因为球霰石表面的碳酸根离子带负电,故表示离子对吸附的是A。
18.(1)CO2+2NaOH Na2CO3+H2O (2)CO2能溶于水且能与水反应 (3)红 (4)有气泡生成 Na2CO3+2HCl 2NaCl+CO2↑+H2O (5)③ (6)CO2和NaOH溶液发生了化学反应
【评分说明】(1)化学方程式中化学式书写错误或未配平均不给分。(4)化学方程式中化学式书写错误或未配平均不给分,未标注“↑”扣1分。
解析 (1)CO2与NaOH发生反应生成碳酸钠和水。(2)CO2溶于水且与水反应也会造成试管内气体减少,气压变小,使U形管内液面左高右低。(3)NaOH溶液显碱性,能使酚酞试液变红。(4)Na2CO3和稀盐酸发生反应生成CO2气体,能证明CO2与NaOH发生了反应的现象为有气泡产生。(5)MN段压强低于初始压强,证明水能吸收CO2。(6)DE段的压强远低于MN段,证明CO2与NaOH溶液发生了化学反应。
19.(1)23.3 (1分)
(2)解:设原BaCl2溶液的溶质质量分数为x。 (1分)
BaCl2+MgSO4 BaSO4↓+MgCl2 (2分)
208 233
100 g×x 23.3 g (1分) (1分)
x=20.8% (2分)
答:原BaCl2溶液的溶质质量分数为20.8%。
【评分说明】解、设、答共1分,计算过程及结果未写单位或单位错,扣1分(不重复扣分);因相对分子质量计算错误导致结果错误,不给分;其他解法,合理均给分。
解析 (1)完全反应生成沉淀的质量为80 g+100 g-156.7 g=23.3 g。(2)根据生成沉淀的质量和化学方程式可计算原BaCl2溶液的溶质质量分数。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024沪教版化学九年级下学期
期末素养综合测试(一)
满分120分,限时100分钟
一、选择题(每小题3分,共36分)
1.(2023河南中考)庄稼一枝花,全靠肥当家。碳酸氢铵(化学式为NH4HCO3)属于 ( )
A.复合肥 B.磷肥
C.钾肥 D.氮肥
2.【新独家原创】2023年7月16日,我国东航在上海正式接收第二架国产C919大型客机,标志着东航商业运营C919大型客机正在提速。下列飞机使用的化学材料中,属于有机合成材料的是 ( )
A.玻璃钢 B.钛合金
C.合成橡胶 D.玻璃
3.【新素材·清洁环保】(2023江苏徐州二模改编)一城青山半城湖,徐州发展既要金山银山,又要绿水青山。下列说法正确的是 ( )
A.废旧金属的回收利用可以节约资源,减少污染
B.欢度节日时,大量燃放烟花爆竹
C.露天烧垃圾是科学方便的垃圾处理方式
D.农业上过量使用农药和化肥可提高农作物产量
4.(2023内蒙古赤峰中考)库水经净化后,成为自来水走进千家万户。下面是人们生活用水的四个情景,其中描述错误的是 ( )
A.为长辈沏茶:茶叶悬浮水中形成的混合物是溶液
B.帮妈妈洗碗:向水中加入的洗洁精可以乳化油污
C.给花草浇水:水是植物进行光合作用的原料之一
D.给鱼缸换水:水中生物靠溶解在水中的氧气呼吸
5.(2023河北魏县一模)青少年正处于身体发育阶段,应关注营养与健康。下列说法错误的是 ( )
A.常喝牛奶可以补充钙元素 B.霉变大米洗净、煮熟后可以食用
C.合理摄入油脂有益身体健康 D.食用蔬菜可以补充维生素
6.【新素材·传统工艺】(2023云南昆明三模)《天工开物》中记载了我省古代劳动人民制盐的过程:“凡滇、蜀两省,远离海滨……多可造井取盐……牛拽盘转,辘轳绞,汲水而上。入于釜中煎炼,顷刻结盐,色成至白。”下列说法不正确的是 ( )
A.“釜”相当于化学实验室中的蒸发皿
B.“汲水而上”中的“水”里含有氯化钠
C.食盐是一种白色固体
D.此方法获得的盐为纯净物
7.(2023广东广州中考)关于下列实验的说法,正确的是 ( )
① ② ③ ④
A.实验①:滴有浓硫酸的部位变黑,说明浓硫酸有腐蚀性
B.实验②:试管壁发烫,说明物质溶解过程伴随热量变化
C.实验③:反应后总质量减小,说明该反应不符合质量守恒定律
D.实验④:氨气用向下排空气法收集,说明氨气的密度比空气大
8.(2023重庆中考B卷)某品牌苏打气泡水的标签如下图所示,下列关于该饮料的说法错误的是 ( )
A.用pH试纸精确测定该饮料的pH
B.整瓶口感一致说明溶液具有均一性
C.过滤不能分离水和碳酸氢钠
D.能补充运动后流失的水和无机盐
9.(2023江苏徐州二模)下列鉴别方法、现象、结论均正确的是 ( )
选项 鉴别对象 方法、现象、结论
A 硬水和软水 取样,分别滴加肥皂水,振荡,泡沫多,浮渣少的为硬水
B 羊毛线和棉纱线 取样,分别灼烧,有烧焦羽毛气味的是棉纱线
C 淀粉和葡萄糖 取样,分别滴加碘水,呈现蓝色的是淀粉
D 氢氧化钠和硝酸铵 取样,加水溶解,用手触摸烧杯壁,发烫的是硝酸铵
10.(2023广西中考)甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法一定正确的是 ( )
A.t3 ℃时,等质量的甲、乙、丙的溶液降温到t1 ℃时,析出晶体最多的是甲的溶液
B.t2 ℃时,将25 g乙加入50 g水中,再降温到t1 ℃,所得溶液的溶质质量分数约为33.3%
C.t1 ℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙
D.t1 ℃时,甲、乙、丙的饱和溶液中,所含溶质的质量大小关系为乙>甲=丙
11.(2023江苏兴化一模)下列各组物质的溶液,不另加试剂不能鉴别的一组是 ( )
A.MgCl2、NaOH、Cu(NO3)2、NaNO3
B.CuCl2、Na2SO4、Ba(OH)2、MgCl2
C.AgNO3、HCl、Na2CO3、CaCl2
D.NaOH、FeCl3、HCl、NaCl
12.(2023江苏镇江月考)烧杯中盛有4.0 g MgO,向其中逐滴滴加100.0 g稀硫酸,然后再在溶液中滴加Ba(OH)2溶液,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法正确的是 ( )
A.a点对应的溶液中有2种溶质
B.b点对应的固体中有Mg(OH)2和BaSO4
C.m=31.43
D.H2SO4在原溶液中的溶质质量分数约为9.8%
二、填空题(共42分)
13.[含评分说明](2023江苏常州天宁调研)(4分)请选择下列相应物质的序号填空。
①聚乙烯 ②聚氯乙烯 ③小苏打
④稀盐酸 ⑤熟石灰
(1)能用于改良酸性土壤的是 。
(2)常用于制作食品保鲜膜的是 。
(3)胃里含有的能助消化的物质是 。
(4)常用于厨房中烘焙糕点的是 。
14.[含评分说明]【新素材·清洁环保】(2023辽宁抚顺本溪辽阳中考)(4分)《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转变。如图是不同年份中世界能源占比结构图,请回答下列问题。
(1)比较2015、2030、2050年能源结构,化石能源占比日益减少的是 。
(2)天然气是比较清洁的能源,其主要成分燃烧的化学方程式为 。
(3)人们正在利用和开发的新能源有
(写一种)。
(4)减少CO2排放已成为全球共识。下列做法符合低碳理念的是
(填字母)。
A.随手关灯
B.节约用纸
C.多使用一次性木筷
15.(2023天津中考)(12分)溶液与人类的生产、生活密切相关。
(1)厨房中的下列物质分别放入水中,能形成溶液的是 (填字母)。
A.白糖 B.花生油 C.面粉
(2)如图为硝酸钾和氯化钠的溶解度曲线示意图。
①t1 ℃时,将40 g硝酸钾加入100 g水中,充分搅拌,形成
(填“饱和”或“不饱和”)溶液;
②P点表示t1 ℃时,硝酸钾的溶解度 (填“大于”“等于”或“小于”)氯化钠的溶解度;
③将t2 ℃时一定质量的硝酸钾饱和溶液降温到t1 ℃,所得溶液的溶质质量分数 (填“增大”“不变”或“减小”)。
(3)在实验室配制一定溶质质量分数的氯化钠溶液,需要用到的玻璃仪器有:试剂瓶、烧杯、 、量筒、胶头滴管。
(4)20 ℃时,向40 g溶质质量分数为20%的氯化钠溶液中加入68 g 水,若得到该温度下氯化钠的饱和溶液,至少需要再加入 g氯化钠固体。(20 ℃时,氯化钠的溶解度为36 g)
16.[含评分说明]【学科素养·科学思维】(2023新疆中考)(14分)盐酸和碳酸钠是重要的化工产品,也是实验室中重要的化学试剂。
(1)增大压强,HCl由气态变为液态,原因是分子的 发生了改变。
(2)碳酸钠俗称 ,属于 (填“酸”“碱”或“盐”),广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
(3)在盐酸中加入一定量碳酸钠固体充分反应。
①此反应的现象是 。
②如图表示该反应前后溶液中存在的主要离子,用pH试纸测定反应后溶液的酸碱度,pH (填“>”“=”或“<”)7。反应后的图中R代表的离子是 。
(4)下列物质中能与盐酸发生反应的是 (填字母)。
A.Pb B.NaHCO3 C.KOH
D.NaNO3 E.Al2O3
17.[含评分说明]【模型法解题】(2023江苏扬州中考节选)(8分)以工业副产品石膏(主要成分是CaSO4)为原料可制备CaCO3。CaCO3有球霰石、方解石等多种形态,其中球霰石广泛应用于油墨、生物材料等领域。
(1)制备CaCO3时,将石膏与水配成悬浊液,再向其中通入NH3、CO2(不考虑石膏中杂质的反应)。
①配制悬浊液时,保持温度不变,为使石膏充分分散在水中,可采取的措施是 、 。
②制备时温度不宜过高,原因是
。
③制备可看作是(NH4)2CO3与CaSO4发生复分解反应,(NH4)2CO3与CaSO4反应生成CaCO3的化学方程式为
。理论上参加反应的CO2与NH3的质量比为 。
(2)反应生成的CaCO3中球霰石与方解石的质量分数与反应时间的关系如图1所示。由图示信息得出的结论是
。
(3)反应时加入某表面活性剂可增加产物中球霰石的含量。该表面活性剂一端带正电荷,另一端为排斥水分子的疏水基团,可与球霰石形成两种吸附作用,如图2所示。
①两种吸附分别为离子对吸附和离子交换吸附。离子对吸附:球霰石表面的C带负电,表面活性剂通过带正电的一端吸附于球霰石表面;离子交换吸附:球霰石表面的Ca2+带正电,表面活性剂中带正电的一端可取代球霰石表面的Ca2+,并吸附于球霰石表面。图2中表示离子对吸附的是 (填“A”或“B”)。
②有研究认为,球霰石转化为方解石经历了球霰石溶解、再沉淀为方解石的过程。表面活性剂能增加产物中球霰石的含量,原因是 。
三、实验探究题(共14分)
18.[含评分说明](2023山东烟台中考)(14分)欲证明“CO2与NaOH能发生化学反应”,
图1
某化学兴趣小组进行了以下探究实验(实验装置中夹持仪器、电脑均已略去)。
实验一:小亮同学按图1所示装置进行实验。
实验前U形管两端液面相平。将NaOH溶液滴入试管中,待反应后恢复到室温,U形管中的液面左高右低。
(1)小亮同学根据U形管中液面高度变化得出结论:CO2与NaOH发生了化学反应,该反应的化学方程式是 。
(2)小明认为仅凭U形管中液面高度变化,不足以得出“CO2与NaOH发生了化学反应”的结论,理由是
。
实验二:为获得充足的证据,兴趣小组设计了图2所示装置进行实验探究,并利用压强传感器测定实验过程中三颈瓶内压强的变化。
图2
按图2所示,打开压强传感器,观察到三颈瓶内初始压强为101 kPa,将滴有酚酞试液的适量氢氧化钠溶液快速推入瓶内,振荡充分反应。待压强不再减小后,再将适量的稀盐酸快速推入瓶内,振荡充分反应。待压强不再增大后,将两个注射器活塞先后拉回原位(不进行活塞操作时,活塞不能自主移动)。瓶内压强变化如图3所示。
(3)滴有酚酞试液的NaOH溶液呈 色。
(4)向瓶内推入适量稀盐酸后,能证明CO2与NaOH已发生了反应的现象是 ,产生此现象的反应的化学方程式是 。
(5)图3中, (填序号)的压强比初始压强低,说明瓶内的水能吸收CO2。
①CD段 ②DE段 ③MN段
(6)图3中,DE段压强远低于MN段压强,能够说明
。
四、计算题(共8分)
19.[含评分说明](2023江苏徐州二模)(8分)化学兴趣小组的同学为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液于烧杯中,向烧杯中不断滴加MgSO4溶液,边滴加边搅拌,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,当加入80克MgSO4溶液时,两者恰好完全反应。请回答:
(1)恰好完全反应时生成沉淀的质量为 克。
(2)原BaCl2溶液的溶质质量分数是多少 (写出计算过程)
答案全解全析
1.D 碳酸氢铵(化学式为NH4HCO3)中含有氮元素,属于氮肥。
2.C 玻璃钢是由玻璃纤维和合成材料复合而成的,属于复合材料;钛合金属于金属材料;合成橡胶属于有机合成材料;玻璃属于无机材料。
3.A 大量燃放烟花爆竹会产生有害气体和烟尘,污染空气,B错误;露天烧垃圾会产生大量的烟尘和有害气体,加重空气污染,C错误;农业上过量使用农药和化肥会造成水体污染、土壤污染,D错误。
4.A 茶叶不溶于水,茶叶悬浮在水中形成的混合物是悬浊液,A不正确。
5.B 霉变的大米中含有黄曲霉毒素,黄曲霉毒素有毒,洗净煮熟后也不能食用,故B不正确。
6.D 由“入于釜中煎炼,顷刻结盐”可知,该操作过程相当于蒸发结晶,则“釜”相当于化学实验室中的蒸发皿,A正确;“汲水而上”中的“水”里含有氯化钠,B正确;食盐是一种白色固体,C正确;此方法获得的盐还含有很多可溶性杂质,属于混合物,D错误。
7.A 生石灰和水反应放热,不能说明物质溶解过程放热,B错误;一切化学反应均遵守质量守恒定律,实验③中反应后总质量减小,是因为碳酸钠和盐酸反应生成的二氧化碳气体从烧杯中逸出,C错误;向下排空气法适用于收集密度比空气小的气体,D错误。
8.A pH试纸只能粗略测定溶液的pH,A错误;溶液具有均一性,因此整瓶口感一致,B正确;碳酸氢钠可溶于水,过滤不能分离水和碳酸氢钠,故C正确;饮料中含有食用盐、水、碳酸氢钠等,可以补充运动后流失的水和无机盐,D正确。
9.C 取样,分别滴加肥皂水,振荡,泡沫少、浮渣多的为硬水,反之则为软水,A错误;取样,分别灼烧,有烧焦羽毛气味的是羊毛线,有烧纸气味的是棉纱线,B错误;氢氧化钠溶于水放热,硝酸铵溶于水吸热,取样,加水溶解,用手触摸烧杯壁,发烫的是氢氧化钠,发凉的是硝酸铵,D错误。
10.C 由于没有指明t3 ℃时甲、乙、丙溶液是否饱和,故将等质量的甲、乙、丙的溶液降温到t1 ℃,析出晶体质量的多少无法判断,故A错误;t2 ℃时,乙的溶解度为50 g,将25 g乙加入50 g水中,恰好形成饱和溶液,所得溶液的溶质质量分数为×100%≈33.3%,乙物质的溶解度随温度的降低而减小,将所得溶液降温到t1 ℃,有晶体析出,所得溶液的溶质质量分数小于33.3%,故B错误;t1 ℃时,甲、乙、丙三种物质的溶解度大小关系为乙>甲=丙,t1 ℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙,故C正确;由于没有指明t1 ℃时甲、乙、丙饱和溶液的质量,因此t1 ℃时,甲、乙、丙的饱和溶液中,无法比较所含溶质的质量大小关系,故D错误。
11.B 首先鉴别出蓝色的氯化铜溶液,当加入剩余的三种物质后,产生蓝色沉淀的为氢氧化钡溶液,将氢氧化钡溶液加入剩余的两种物质中,均产生白色沉淀,不能区分硫酸钠和氯化镁。
12.C a点发生的反应为MgO+H2SO4 MgSO4+H2O,a点滴加的硫酸全部反应,此时溶液中的溶质只有硫酸镁,A错误;b点是剩余的硫酸与氢氧化钡反应生成硫酸钡和水,且到c点时硫酸才消耗完,因此b点对应固体为硫酸钡,B错误;cd段,硫酸镁与氢氧化钡反应生成氢氧化镁沉淀和硫酸钡沉淀,由质量守恒定律可知,整个反应过程中镁元素的质量不变,为4.0 g×=2.4 g,则氢氧化镁的质量为2.4 g÷=5.8 g,cd段生成硫酸钡的质量为×233=23.3 g,m=2.33+5.8+23.3=31.43,C正确;硫酸中溶质的质量为2.33 g×+4.0 g×=10.78 g,所以H2SO4在原溶液中的溶质质量分数为×100%=10.78%,D错误。
13.(1)⑤ (2)① (3)④ (4)③
【评分说明】书写化学式或名称均不给分。
解析 (1)熟石灰是一种碱,能与酸性物质反应,能用于改良酸性土壤。(2)聚乙烯无毒,常用于制作食品保鲜膜。(3)胃里含有的能助消化的物质是稀盐酸。(4)小苏打受热时会分解产生二氧化碳气体,常用于厨房中烘焙糕点。
14.(1)煤炭、石油 (2)CH4+2O2 CO2+2H2O (3)太阳能(合理即可) (4)AB
【评分说明】(1)错写、漏写均不给分。(2)化学方程式未标注条件或未配平或误标“↑”均不给分。(3)“太阳能”“风能”“地热能”等合理答案均给分。(4)错选、漏选均不给分。
解析 (2)天然气的主要成分是甲烷,甲烷与氧气在点燃条件下反应生成二氧化碳和水。(3)目前人们正在利用和开发的新能源有太阳能、核能、风能、地热能、潮汐能、生物质能等。(4)随手关灯和节约用纸均符合低碳理念;多使用一次性木筷不符合低碳理念。
15.(1)A (2)①饱和 ②等于 ③减小 (3)玻璃棒 (4)28
解析 (1)白糖易溶于水,放入水中能形成溶液。(2)①t1 ℃时,硝酸钾的溶解度小于40 g,则t1 ℃时,将40 g硝酸钾加入100 g水中,充分搅拌,形成饱和溶液。②P点是硝酸钾和氯化钠溶解度曲线的交点,P点表示t1 ℃时,硝酸钾的溶解度等于氯化钠的溶解度。③将t2 ℃时一定质量的硝酸钾饱和溶液降温到t1 ℃,硝酸钾的溶解度减小,其溶液会析出硝酸钾晶体,故所得溶液的溶质质量分数减小。(4)设至少需要再加入氯化钠固体的质量为x,,则x=28 g,即至少需要再加入28 g氯化钠固体。
16.(1)间隔 (2)纯碱(或苏打) 盐 (3)①固体逐渐溶解,有气泡产生 ②< Na+ (4)ABCE
【评分说明】(1)填“间隔”“间隙”均给分。(2)填“纯碱”或“苏打”均给分。(4)错选、漏选均不给分。
解析 (2)碳酸钠俗称纯碱或苏打,由金属阳离子和酸根阴离子构成,属于盐。(3)①碳酸钠和稀盐酸反应会生成二氧化碳气体,故现象为固体逐渐溶解,有气泡产生。②根据图示,反应后的溶液中盐酸有剩余,则溶液显酸性,则pH<7;氯化钠由钠离子和氯离子构成,所以反应后的图中R代表的离子是Na+。(4)Pb能和稀盐酸反应生成氯化铅和氢气;NaHCO3和稀盐酸反应生成氯化钠、水和二氧化碳;KOH与稀盐酸反应生成氯化钾和水;NaNO3和稀盐酸互相交换成分无沉淀、气体或水生成,不能发生反应;Al2O3和稀盐酸反应生成氯化铝和水。
17.(1)①粉碎石膏 搅拌(合理即可) ②温度过高,氨气和二氧化碳的溶解度小,影响产率 ③(NH4)2CO3+CaSO4 CaCO3↓+(NH4)2SO4 22∶17 (2)在一定条件下,随着反应时间的增加,碳酸钙的球霰石形态会转化为方解石形态(合理即可) (3)①A ②表面活性剂通过两种吸附作用覆盖在球霰石表面,阻碍球霰石的溶解(合理即可)
【评分说明】(1)①答案合理均给分。③化学方程式中化学式书写错误、未标注“↓”均不给分,。(2)表述合理均给分。(3)②表述合理均给分。
解析 (1)②制备时温度不宜过高,原因是氨气和二氧化碳的溶解度随温度的升高而减小,影响产率。③碳酸铵与硫酸钙反应生成碳酸钙和硫酸铵;氨气、二氧化碳和水反应生成碳酸铵,化学方程式为2NH3+CO2+H2O (NH4)2CO3,即理论上参加反应的二氧化碳与氨气的质量比为44∶(17×2)=22∶17。(2)由题图1可知,在一定条件下,随着反应的进行,方解石的质量分数逐渐增大,球霰石的质量分数逐渐减小,故可得出结论:在一定条件下,随着反应时间的增加,碳酸钙的球霰石形态会转化为方解石形态。(3)①由题干信息可知,离子对吸附是表面活性剂通过带正电的一端吸附于球霰石表面,因为球霰石表面的碳酸根离子带负电,故表示离子对吸附的是A。
18.(1)CO2+2NaOH Na2CO3+H2O (2)CO2能溶于水且能与水反应 (3)红 (4)有气泡生成 Na2CO3+2HCl 2NaCl+CO2↑+H2O (5)③ (6)CO2和NaOH溶液发生了化学反应
【评分说明】(1)化学方程式中化学式书写错误或未配平均不给分。(4)化学方程式中化学式书写错误或未配平均不给分,未标注“↑”扣1分。
解析 (1)CO2与NaOH发生反应生成碳酸钠和水。(2)CO2溶于水且与水反应也会造成试管内气体减少,气压变小,使U形管内液面左高右低。(3)NaOH溶液显碱性,能使酚酞试液变红。(4)Na2CO3和稀盐酸发生反应生成CO2气体,能证明CO2与NaOH发生了反应的现象为有气泡产生。(5)MN段压强低于初始压强,证明水能吸收CO2。(6)DE段的压强远低于MN段,证明CO2与NaOH溶液发生了化学反应。
19.(1)23.3 (1分)
(2)解:设原BaCl2溶液的溶质质量分数为x。 (1分)
BaCl2+MgSO4 BaSO4↓+MgCl2 (2分)
208 233
100 g×x 23.3 g (1分) (1分)
x=20.8% (2分)
答:原BaCl2溶液的溶质质量分数为20.8%。
【评分说明】解、设、答共1分,计算过程及结果未写单位或单位错,扣1分(不重复扣分);因相对分子质量计算错误导致结果错误,不给分;其他解法,合理均给分。
解析 (1)完全反应生成沉淀的质量为80 g+100 g-156.7 g=23.3 g。(2)根据生成沉淀的质量和化学方程式可计算原BaCl2溶液的溶质质量分数。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
