2024沪教版化学九年级下学期课时练--专项素养综合全练(二)金属活动性顺序的探究及应用
文档属性
| 名称 | 2024沪教版化学九年级下学期课时练--专项素养综合全练(二)金属活动性顺序的探究及应用 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 17:02:09 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2024沪教版化学九年级下学期
专项素养综合全练(二)
金属活动性顺序的探究及应用
类型一 金属活动性顺序的比较与验证
1.(2023河北雄县月考)有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生气泡,Y不反应;如果把Y和Z分别放入硝酸银溶液中,在Y表面有银白色物质析出,而Z没有变化。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为 ( )
A.X、Y、Z B.Z、Y、X
C.Y、X、Z D.X、Z、Y
2.(2023陕西中考A卷)用下列各组物质进行实验,能验证Mg、Ag、Cu三种金属活动性强弱的是 ( )
A.Mg、Ag、Cu、稀硫酸
B.Mg、Ag、CuSO4溶液
C.Ag、Cu、MgCl2溶液
D.Ag、CuCl2溶液、MgSO4溶液
3.(2023海南二模)某同学为验证镁、铁、铜、银的金属活动性顺序,设计了如图所示的四个实验(金属片均已打磨,且形状、大小相同;实验①、②、③所用稀盐酸的溶质质量分数和体积均相同)。下列分析不正确的是 ( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
4.【学科素养·科学探究与实践】(2023河南中考)某化学小组用下图所示实验装置,探究铝、铜、银的金属活动性顺序。
(1)铝丝浸入溶液前需要先用砂纸打磨,其目的是什么
(2)请写出装置A或B中发生反应的化学方程式。
(3)通过图示中的实验不能判断铜、银的金属活动性顺序,请补充实验继续探究。(简要叙述实验步骤)
类型二 金属与酸反应的图像分析
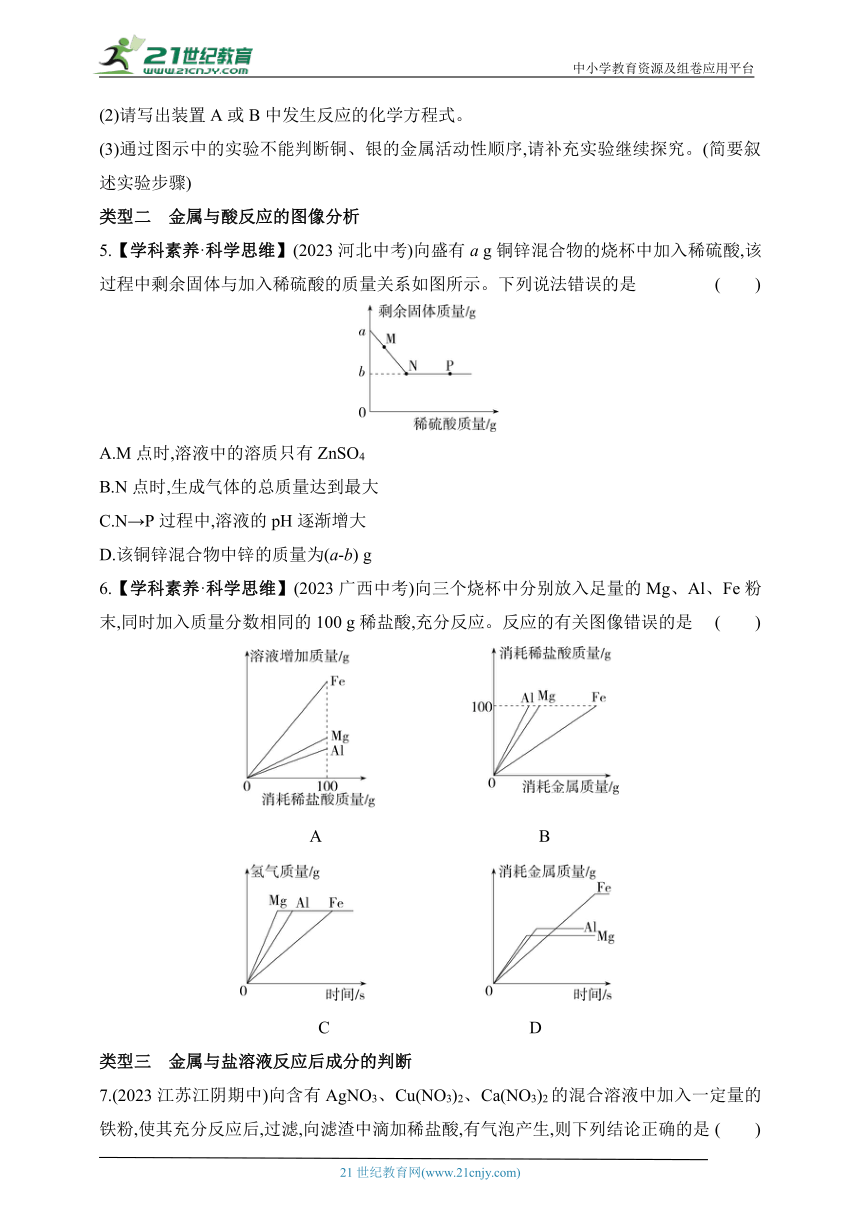
5.【学科素养·科学思维】(2023河北中考)向盛有a g铜锌混合物的烧杯中加入稀硫酸,该过程中剩余固体与加入稀硫酸的质量关系如图所示。下列说法错误的是 ( )
A.M点时,溶液中的溶质只有ZnSO4
B.N点时,生成气体的总质量达到最大
C.N→P过程中,溶液的pH逐渐增大
D.该铜锌混合物中锌的质量为(a-b) g
6.【学科素养·科学思维】(2023广西中考)向三个烧杯中分别放入足量的Mg、Al、Fe粉末,同时加入质量分数相同的100 g稀盐酸,充分反应。反应的有关图像错误的是 ( )
A B
C D
类型三 金属与盐溶液反应后成分的判断
7.(2023江苏江阴期中)向含有AgNO3、Cu(NO3)2、Ca(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是 ( )
A.滤液中一定含Ag+、Cu2+、Ca2+、Fe2+
B.滤液中一定含Fe2+,可能含Ca2+
C.滤液中一定含Ca2+、Fe2+,可能含Cu2+
D.滤液中一定含Fe2+、Ca2+,不含Cu2+、Ag+
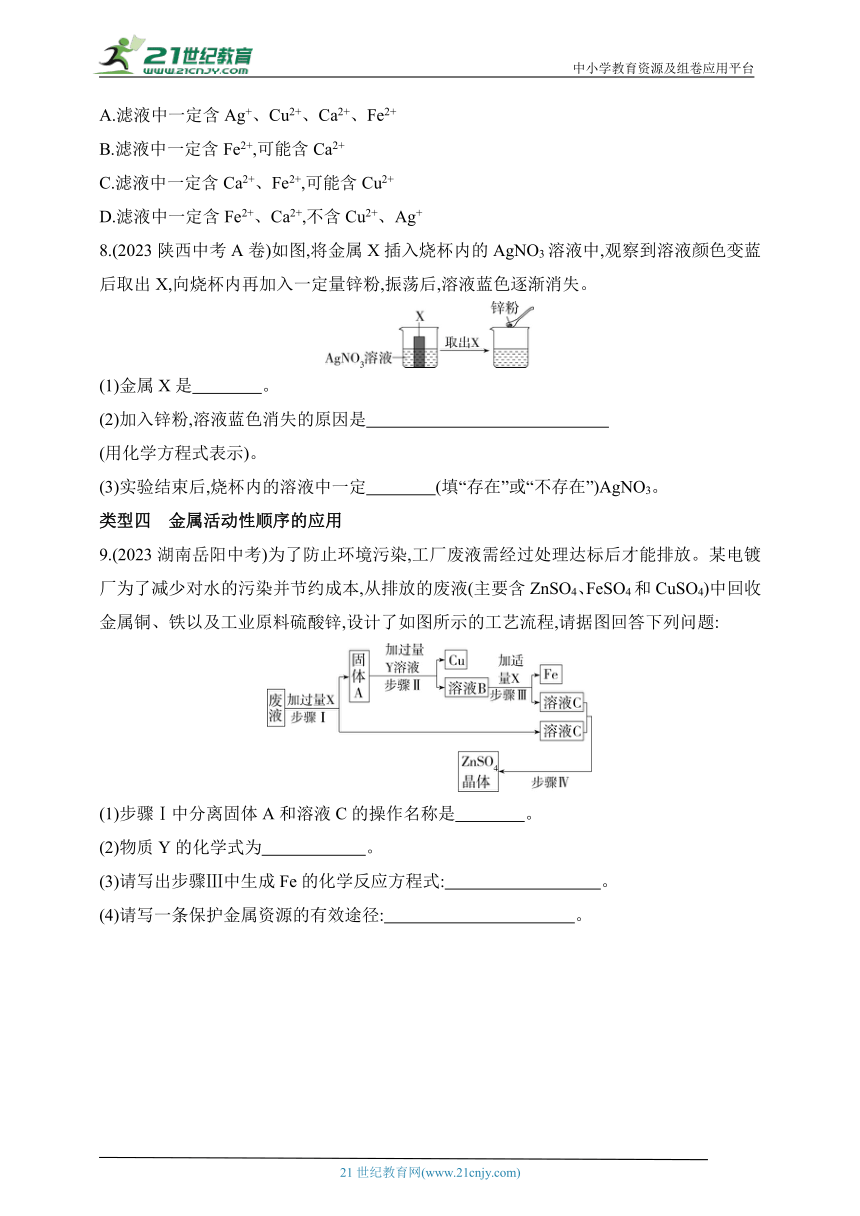
8.(2023陕西中考A卷)如图,将金属X插入烧杯内的AgNO3溶液中,观察到溶液颜色变蓝后取出X,向烧杯内再加入一定量锌粉,振荡后,溶液蓝色逐渐消失。
(1)金属X是 。
(2)加入锌粉,溶液蓝色消失的原因是
(用化学方程式表示)。
(3)实验结束后,烧杯内的溶液中一定 (填“存在”或“不存在”)AgNO3。
类型四 金属活动性顺序的应用
9.(2023湖南岳阳中考)为了防止环境污染,工厂废液需经过处理达标后才能排放。某电镀厂为了减少对水的污染并节约成本,从排放的废液(主要含ZnSO4、FeSO4和CuSO4)中回收金属铜、铁以及工业原料硫酸锌,设计了如图所示的工艺流程,请据图回答下列问题:
(1)步骤Ⅰ中分离固体A和溶液C的操作名称是 。
(2)物质Y的化学式为 。
(3)请写出步骤Ⅲ中生成Fe的化学反应方程式: 。
(4)请写一条保护金属资源的有效途径: 。
答案全解全析
1.A 把X和Y分别放入稀硫酸中,X溶解并产生气泡,Y不反应,说明X的活动性比Y强;把Y和Z分别放入硝酸银溶液中,在Y表面有银白色物质析出,而Z没有变化,说明Y的活动性大于银,而银的活动性大于Z,则X、Y、Z三种金属的活动性顺序为X>Y>Z。故选A。
2.B Cu、Ag均不与稀硫酸反应,故不能比较Cu、Ag的活动性强弱;Mg能与CuSO4溶液反应置换出铜,证明活动性:Mg>Cu,Ag不与CuSO4溶液反应,证明活动性:Cu>Ag,则三种金属的活动性:Mg>Cu>Ag;Ag、Cu均不与MgCl2溶液反应,证明Mg的活动性比Cu、Ag强,不能比较Cu、Ag的活动性强弱;Ag与CuCl2溶液、MgSO4溶液均不反应,证明Ag的活动性比Cu、Mg弱,不能比较Cu、Mg的活动性强弱。
3.B 镁与稀盐酸反应比铁与稀盐酸反应剧烈,能判断出镁的活动性比铁强,A正确;实验②中铁能和稀盐酸反应生成氢气,说明活动性:Fe>H,实验④中铜能和硝酸银反应,说明活动性:Cu>Ag,不能判断出铁、铜的金属活动性强弱,B错误、C正确;实验③中铜和稀盐酸不反应,说明活动性:氢>铜,综合实验①②③④的结论可知,金属活动性:镁>铁>铜>银,D正确。
4.(1)除去铝丝表面的氧化膜。 (2)Al+3AgNO3 Al(NO3)3+3Ag[或2Al+3Cu(NO3)2 2Al(NO3)3+3Cu]。 (3)将铜丝插入硝酸银溶液中(或将银丝插入硝酸铜溶液中,合理即可)。
解析 (1)铝易与空气中的氧气反应生成氧化铝薄膜,影响铝与其他物质的反应,故铝丝浸入溶液前需要先用砂纸打磨。(2)装置A中,铝和硝酸银反应生成硝酸铝和银。装置B中,铝和硝酸铜反应生成硝酸铝和铜。(3)比较铜、银的金属活动性顺序,可将铜丝插入硝酸银溶液中,铜能置换出硝酸银溶液中的银,则铜的金属活动性强于银;或将银丝插入硝酸铜溶液中,银不能置换出硝酸铜溶液中的铜,也可以判断出铜的金属活动性强于银。
5.C M点时,溶液中的溶质只有ZnSO4,A正确;N点时,锌与稀硫酸恰好完全反应,生成气体的总质量达到最大,B正确;N→P过程中,锌已经完全反应,硫酸过量,溶液酸性增强,溶液的pH逐渐减小,C错误;根据图像信息可知,铜锌混合物的质量为a g,加入稀硫酸与铜锌混合物中的锌完全反应后,剩余铜的质量为b g,则铜锌混合物中锌的质量为(a-b)g,D正确。
6.D 根据化学方程式中的质量关系可知,消耗相同质量的盐酸,生成氢气的质量相等,同时消耗金属的质量关系为Fe>Mg>Al,故溶液质量的增加关系为Fe>Mg>Al,A、B正确。金属活动性顺序为Mg>Al>Fe,则与相同的酸反应的速率:Mg>Al>Fe,与等量盐酸完全反应,最后生成氢气的质量相等,C正确。金属活动性顺序为Mg>Al>Fe,所以与相同的酸反应时,相同时间内消耗金属的质量关系为Mg>Al>Fe;消耗相同质量的盐酸,同时消耗金属的质量关系为Fe>Mg>Al,D错误。
7.D 因为金属活动性:Ca>Fe>Cu>Ag,故向含有AgNO3、Cu(NO3)2、Ca(NO3)2的混合溶液中加入一定量的铁粉,铁不与Ca(NO3)2反应,铁先与AgNO3反应生成Fe(NO3)2与Ag,待混合溶液中的AgNO3完全反应,若Fe有剩余,再与Cu(NO3)2反应生成Fe(NO3)2与Cu。充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,可证明滤渣中一定含Ag、Cu、Fe,滤液中一定含Fe(NO3)2、Ca(NO3)2,不可能含Cu(NO3)2、AgNO3。
8.(1)铜 (2)Zn+Cu(NO3)2 Cu+Zn(NO3)2 (3)不存在
解析 (1)将金属X插入AgNO3溶液中,观察到溶液颜色变蓝,说明金属X为铜,铜与硝酸银反应生成银和硝酸铜。(2)硝酸铜与锌反应生成硝酸锌和铜,故溶液蓝色消失,锌粉表面有红色固体析出。(3)金属活动性:锌>铜>银,故锌将AgNO3完全反应后才能与Cu(NO3)2反应,溶液蓝色逐渐消失,说明锌已经将硝酸铜完全反应,所以实验结束后,烧杯内的溶液中一定不存在AgNO3。
9.(1)过滤 (2)H2SO4 (3)Zn+FeSO4 ZnSO4+Fe (4)废旧金属回收再利用(合理即可)
解析 (1)步骤Ⅰ中分离固体A和溶液C的操作名称是过滤。(2)固体A是铁、锌和铜,稀硫酸能和铁反应生成硫酸亚铁和氢气,能和锌反应生成硫酸锌和氢气,不能和铜反应,因此物质Y的化学式为H2SO4。(3)步骤Ⅲ中,锌和硫酸亚铁反应生成硫酸锌和铁。(4)保护金属资源的有效途径有废旧金属回收再利用、寻找金属替代品等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024沪教版化学九年级下学期
专项素养综合全练(二)
金属活动性顺序的探究及应用
类型一 金属活动性顺序的比较与验证
1.(2023河北雄县月考)有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生气泡,Y不反应;如果把Y和Z分别放入硝酸银溶液中,在Y表面有银白色物质析出,而Z没有变化。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为 ( )
A.X、Y、Z B.Z、Y、X
C.Y、X、Z D.X、Z、Y
2.(2023陕西中考A卷)用下列各组物质进行实验,能验证Mg、Ag、Cu三种金属活动性强弱的是 ( )
A.Mg、Ag、Cu、稀硫酸
B.Mg、Ag、CuSO4溶液
C.Ag、Cu、MgCl2溶液
D.Ag、CuCl2溶液、MgSO4溶液
3.(2023海南二模)某同学为验证镁、铁、铜、银的金属活动性顺序,设计了如图所示的四个实验(金属片均已打磨,且形状、大小相同;实验①、②、③所用稀盐酸的溶质质量分数和体积均相同)。下列分析不正确的是 ( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
4.【学科素养·科学探究与实践】(2023河南中考)某化学小组用下图所示实验装置,探究铝、铜、银的金属活动性顺序。
(1)铝丝浸入溶液前需要先用砂纸打磨,其目的是什么
(2)请写出装置A或B中发生反应的化学方程式。
(3)通过图示中的实验不能判断铜、银的金属活动性顺序,请补充实验继续探究。(简要叙述实验步骤)
类型二 金属与酸反应的图像分析
5.【学科素养·科学思维】(2023河北中考)向盛有a g铜锌混合物的烧杯中加入稀硫酸,该过程中剩余固体与加入稀硫酸的质量关系如图所示。下列说法错误的是 ( )
A.M点时,溶液中的溶质只有ZnSO4
B.N点时,生成气体的总质量达到最大
C.N→P过程中,溶液的pH逐渐增大
D.该铜锌混合物中锌的质量为(a-b) g
6.【学科素养·科学思维】(2023广西中考)向三个烧杯中分别放入足量的Mg、Al、Fe粉末,同时加入质量分数相同的100 g稀盐酸,充分反应。反应的有关图像错误的是 ( )
A B
C D
类型三 金属与盐溶液反应后成分的判断
7.(2023江苏江阴期中)向含有AgNO3、Cu(NO3)2、Ca(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是 ( )
A.滤液中一定含Ag+、Cu2+、Ca2+、Fe2+
B.滤液中一定含Fe2+,可能含Ca2+
C.滤液中一定含Ca2+、Fe2+,可能含Cu2+
D.滤液中一定含Fe2+、Ca2+,不含Cu2+、Ag+
8.(2023陕西中考A卷)如图,将金属X插入烧杯内的AgNO3溶液中,观察到溶液颜色变蓝后取出X,向烧杯内再加入一定量锌粉,振荡后,溶液蓝色逐渐消失。
(1)金属X是 。
(2)加入锌粉,溶液蓝色消失的原因是
(用化学方程式表示)。
(3)实验结束后,烧杯内的溶液中一定 (填“存在”或“不存在”)AgNO3。
类型四 金属活动性顺序的应用
9.(2023湖南岳阳中考)为了防止环境污染,工厂废液需经过处理达标后才能排放。某电镀厂为了减少对水的污染并节约成本,从排放的废液(主要含ZnSO4、FeSO4和CuSO4)中回收金属铜、铁以及工业原料硫酸锌,设计了如图所示的工艺流程,请据图回答下列问题:
(1)步骤Ⅰ中分离固体A和溶液C的操作名称是 。
(2)物质Y的化学式为 。
(3)请写出步骤Ⅲ中生成Fe的化学反应方程式: 。
(4)请写一条保护金属资源的有效途径: 。
答案全解全析
1.A 把X和Y分别放入稀硫酸中,X溶解并产生气泡,Y不反应,说明X的活动性比Y强;把Y和Z分别放入硝酸银溶液中,在Y表面有银白色物质析出,而Z没有变化,说明Y的活动性大于银,而银的活动性大于Z,则X、Y、Z三种金属的活动性顺序为X>Y>Z。故选A。
2.B Cu、Ag均不与稀硫酸反应,故不能比较Cu、Ag的活动性强弱;Mg能与CuSO4溶液反应置换出铜,证明活动性:Mg>Cu,Ag不与CuSO4溶液反应,证明活动性:Cu>Ag,则三种金属的活动性:Mg>Cu>Ag;Ag、Cu均不与MgCl2溶液反应,证明Mg的活动性比Cu、Ag强,不能比较Cu、Ag的活动性强弱;Ag与CuCl2溶液、MgSO4溶液均不反应,证明Ag的活动性比Cu、Mg弱,不能比较Cu、Mg的活动性强弱。
3.B 镁与稀盐酸反应比铁与稀盐酸反应剧烈,能判断出镁的活动性比铁强,A正确;实验②中铁能和稀盐酸反应生成氢气,说明活动性:Fe>H,实验④中铜能和硝酸银反应,说明活动性:Cu>Ag,不能判断出铁、铜的金属活动性强弱,B错误、C正确;实验③中铜和稀盐酸不反应,说明活动性:氢>铜,综合实验①②③④的结论可知,金属活动性:镁>铁>铜>银,D正确。
4.(1)除去铝丝表面的氧化膜。 (2)Al+3AgNO3 Al(NO3)3+3Ag[或2Al+3Cu(NO3)2 2Al(NO3)3+3Cu]。 (3)将铜丝插入硝酸银溶液中(或将银丝插入硝酸铜溶液中,合理即可)。
解析 (1)铝易与空气中的氧气反应生成氧化铝薄膜,影响铝与其他物质的反应,故铝丝浸入溶液前需要先用砂纸打磨。(2)装置A中,铝和硝酸银反应生成硝酸铝和银。装置B中,铝和硝酸铜反应生成硝酸铝和铜。(3)比较铜、银的金属活动性顺序,可将铜丝插入硝酸银溶液中,铜能置换出硝酸银溶液中的银,则铜的金属活动性强于银;或将银丝插入硝酸铜溶液中,银不能置换出硝酸铜溶液中的铜,也可以判断出铜的金属活动性强于银。
5.C M点时,溶液中的溶质只有ZnSO4,A正确;N点时,锌与稀硫酸恰好完全反应,生成气体的总质量达到最大,B正确;N→P过程中,锌已经完全反应,硫酸过量,溶液酸性增强,溶液的pH逐渐减小,C错误;根据图像信息可知,铜锌混合物的质量为a g,加入稀硫酸与铜锌混合物中的锌完全反应后,剩余铜的质量为b g,则铜锌混合物中锌的质量为(a-b)g,D正确。
6.D 根据化学方程式中的质量关系可知,消耗相同质量的盐酸,生成氢气的质量相等,同时消耗金属的质量关系为Fe>Mg>Al,故溶液质量的增加关系为Fe>Mg>Al,A、B正确。金属活动性顺序为Mg>Al>Fe,则与相同的酸反应的速率:Mg>Al>Fe,与等量盐酸完全反应,最后生成氢气的质量相等,C正确。金属活动性顺序为Mg>Al>Fe,所以与相同的酸反应时,相同时间内消耗金属的质量关系为Mg>Al>Fe;消耗相同质量的盐酸,同时消耗金属的质量关系为Fe>Mg>Al,D错误。
7.D 因为金属活动性:Ca>Fe>Cu>Ag,故向含有AgNO3、Cu(NO3)2、Ca(NO3)2的混合溶液中加入一定量的铁粉,铁不与Ca(NO3)2反应,铁先与AgNO3反应生成Fe(NO3)2与Ag,待混合溶液中的AgNO3完全反应,若Fe有剩余,再与Cu(NO3)2反应生成Fe(NO3)2与Cu。充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,可证明滤渣中一定含Ag、Cu、Fe,滤液中一定含Fe(NO3)2、Ca(NO3)2,不可能含Cu(NO3)2、AgNO3。
8.(1)铜 (2)Zn+Cu(NO3)2 Cu+Zn(NO3)2 (3)不存在
解析 (1)将金属X插入AgNO3溶液中,观察到溶液颜色变蓝,说明金属X为铜,铜与硝酸银反应生成银和硝酸铜。(2)硝酸铜与锌反应生成硝酸锌和铜,故溶液蓝色消失,锌粉表面有红色固体析出。(3)金属活动性:锌>铜>银,故锌将AgNO3完全反应后才能与Cu(NO3)2反应,溶液蓝色逐渐消失,说明锌已经将硝酸铜完全反应,所以实验结束后,烧杯内的溶液中一定不存在AgNO3。
9.(1)过滤 (2)H2SO4 (3)Zn+FeSO4 ZnSO4+Fe (4)废旧金属回收再利用(合理即可)
解析 (1)步骤Ⅰ中分离固体A和溶液C的操作名称是过滤。(2)固体A是铁、锌和铜,稀硫酸能和铁反应生成硫酸亚铁和氢气,能和锌反应生成硫酸锌和氢气,不能和铜反应,因此物质Y的化学式为H2SO4。(3)步骤Ⅲ中,锌和硫酸亚铁反应生成硫酸锌和铁。(4)保护金属资源的有效途径有废旧金属回收再利用、寻找金属替代品等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
