【沪教版(全国)】化学九年级下册 7.1.2 溶液的酸碱性 同步练习(含答案)
文档属性
| 名称 | 【沪教版(全国)】化学九年级下册 7.1.2 溶液的酸碱性 同步练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 604.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 08:35:04 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
7.1.2 溶液的酸碱性
一、单选题
1.下列物质中酸性最强的是( )
A.苹果汁(2.9~3.3) B.西瓜汁(5~6)
C.牛奶(6.3~6.6) D.牙膏(8~9)
2.下列液体酸性最强的是( )
A.柠檬汁(pH=2~3) B.酱油(pH=4~5)
C.牛奶(pH=6~7) D.鸡蛋清(pH=7~8)
3.下列生活中常见的饮品可以使紫色石蕊溶液变蓝色的是( )
A.苹果醋 B.纯牛奶 C.柠檬汁 D.苏打水
4.能使紫色石蕊试液变红的是( )
A.蒸馏水 B.盐酸 C.食盐水 D.石灰水
5.下列图像能正确反映对应变化关系的是( )
A. 在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量
B. 用胃舒平[主要成分Al(OH)3]治疗胃酸过多时胃液pH的情况
C. 向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量
D. 加热一定量氯酸钾和二氧化锰固体混合物
6.下表列出了生活中一些常见的物质的pH,其中显碱性的是( )
食物 鸡蛋清 牛奶 葡萄汁 食醋
pH 7.6~8.0 6.3~6.6 3.5~4.5 2.4~3.0
A.鸡蛋清 B.牛奶 C.葡萄汁 D.食醋
7.几种作物适宜生长的pH范围如下:
作物 茶树 水稻 薄荷 马玲薯
pH范围 5.0~5.5 6.0~7.0 7.0~8.0 4.8~5.5
取某地土壤的浸出液加入石蕊溶液,溶液略显红色,则该土壤最不适宜种植的作物是( )
A.茶树 B.薄荷 C.马玲薯 D.水稻
8.下列数据是人体内一些液体的正常pH范围,其中酸性最强的是( )
A.胃液0.9~1.5 B.唾液6.6~7.1
C.胆汁7.1~7.3 D.胰液7.5~8.0
9.下表列出了一些常见物质的pH范围,其中碱性最强的是( )
物质名称 炉具清洁剂 肥皂水 矿泉水 厕所清洁剂
pH范围 12~13 9.5~10.5 6.8~7.8 1~2
A.炉具清洁剂 B.肥皂水 C.矿泉水 D.厕所清洁剂
10.下列图像能够正确反映其对应实验过程中相关量的变化关系的是( )
A.将CO通过盛有一定量炽热Fe2O3的硬质玻璃管
B.向盛有一定量氢氧化钠溶液的烧杯中逐渐加入水
C.足量红磷在含有一定量空气的密闭容器中燃烧
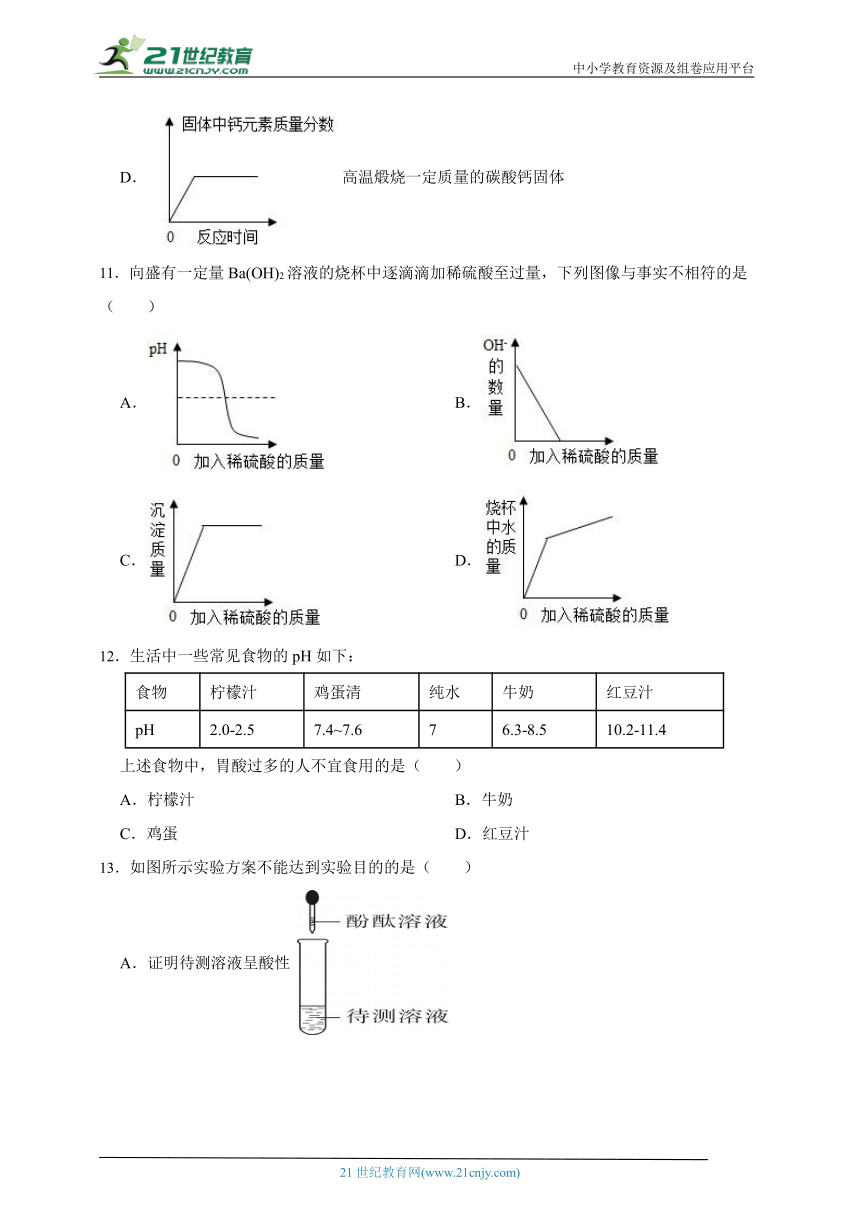
D.高温煅烧一定质量的碳酸钙固体
11.向盛有一定量Ba(OH)2溶液的烧杯中逐滴滴加稀硫酸至过量,下列图像与事实不相符的是( )
A. B.
C. D.
12.生活中一些常见食物的pH如下:
食物 柠檬汁 鸡蛋清 纯水 牛奶 红豆汁
pH 2.0-2.5 7.4~7.6 7 6.3-8.5 10.2-11.4
上述食物中,胃酸过多的人不宜食用的是( )
A.柠檬汁 B.牛奶
C.鸡蛋 D.红豆汁
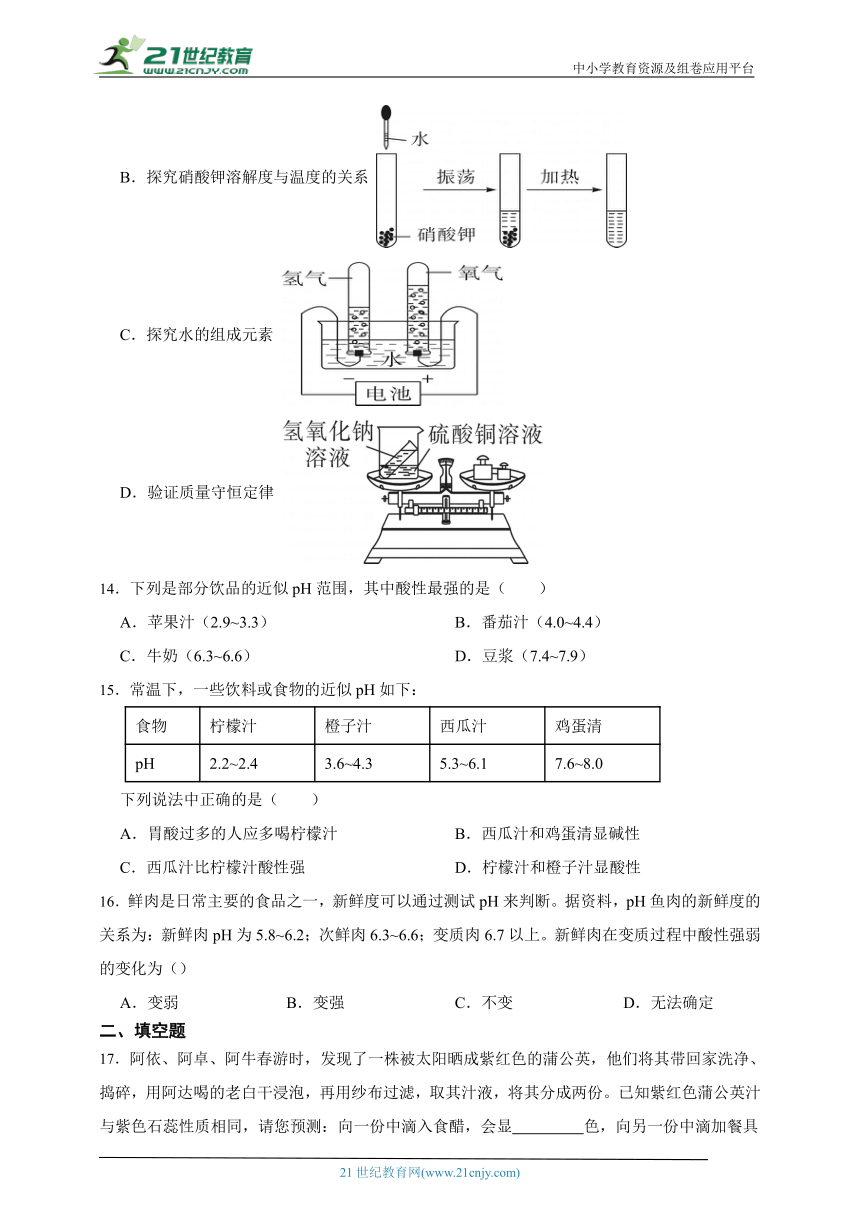
13.如图所示实验方案不能达到实验目的的是( )
A.证明待测溶液呈酸性
B.探究硝酸钾溶解度与温度的关系
C.探究水的组成元素
D.验证质量守恒定律
14.下列是部分饮品的近似pH范围,其中酸性最强的是( )
A.苹果汁(2.9~3.3) B.番茄汁(4.0~4.4)
C.牛奶(6.3~6.6) D.豆浆(7.4~7.9)
15.常温下,一些饮料或食物的近似pH如下:
食物 柠檬汁 橙子汁 西瓜汁 鸡蛋清
pH 2.2~2.4 3.6~4.3 5.3~6.1 7.6~8.0
下列说法中正确的是( )
A.胃酸过多的人应多喝柠檬汁 B.西瓜汁和鸡蛋清显碱性
C.西瓜汁比柠檬汁酸性强 D.柠檬汁和橙子汁显酸性
16.鲜肉是日常主要的食品之一,新鲜度可以通过测试pH来判断。据资料,pH鱼肉的新鲜度的关系为:新鲜肉pH为5.8~6.2;次鲜肉6.3~6.6;变质肉6.7以上。新鲜肉在变质过程中酸性强弱的变化为()
A.变弱 B.变强 C.不变 D.无法确定
二、填空题
17.阿依、阿卓、阿牛春游时,发现了一株被太阳晒成紫红色的蒲公英,他们将其带回家洗净、捣碎,用阿达喝的老白干浸泡,再用纱布过滤,取其汁液,将其分成两份。已知紫红色蒲公英汁与紫色石蕊性质相同,请您预测:向一份中滴入食醋,会显 色,向另一份中滴加餐具洗洁精,会显 色。
18.2019 年北京举办的世界园艺博览会展示了各色花卉千余种。不同的花卉适合不同的酸碱度土壤。北京城区土壤偏碱性,下表中适宜北京城区自然生长的花卉为 (填字母序号)。
选项 花卉种类 适宜土壤酸碱度
A 杜鹃、栀子花 5~6.8
B 迎春、夹竹桃、榆叶梅 7.3~8
C 向日葵、桃树 6~8
19.小江同学取5mL氢氧化钠溶液于试管中,滴入几滴酚酞溶液,可观察到的现象为 。
20.中央电视台暑期推出的科学类节目《加油!向未来》将科学知识融合到节目中,深受广大学生喜爱。请你参与节目回答问题:
(1)人体内含量最多的微量元素是钙还是铁? ;
(2)炒菜时油锅中的油不慎着火,可以采取的灭火方法是 ;
(3)用厨房中的白醋浸过的白色纸花,喷上一种试剂后,变成漂亮的红色小花,这种试剂是 。
三、实验探究题
21.黄冈市沧浪中学化学兴趣小组,用自制的酸碱指示剂对KNO3、NaOH、HCl等溶液的酸碱性进行测定,结果记录如下:
植物的汁液 在HCl溶液中 在KNO3溶液中 在NaOH溶液中
牵牛花瓣 红 色 紫 色 蓝 色
胡萝卜 橙 色 橙 色 橙 色
月季花瓣 浅红色 红 色 黄 色
(1)经过探究,发现 根本不宜作酸碱指示剂,这三种物质中理想的指示剂是 。
(2)小明是一个勤于思考,喜欢钻研的同学,发现了牵牛花瓣汁液遇NaOH溶液变蓝色后,思考到了一个问题:NaOH溶液中到底是哪种粒子使牵牛花汁液显蓝色呢?于是他和同学们继续探究:
【提出问题】NaOH溶液中何种粒子使牵牛花汁液发生颜色改变?
【提出猜想】猜想1:使牵牛花汁液变色的粒子是H2O
猜想2:使牵牛花汁液变色的粒子是
猜想3:使牵牛花汁液变色的粒子是 。
(3)【设计实验】
实 验 步 骤 实验现象 实 验 结 论
①向盛有少量蒸馏水的试管里,滴加2滴牵牛花汁液,振荡 溶液呈紫色 使牵牛花汁液变色的不是
②向盛有少量氯化钠溶液的试管里,滴加2滴牵牛花汁液,振荡 溶液呈紫色 使牵牛花汁液变色的不是
③ 溶液呈蓝色 使牵牛花汁液变色的只能是
22.以下是初中化学的基本实验,请回答下列问题。
(1)实验一中水的温度要求较高的理由是: ;
(2)实验二的目的是 ;
(3)依据实验三的实验现象,说明了二氧化碳的化学性质是 。
四、综合题
23.阅读下列材料,回答问题:
中国传统文化博大精深,中华美食更是名扬天下。在我国北方地区有腌制“腊八蒜”的传统,每年进入腊月后,人们将蒜瓣用食醋浸泡后密封在容器里低温储存。制作好的“腊八蒜”受到了很多人的喜爱,而且它还具有保健的功效。
大蒜是天然的杀菌食品,其中含有的大蒜素(C6H10OS2)具有很强的杀灭细菌和病毒的作用,可用于预防急性肠胃炎的发生。腌制好的“腊八蒜”减轻了生蒜的刺激性味道,但保留了抗氧化性。
(1)腌制“腊八蒜”中用到的食醋,其pH 7(填“>”“<”或“=”);
(2)大蒜中的大蒜素是由 种元素组成。
24.我国新版《生活饮用水卫生标准》于2023年4月1日正式实施。
(1)某水样检测出含氮、磷等,这里的氮、磷是指____(填序号)。
A.单质 B.分子 C.原子 D.元素
(2)为使水澄清透明,净化水时可加入絮凝剂,使杂质沉降,然后通过 (填操作名称)而实现。
(3)新标准明确规定生活饮用水的pH范围,测定水样酸碱度—pH,可选用 。
五、科普阅读题
25.阅读下列科普短文。冬季路面积雪给交通带来安全隐患,抛撒融雪剂是融雪的常用方法。
融雪剂的种类繁多,其中氯化钠、氯化钙、氯化镁等氯盐融雪剂价格低廉、融雪快,但其中的氯离子对路面等腐蚀性大。CMA类(乙酸钙镁盐)融雪剂除冰效果好、腐蚀性小,但价格高,多用于机场道路等重要场所。此外,乙酸钾(CH3COOK)、磷酸二氢钾(KH2PO4)、碳酸氢钾(KHCO3)等物质也常用于融雪。
研究人员配制出A、B两组融雪剂(如图),并与CMA类和NaCl融雪剂进行性能比对(见下表)。
不同融雪剂性能指标的检测结果
项目 技术标准 A组 B组 CMA类 NaCl
pH 6.5~9.0 7.2 7.4 9.0 7
冰点/℃ <-20.0 -23.2 -21.0 -21.0 -18.0
融雪化冰能力/mL ≥7 12.5 10.7 10.3 11
溶解速度/s ≤190 132 167 152 106
混凝土质量腐蚀/% ≤1.0 1.12 0.40 0.13 1.10
(本文中冰点指加入融雪剂后雪水的凝固温度)
研究发现,将不同融雪剂混合使用,部分性能指标优于其他两类,但仍存在一些问题,目前研究人员正在研发性能更好的融雪剂。
依据文章内容回答下列问题。
(1)MgCl2中镁元素和氯元素的质量比是 。
(2)A、B组融雪剂均属于 (填“纯净物”或“混合物”)。A组比B组腐蚀性强的原因是 。
(3)CMA类融雪剂的溶液呈 (填“酸性”、“中性”或“碱性”)。
(4)下列说法中,正确的是 (填序号)。
A
融雪剂可以降低雪水的凝固温度,使其难以形成冰
B
CMA类融雪剂的融雪化冰能力最强
C
B组融雪剂性能指标符合表中全部技术标准
六、计算题
26.将溶质质量分数为7.3%的稀盐酸逐滴加入10g氢氧化钠溶液中,边加边搅拌,随着稀盐酸的加入,溶液pH的变化如图所示。试回答:
(1)图中表示稀盐酸和氢氧化钠溶液恰好完全反应的点是 (填字母)。
(2)计算氢氧化钠溶液中溶质的质量分数。
27.常温下,一锥形瓶中盛有10g溶质质量分数为8%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加一定溶质质量分数的稀盐酸,用pH传感器测得溶液pH与加入稀盐酸的关系曲线如图所示,请回答下列问题:
(1)图中B点溶液呈 色
(2)计算稀盐酸中溶质质量分数(写出计算过程)
答案解析部分
1.【答案】A
【解析】【解答】pH越小酸性越强,因此苹果汁的酸性最强。
故答案为:A。
【分析】pH小于7时,显酸性,pH越小酸性越强。
2.【答案】A
【解析】【解答】鸡蛋清的pH大于7,显碱性;柠檬汁、酱油、牛奶等物质的pH都小于7,显酸性,柠檬汁的pH最小,酸性最强。
故答案为:A。
【分析】溶液的pH值<7,显酸性,从7到1,酸性逐渐增强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,从7到14,碱性逐渐增强。
3.【答案】D
【解析】【解答】解:石蕊遇碱变蓝色,遇酸变红色。
A、苹果醋显酸性,使石蕊变红色,不符合题意;
B、纯牛奶显中性,不使石蕊变色,故不符合题意;
C、柠檬汁显酸性,使石蕊变红色,不符合题意;
D、苏打水是碳酸氢钠溶液,显碱性,使石蕊变蓝色,故符合题意。
故答案为:D.
【分析】根据石蕊遇碱变蓝色,遇酸变红色来解答。
4.【答案】B
【解析】【解答】A. 蒸馏水显中性,不能使紫色石蕊试液变色,故不符合题意;
B. 盐酸显酸性,能使使紫色石蕊试液变红色,故符合题意;
C. 食盐水显中性,不能使紫色石蕊试液变色,故不符合题意;
D. 石灰水显碱性,能使紫色石蕊试液变蓝色,故不符合题意;
故答案为:B。
【分析】酸性溶液能使使紫色石蕊试液变红色。
5.【答案】C
【解析】【解答】根据所学知识和题中信息知,A、在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量,铁比铜活泼,铜比银活泼,铁与硝酸银溶液反应生成硝酸亚铁和银,铁与硝酸铜溶液反应生成硝酸亚铁和铜,硝酸铜的质量分数最后应变为零,A不符合题意;
B、用胃舒平[主要成分Al (OH)3 ]治疗胃酸过多时胃液pH的情况,氢氧化铝与盐酸反应生成氯化铝和水,氢氧化铝属于固体,pH值不可能超过7,B不符合题意;
C、向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量,氧化铜与稀硫酸反应生成硫酸铜和水,溶液中铜元素的质量应先增加,后达一定值,C符合题意;
D、加热一定量氯酸钾和二氧化锰固体混合物,二氧化锰是氯酸钾分解的催化剂,氯酸钾分解为氯化钾和氧气,固体中二氧化锰的质量分数应先增加,后达一定值,D不符合题意。
故答案为:C
【分析】A、铁粉过量,硝酸铜完全反应,直至为0。
B、胃液主要成分是盐酸,pH不可能大于7。
C、氧化铜是固定质量的,直至完全溶解。
D、二氧化锰是催化剂质量不变。
6.【答案】A
【解析】【解答】A. 鸡蛋清的pH在7.6~8.0之间,pH大于7 ,则显碱性,故A符合题意;
B. 牛奶的pH在6.3~6.6之间,pH小于7 ,则显酸性,故B不符合题意;
C. 葡萄汁的pH在3.5~4.5之间,pH小于7 ,则显酸性,故C不符合题意;
D. 食醋的pH在2.4~3.0之间,pH小于7 ,则显酸性,故D不符合题意。
故答案为:A。
【分析】溶液的pH值<7,显酸性,从7到1,酸性逐渐增强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,从7到14,碱性逐渐增强。
7.【答案】B
【解析】【解答】取某地土壤的浸出液加入石蕊溶液,溶液略显红色说明土壤呈酸性,薄荷在碱性土壤生成,在酸性土壤最不适宜。
故答案为:B。
【分析】溶液的pH值<7,显酸性,从7到1,酸性逐渐增强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,从7到14,碱性逐渐增强。
8.【答案】A
【解析】【解答】酸性溶液的pH<7,且pH越小,酸性越强,胃液、唾液的pH<7,且胃液的pH更小,
故答案为:A。
【分析】溶液的pH值<7,显酸性,从7到1,酸性逐渐增强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,从7到14,碱性逐渐增强。
9.【答案】A
【解析】【解答】pH<7,显酸性,pH=7,显中性,pH>7,显碱性,且pH值越大,碱性越强,炉具清洁剂的pH值最大,故炉具清洁剂的碱性最强。
故答案为:A。
【分析】根据溶液pH与酸碱性关系分析,溶液pH<7时,呈酸性,且越小酸性越强,溶液pH>7时,呈碱性,且越大碱性越强,溶液pH=7时,呈中性。
10.【答案】A
【解析】【解答】A、一氧化碳和氧化铁反应生成铁和二氧化碳,所以将CO通过盛有一定量炽热Fe2O3的硬质玻璃管,固体的质量会不断减少,当反应完毕后固体的质量不变,为一定值,故A符合题意;
B、向盛有一定量氢氧化钠溶液的烧杯中逐渐加入水,溶液仍然呈碱性,溶液的pH值不会小于7,故B不符合题意;
C、氮气的化学性质稳定,足量红磷在含有一定量空气的密闭容器中燃烧,氮气不反应,反应前后质量不会减少,故C不符合题意;
D、高温煅烧一定质量的碳酸钙固体,生成氧化钙和二氧化碳,所以固体中钙元素的质量分数会增大,当反应完毕后固体的质量分数不变,为一定值,但是开始钙元素的质量分数不为0,故D不符合题意。
故答案为:A。
【分析】本题是图像的判断题,解答时要通过题目要求分析涉及到的各物质之间量的关系,结合变化趋势先做出判断,如随着横坐标物质量的变化,纵坐标表示的物质的量的变化趋势,增加或降低等,再确定图形中的起点、终点、转折点是否符合题意。
11.【答案】D
【解析】【解答】A、向盛有一定量Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,反应生成硫酸钡和水,溶液的pH逐渐减小,恰好反应时pH为7,继续滴加稀硫酸,pH继续冲减小,不符合题意;
B、向盛有一定量Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,反应生成硫酸钡和水,溶液中氢氧根离子被氢离子消耗,逐渐减少,直至为零,不符合题意;
C、向盛有一定量Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,反应生成硫酸钡和水,反应开始就产生沉淀,逐渐增加,氢氧化钡完全反应后,不再增加,不符合题意;
D、向盛有一定量Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,反应生成硫酸钡和水,反应没有开始溶液有水,烧杯中水的质量开始不为0,符合题意。
故答案为:D。
【分析】本题是图像的判断题,解答时要通过题目要求分析涉及到的各物质之间量的关系,结合变化趋势先做出判断,如随着横坐标物质量的变化,纵坐标表示的物质的量的变化趋势,增加或降低等,再确定图形中的起点、终点、转折点是否正确。
12.【答案】A
【解析】【解答】当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性,且pH越小,酸性越强;当溶液的pH大于7时,呈碱性,且pH越大,碱性越强;胃酸过多的人不宜食用的是酸性食物。
A. 柠檬汁的pH为2.0-2.5,小于7,显酸性,故符合题意;
B. 牛奶的pH为6.3-8.5,可能显酸性、中性或碱性,故不符合题意;
C. 鸡蛋清的pH为7.6~8.0,大于7,显碱性,故不符合题意;
D. 红豆汁的pH为10.2-11.4,大于7,显碱性,故不符合题意。
故答案为:A。
【分析】酸性溶液pH值小于7,胃酸过多的人不宜食用的是酸性食物。
13.【答案】A
【解析】【解答】A. 酚酞遇碱变红,遇酸性和中性溶液不变色,所以不能用酚酞来验证溶液是否呈酸性,故A符合题意;
B. 探究硝酸钾溶解度与温度的关系,加水后溶解一部分,但还有部分固体剩余,加热后剩余固体也溶解,证明硝酸钾的溶解度随温度的升高而增加,故B正确,不符合题意;
C. 探究水的组成元素,通过电解水实验,产生氢气和氧气,证明水是由氢元素和氧元素组成的,故C正确,不符合题意;
D. 验证质量守恒定律,在天平左侧的硫酸铜溶液中加入氢氧化钠溶液,反应后天平保持平衡,证明质量守恒,故D正确,不符合题意。
故答案为:A。
【分析】A、酸性溶液、中性溶液不能使无色酚酞试液变色。
B、硝酸钾的溶解度随温度升高而升高。
C、根据质量守恒定律可知,反应前后元素的种类不变。
D、化学反应遵循质量守恒定律。
14.【答案】A
【解析】【解答】溶液的酸碱度常用pH来表示,pH范围通常在0~14之间。pH<7 溶液呈酸性;pH=7 溶液呈中性;pH>7 溶液呈碱性。pH越小,溶液的酸性越强;pH越大,溶液的碱性越强。苹果汁pH最小,
故答案为:A。
【分析】根据溶液pH与酸碱性关系分析,溶液pH<7时,呈酸性,且越小酸性越强,溶液pH>7时,呈碱性,且越大碱性越强,溶液pH=7时,呈中性。
15.【答案】D
【解析】【解答】A、柠檬汁pH 范围是2.2~2.4,pH<7,显酸性,胃酸过多的人应尽量少喝柠檬汁,否则会加重病情,故不符合题意。
B、西瓜汁pH 范围是5.3~6.1,pH<7,显酸性,鸡蛋清pH 范围是7.6~8.0,pH﹥7,显碱性,故不符合题意。
C、西瓜汁pH 范围是5.3~6.1,柠檬汁pH 范围是2.2~2.4,均小于7,且柠檬汁的pH小于西瓜汁,则柠檬汁比西瓜汁的酸性强,故不符合题意。
D、柠檬汁pH 范围是2.2~2.4,橙子汁pH 范围是3.6~4.3,均小于7,则柠檬汁和橙子汁显酸性,故符合题意。
故答案为:D。
【分析】酸性溶液的pH<7,pH越小酸性越强;碱性溶液的pH﹥7,pH越大碱性越强。
16.【答案】A
【解析】【解答】新鲜肉在变质过程中pH逐渐升高,酸性逐渐变弱,
故答案为:A。
【分析】根据溶液呈酸性时pH越大,则酸性越弱分析;
17.【答案】红;蓝
【解析】【解答】紫色石蕊遇到酸性变红,遇到碱性变蓝,所以加入食醋(显酸性)会变红色;洗洁精(显碱性、可去除油污)变蓝色。
【分析】食醋显酸性,紫色石蕊遇到酸性变红,洗洁精显碱性,遇到碱性变蓝。
18.【答案】B
【解析】【解答】土壤呈碱性,则适合种植的花卉种类应该适合在碱性土壤的环境中。碱性土壤的pH>7。所以适宜北京城区自然生长的花卉为大于7的花卉,即迎春、夹竹桃。榆叶梅。
故答案为:B。
【分析】pH>7,显碱性。
19.【答案】溶液变红
【解析】【解答】氢氧化钠溶液呈碱性,能使酚酞溶液呈红色。小江同学取5mL氢氧化钠溶液于试管中,滴入几滴酚酞溶液,可观察到的现象为溶液变红。
【分析】碱性溶液能使无色酚酞试液变红色。
20.【答案】(1)铁
(2)盖上锅盖
(3)石蕊试液
【解析】【解答】(1)人体内含量最多的微量元素是铁,钙元素是人体中的常量元素,故填:铁;(2)炒菜时油锅中的油不慎着火,可以采取盖上锅盖的灭火方法,故填:盖上锅盖;(3)用厨房中的白醋浸过的白色纸花,喷上一种试剂后,变成漂亮的红色小花,石蕊试液在酸性溶液中会变红色,故这种试剂是石蕊试液,故填:石蕊试液。
故答案为:铁;盖上锅盖;石蕊试液。
【分析】(1)根据微量元素及常量元素的种类分析;
(2)根据灭火原理分析,注意燃烧条件同时满足三个,而灭火只需撤掉其中一个即可;
(3)根据酸溶液能使石蕊变红分析。
21.【答案】(1)胡萝卜汁液;牵牛花汁液
(2)Na+;OH-
(3)H2O;Na+;向盛有少量氢氧化钠溶液的试管里,滴加2滴牵牛花汁液,振荡;OH-
【解析】【解答】①胡萝卜汁液与酸碱溶液均不变色,故不能做指示剂,牵牛花汁液与酸碱变色最明显,故最好;(2)因为NaOH溶液中存在着Na+、OH 、H2O等三种粒子,故分别猜想是这三种离子使其变色,然后分别取用含有其中一种离子的溶液进行实验,根据实验结果判断,猜想2:使牵牛花汁液变色的粒子是Na+;猜想3:使牵牛花汁液变色的粒子是OH-;
设计实验如下:
实 验 步 骤 实验现象 实 验 结 论
①向盛有少量蒸馏水的试管里,滴加2滴牵牛花汁液,振荡 溶液呈紫色 使牵牛花汁液变色的不是 ____ H2O _______
②向盛有少量氯化钠溶液的试管里,滴加2滴牵牛花汁液,振荡 溶液呈紫色 使牵牛花汁液变色的不是__ Na+______
③___向盛有少量氢氧化钠溶液的试管里,滴加2滴牵牛花汁液,振荡__ 溶液呈蓝色 使牵牛花汁液变色的只能是__ OH-___
故答案为:胡萝卜汁液;牵牛花汁液;Na+;OH-;H2O;Na+;向盛有少量氢氧化钠溶液的试管里,滴加2滴牵牛花汁液,振荡;OH-。
【分析】本题主要考查酸碱的性质及其酸碱指示剂的选择。主要根据其变色的pH范围进行选择。
22.【答案】(1)使温度达到白磷的着火点
(2)验证氢氧化钠与稀盐酸能发生中和反应
(3)二氧化碳能与水反应
【解析】【解答】(1)燃烧需要同时满足三个条件,实验一中水的温度要求较高,是因为使温度达到白磷的着火点。(2)实验二是氢氧化钠溶液与稀盐酸反应生成氯化钠和水,实验二的目的是验证氢氧化钠与稀盐酸能发生中和反应。(3)二氧化碳与水反应生成碳酸,能使紫色石蕊试纸变红,现象是湿润的紫色石蕊试纸变为红色,干燥的紫色石蕊试纸不变色,所以依据实验三的实验现象,说明了二氧化碳的化学性质是二氧化碳能与水反应。
【分析】(1)燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点,进行分析解答。(2)实验二是氢氧化钠溶液与稀盐酸反应生成氯化钠和水,进行分析解答。(3)根据二氧化碳的化学性质,进行分析解答。
23.【答案】(1)<
(2)4
【解析】【解答】(1)醋酸的溶液呈酸性,所以其pH小于7;
(2)由大蒜素(C6H10OS2)的化学式可知,大蒜素是由碳、氢、氧、硫四种元素组成的。
【分析】(1)食醋中含有醋酸,所以其pH<7;
(2)根据蒜素的化学式可知,蒜素是由四种元素组成的。
24.【答案】(1)D
(2)过滤
(3)pH试纸
【解析】【解答】(1)某水样检测出含氮、磷等,这里的氮、磷是指元素;
(2)净化水时可加入絮凝剂,使杂质沉降,然后通过过滤将固体和液体分离;
(3)测定水样酸碱度—pH,可选用 pH试纸。
【分析】(1)根据物质由元素组成,所给成分为元素分析;
(2)根据过滤的原理分析;
(3)根据pH试纸测定溶液酸碱度分析。
25.【答案】(1)24:71
(2)混合物;A组比B组氯离子含量高
(3)碱性
(4)AC
【解析】【解答】(1)MgCl2中镁元素和氯元素的质量比是24:(35.5×2)=24:71。(2)根据图示可知,A、B组融雪剂均由多种物质组成,属于混合物;根据题意,氯离子对路面等腐蚀性大,A组中含有14%的氯化钙、36%的氯化镁,B组只含有15%的氯化钙,A组比B组氯离子含量高,故A组比B组腐蚀性强。(3)CMA类融雪剂的溶液pH=9.0,大于7,故呈碱性。(4)A、融雪剂可以降低雪水的凝固温度,使其难以形成冰,正确;
B、CMA类融雪剂的融雪化冰能力对应的数字最小,能力最弱,错误;
C、根据表格,B组融雪剂性能指标符合表中全部技术标准,正确。
故答案为:AC。
【分析】(1)物质组成中各元素的质量比等于(A元素的相对原子质量*A元素的下角标):(B元素的相对原子质量*B元素的下角标)
(2)由一种物质组成的物质称为纯净物,由两种或两种以上物质组成的物质称为混合物。
(3)标准状况下,pH大于7的物质显碱性,pH等于7的物质显中性,pH小于7的物质显酸性。
(4)依据表格内容合理分析就能得到正确答案。
26.【答案】(1)b
(2)解:设氢氧化钠溶液中溶质的质量为x
x=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
【解析】【解答】(1)由图可知,b点时pH=7,说明稀盐酸和氢氧化钠溶液恰好完全反应;
【分析】(1)酸碱恰好完全中和时pH=7;
(2)先由反应掉氯化氢的质量根据化学方程式的计算,计算出参加反应的氢氧化钠的质量,最后用反应掉氢氧化钠的质量除以其总质量10g既得氢氧化钠溶液中溶质的质量分数。
27.【答案】(1)无
(2)解:设HCl的溶质质量分数为x
x=7.3%
答:稀盐酸的溶质质量分数为7.3%。
【解析】【解答】(1)只有碱性溶液可以使无色酚酞变红色,B点溶液的pH值等于7,溶液呈中性,故无色酚酞不变色;
【分析】(1)根据酚酞遇中性溶液呈无色分析;
(2)根据反应的氢氧化钠(氢氧化钠溶液中溶质质量)质量代入方程式中,利用方程式中物质间质量关系计算盐酸中溶质质量及质量分数分析。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
7.1.2 溶液的酸碱性
一、单选题
1.下列物质中酸性最强的是( )
A.苹果汁(2.9~3.3) B.西瓜汁(5~6)
C.牛奶(6.3~6.6) D.牙膏(8~9)
2.下列液体酸性最强的是( )
A.柠檬汁(pH=2~3) B.酱油(pH=4~5)
C.牛奶(pH=6~7) D.鸡蛋清(pH=7~8)
3.下列生活中常见的饮品可以使紫色石蕊溶液变蓝色的是( )
A.苹果醋 B.纯牛奶 C.柠檬汁 D.苏打水
4.能使紫色石蕊试液变红的是( )
A.蒸馏水 B.盐酸 C.食盐水 D.石灰水
5.下列图像能正确反映对应变化关系的是( )
A. 在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量
B. 用胃舒平[主要成分Al(OH)3]治疗胃酸过多时胃液pH的情况
C. 向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量
D. 加热一定量氯酸钾和二氧化锰固体混合物
6.下表列出了生活中一些常见的物质的pH,其中显碱性的是( )
食物 鸡蛋清 牛奶 葡萄汁 食醋
pH 7.6~8.0 6.3~6.6 3.5~4.5 2.4~3.0
A.鸡蛋清 B.牛奶 C.葡萄汁 D.食醋
7.几种作物适宜生长的pH范围如下:
作物 茶树 水稻 薄荷 马玲薯
pH范围 5.0~5.5 6.0~7.0 7.0~8.0 4.8~5.5
取某地土壤的浸出液加入石蕊溶液,溶液略显红色,则该土壤最不适宜种植的作物是( )
A.茶树 B.薄荷 C.马玲薯 D.水稻
8.下列数据是人体内一些液体的正常pH范围,其中酸性最强的是( )
A.胃液0.9~1.5 B.唾液6.6~7.1
C.胆汁7.1~7.3 D.胰液7.5~8.0
9.下表列出了一些常见物质的pH范围,其中碱性最强的是( )
物质名称 炉具清洁剂 肥皂水 矿泉水 厕所清洁剂
pH范围 12~13 9.5~10.5 6.8~7.8 1~2
A.炉具清洁剂 B.肥皂水 C.矿泉水 D.厕所清洁剂
10.下列图像能够正确反映其对应实验过程中相关量的变化关系的是( )
A.将CO通过盛有一定量炽热Fe2O3的硬质玻璃管
B.向盛有一定量氢氧化钠溶液的烧杯中逐渐加入水
C.足量红磷在含有一定量空气的密闭容器中燃烧
D.高温煅烧一定质量的碳酸钙固体
11.向盛有一定量Ba(OH)2溶液的烧杯中逐滴滴加稀硫酸至过量,下列图像与事实不相符的是( )
A. B.
C. D.
12.生活中一些常见食物的pH如下:
食物 柠檬汁 鸡蛋清 纯水 牛奶 红豆汁
pH 2.0-2.5 7.4~7.6 7 6.3-8.5 10.2-11.4
上述食物中,胃酸过多的人不宜食用的是( )
A.柠檬汁 B.牛奶
C.鸡蛋 D.红豆汁
13.如图所示实验方案不能达到实验目的的是( )
A.证明待测溶液呈酸性
B.探究硝酸钾溶解度与温度的关系
C.探究水的组成元素
D.验证质量守恒定律
14.下列是部分饮品的近似pH范围,其中酸性最强的是( )
A.苹果汁(2.9~3.3) B.番茄汁(4.0~4.4)
C.牛奶(6.3~6.6) D.豆浆(7.4~7.9)
15.常温下,一些饮料或食物的近似pH如下:
食物 柠檬汁 橙子汁 西瓜汁 鸡蛋清
pH 2.2~2.4 3.6~4.3 5.3~6.1 7.6~8.0
下列说法中正确的是( )
A.胃酸过多的人应多喝柠檬汁 B.西瓜汁和鸡蛋清显碱性
C.西瓜汁比柠檬汁酸性强 D.柠檬汁和橙子汁显酸性
16.鲜肉是日常主要的食品之一,新鲜度可以通过测试pH来判断。据资料,pH鱼肉的新鲜度的关系为:新鲜肉pH为5.8~6.2;次鲜肉6.3~6.6;变质肉6.7以上。新鲜肉在变质过程中酸性强弱的变化为()
A.变弱 B.变强 C.不变 D.无法确定
二、填空题
17.阿依、阿卓、阿牛春游时,发现了一株被太阳晒成紫红色的蒲公英,他们将其带回家洗净、捣碎,用阿达喝的老白干浸泡,再用纱布过滤,取其汁液,将其分成两份。已知紫红色蒲公英汁与紫色石蕊性质相同,请您预测:向一份中滴入食醋,会显 色,向另一份中滴加餐具洗洁精,会显 色。
18.2019 年北京举办的世界园艺博览会展示了各色花卉千余种。不同的花卉适合不同的酸碱度土壤。北京城区土壤偏碱性,下表中适宜北京城区自然生长的花卉为 (填字母序号)。
选项 花卉种类 适宜土壤酸碱度
A 杜鹃、栀子花 5~6.8
B 迎春、夹竹桃、榆叶梅 7.3~8
C 向日葵、桃树 6~8
19.小江同学取5mL氢氧化钠溶液于试管中,滴入几滴酚酞溶液,可观察到的现象为 。
20.中央电视台暑期推出的科学类节目《加油!向未来》将科学知识融合到节目中,深受广大学生喜爱。请你参与节目回答问题:
(1)人体内含量最多的微量元素是钙还是铁? ;
(2)炒菜时油锅中的油不慎着火,可以采取的灭火方法是 ;
(3)用厨房中的白醋浸过的白色纸花,喷上一种试剂后,变成漂亮的红色小花,这种试剂是 。
三、实验探究题
21.黄冈市沧浪中学化学兴趣小组,用自制的酸碱指示剂对KNO3、NaOH、HCl等溶液的酸碱性进行测定,结果记录如下:
植物的汁液 在HCl溶液中 在KNO3溶液中 在NaOH溶液中
牵牛花瓣 红 色 紫 色 蓝 色
胡萝卜 橙 色 橙 色 橙 色
月季花瓣 浅红色 红 色 黄 色
(1)经过探究,发现 根本不宜作酸碱指示剂,这三种物质中理想的指示剂是 。
(2)小明是一个勤于思考,喜欢钻研的同学,发现了牵牛花瓣汁液遇NaOH溶液变蓝色后,思考到了一个问题:NaOH溶液中到底是哪种粒子使牵牛花汁液显蓝色呢?于是他和同学们继续探究:
【提出问题】NaOH溶液中何种粒子使牵牛花汁液发生颜色改变?
【提出猜想】猜想1:使牵牛花汁液变色的粒子是H2O
猜想2:使牵牛花汁液变色的粒子是
猜想3:使牵牛花汁液变色的粒子是 。
(3)【设计实验】
实 验 步 骤 实验现象 实 验 结 论
①向盛有少量蒸馏水的试管里,滴加2滴牵牛花汁液,振荡 溶液呈紫色 使牵牛花汁液变色的不是
②向盛有少量氯化钠溶液的试管里,滴加2滴牵牛花汁液,振荡 溶液呈紫色 使牵牛花汁液变色的不是
③ 溶液呈蓝色 使牵牛花汁液变色的只能是
22.以下是初中化学的基本实验,请回答下列问题。
(1)实验一中水的温度要求较高的理由是: ;
(2)实验二的目的是 ;
(3)依据实验三的实验现象,说明了二氧化碳的化学性质是 。
四、综合题
23.阅读下列材料,回答问题:
中国传统文化博大精深,中华美食更是名扬天下。在我国北方地区有腌制“腊八蒜”的传统,每年进入腊月后,人们将蒜瓣用食醋浸泡后密封在容器里低温储存。制作好的“腊八蒜”受到了很多人的喜爱,而且它还具有保健的功效。
大蒜是天然的杀菌食品,其中含有的大蒜素(C6H10OS2)具有很强的杀灭细菌和病毒的作用,可用于预防急性肠胃炎的发生。腌制好的“腊八蒜”减轻了生蒜的刺激性味道,但保留了抗氧化性。
(1)腌制“腊八蒜”中用到的食醋,其pH 7(填“>”“<”或“=”);
(2)大蒜中的大蒜素是由 种元素组成。
24.我国新版《生活饮用水卫生标准》于2023年4月1日正式实施。
(1)某水样检测出含氮、磷等,这里的氮、磷是指____(填序号)。
A.单质 B.分子 C.原子 D.元素
(2)为使水澄清透明,净化水时可加入絮凝剂,使杂质沉降,然后通过 (填操作名称)而实现。
(3)新标准明确规定生活饮用水的pH范围,测定水样酸碱度—pH,可选用 。
五、科普阅读题
25.阅读下列科普短文。冬季路面积雪给交通带来安全隐患,抛撒融雪剂是融雪的常用方法。
融雪剂的种类繁多,其中氯化钠、氯化钙、氯化镁等氯盐融雪剂价格低廉、融雪快,但其中的氯离子对路面等腐蚀性大。CMA类(乙酸钙镁盐)融雪剂除冰效果好、腐蚀性小,但价格高,多用于机场道路等重要场所。此外,乙酸钾(CH3COOK)、磷酸二氢钾(KH2PO4)、碳酸氢钾(KHCO3)等物质也常用于融雪。
研究人员配制出A、B两组融雪剂(如图),并与CMA类和NaCl融雪剂进行性能比对(见下表)。
不同融雪剂性能指标的检测结果
项目 技术标准 A组 B组 CMA类 NaCl
pH 6.5~9.0 7.2 7.4 9.0 7
冰点/℃ <-20.0 -23.2 -21.0 -21.0 -18.0
融雪化冰能力/mL ≥7 12.5 10.7 10.3 11
溶解速度/s ≤190 132 167 152 106
混凝土质量腐蚀/% ≤1.0 1.12 0.40 0.13 1.10
(本文中冰点指加入融雪剂后雪水的凝固温度)
研究发现,将不同融雪剂混合使用,部分性能指标优于其他两类,但仍存在一些问题,目前研究人员正在研发性能更好的融雪剂。
依据文章内容回答下列问题。
(1)MgCl2中镁元素和氯元素的质量比是 。
(2)A、B组融雪剂均属于 (填“纯净物”或“混合物”)。A组比B组腐蚀性强的原因是 。
(3)CMA类融雪剂的溶液呈 (填“酸性”、“中性”或“碱性”)。
(4)下列说法中,正确的是 (填序号)。
A
融雪剂可以降低雪水的凝固温度,使其难以形成冰
B
CMA类融雪剂的融雪化冰能力最强
C
B组融雪剂性能指标符合表中全部技术标准
六、计算题
26.将溶质质量分数为7.3%的稀盐酸逐滴加入10g氢氧化钠溶液中,边加边搅拌,随着稀盐酸的加入,溶液pH的变化如图所示。试回答:
(1)图中表示稀盐酸和氢氧化钠溶液恰好完全反应的点是 (填字母)。
(2)计算氢氧化钠溶液中溶质的质量分数。
27.常温下,一锥形瓶中盛有10g溶质质量分数为8%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加一定溶质质量分数的稀盐酸,用pH传感器测得溶液pH与加入稀盐酸的关系曲线如图所示,请回答下列问题:
(1)图中B点溶液呈 色
(2)计算稀盐酸中溶质质量分数(写出计算过程)
答案解析部分
1.【答案】A
【解析】【解答】pH越小酸性越强,因此苹果汁的酸性最强。
故答案为:A。
【分析】pH小于7时,显酸性,pH越小酸性越强。
2.【答案】A
【解析】【解答】鸡蛋清的pH大于7,显碱性;柠檬汁、酱油、牛奶等物质的pH都小于7,显酸性,柠檬汁的pH最小,酸性最强。
故答案为:A。
【分析】溶液的pH值<7,显酸性,从7到1,酸性逐渐增强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,从7到14,碱性逐渐增强。
3.【答案】D
【解析】【解答】解:石蕊遇碱变蓝色,遇酸变红色。
A、苹果醋显酸性,使石蕊变红色,不符合题意;
B、纯牛奶显中性,不使石蕊变色,故不符合题意;
C、柠檬汁显酸性,使石蕊变红色,不符合题意;
D、苏打水是碳酸氢钠溶液,显碱性,使石蕊变蓝色,故符合题意。
故答案为:D.
【分析】根据石蕊遇碱变蓝色,遇酸变红色来解答。
4.【答案】B
【解析】【解答】A. 蒸馏水显中性,不能使紫色石蕊试液变色,故不符合题意;
B. 盐酸显酸性,能使使紫色石蕊试液变红色,故符合题意;
C. 食盐水显中性,不能使紫色石蕊试液变色,故不符合题意;
D. 石灰水显碱性,能使紫色石蕊试液变蓝色,故不符合题意;
故答案为:B。
【分析】酸性溶液能使使紫色石蕊试液变红色。
5.【答案】C
【解析】【解答】根据所学知识和题中信息知,A、在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量,铁比铜活泼,铜比银活泼,铁与硝酸银溶液反应生成硝酸亚铁和银,铁与硝酸铜溶液反应生成硝酸亚铁和铜,硝酸铜的质量分数最后应变为零,A不符合题意;
B、用胃舒平[主要成分Al (OH)3 ]治疗胃酸过多时胃液pH的情况,氢氧化铝与盐酸反应生成氯化铝和水,氢氧化铝属于固体,pH值不可能超过7,B不符合题意;
C、向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量,氧化铜与稀硫酸反应生成硫酸铜和水,溶液中铜元素的质量应先增加,后达一定值,C符合题意;
D、加热一定量氯酸钾和二氧化锰固体混合物,二氧化锰是氯酸钾分解的催化剂,氯酸钾分解为氯化钾和氧气,固体中二氧化锰的质量分数应先增加,后达一定值,D不符合题意。
故答案为:C
【分析】A、铁粉过量,硝酸铜完全反应,直至为0。
B、胃液主要成分是盐酸,pH不可能大于7。
C、氧化铜是固定质量的,直至完全溶解。
D、二氧化锰是催化剂质量不变。
6.【答案】A
【解析】【解答】A. 鸡蛋清的pH在7.6~8.0之间,pH大于7 ,则显碱性,故A符合题意;
B. 牛奶的pH在6.3~6.6之间,pH小于7 ,则显酸性,故B不符合题意;
C. 葡萄汁的pH在3.5~4.5之间,pH小于7 ,则显酸性,故C不符合题意;
D. 食醋的pH在2.4~3.0之间,pH小于7 ,则显酸性,故D不符合题意。
故答案为:A。
【分析】溶液的pH值<7,显酸性,从7到1,酸性逐渐增强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,从7到14,碱性逐渐增强。
7.【答案】B
【解析】【解答】取某地土壤的浸出液加入石蕊溶液,溶液略显红色说明土壤呈酸性,薄荷在碱性土壤生成,在酸性土壤最不适宜。
故答案为:B。
【分析】溶液的pH值<7,显酸性,从7到1,酸性逐渐增强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,从7到14,碱性逐渐增强。
8.【答案】A
【解析】【解答】酸性溶液的pH<7,且pH越小,酸性越强,胃液、唾液的pH<7,且胃液的pH更小,
故答案为:A。
【分析】溶液的pH值<7,显酸性,从7到1,酸性逐渐增强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,从7到14,碱性逐渐增强。
9.【答案】A
【解析】【解答】pH<7,显酸性,pH=7,显中性,pH>7,显碱性,且pH值越大,碱性越强,炉具清洁剂的pH值最大,故炉具清洁剂的碱性最强。
故答案为:A。
【分析】根据溶液pH与酸碱性关系分析,溶液pH<7时,呈酸性,且越小酸性越强,溶液pH>7时,呈碱性,且越大碱性越强,溶液pH=7时,呈中性。
10.【答案】A
【解析】【解答】A、一氧化碳和氧化铁反应生成铁和二氧化碳,所以将CO通过盛有一定量炽热Fe2O3的硬质玻璃管,固体的质量会不断减少,当反应完毕后固体的质量不变,为一定值,故A符合题意;
B、向盛有一定量氢氧化钠溶液的烧杯中逐渐加入水,溶液仍然呈碱性,溶液的pH值不会小于7,故B不符合题意;
C、氮气的化学性质稳定,足量红磷在含有一定量空气的密闭容器中燃烧,氮气不反应,反应前后质量不会减少,故C不符合题意;
D、高温煅烧一定质量的碳酸钙固体,生成氧化钙和二氧化碳,所以固体中钙元素的质量分数会增大,当反应完毕后固体的质量分数不变,为一定值,但是开始钙元素的质量分数不为0,故D不符合题意。
故答案为:A。
【分析】本题是图像的判断题,解答时要通过题目要求分析涉及到的各物质之间量的关系,结合变化趋势先做出判断,如随着横坐标物质量的变化,纵坐标表示的物质的量的变化趋势,增加或降低等,再确定图形中的起点、终点、转折点是否符合题意。
11.【答案】D
【解析】【解答】A、向盛有一定量Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,反应生成硫酸钡和水,溶液的pH逐渐减小,恰好反应时pH为7,继续滴加稀硫酸,pH继续冲减小,不符合题意;
B、向盛有一定量Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,反应生成硫酸钡和水,溶液中氢氧根离子被氢离子消耗,逐渐减少,直至为零,不符合题意;
C、向盛有一定量Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,反应生成硫酸钡和水,反应开始就产生沉淀,逐渐增加,氢氧化钡完全反应后,不再增加,不符合题意;
D、向盛有一定量Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,反应生成硫酸钡和水,反应没有开始溶液有水,烧杯中水的质量开始不为0,符合题意。
故答案为:D。
【分析】本题是图像的判断题,解答时要通过题目要求分析涉及到的各物质之间量的关系,结合变化趋势先做出判断,如随着横坐标物质量的变化,纵坐标表示的物质的量的变化趋势,增加或降低等,再确定图形中的起点、终点、转折点是否正确。
12.【答案】A
【解析】【解答】当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性,且pH越小,酸性越强;当溶液的pH大于7时,呈碱性,且pH越大,碱性越强;胃酸过多的人不宜食用的是酸性食物。
A. 柠檬汁的pH为2.0-2.5,小于7,显酸性,故符合题意;
B. 牛奶的pH为6.3-8.5,可能显酸性、中性或碱性,故不符合题意;
C. 鸡蛋清的pH为7.6~8.0,大于7,显碱性,故不符合题意;
D. 红豆汁的pH为10.2-11.4,大于7,显碱性,故不符合题意。
故答案为:A。
【分析】酸性溶液pH值小于7,胃酸过多的人不宜食用的是酸性食物。
13.【答案】A
【解析】【解答】A. 酚酞遇碱变红,遇酸性和中性溶液不变色,所以不能用酚酞来验证溶液是否呈酸性,故A符合题意;
B. 探究硝酸钾溶解度与温度的关系,加水后溶解一部分,但还有部分固体剩余,加热后剩余固体也溶解,证明硝酸钾的溶解度随温度的升高而增加,故B正确,不符合题意;
C. 探究水的组成元素,通过电解水实验,产生氢气和氧气,证明水是由氢元素和氧元素组成的,故C正确,不符合题意;
D. 验证质量守恒定律,在天平左侧的硫酸铜溶液中加入氢氧化钠溶液,反应后天平保持平衡,证明质量守恒,故D正确,不符合题意。
故答案为:A。
【分析】A、酸性溶液、中性溶液不能使无色酚酞试液变色。
B、硝酸钾的溶解度随温度升高而升高。
C、根据质量守恒定律可知,反应前后元素的种类不变。
D、化学反应遵循质量守恒定律。
14.【答案】A
【解析】【解答】溶液的酸碱度常用pH来表示,pH范围通常在0~14之间。pH<7 溶液呈酸性;pH=7 溶液呈中性;pH>7 溶液呈碱性。pH越小,溶液的酸性越强;pH越大,溶液的碱性越强。苹果汁pH最小,
故答案为:A。
【分析】根据溶液pH与酸碱性关系分析,溶液pH<7时,呈酸性,且越小酸性越强,溶液pH>7时,呈碱性,且越大碱性越强,溶液pH=7时,呈中性。
15.【答案】D
【解析】【解答】A、柠檬汁pH 范围是2.2~2.4,pH<7,显酸性,胃酸过多的人应尽量少喝柠檬汁,否则会加重病情,故不符合题意。
B、西瓜汁pH 范围是5.3~6.1,pH<7,显酸性,鸡蛋清pH 范围是7.6~8.0,pH﹥7,显碱性,故不符合题意。
C、西瓜汁pH 范围是5.3~6.1,柠檬汁pH 范围是2.2~2.4,均小于7,且柠檬汁的pH小于西瓜汁,则柠檬汁比西瓜汁的酸性强,故不符合题意。
D、柠檬汁pH 范围是2.2~2.4,橙子汁pH 范围是3.6~4.3,均小于7,则柠檬汁和橙子汁显酸性,故符合题意。
故答案为:D。
【分析】酸性溶液的pH<7,pH越小酸性越强;碱性溶液的pH﹥7,pH越大碱性越强。
16.【答案】A
【解析】【解答】新鲜肉在变质过程中pH逐渐升高,酸性逐渐变弱,
故答案为:A。
【分析】根据溶液呈酸性时pH越大,则酸性越弱分析;
17.【答案】红;蓝
【解析】【解答】紫色石蕊遇到酸性变红,遇到碱性变蓝,所以加入食醋(显酸性)会变红色;洗洁精(显碱性、可去除油污)变蓝色。
【分析】食醋显酸性,紫色石蕊遇到酸性变红,洗洁精显碱性,遇到碱性变蓝。
18.【答案】B
【解析】【解答】土壤呈碱性,则适合种植的花卉种类应该适合在碱性土壤的环境中。碱性土壤的pH>7。所以适宜北京城区自然生长的花卉为大于7的花卉,即迎春、夹竹桃。榆叶梅。
故答案为:B。
【分析】pH>7,显碱性。
19.【答案】溶液变红
【解析】【解答】氢氧化钠溶液呈碱性,能使酚酞溶液呈红色。小江同学取5mL氢氧化钠溶液于试管中,滴入几滴酚酞溶液,可观察到的现象为溶液变红。
【分析】碱性溶液能使无色酚酞试液变红色。
20.【答案】(1)铁
(2)盖上锅盖
(3)石蕊试液
【解析】【解答】(1)人体内含量最多的微量元素是铁,钙元素是人体中的常量元素,故填:铁;(2)炒菜时油锅中的油不慎着火,可以采取盖上锅盖的灭火方法,故填:盖上锅盖;(3)用厨房中的白醋浸过的白色纸花,喷上一种试剂后,变成漂亮的红色小花,石蕊试液在酸性溶液中会变红色,故这种试剂是石蕊试液,故填:石蕊试液。
故答案为:铁;盖上锅盖;石蕊试液。
【分析】(1)根据微量元素及常量元素的种类分析;
(2)根据灭火原理分析,注意燃烧条件同时满足三个,而灭火只需撤掉其中一个即可;
(3)根据酸溶液能使石蕊变红分析。
21.【答案】(1)胡萝卜汁液;牵牛花汁液
(2)Na+;OH-
(3)H2O;Na+;向盛有少量氢氧化钠溶液的试管里,滴加2滴牵牛花汁液,振荡;OH-
【解析】【解答】①胡萝卜汁液与酸碱溶液均不变色,故不能做指示剂,牵牛花汁液与酸碱变色最明显,故最好;(2)因为NaOH溶液中存在着Na+、OH 、H2O等三种粒子,故分别猜想是这三种离子使其变色,然后分别取用含有其中一种离子的溶液进行实验,根据实验结果判断,猜想2:使牵牛花汁液变色的粒子是Na+;猜想3:使牵牛花汁液变色的粒子是OH-;
设计实验如下:
实 验 步 骤 实验现象 实 验 结 论
①向盛有少量蒸馏水的试管里,滴加2滴牵牛花汁液,振荡 溶液呈紫色 使牵牛花汁液变色的不是 ____ H2O _______
②向盛有少量氯化钠溶液的试管里,滴加2滴牵牛花汁液,振荡 溶液呈紫色 使牵牛花汁液变色的不是__ Na+______
③___向盛有少量氢氧化钠溶液的试管里,滴加2滴牵牛花汁液,振荡__ 溶液呈蓝色 使牵牛花汁液变色的只能是__ OH-___
故答案为:胡萝卜汁液;牵牛花汁液;Na+;OH-;H2O;Na+;向盛有少量氢氧化钠溶液的试管里,滴加2滴牵牛花汁液,振荡;OH-。
【分析】本题主要考查酸碱的性质及其酸碱指示剂的选择。主要根据其变色的pH范围进行选择。
22.【答案】(1)使温度达到白磷的着火点
(2)验证氢氧化钠与稀盐酸能发生中和反应
(3)二氧化碳能与水反应
【解析】【解答】(1)燃烧需要同时满足三个条件,实验一中水的温度要求较高,是因为使温度达到白磷的着火点。(2)实验二是氢氧化钠溶液与稀盐酸反应生成氯化钠和水,实验二的目的是验证氢氧化钠与稀盐酸能发生中和反应。(3)二氧化碳与水反应生成碳酸,能使紫色石蕊试纸变红,现象是湿润的紫色石蕊试纸变为红色,干燥的紫色石蕊试纸不变色,所以依据实验三的实验现象,说明了二氧化碳的化学性质是二氧化碳能与水反应。
【分析】(1)燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点,进行分析解答。(2)实验二是氢氧化钠溶液与稀盐酸反应生成氯化钠和水,进行分析解答。(3)根据二氧化碳的化学性质,进行分析解答。
23.【答案】(1)<
(2)4
【解析】【解答】(1)醋酸的溶液呈酸性,所以其pH小于7;
(2)由大蒜素(C6H10OS2)的化学式可知,大蒜素是由碳、氢、氧、硫四种元素组成的。
【分析】(1)食醋中含有醋酸,所以其pH<7;
(2)根据蒜素的化学式可知,蒜素是由四种元素组成的。
24.【答案】(1)D
(2)过滤
(3)pH试纸
【解析】【解答】(1)某水样检测出含氮、磷等,这里的氮、磷是指元素;
(2)净化水时可加入絮凝剂,使杂质沉降,然后通过过滤将固体和液体分离;
(3)测定水样酸碱度—pH,可选用 pH试纸。
【分析】(1)根据物质由元素组成,所给成分为元素分析;
(2)根据过滤的原理分析;
(3)根据pH试纸测定溶液酸碱度分析。
25.【答案】(1)24:71
(2)混合物;A组比B组氯离子含量高
(3)碱性
(4)AC
【解析】【解答】(1)MgCl2中镁元素和氯元素的质量比是24:(35.5×2)=24:71。(2)根据图示可知,A、B组融雪剂均由多种物质组成,属于混合物;根据题意,氯离子对路面等腐蚀性大,A组中含有14%的氯化钙、36%的氯化镁,B组只含有15%的氯化钙,A组比B组氯离子含量高,故A组比B组腐蚀性强。(3)CMA类融雪剂的溶液pH=9.0,大于7,故呈碱性。(4)A、融雪剂可以降低雪水的凝固温度,使其难以形成冰,正确;
B、CMA类融雪剂的融雪化冰能力对应的数字最小,能力最弱,错误;
C、根据表格,B组融雪剂性能指标符合表中全部技术标准,正确。
故答案为:AC。
【分析】(1)物质组成中各元素的质量比等于(A元素的相对原子质量*A元素的下角标):(B元素的相对原子质量*B元素的下角标)
(2)由一种物质组成的物质称为纯净物,由两种或两种以上物质组成的物质称为混合物。
(3)标准状况下,pH大于7的物质显碱性,pH等于7的物质显中性,pH小于7的物质显酸性。
(4)依据表格内容合理分析就能得到正确答案。
26.【答案】(1)b
(2)解:设氢氧化钠溶液中溶质的质量为x
x=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
【解析】【解答】(1)由图可知,b点时pH=7,说明稀盐酸和氢氧化钠溶液恰好完全反应;
【分析】(1)酸碱恰好完全中和时pH=7;
(2)先由反应掉氯化氢的质量根据化学方程式的计算,计算出参加反应的氢氧化钠的质量,最后用反应掉氢氧化钠的质量除以其总质量10g既得氢氧化钠溶液中溶质的质量分数。
27.【答案】(1)无
(2)解:设HCl的溶质质量分数为x
x=7.3%
答:稀盐酸的溶质质量分数为7.3%。
【解析】【解答】(1)只有碱性溶液可以使无色酚酞变红色,B点溶液的pH值等于7,溶液呈中性,故无色酚酞不变色;
【分析】(1)根据酚酞遇中性溶液呈无色分析;
(2)根据反应的氢氧化钠(氢氧化钠溶液中溶质质量)质量代入方程式中,利用方程式中物质间质量关系计算盐酸中溶质质量及质量分数分析。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
