6.3 物质的溶解性 第2课时 课件(共33张PPT内嵌视频) 2023-2024学年初中化学沪教版九年级下册
文档属性
| 名称 | 6.3 物质的溶解性 第2课时 课件(共33张PPT内嵌视频) 2023-2024学年初中化学沪教版九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-08 16:43:25 | ||
图片预览










文档简介
(共33张PPT)
第3节 物质的溶解性
第2课时
家庭饲养金鱼,常常向鱼缸里通入空气。
炎热的夏天,特别是黎明时分,池塘里的鱼大量浮到水面上(即“浮头” ),严重时还造成鱼群大量死亡(即“泛塘” )。
这些生活现象与什么有关 ?
1.了解溶解度的含义,会绘制和使用溶解度曲线。
2.了解结晶现象及其在生产、生活中的应用。
【探究1】物质溶解性的定量表示
活动与探究
硝酸钾
白色粉末
易溶于水
氯化钠
俗名“食盐”
易溶于水
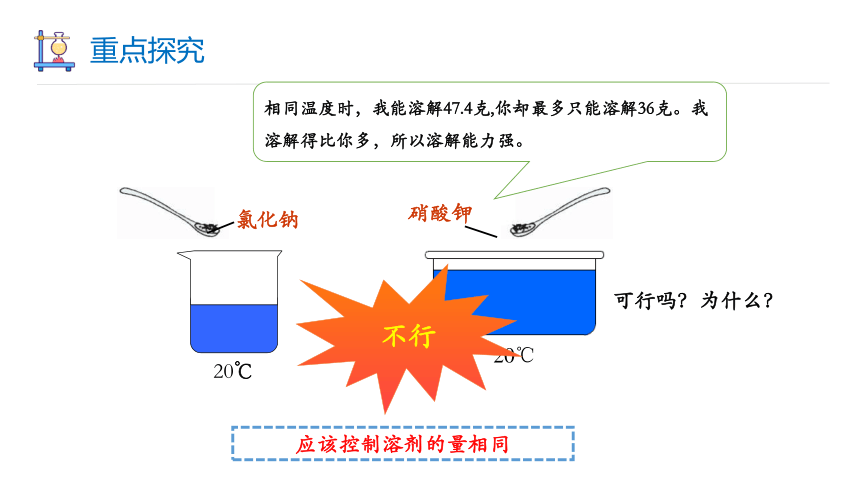
我们都知道氯化钠和硝酸钾都易溶于水,它们的溶解能力谁大呢 如何比较?
20℃
氯化钠
应该控制溶剂的量相同
可行吗?为什么?
硝酸钾
20℃
不行
相同温度时,我能溶解47.4克,你却最多只能溶解36克。我溶解得比你多,所以溶解能力强。
20℃
氯化钠
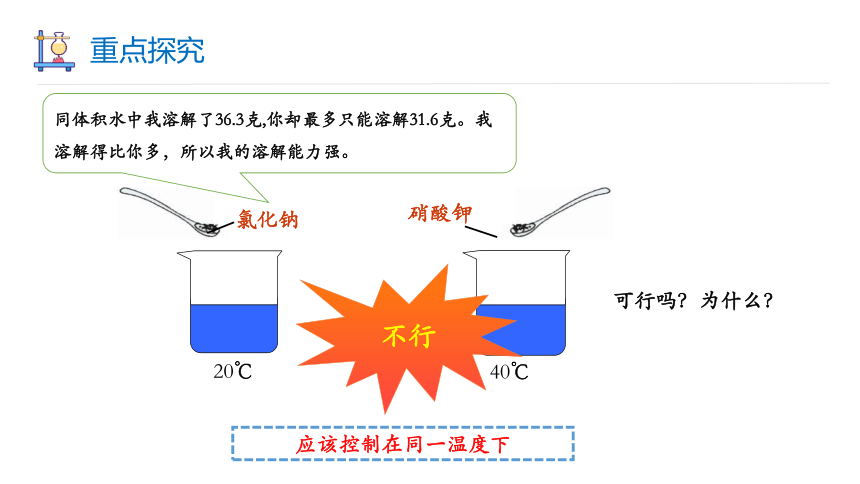
应该控制在同一温度下
可行吗?为什么?
40℃
硝酸钾
同体积水中我溶解了36.3克,你却最多只能溶解31.6克。我溶解得比你多,所以我的溶解能力强。
不行
40℃
1g硝酸钾
20℃
1g氯化钠
应该控制都达到饱和状态
可行吗?为什么?
不行
相同温度和相同体积的水,我们都能完全溶解1克,所以我们的溶解能力一样强。
交流与讨论
1.比较不同物质的溶解能力,应该控制的条件有?
定状态(达到饱和)
定温度
定溶剂的量
溶解度
概念:在一定温度下,某固态物质在100g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
一定温度
100g溶剂(一般指水)
饱和状态
条件:
标准:
溶液状态:
单位:
质量(g)
固体溶解度的四要素
化学上通常用溶解度来定量表示某种物质在某种溶剂中的溶解性。
交流与讨论
1.“20℃时,氯化钠固体的溶解度为36.0g”,其含义是什么?
在20℃时,100g水中溶解36.0g氯化钠固体,溶液达到饱和。
在20℃时,100g水中最多可溶解36.0g氯化钠固体。
温度 溶质的质量 溶剂的质量 饱和溶液的质量
20℃
31.6g
100g
131.6g
2.“20℃时,硝酸钾的溶解度是31.6g”,其饱和溶液成分质量是怎样的关系?将其关系填入下表:
m质:m剂:m液 = 31.6:100:131.6
①指该物质在此温度下,在100g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量。
②指在此温度下,该物质的饱和溶液中,溶质、溶剂与饱和溶液三者之间的质量比=S∶100g∶(100g+S)。
溶解度的含义
小结
溶解度 S≥10g 1g≤S<10g 0.01g≤S<1g S<0.01g
溶解性/20℃
交流与讨论
3.结合课本,说一说物质在水中的溶解性与溶解度有什么关系
难溶物质习惯上叫做 “不溶” 物质,但这只是相对而言,并非绝对不溶。
易溶
可溶
微溶
难溶
注意:
【探究2】溶解度曲线
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 200 246
下表是硝酸钾在不同温度时的溶解度数据
请你用纵坐标表示溶解度,横坐标表示温度,根据以上数据,在坐标纸上绘制溶解度随温度变化的曲线——溶解度曲线。
活动与探究
温度/℃
溶解度/g
交流与讨论
1.根据以上曲线,55℃时硝酸钾的溶解度是多少?其含义是什么?除此之外,你得出了什么结论?
伴随温度升高,硝酸钾的溶解度越来越高。
根据图象,55℃时,硝酸钾的溶解度大概是95。
代表在55℃时,100g水中可以溶解95g的硝酸钾。
2.溶解度曲线图中各个点的意义是?
(1)曲线上每个点表示某温度下某溶质的溶解度。(a点)
换句话说:溶解度曲线上的每个点都是该溶质在该温度下的一种饱和溶液。
(2)两条曲线的交点表示在该温度下两种物质的溶解度相等。(b点)
(3)曲线下方的点表示对应温度下该溶质的不饱和溶液。(c点)
(4)曲线上方的点表示以该数据配置的溶液在该温度下为饱和溶液,且有未溶解完的溶质。(d点)
a
b
c
d
3.如图是氢氧化钙的溶解度曲线,根据曲线你得出的结论是什么?
氢氧化钙的溶解度随着温度的升高而减小
4.通过溶解度曲线,可以得到哪些信息?
①可以判断固体物质的溶解度受温度影响的变化情况。
②可以比较不同物质在同一温度时溶解度的大小。
③可以查出同一种物质在不同温度时的溶解度。
【探究3】气体物质的溶解度
观察与思考
结合生活事例,想一想其中的道理。
拉开可口可乐易拉罐时,有大量的气体泡沫喷出
喝了汽水后会打嗝
1.打开汽水瓶盖时,汽水为什么会喷出。这说明气体在水中的溶解度与什么有关?
2.喝了汽水后,为什么会打嗝,这说明气体的溶解度还与什么有关?
3.对于气体物质,研究它的质量方便还是体积方便?
气体的溶解度
在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时溶解的气体体积。
打开瓶塞,压强减小,CO2溶解性减弱,所以从水中逸出
温度升高,CO2溶解性减弱,从体内逸出
影响气体溶解度的因素(外因)
压强:气体溶解度一般随压强增大而增大,减小而减小。
温度:气体溶解度一般随温度升高而减少,降低而增大。
气体溶解度的五要素:
①压强101kPa ②一定温度 ③1体积水 ④达到饱和状态 ⑤气体体积
2.气体溶解度与固体溶解度的区别是?
固体溶解度 气体溶解度
溶剂的量
条件不同
单位
100g
1体积
受温度影响
受温度、压强影响
g
体积
【探究4】结晶
完成【实验1】、【实验2】,观察现象,回答问题。
活动与探究
【实验1】用酒精灯加热10mL浓的氯化钠溶液,用玻璃棒搅拌至出现较多晶体时停止加热。
交流与讨论
【实验1】中有哪些操作要点?
操作要点
(1)蒸发皿中的液体量不能超过蒸发皿容积的2/3。
(2)加热时,用玻璃棒不断搅拌,防止局部温度过高造成液滴飞溅。
(3)当蒸发皿中出现较多量固体时,停止加热,并用玻璃棒不断搅拌,利用余热将剩余水分蒸干。
(4)热的蒸发皿用坩埚钳夹持放在石棉网上,以免烫坏实验桌。
【实验2】在一个盛有 30 mL 沸水的烧杯中不断加入硝酸钾,配制成硝酸钾饱和溶液,将烧杯放在冷水中降温,观察实验现象。
冷却后硝酸钾晶体从溶液中析出
1.结晶的方法有哪些?
交流与讨论
蒸发溶剂结晶法:加热到较高温度时,溶解度随温度变化不大的物质随着溶剂的减少析出。
a.析出晶体前溶液必须达到饱和状态.
b.改变条件(蒸发溶剂、降低温度),溶剂溶解溶质的量下降,使饱和溶液析出晶体
2.结晶的条件有哪些?
冷却结晶法:在较高温度时,形成的饱和溶液因降温超过其溶解量的限度,溶质析出。
3.为什么食盐溶液结晶用蒸发溶剂的方法,而硝酸钾溶液结晶则用冷却热饱和溶液(即降温结晶)的方法?你能根据二者的溶解度随温度改变的规律来做出解释吗?
降温结晶
1.90℃时,109克的某物质溶在100克水中得到溶液①,当温度从90℃降到60℃时,得到溶液②,这时溶液中是否有晶体析出?
溶液①与溶液②的溶质质量分数是否相同?
2.当温度从60℃降到40℃时得到溶液③,这时溶液中有没有晶体析出?析出多少克?
3.当温度从40℃降到20℃时得到溶液④,这时又有多少克晶体析出?
否
是
有,45g
32g
适用于S受t影响较大的固体溶质
饱和氯化钠溶液降温能否析出大量晶体?
用什么方法可以使氯化钠晶体析出?
蒸发结晶
尤其适用于S受t影响较小的固体物质
不能
蒸发结晶
利用结晶法,可以将我们需要的物质从含杂质的混合物中分离或提纯出来。
例如,海水晒盐、蔗汁制糖
结晶法的应用
联想与启示
1.室温下,向一定质量的氯化钠溶液中加入10g氯化钠固体,充分搅拌后,尚有部分固体未溶解。再加入10g水后,固体全部溶解,下列判断正确的是 ( )
A.加水前一定是饱和溶液
B.加水前可能是饱和溶液
C.加水后一定是饱和溶液
D.加水后一定是不饱和溶液
A
2.为了增大硝酸钾的溶解度,可采取的方法是( )
A.加入大量硝酸钾固体 B.升高温度
C.加入大量水 D.降低温度
B
3.10℃时,20g水中溶解了2g甲物质,正好形成饱和溶液;50℃时,100g水中最多溶解乙物质25g。则甲、乙两种物质的溶解度大小关系是( )
A.甲=乙 B.甲<乙 C.甲>乙 D.无法比较
D
4.恒温条件下,盛放在敞口容器中的饱和食盐水久置后会有少量晶体析出,这是因为( )
A. 溶剂量减小 B. 溶解度减小
C. 溶液不稳定 D. 生成了新物质
A
5.适宜使用结晶法分离的一组混合物是( )
A. KCl和KNO3 B. KCl和MnO2
C. NaCl和泥沙 D. S和C
A
溶解度
概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
固体溶解度
气体溶解度
影响因素
内因:溶质、溶剂本身的性质
外因:温度[多数固体物质溶解度随温度的升高而增大]
概念:在压强为101 kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积
影响因素
内因:溶质、溶剂本身的性质
外因:温度(温度越高,气体的溶解度越小)、压强(压强越大,气体
的溶解度越大)
溶解度曲线
饱和溶液
饱和溶液
饱和溶液冷却结晶法
蒸发溶剂结晶法
结晶
第3节 物质的溶解性
第2课时
家庭饲养金鱼,常常向鱼缸里通入空气。
炎热的夏天,特别是黎明时分,池塘里的鱼大量浮到水面上(即“浮头” ),严重时还造成鱼群大量死亡(即“泛塘” )。
这些生活现象与什么有关 ?
1.了解溶解度的含义,会绘制和使用溶解度曲线。
2.了解结晶现象及其在生产、生活中的应用。
【探究1】物质溶解性的定量表示
活动与探究
硝酸钾
白色粉末
易溶于水
氯化钠
俗名“食盐”
易溶于水
我们都知道氯化钠和硝酸钾都易溶于水,它们的溶解能力谁大呢 如何比较?
20℃
氯化钠
应该控制溶剂的量相同
可行吗?为什么?
硝酸钾
20℃
不行
相同温度时,我能溶解47.4克,你却最多只能溶解36克。我溶解得比你多,所以溶解能力强。
20℃
氯化钠
应该控制在同一温度下
可行吗?为什么?
40℃
硝酸钾
同体积水中我溶解了36.3克,你却最多只能溶解31.6克。我溶解得比你多,所以我的溶解能力强。
不行
40℃
1g硝酸钾
20℃
1g氯化钠
应该控制都达到饱和状态
可行吗?为什么?
不行
相同温度和相同体积的水,我们都能完全溶解1克,所以我们的溶解能力一样强。
交流与讨论
1.比较不同物质的溶解能力,应该控制的条件有?
定状态(达到饱和)
定温度
定溶剂的量
溶解度
概念:在一定温度下,某固态物质在100g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
一定温度
100g溶剂(一般指水)
饱和状态
条件:
标准:
溶液状态:
单位:
质量(g)
固体溶解度的四要素
化学上通常用溶解度来定量表示某种物质在某种溶剂中的溶解性。
交流与讨论
1.“20℃时,氯化钠固体的溶解度为36.0g”,其含义是什么?
在20℃时,100g水中溶解36.0g氯化钠固体,溶液达到饱和。
在20℃时,100g水中最多可溶解36.0g氯化钠固体。
温度 溶质的质量 溶剂的质量 饱和溶液的质量
20℃
31.6g
100g
131.6g
2.“20℃时,硝酸钾的溶解度是31.6g”,其饱和溶液成分质量是怎样的关系?将其关系填入下表:
m质:m剂:m液 = 31.6:100:131.6
①指该物质在此温度下,在100g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量。
②指在此温度下,该物质的饱和溶液中,溶质、溶剂与饱和溶液三者之间的质量比=S∶100g∶(100g+S)。
溶解度的含义
小结
溶解度 S≥10g 1g≤S<10g 0.01g≤S<1g S<0.01g
溶解性/20℃
交流与讨论
3.结合课本,说一说物质在水中的溶解性与溶解度有什么关系
难溶物质习惯上叫做 “不溶” 物质,但这只是相对而言,并非绝对不溶。
易溶
可溶
微溶
难溶
注意:
【探究2】溶解度曲线
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 200 246
下表是硝酸钾在不同温度时的溶解度数据
请你用纵坐标表示溶解度,横坐标表示温度,根据以上数据,在坐标纸上绘制溶解度随温度变化的曲线——溶解度曲线。
活动与探究
温度/℃
溶解度/g
交流与讨论
1.根据以上曲线,55℃时硝酸钾的溶解度是多少?其含义是什么?除此之外,你得出了什么结论?
伴随温度升高,硝酸钾的溶解度越来越高。
根据图象,55℃时,硝酸钾的溶解度大概是95。
代表在55℃时,100g水中可以溶解95g的硝酸钾。
2.溶解度曲线图中各个点的意义是?
(1)曲线上每个点表示某温度下某溶质的溶解度。(a点)
换句话说:溶解度曲线上的每个点都是该溶质在该温度下的一种饱和溶液。
(2)两条曲线的交点表示在该温度下两种物质的溶解度相等。(b点)
(3)曲线下方的点表示对应温度下该溶质的不饱和溶液。(c点)
(4)曲线上方的点表示以该数据配置的溶液在该温度下为饱和溶液,且有未溶解完的溶质。(d点)
a
b
c
d
3.如图是氢氧化钙的溶解度曲线,根据曲线你得出的结论是什么?
氢氧化钙的溶解度随着温度的升高而减小
4.通过溶解度曲线,可以得到哪些信息?
①可以判断固体物质的溶解度受温度影响的变化情况。
②可以比较不同物质在同一温度时溶解度的大小。
③可以查出同一种物质在不同温度时的溶解度。
【探究3】气体物质的溶解度
观察与思考
结合生活事例,想一想其中的道理。
拉开可口可乐易拉罐时,有大量的气体泡沫喷出
喝了汽水后会打嗝
1.打开汽水瓶盖时,汽水为什么会喷出。这说明气体在水中的溶解度与什么有关?
2.喝了汽水后,为什么会打嗝,这说明气体的溶解度还与什么有关?
3.对于气体物质,研究它的质量方便还是体积方便?
气体的溶解度
在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时溶解的气体体积。
打开瓶塞,压强减小,CO2溶解性减弱,所以从水中逸出
温度升高,CO2溶解性减弱,从体内逸出
影响气体溶解度的因素(外因)
压强:气体溶解度一般随压强增大而增大,减小而减小。
温度:气体溶解度一般随温度升高而减少,降低而增大。
气体溶解度的五要素:
①压强101kPa ②一定温度 ③1体积水 ④达到饱和状态 ⑤气体体积
2.气体溶解度与固体溶解度的区别是?
固体溶解度 气体溶解度
溶剂的量
条件不同
单位
100g
1体积
受温度影响
受温度、压强影响
g
体积
【探究4】结晶
完成【实验1】、【实验2】,观察现象,回答问题。
活动与探究
【实验1】用酒精灯加热10mL浓的氯化钠溶液,用玻璃棒搅拌至出现较多晶体时停止加热。
交流与讨论
【实验1】中有哪些操作要点?
操作要点
(1)蒸发皿中的液体量不能超过蒸发皿容积的2/3。
(2)加热时,用玻璃棒不断搅拌,防止局部温度过高造成液滴飞溅。
(3)当蒸发皿中出现较多量固体时,停止加热,并用玻璃棒不断搅拌,利用余热将剩余水分蒸干。
(4)热的蒸发皿用坩埚钳夹持放在石棉网上,以免烫坏实验桌。
【实验2】在一个盛有 30 mL 沸水的烧杯中不断加入硝酸钾,配制成硝酸钾饱和溶液,将烧杯放在冷水中降温,观察实验现象。
冷却后硝酸钾晶体从溶液中析出
1.结晶的方法有哪些?
交流与讨论
蒸发溶剂结晶法:加热到较高温度时,溶解度随温度变化不大的物质随着溶剂的减少析出。
a.析出晶体前溶液必须达到饱和状态.
b.改变条件(蒸发溶剂、降低温度),溶剂溶解溶质的量下降,使饱和溶液析出晶体
2.结晶的条件有哪些?
冷却结晶法:在较高温度时,形成的饱和溶液因降温超过其溶解量的限度,溶质析出。
3.为什么食盐溶液结晶用蒸发溶剂的方法,而硝酸钾溶液结晶则用冷却热饱和溶液(即降温结晶)的方法?你能根据二者的溶解度随温度改变的规律来做出解释吗?
降温结晶
1.90℃时,109克的某物质溶在100克水中得到溶液①,当温度从90℃降到60℃时,得到溶液②,这时溶液中是否有晶体析出?
溶液①与溶液②的溶质质量分数是否相同?
2.当温度从60℃降到40℃时得到溶液③,这时溶液中有没有晶体析出?析出多少克?
3.当温度从40℃降到20℃时得到溶液④,这时又有多少克晶体析出?
否
是
有,45g
32g
适用于S受t影响较大的固体溶质
饱和氯化钠溶液降温能否析出大量晶体?
用什么方法可以使氯化钠晶体析出?
蒸发结晶
尤其适用于S受t影响较小的固体物质
不能
蒸发结晶
利用结晶法,可以将我们需要的物质从含杂质的混合物中分离或提纯出来。
例如,海水晒盐、蔗汁制糖
结晶法的应用
联想与启示
1.室温下,向一定质量的氯化钠溶液中加入10g氯化钠固体,充分搅拌后,尚有部分固体未溶解。再加入10g水后,固体全部溶解,下列判断正确的是 ( )
A.加水前一定是饱和溶液
B.加水前可能是饱和溶液
C.加水后一定是饱和溶液
D.加水后一定是不饱和溶液
A
2.为了增大硝酸钾的溶解度,可采取的方法是( )
A.加入大量硝酸钾固体 B.升高温度
C.加入大量水 D.降低温度
B
3.10℃时,20g水中溶解了2g甲物质,正好形成饱和溶液;50℃时,100g水中最多溶解乙物质25g。则甲、乙两种物质的溶解度大小关系是( )
A.甲=乙 B.甲<乙 C.甲>乙 D.无法比较
D
4.恒温条件下,盛放在敞口容器中的饱和食盐水久置后会有少量晶体析出,这是因为( )
A. 溶剂量减小 B. 溶解度减小
C. 溶液不稳定 D. 生成了新物质
A
5.适宜使用结晶法分离的一组混合物是( )
A. KCl和KNO3 B. KCl和MnO2
C. NaCl和泥沙 D. S和C
A
溶解度
概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
固体溶解度
气体溶解度
影响因素
内因:溶质、溶剂本身的性质
外因:温度[多数固体物质溶解度随温度的升高而增大]
概念:在压强为101 kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积
影响因素
内因:溶质、溶剂本身的性质
外因:温度(温度越高,气体的溶解度越小)、压强(压强越大,气体
的溶解度越大)
溶解度曲线
饱和溶液
饱和溶液
饱和溶液冷却结晶法
蒸发溶剂结晶法
结晶
