6.2.1溶液的组成溶液浓度的表示课件(共28张PPT 内嵌视频)2023-2024学年度沪教版化学九年级下册
文档属性
| 名称 | 6.2.1溶液的组成溶液浓度的表示课件(共28张PPT 内嵌视频)2023-2024学年度沪教版化学九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 27.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 09:07:08 | ||
图片预览







文档简介
(共28张PPT)
九年级下册
沪教版
课时1 溶液的组成
溶液浓度的表示
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 知道溶液的组成,知道常见溶剂有水、酒精、汽油等。
2. 知道溶质、溶剂等概念,能说出一些常见溶液的溶质和溶剂。
3. 学会溶液组成的一种表示方法——溶质的质量分数。
4. 能运用溶质的质量分数公式进行简单的计算,以及配制一定溶质质量分数的溶液。
重难点
重点
重点
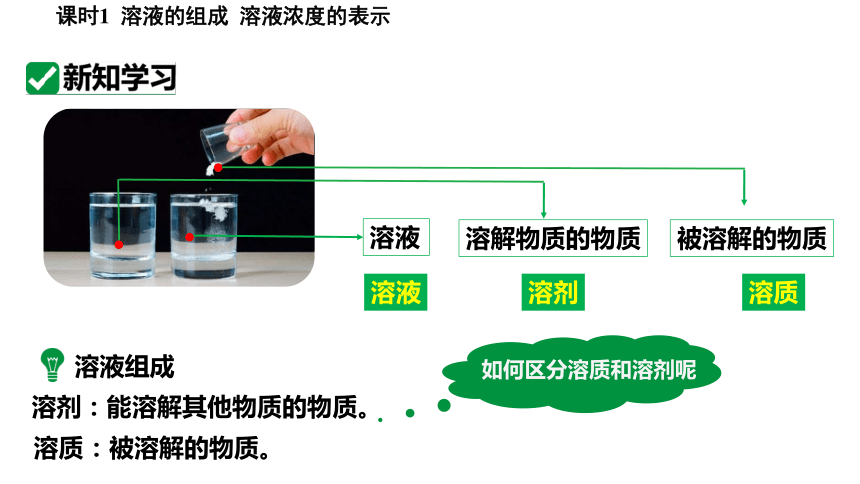
高锰酸钾、食盐、蔗糖、泥土(或粉笔灰)和食用油与等量适量的水充分混合,哪些物质能形成溶液?形成的溶液具有什么特征?
高锰酸钾、食盐、蔗糖溶于水能形成均一、稳定的溶液
以上物质溶于水形成的溶液中分别有哪些物质?我们如何使用化学语言来规范的描述和表达它们呢?
溶质
溶剂
溶液
溶液
被溶解的物质
溶解物质的物质
溶液组成
溶剂:能溶解其他物质的物质。
溶质:被溶解的物质。
如何区分溶质和溶剂呢
溶质:
溶剂:
一般为液体,水是最常用的溶剂,汽油、酒精也是溶剂
可以是固体、液体、气体
一种溶液中的溶质可以是一种或多种
一种溶液中的溶剂只有一种
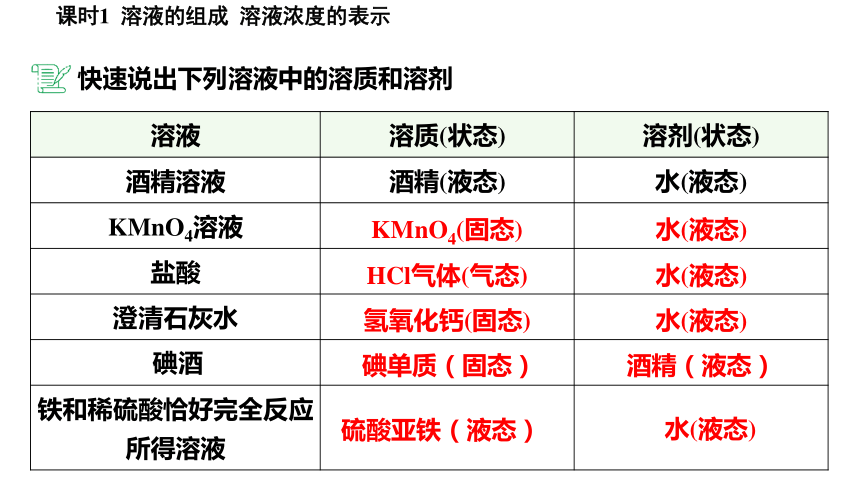
溶液 溶质(状态) 溶剂(状态)
酒精溶液 酒精(液态) 水(液态)
KMnO4溶液
盐酸
澄清石灰水
碘酒
铁和稀硫酸恰好完全反应所得溶液
快速说出下列溶液中的溶质和溶剂
KMnO4(固态)
水(液态)
HCl气体(气态)
水(液态)
碘单质(固态)
酒精(液态)
硫酸亚铁(液态)
水(液态)
氢氧化钙(固态)
水(液态)
溶质和溶剂的判断
(1)固体、气体和液体混合形成的溶液,固体、气体为溶质,液体为溶剂。
(2)液体和液体混合形成的溶液,量多的视为溶剂,量少的视为溶质,但凡有水则一律视水为溶剂。
如:酒精和水互溶时,将水当作溶剂,酒精当作溶质。
(3)物质溶解时如果发生化学变化,溶质为反应后可溶于水的生成物。
溶液与溶质、溶剂之间量的关系
(1)质量关系:溶液质量=溶质质量+溶剂质量
(2)体积关系:溶液体积一般小于溶质体积与溶剂体积之和
为什么体积会变小?
未溶解的部分不能计算在溶质质量中
我们知道化学物质的种类非常的多,能形成溶液的数量也特别庞大,那么如何给溶液命名呢?
?
“某溶质”的“某溶剂”溶液;水是溶剂时省略溶剂水得名称,简称“某溶质”溶液
如:
(1)碘单质的酒精溶液→碘酒
(2)氯化钠的水溶液→氯化钠溶液
称取3g蔗糖加到烧杯中,再用量筒量取20mL水加入烧杯中,搅拌使蔗糖完全溶解,得到蔗糖溶液①。
称取5g蔗糖加到烧杯中,再用量筒量取50mL水加入烧杯中,搅拌使蔗糖完全溶解,得到蔗糖溶液②。
“有颜色的溶液我们可以通过溶液颜色深浅粗略判断溶液的浓稀;蔗糖溶液可以通过品尝粗略判断溶液的浓稀,但对于无色、不能品尝的大多溶液而言,我们如何精确的描述两份溶液的浓度呢?
溶液的浓度
一定量溶液中所含溶质的量叫做溶液的浓度。溶液的浓度有多种方法表示,常用溶液中所含溶质的质量分数来表示:即溶液的溶质质量分数。
(1)溶液的溶质质量分数:溶质质量与溶液质量之比,常用百分数表示。
(2)计算公式:
=
溶质的质量分数 =
溶液 溶质质量 /g 溶剂质量 /g 溶液质量 /g
蔗糖溶液① 3 20 23
蔗糖溶液② 5 50 55
通过计算是不是也可以知道哪一份更甜了呢
13%
9%
1
4
2
3
蔗糖的质量占整个溶液质量的9%
每9g蔗糖溶于91g水形成的溶液
100g蔗糖溶液中含有蔗糖9g
m蔗糖:m水:m蔗糖溶液
=9:91:100
9%的蔗糖溶液的含义。
溶液中溶质的质量分数的理解
①溶质的质量指的是形成溶液的那部分溶质的质量,不包括没有溶解的或析出的溶质 。
②计算时上下质量单位要统一,需要×100%,最后结果要写成百分数。
③溶液具有稳定性,只要外界条件不变,其溶质的质量分数不变。
④溶液具有均一性,溶液的任意部分的浓度均相等。
溶液的质量可以通过溶液的体积和密度进行计算
溶液的质量(g) = 溶液的体积(mL)×溶液密度(g·mL-1)
m(溶液 ) =V(溶液 )×ρ(溶液 )
如:20mL密度为0.3g/mL的氯化钠溶液的质量为:
m =20mL×0.3g/mL=6g
如何配制50 g质量分数为6%的氯化钠溶液?观看实验视频,并记录实验步骤
实验用品:
食盐、蒸馏水等
托盘天平(含砝码)、纸片、药匙、烧杯、量筒、胶头滴管、玻璃棒等
操作流程:
每个步骤都用到了哪
些仪器?
实验步骤:
①计算:需要食盐质量:50g × 6% = 3g
需要水的质量:50g – 3g = 47g ,即47mL
②称量:用托盘天平称量3 g食盐(注意左物右码)
③量取:用量筒量取47mL水(当快接近刻度线时,改用胶头滴管滴加,注意量筒平放、视线与凹液面最低点相平)
④溶解:用玻璃棒搅拌,使氯化钠溶解
(玻璃棒作用:搅拌,加快固体溶解)
⑤转移:将配制好的溶液装入试剂瓶中,贴上标签,标签上应包括药品的名称、化学式、溶液的质量分数
氯化钠溶液
NaCl 6%
溶质多了→变 .
溶质少了→变 .
溶剂多了→变 .
溶剂少了→变 .
溶质质量变化引起的质量分数变化
溶剂质量变化引起的质量分数变化
①固体药品中含水分( )
②固体药品转移时有损失( )
③称量时药品和砝码放颠倒且动了游码( )
④烧杯内壁有水( )
⑥量水时仰视读数( )
⑦量水时俯视读数( )
⑧量好的水倒入烧杯时溅出 ( )
⑨配制好的溶液装瓶时撒出一部分( )
⑤砝码生锈( )
实验时出现以下情况,对溶质质量分数有什么影响?
偏小
偏小
偏小
偏小
偏大
偏大
不变
偏小
偏大
关键点:溶质或溶剂质量的变化情况
(ω偏大)
稀
浓
(ω偏小)
(ω偏大)
(ω偏小)
浓
稀
溶液的组成
配制一定浓度的氯化钠溶液
溶液的组成
溶液浓度的表示
溶质
溶剂
=
溶液质量
溶质质量
溶质的质量分数
×100%
①计算:②称量:③量取:④溶解:⑤转移
1.某氯化钠溶液的溶质质量分数为16%,它表示的含义是 ( )
A.溶液中含有氯化钠16g B.溶液质量为100g
C.每100g溶液中含氯化钠16g D.每100g水中溶解了16g氯化钠
C
2. 配制50g溶质质量分数为6%的氢氧化钠溶液,不需要用到的仪器是
( )
C
3.要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90mL水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
D
4. 农业上常用16%的NaCl溶液来选种。实验室欲配制100g该溶质质量分数的溶液,下列说法不正确的是( )
A. 计算所需氯化钠的质量为16g
B. 量取水时当液面接近刻度时改用胶头滴管
C. 溶解过程中玻璃棒的作用是搅拌
D. 配制好的溶液中溶质和溶剂的质量比为4∶25
D
(1)所得溶液中,溶质与溶剂质量比为1:2的是( )
A. ① B. ② C. ③ D. ④
5. 用MgCl2溶液喷洒路面可融雪、防尘。20℃时,按下表数据配制溶液,回答问题。
C
序号 ① ② ③ ④
MgCl2的质量/g 30 40 50 60
水的质量/g 100 100 100 100
(2)①中溶质的质量分数约为( )
A. 23% B. 30% C. 35% D. 43%
A
6.20 ℃时,配制80 g溶质质量分数为10%的NaOH溶液。
(1)用图中仪器完成实验,还缺少的玻璃仪器是_______(填名称)。
(2)玻璃棒在配制实验中的作用是________________。
(3)配制该溶液需要_____g水。
(4)经测定,配制的溶液中溶质质量分数小于10%,其原因可能是___。
A. NaOH固体本身不纯 B. 称量固体时左码右物
C. 量取的水没有完全转移到烧杯
烧杯
搅拌、加速溶解
72
AB
7. 100 g某硫酸恰好与13 g锌完全反应。试计算这种硫酸中溶质的质量分数。
化学反应中若有溶液参加,反应的实质是溶液中的溶质参加反应。
如果已知条件是混合物或溶液质量时,该如何带入化学方程式?
须代入纯净物(溶质)的质量进行计算。
设稀硫酸溶液中含溶质的质量为x
Zn + H2SO4 = ZnSO4 + H2↑
解:
65
98
13g
x
65
98
13g
x
x=19.6g
19.6g
100g
×100%
=19.6%
则该硫酸中溶质的质量分数为
答:则该硫酸中溶质的质量分数为19.6%
=
九年级下册
沪教版
课时1 溶液的组成
溶液浓度的表示
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 知道溶液的组成,知道常见溶剂有水、酒精、汽油等。
2. 知道溶质、溶剂等概念,能说出一些常见溶液的溶质和溶剂。
3. 学会溶液组成的一种表示方法——溶质的质量分数。
4. 能运用溶质的质量分数公式进行简单的计算,以及配制一定溶质质量分数的溶液。
重难点
重点
重点
高锰酸钾、食盐、蔗糖、泥土(或粉笔灰)和食用油与等量适量的水充分混合,哪些物质能形成溶液?形成的溶液具有什么特征?
高锰酸钾、食盐、蔗糖溶于水能形成均一、稳定的溶液
以上物质溶于水形成的溶液中分别有哪些物质?我们如何使用化学语言来规范的描述和表达它们呢?
溶质
溶剂
溶液
溶液
被溶解的物质
溶解物质的物质
溶液组成
溶剂:能溶解其他物质的物质。
溶质:被溶解的物质。
如何区分溶质和溶剂呢
溶质:
溶剂:
一般为液体,水是最常用的溶剂,汽油、酒精也是溶剂
可以是固体、液体、气体
一种溶液中的溶质可以是一种或多种
一种溶液中的溶剂只有一种
溶液 溶质(状态) 溶剂(状态)
酒精溶液 酒精(液态) 水(液态)
KMnO4溶液
盐酸
澄清石灰水
碘酒
铁和稀硫酸恰好完全反应所得溶液
快速说出下列溶液中的溶质和溶剂
KMnO4(固态)
水(液态)
HCl气体(气态)
水(液态)
碘单质(固态)
酒精(液态)
硫酸亚铁(液态)
水(液态)
氢氧化钙(固态)
水(液态)
溶质和溶剂的判断
(1)固体、气体和液体混合形成的溶液,固体、气体为溶质,液体为溶剂。
(2)液体和液体混合形成的溶液,量多的视为溶剂,量少的视为溶质,但凡有水则一律视水为溶剂。
如:酒精和水互溶时,将水当作溶剂,酒精当作溶质。
(3)物质溶解时如果发生化学变化,溶质为反应后可溶于水的生成物。
溶液与溶质、溶剂之间量的关系
(1)质量关系:溶液质量=溶质质量+溶剂质量
(2)体积关系:溶液体积一般小于溶质体积与溶剂体积之和
为什么体积会变小?
未溶解的部分不能计算在溶质质量中
我们知道化学物质的种类非常的多,能形成溶液的数量也特别庞大,那么如何给溶液命名呢?
?
“某溶质”的“某溶剂”溶液;水是溶剂时省略溶剂水得名称,简称“某溶质”溶液
如:
(1)碘单质的酒精溶液→碘酒
(2)氯化钠的水溶液→氯化钠溶液
称取3g蔗糖加到烧杯中,再用量筒量取20mL水加入烧杯中,搅拌使蔗糖完全溶解,得到蔗糖溶液①。
称取5g蔗糖加到烧杯中,再用量筒量取50mL水加入烧杯中,搅拌使蔗糖完全溶解,得到蔗糖溶液②。
“有颜色的溶液我们可以通过溶液颜色深浅粗略判断溶液的浓稀;蔗糖溶液可以通过品尝粗略判断溶液的浓稀,但对于无色、不能品尝的大多溶液而言,我们如何精确的描述两份溶液的浓度呢?
溶液的浓度
一定量溶液中所含溶质的量叫做溶液的浓度。溶液的浓度有多种方法表示,常用溶液中所含溶质的质量分数来表示:即溶液的溶质质量分数。
(1)溶液的溶质质量分数:溶质质量与溶液质量之比,常用百分数表示。
(2)计算公式:
=
溶质的质量分数 =
溶液 溶质质量 /g 溶剂质量 /g 溶液质量 /g
蔗糖溶液① 3 20 23
蔗糖溶液② 5 50 55
通过计算是不是也可以知道哪一份更甜了呢
13%
9%
1
4
2
3
蔗糖的质量占整个溶液质量的9%
每9g蔗糖溶于91g水形成的溶液
100g蔗糖溶液中含有蔗糖9g
m蔗糖:m水:m蔗糖溶液
=9:91:100
9%的蔗糖溶液的含义。
溶液中溶质的质量分数的理解
①溶质的质量指的是形成溶液的那部分溶质的质量,不包括没有溶解的或析出的溶质 。
②计算时上下质量单位要统一,需要×100%,最后结果要写成百分数。
③溶液具有稳定性,只要外界条件不变,其溶质的质量分数不变。
④溶液具有均一性,溶液的任意部分的浓度均相等。
溶液的质量可以通过溶液的体积和密度进行计算
溶液的质量(g) = 溶液的体积(mL)×溶液密度(g·mL-1)
m(溶液 ) =V(溶液 )×ρ(溶液 )
如:20mL密度为0.3g/mL的氯化钠溶液的质量为:
m =20mL×0.3g/mL=6g
如何配制50 g质量分数为6%的氯化钠溶液?观看实验视频,并记录实验步骤
实验用品:
食盐、蒸馏水等
托盘天平(含砝码)、纸片、药匙、烧杯、量筒、胶头滴管、玻璃棒等
操作流程:
每个步骤都用到了哪
些仪器?
实验步骤:
①计算:需要食盐质量:50g × 6% = 3g
需要水的质量:50g – 3g = 47g ,即47mL
②称量:用托盘天平称量3 g食盐(注意左物右码)
③量取:用量筒量取47mL水(当快接近刻度线时,改用胶头滴管滴加,注意量筒平放、视线与凹液面最低点相平)
④溶解:用玻璃棒搅拌,使氯化钠溶解
(玻璃棒作用:搅拌,加快固体溶解)
⑤转移:将配制好的溶液装入试剂瓶中,贴上标签,标签上应包括药品的名称、化学式、溶液的质量分数
氯化钠溶液
NaCl 6%
溶质多了→变 .
溶质少了→变 .
溶剂多了→变 .
溶剂少了→变 .
溶质质量变化引起的质量分数变化
溶剂质量变化引起的质量分数变化
①固体药品中含水分( )
②固体药品转移时有损失( )
③称量时药品和砝码放颠倒且动了游码( )
④烧杯内壁有水( )
⑥量水时仰视读数( )
⑦量水时俯视读数( )
⑧量好的水倒入烧杯时溅出 ( )
⑨配制好的溶液装瓶时撒出一部分( )
⑤砝码生锈( )
实验时出现以下情况,对溶质质量分数有什么影响?
偏小
偏小
偏小
偏小
偏大
偏大
不变
偏小
偏大
关键点:溶质或溶剂质量的变化情况
(ω偏大)
稀
浓
(ω偏小)
(ω偏大)
(ω偏小)
浓
稀
溶液的组成
配制一定浓度的氯化钠溶液
溶液的组成
溶液浓度的表示
溶质
溶剂
=
溶液质量
溶质质量
溶质的质量分数
×100%
①计算:②称量:③量取:④溶解:⑤转移
1.某氯化钠溶液的溶质质量分数为16%,它表示的含义是 ( )
A.溶液中含有氯化钠16g B.溶液质量为100g
C.每100g溶液中含氯化钠16g D.每100g水中溶解了16g氯化钠
C
2. 配制50g溶质质量分数为6%的氢氧化钠溶液,不需要用到的仪器是
( )
C
3.要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90mL水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
D
4. 农业上常用16%的NaCl溶液来选种。实验室欲配制100g该溶质质量分数的溶液,下列说法不正确的是( )
A. 计算所需氯化钠的质量为16g
B. 量取水时当液面接近刻度时改用胶头滴管
C. 溶解过程中玻璃棒的作用是搅拌
D. 配制好的溶液中溶质和溶剂的质量比为4∶25
D
(1)所得溶液中,溶质与溶剂质量比为1:2的是( )
A. ① B. ② C. ③ D. ④
5. 用MgCl2溶液喷洒路面可融雪、防尘。20℃时,按下表数据配制溶液,回答问题。
C
序号 ① ② ③ ④
MgCl2的质量/g 30 40 50 60
水的质量/g 100 100 100 100
(2)①中溶质的质量分数约为( )
A. 23% B. 30% C. 35% D. 43%
A
6.20 ℃时,配制80 g溶质质量分数为10%的NaOH溶液。
(1)用图中仪器完成实验,还缺少的玻璃仪器是_______(填名称)。
(2)玻璃棒在配制实验中的作用是________________。
(3)配制该溶液需要_____g水。
(4)经测定,配制的溶液中溶质质量分数小于10%,其原因可能是___。
A. NaOH固体本身不纯 B. 称量固体时左码右物
C. 量取的水没有完全转移到烧杯
烧杯
搅拌、加速溶解
72
AB
7. 100 g某硫酸恰好与13 g锌完全反应。试计算这种硫酸中溶质的质量分数。
化学反应中若有溶液参加,反应的实质是溶液中的溶质参加反应。
如果已知条件是混合物或溶液质量时,该如何带入化学方程式?
须代入纯净物(溶质)的质量进行计算。
设稀硫酸溶液中含溶质的质量为x
Zn + H2SO4 = ZnSO4 + H2↑
解:
65
98
13g
x
65
98
13g
x
x=19.6g
19.6g
100g
×100%
=19.6%
则该硫酸中溶质的质量分数为
答:则该硫酸中溶质的质量分数为19.6%
=
