6.3物质的溶解性课件(共65张PPT 内嵌视频)2023-2024学年度沪教版化学九年级下册
文档属性
| 名称 | 6.3物质的溶解性课件(共65张PPT 内嵌视频)2023-2024学年度沪教版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 25.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 00:00:00 | ||
图片预览










文档简介
(共65张PPT)
第3节 物质的溶解性
(潘东子巧妙运盐中的化学知识)
九年级下册
沪教版
学习目标
新知学习
课堂小结
1
2
3
1. 能够说出饱和溶液和不饱和溶液的涵义。了解两者互变的途径。
2. 能准确描述固体溶解度的概念,知道温度对常见固体物质溶解度的影响。
3. 知道气体溶解度,能说出温度、压强对气体溶解度的影响。
4. 能看懂溶解度曲线,会利用溶解度曲线来获取相关信息。
5. 能举例说明结晶现象;能够说出使饱和溶液析出晶体的方法。
6. 能解释从海水中提取食盐(海水晒盐)的原理。
新知学习
同学们好,上课前我先给 大家讲一个少年英雄潘冬子的故事,潘冬子是经典电影《闪闪的红星》中的一个角色,在他十岁的时候,受到父母的影响,他一心想要参加红军,于是他巧妙地与敌人周旋,冒险为游击队送盐,巧妙躲避敌人的搜查,在此过程中,他应用了一些化学知识,下面我们一起学习在潘冬子运盐的过程中都应用了哪些化学相关知识。
过程1 食盐溶水欲上山——影响物质溶解性的因素
潘东子利用食盐易溶于水的性质试图将食盐送给游记队战士。
一种物质(溶质)溶解在另一种物质(溶剂)里的能力叫做物质的溶解性。
问题1:物质的溶解性与什么因素有关呢?
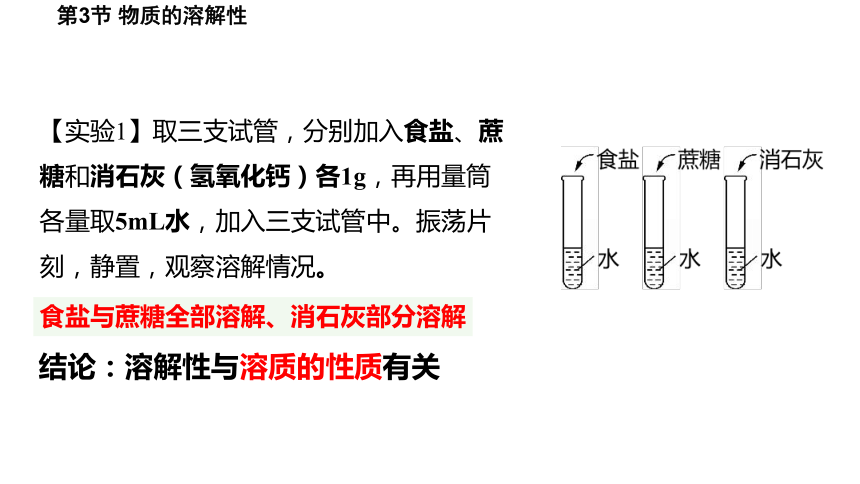
【实验1】取三支试管,分别加入食盐、蔗糖和消石灰(氢氧化钙)各1g,再用量筒各量取5mL水,加入三支试管中。振荡片刻,静置,观察溶解情况。
食盐与蔗糖全部溶解、消石灰部分溶解
结论:溶解性与溶质的性质有关
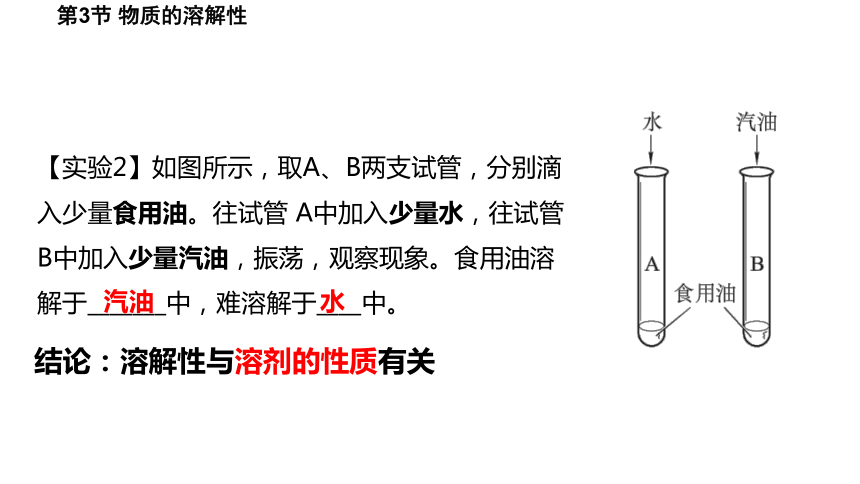
【实验2】如图所示,取A、B两支试管,分别滴入少量食用油。往试管 A中加入少量水,往试管B中加入少量汽油,振荡,观察现象。食用油溶解于_______中,难溶解于____中。
水
汽油
结论:溶解性与溶剂的性质有关
【实验3】取1支试管,加入3g硝酸钾,然后加入5mL水,充分振荡,硝酸钾是否能完全溶解?如不能完全溶解,将试管加热,观察发生的变化。
起始时,硝酸钾部分溶解
加热后,试管底部的固体全部溶解
结论:物质溶解性与温度有关
溶质 溶剂 温度 结论
探究1
探究2
探究3
溶解性与温度有关
溶解性与溶质的性质有关
溶解性与溶剂的性质有关
相同
相同
不同
相同
相同
不同
相同
相同
不同
分析
对比实验:(控制变量法)
影响物质溶解的因素
温度
内因
溶质性质
不同的物质在同一溶剂中的溶解性不同。如食盐和蔗糖可溶于水,而氢氧化钙则较难溶于水。
溶剂性质
同一种物质在不同溶剂中的溶解性不同。如食用油难溶于水,却易溶于汽油等有机溶剂。
外因
同一种物质在同一溶剂中的溶解性与温度有关。
归纳
一般来说,多数物质的溶解性随着温度的升高而增大,但氢氧化钙则相反。
大衣、羽绒服常常需要干洗,你知道干洗的原理吗?
干洗衣物的干洗剂有多种,成分主要是四氯化碳、三氯甲烷、汽油、香精等,清洗时用细沙布蘸取干洗剂擦拭油污,使油污溶解在溶剂里,然后在空气中晾晒使溶剂挥发。
过程1 食盐溶水欲上山——认识饱和溶液
潘东子利用食盐易溶于水的性质试图将食盐送给游记队战士。
问题2:食盐(溶质)能不能无限制地溶解在一定量的水中呢?
【实验1】取一瓶底部留有硝酸钾晶体的硝酸钾溶液,分别取出20mL上层清液加入A、B两个试管中,再向两个试管中分别加入2g硝酸钾晶体,充分振荡,观察现象。
KNO3固体不能继续溶解
2g
硝酸钾
20ml硝酸钾溶液
A
2g
硝酸钾
B
20ml硝酸钾溶液
结论:一定温度下,硝酸钾在水中溶解的量是有限度的
【实验2】在A试管中再加入5mL水,观察未溶解的硝酸钾是否继续溶解。
【实验3】在酒精灯上加热B试管,观察未溶解的硝酸钾是否继续溶解。
5ml水
A
20ml硝酸钾溶液+2g硝酸钾
20ml硝酸钾溶液
B
KNO3固体继续溶解
KNO3固体继续溶解
结论:在一定量的溶剂中,硝酸钾溶解的量随温度的升高而增大
一定温度下,向一定量溶剂里加入某种溶质,
当溶质不能再继续溶解时,得到的溶液叫做这种溶质的饱和溶液;
还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
总结
在一定温度下,饱和的氯化钠溶液还能再溶解蔗糖吗?
这说明了什么?
过程1 食盐溶水欲上山——判断饱和溶液
潘东子利用食盐易溶于水的性质试图将食盐送给游记队战士。
问题3:如何判断食盐水是否已经饱和?
现在有两杯食盐溶液,其中一份中有未溶解的食盐固体,另一份中没有未溶解的食盐固体,如何判断它们是饱和的还是不饱和的?
?
原溶液是饱和溶液
原溶液是不饱和溶液
不能继续溶解
若溶液中有未溶解的溶质,且溶质的量不再减少
能继续溶解
观察法
观察法
实验法
向溶液中加入该溶质
判断某溶液是否饱和的方法
通过上述实验分析判断,饱和溶液和不饱和溶液之间是可以相互转化的
过程2 灵机一动“盐上身”
通过关卡的时候,东子意识到使用竹筒盛食盐水的方法可能会被发现导致运送失败,他灵机一动跑到河边将竹筒里的食盐水倒在里面的棉衣上,成功躲过敌人搜查。
问题4:如何将食盐“提取”出来?
过程3 淘洗蒸煮现盐形——认识结晶
成功过关卡之后,冬子和爷爷一起将棉衣放在水中浸泡,然后将盐水放到铁锅里煮,最后得到白花花的食盐。
饱和溶液改变条件后,有晶体析出。形成晶体的过程。
结晶:
【实验2 】在一个盛有10mL沸水的烧杯中不断加入硝酸钾,配制成硝酸钾饱和溶液,将烧杯放在冷水中降温,观察实验现象。
实验现象:硝酸钾的饱和溶液中析出晶体
【实验1】取10mL浓的氯化钠溶液,用酒精灯加热,用玻璃棒搅拌至出现较多晶体时停止加热,利用余温蒸发剩余的水分。
析出晶体原因:
(1)析出晶体前溶液已达到饱和状态。
(2)改变条件(蒸发溶剂、降低温度),溶剂溶解溶质的量下降(对大多数固体而言),使饱和溶液析出晶体。
溶解度/g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
氯化钠
硝酸钾
为什么食盐溶液结晶用蒸发溶剂的方法,而硝酸钾溶液结晶则用冷却热饱和溶液(即冷却结晶又叫降温结晶)的方法?你能根据二者的溶解性随温度改变的规律来做出解释吗?
饱 和 溶 液
结 晶
冷 却
溶解性随温度升高而增大,且随温度变化改变明显的溶质
蒸发溶剂
溶解性随温度改变不明显的溶质
结晶方法
如何在混有少量NaCl的KNO3中获得较纯净的KNO3
溶解度/g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
氯化钠
硝酸钾
混合物
加热溶解
KNO3
降温
KNO3析出
量少
且溶解性随温度降低变化不大
不饱和,不结晶
热溶液
量大
且溶解性随温度降低显著下降
易饱和,易结晶
NaCl
结晶方法
结晶方法 原理 适用情况 举例
冷却热饱和溶液法 (降温结晶法)
蒸发溶剂法 (蒸发结晶法)
将溶液制成较高温度下的饱和溶液,再降温冷却,析出晶体,过滤得到晶体
溶解性受温度影响变化较大的固态物质
从KNO3饱和溶液中得到KNO3晶体
将溶液加热蒸发,使其达到饱和后,继续蒸发溶剂,溶质结晶析出
溶解性受温度影响变化不大的固态物质
从NaCl饱和溶液中得到NaCl晶体
蒸发
②加热时,应不断用玻璃棒搅拌溶液,防止液体
因局部温度过高造成液滴飞溅;
③加热到蒸发皿中出现较多固体时,停止加热,
并用玻璃棒继续搅拌,利用余热将溶剂蒸干;
④热的蒸发皿应用坩埚钳夹持小心地放在陶土网上。
(1)蒸发仪器:蒸发皿、酒精灯、玻璃棒
(2)操作要点:
玻璃棒
蒸发皿
酒精灯
①蒸发皿中的液体量不宜超过蒸发皿容积的 ;
蒸发
你有听说过“夏天晒盐”、“冬天捞碱”吗,它们分别运用的是什么原理?
夏天盐田 冬天碱池
海水晒盐过程
海水
贮水池
蒸发池
结晶池
粗盐
母液
氯化钠
多种化工产品
(将泥沙沉降)
析出晶体后的溶液叫母液,对于析出的溶质来说是饱和溶液。
(也叫苦卤,是氯化钠的饱和溶液)
(利用风吹和日晒使水分蒸发)
海水晒盐制得的食盐中常有少量泥沙,如何除去泥沙获得较纯净的食盐呢?
粗盐的初步提纯
实验用品:
粗盐(含难溶性杂质)、蒸馏水;
托盘天平(含砝码)、漏斗、纸片、药匙、烧杯、量筒、胶头滴管、玻璃棒、铁架台(带铁圈)、滤纸、酒精灯、蒸发皿、坩埚钳、陶土网、火柴、剪刀等。
实验装置及步骤:
(1)称量与溶解:用托盘天平称取2g左右粗盐,并用量筒量取10mL蒸馏水,将粗盐和蒸馏水转移到烧杯中,用玻璃棒搅拌,使粗盐充分溶解。
(2)过滤:制作过滤器,并进行过滤操作。仔细观察滤纸上的剩余物及滤液的颜色。若滤液浑浊,则必须重新过滤。
(3)蒸发:将过滤后所得的溶液转移至蒸发皿中,将蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液。待蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干。
(4)转移:将所得精盐转移到滤纸称量,计算产率。
蒸发
因为海水中含有一些可溶性杂质,因此得到的精盐并不是纯净物
蒸发结晶适用于分离易溶物和难溶物
实验中多次使用玻璃棒,作用一样吗?
(1)溶解时,玻璃棒的作用是搅拌,加快溶解
(2)过滤时,玻璃棒的作用是引流
(3)蒸发时,防止液体因局部温度过高造成液滴飞溅,且加快蒸发速度
(4)转移时,玻璃棒的作用是转移固体
溶液的变化——饱和溶液与不饱和溶液的转化
棉衣浸泡后的溶液
有食盐析出的溶液
不饱和溶液
饱和溶液
蒸发溶剂
?
问题5 饱和溶液和不饱和溶液如何相互转化?
②升高温度,饱和硝酸钾溶液变为不饱和溶液;
①增加溶剂,饱和硝酸钾溶液变为不饱和溶液;
一般情况下固体溶质的溶液,饱和溶液与不饱和溶液之间的相互转化方法:
加溶剂、升高温度
加入溶质、蒸发溶剂、
降低温度
饱和
溶液
不饱和
溶液
适用于任何溶液
(其中温度影响可用于大多数固体物质)Ca(OH)2等除外!
辩一辩
饱和溶液一定是浓溶液
稀溶液一定是
不饱和溶液
他们谁是正确的?
饱和溶液,不饱和溶液与浓溶液和稀溶液的关系
(1)饱和溶液不一定是浓溶液;
(2)不饱和溶液不一定是稀溶液;
(3)相同溶质、相同温度:饱和溶液一定比不饱和溶液浓。
浓溶液
稀溶液
饱和溶液
不饱和溶液
从定量的角度来看运盐过程——物质溶解性的定量表示
潘东子利用食盐易溶于水的性质试图将食盐送给游记队战士。
问题6:一定温度下,在一定量溶剂里,溶质的溶解量是有一定限度的。如何准确表示这个限度呢?
溶解度:在一定温度下,该物质在100g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量。
条件
标准
状态
单位
在一定温度下
在100g溶剂里
(一般指水)
溶液达到饱和
“g”
溶解度的四要素
S
表示
例:在20℃时,氯化钠溶解度是36g。以下有关说法是否正确?如不正确请说明原因。
(1)20℃时,100g 水最多能溶解氯化钠固体 36g。
(2)20℃时,将 36g 氯化钠固体溶解于 100g 水中,所得溶液是氯化钠的饱和溶液。
(3)10g 水最多溶解氯化钠固体 3.6g。
例:在20℃时,氯化钠溶解度是36g。以下有关说法是否正确?如不正确请说明原因。
(4)20℃时,100g 氯化钠饱和溶液中含有氯化钠 36g。
(5)20℃时,氯化钠溶液中水与氯化钠的质量比为 25:9。
(6)20℃时,从足量氯化钠饱和溶液中蒸发 100g 水,能析出 36g 氯化钠晶体。
20℃时氯化钠和硝酸钾的溶解能力谁强?
常见物质的溶解度(20℃)
物质名称 氯化钠 氢氧化钙 蔗 糖 氯酸钾 氯化铵 硝酸钾
溶解度/克 36.0 0.165 203.9 7.4 37.2 31.6
溶解度/g(20℃) <0.01 0.01~1 1~10 >10
溶解性 难溶 微溶 可溶 易溶
举例 AgCl Ca(OH)2 KClO3 KNO3
溶解性只是定性地说明某种物质在某种溶剂里溶解能力的大小,而溶解度是衡量某种物质在某种溶剂里溶解性强弱的尺度。
常温下(20℃)溶解度与溶解性的关系
溶解度与溶解性有什么关系呢?
.
.
.
0.01g
1g
10g
难(不)溶
微溶
可溶
易溶
同一固体物质在不同温度下的溶解度不同,该用什么方法表示该物质的溶解度呢?
(1)列表法(溶解度表格)
温度/℃ 0 10 20 30 40 50 60 70
溶解 度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138
从表中你能获取到哪些信息?
溶解度/g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
饱和
不饱和
根据硝酸钾溶解度曲线,你能得到哪些信息?
(2)图像法(溶解度曲线)
物质在水中的溶解度随温度的变化而变化的曲线。横坐标表示温度,纵坐标表示溶解度。
硝酸钾
溶解度/g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
饱和
不饱和
硝酸钾
点:
曲线上的点:表示某物质在对应温度下的溶解度
线:
溶解度随温度的变化趋势:硝酸钾的溶解度随温度的升高而增大
面:
①曲线以上的区域:表示该溶质的饱和溶液且有未溶解的固体;
②曲线以下的区域:表示该溶质的不饱和溶液
2.在40℃时,比较硝酸钾的溶解度与硝酸钠的溶解度大小。
观察图示回答下列问题:
S硝酸钾<S硝酸钠
3.在80℃时,比较氯化钠、氯化钾、氯化铵、硼酸的溶解度由大到小的顺序
S氯化铵>S氯化钾>S氯化钠>S硼酸
1.两曲线交点B有何意义?
在68℃时,硝酸钾与硝酸钠的溶解度相等.
4.在80℃时,计算饱和硝酸钠的溶质质量分数。
60%
B
5.几种物质的溶解度随温度的变化趋势如何?
①陡升型:大多数固体物质的溶解度随温度的升高而增大明显。
②缓升型:少数固体物质的溶解度随温度的升高而增大不明显。
③下降型:极少数固体物质的溶解度随温度的升高而减小。
如:KNO3
如:NaCl
如:Ca(OH)2
溶解度曲线的应用
①查某种物质在某温度时的溶解度。
②判断物质的溶解度随温度变化的趋势。
③比较不同物质在同一温度时的溶解度大小。
④比较物质的溶解度受温度变化影响的大小,进一步确定该物质的结晶方法。
⑤确定某物质的饱和溶液和不饱和溶液的转化方法。
列表法和曲线图法表示物质的溶解度时,它们的优点和局限性各是什么呢?
(1)制汽水时常常需要加压,而打开汽水瓶盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
(2)喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
气体溶解度随温度升高而降低。
气体溶解度随压强的增大而增大。
议一议
气体的溶解度:气体的溶解度是指压强为101kPa和一定温度时,某气体在 1体积水里溶解达到饱和状态时的体积。
影响气体溶解度的因素
内因
外因
溶质和溶剂本身的性质
在压强不变的条件下,气体的溶解度随温度的升高而减小,反之则增大
在温度不变的条件下,气体的溶解度随压强的增大而增大,反之则减小
影响气体溶解度的因素
(1)天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
议一议
(2)探究铁生锈条件的实验中,一支试管中的蒸馏水需要煮沸迅速冷却的原因是什么?
迅速冷却的沸水
课堂小结
问题1:物质的溶解性与什么因素有关呢?
问题2:食盐(溶质)能不能无限制地溶解在一定量的水中呢?
问题3:如何判断食盐水是否已经饱和?
问题4:如何将食盐“提取”出来?
问题5 饱和溶液和不饱和溶液如何相互转化?
问题6:一定温度下,在一定量溶剂里,溶质的溶解量是有一定限度的。如何准确表示这个限度呢?
A
B
C
D
1. 硝酸钾易溶于水。室温下,若在某硝酸钾溶液中加入硝酸钾,观察到硝酸钾继续溶解,原溶液是 ________ (选填“饱和”或“不饱和”)溶液;当加入的硝酸钾固体不能继续溶解时,说明此时溶液已处于________ (选填“饱和”或“不饱和”)状态。 加热片刻,剩余的固体全部溶解,此时溶液的状态为________ (选填“饱和”“不饱和”或“无法确定”)。
不饱和
饱和
无法确定
2. 炎热的夏天,喝汽水有助于解渴消暑。
(1)打开汽水瓶盖,发现有大量的气泡逸出,这说明气体的溶解度与____有关。
(2)喝了汽水以后,常常打嗝,这说明气体的溶解度与_____有关。
(3)在家中也可以自制汽水,一般采用凉开水制汽水的原因是__________
_________________________________________________________。
压强
温度
CO2的溶解
度随温度的降低而增大,凉开水温度较低,溶解的二氧化碳较多
(4)夏天从4℃的冰箱冷藏室里拿出一杯底部还有少量蔗糖晶体的溶液 a, 在室温下放置 一段时间后(不考虑水的蒸发),
发现晶体消失了,得到溶液b。 下列有关说法
中正确的是( )
A. 溶 液 a 与溶液b 质量相等
B. 溶 液 a 一定是饱和溶液
C. 溶 液 b 中的溶质减少
D. 该过程中蔗糖的溶解度不变
B
3. 海水晒盐的大致过程如下,请回答下列问题。
(1)海水是氯化钠的________(选填"饱和"或"不饱和")溶液。
(2)将海水引入贮水池一段时间后,可以发现池底有沉淀,说明此过程的主要作用是除去 ________。
(3)在蒸发池中,主要通过___________的方式蒸发水分,在此过程中,氯化钠质量的变化情况是 ______,水的质量的变化情况是________。
不饱和
泥沙等
太阳能日晒
不变
减小
3. 海水晒盐的大致过程如下,请回答下列问题。
(4)结晶池中的粗盐是________(选填“纯净物”或“混合物”)。
(5)对母液进行加工,可以获得多种化工产品,说明海水中除氯化钠外,还含有________________。
混合物
多种矿物质等
4.实验室中有两瓶失去标签的白色固体,只知道其中一瓶是氯化钠,另一瓶是碳酸钙,为了区别这两瓶白色固体,我们可采用哪种物理方法?
分别取样,加入适量水,若能溶解,则是氯化钠,若不能溶解,则是碳酸钙。
5.已知20℃时,100克水中溶解36克NaCl刚好成为饱和溶液。
(1)在此温度下, 100克水中加入33克NaCl,得到的溶液是_______溶液。
(2)再加3克NaCl,得到的溶液是______溶液。
(3)继续加3克NaCl,得到的溶液是 ______溶液,溶液的质量为______克 。
不饱和
饱和
饱和
136
6. 甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题。
(1)t3℃时,三种物质的溶解度由小到大的顺序是____________。
(2)t2℃时,____和____的溶解度相等。
t2
溶解度/g
甲
乙
丙
t1
t3
温度/℃
甲
丙
乙 = 丙 < 甲
(3)三种物质中,___的溶解度受温度的影响最大,___的溶解度受温度的影响最小,___的溶解度随温度的升高而减小。
甲
乙
丙
(2021安徽)阅读下列短文,回答问题。
红色经典影片《闪闪的红星》中有一段儿童团员潘冬子给红军送盐的故事。冬子开始把食盐装在竹筒中,打算扮作上山砍柴的人将食盐送给红军。途中发现敌人盘查严格,冬子急中生智跑到河边,把竹筒里的食盐全部溶成盐水,再用棉袄吸收,最终顺利地将食盐送给了红军。
真题再现
(1)从微观角度分析,氯化钠是由_____(填“分子”“原子”或“离子”)构成;从元素角度分析,氯化钠溶液中+1价的元素有_______(填元素符号)。
离子
Na、H
(2)从盐水中重新得到食盐固体,需进行操作的名称是________。
(3)氯化钠的溶解度曲线如图。假设冬子的竹筒中有358 g氯化钠,10℃时最少需用________g水溶解。
(4)氯化钠在生活中的用途有_____________(写出1点即可)。
蒸发
1000
制作调味品
胡萝卜如果生吃,其中的β-胡萝卜素只有25%被吸收,如果用食用油烹调后,则能吸收95%,查阅资料了解吸收效率高低的原因。
拓展与实践
第3节 物质的溶解性
(潘东子巧妙运盐中的化学知识)
九年级下册
沪教版
学习目标
新知学习
课堂小结
1
2
3
1. 能够说出饱和溶液和不饱和溶液的涵义。了解两者互变的途径。
2. 能准确描述固体溶解度的概念,知道温度对常见固体物质溶解度的影响。
3. 知道气体溶解度,能说出温度、压强对气体溶解度的影响。
4. 能看懂溶解度曲线,会利用溶解度曲线来获取相关信息。
5. 能举例说明结晶现象;能够说出使饱和溶液析出晶体的方法。
6. 能解释从海水中提取食盐(海水晒盐)的原理。
新知学习
同学们好,上课前我先给 大家讲一个少年英雄潘冬子的故事,潘冬子是经典电影《闪闪的红星》中的一个角色,在他十岁的时候,受到父母的影响,他一心想要参加红军,于是他巧妙地与敌人周旋,冒险为游击队送盐,巧妙躲避敌人的搜查,在此过程中,他应用了一些化学知识,下面我们一起学习在潘冬子运盐的过程中都应用了哪些化学相关知识。
过程1 食盐溶水欲上山——影响物质溶解性的因素
潘东子利用食盐易溶于水的性质试图将食盐送给游记队战士。
一种物质(溶质)溶解在另一种物质(溶剂)里的能力叫做物质的溶解性。
问题1:物质的溶解性与什么因素有关呢?
【实验1】取三支试管,分别加入食盐、蔗糖和消石灰(氢氧化钙)各1g,再用量筒各量取5mL水,加入三支试管中。振荡片刻,静置,观察溶解情况。
食盐与蔗糖全部溶解、消石灰部分溶解
结论:溶解性与溶质的性质有关
【实验2】如图所示,取A、B两支试管,分别滴入少量食用油。往试管 A中加入少量水,往试管B中加入少量汽油,振荡,观察现象。食用油溶解于_______中,难溶解于____中。
水
汽油
结论:溶解性与溶剂的性质有关
【实验3】取1支试管,加入3g硝酸钾,然后加入5mL水,充分振荡,硝酸钾是否能完全溶解?如不能完全溶解,将试管加热,观察发生的变化。
起始时,硝酸钾部分溶解
加热后,试管底部的固体全部溶解
结论:物质溶解性与温度有关
溶质 溶剂 温度 结论
探究1
探究2
探究3
溶解性与温度有关
溶解性与溶质的性质有关
溶解性与溶剂的性质有关
相同
相同
不同
相同
相同
不同
相同
相同
不同
分析
对比实验:(控制变量法)
影响物质溶解的因素
温度
内因
溶质性质
不同的物质在同一溶剂中的溶解性不同。如食盐和蔗糖可溶于水,而氢氧化钙则较难溶于水。
溶剂性质
同一种物质在不同溶剂中的溶解性不同。如食用油难溶于水,却易溶于汽油等有机溶剂。
外因
同一种物质在同一溶剂中的溶解性与温度有关。
归纳
一般来说,多数物质的溶解性随着温度的升高而增大,但氢氧化钙则相反。
大衣、羽绒服常常需要干洗,你知道干洗的原理吗?
干洗衣物的干洗剂有多种,成分主要是四氯化碳、三氯甲烷、汽油、香精等,清洗时用细沙布蘸取干洗剂擦拭油污,使油污溶解在溶剂里,然后在空气中晾晒使溶剂挥发。
过程1 食盐溶水欲上山——认识饱和溶液
潘东子利用食盐易溶于水的性质试图将食盐送给游记队战士。
问题2:食盐(溶质)能不能无限制地溶解在一定量的水中呢?
【实验1】取一瓶底部留有硝酸钾晶体的硝酸钾溶液,分别取出20mL上层清液加入A、B两个试管中,再向两个试管中分别加入2g硝酸钾晶体,充分振荡,观察现象。
KNO3固体不能继续溶解
2g
硝酸钾
20ml硝酸钾溶液
A
2g
硝酸钾
B
20ml硝酸钾溶液
结论:一定温度下,硝酸钾在水中溶解的量是有限度的
【实验2】在A试管中再加入5mL水,观察未溶解的硝酸钾是否继续溶解。
【实验3】在酒精灯上加热B试管,观察未溶解的硝酸钾是否继续溶解。
5ml水
A
20ml硝酸钾溶液+2g硝酸钾
20ml硝酸钾溶液
B
KNO3固体继续溶解
KNO3固体继续溶解
结论:在一定量的溶剂中,硝酸钾溶解的量随温度的升高而增大
一定温度下,向一定量溶剂里加入某种溶质,
当溶质不能再继续溶解时,得到的溶液叫做这种溶质的饱和溶液;
还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
总结
在一定温度下,饱和的氯化钠溶液还能再溶解蔗糖吗?
这说明了什么?
过程1 食盐溶水欲上山——判断饱和溶液
潘东子利用食盐易溶于水的性质试图将食盐送给游记队战士。
问题3:如何判断食盐水是否已经饱和?
现在有两杯食盐溶液,其中一份中有未溶解的食盐固体,另一份中没有未溶解的食盐固体,如何判断它们是饱和的还是不饱和的?
?
原溶液是饱和溶液
原溶液是不饱和溶液
不能继续溶解
若溶液中有未溶解的溶质,且溶质的量不再减少
能继续溶解
观察法
观察法
实验法
向溶液中加入该溶质
判断某溶液是否饱和的方法
通过上述实验分析判断,饱和溶液和不饱和溶液之间是可以相互转化的
过程2 灵机一动“盐上身”
通过关卡的时候,东子意识到使用竹筒盛食盐水的方法可能会被发现导致运送失败,他灵机一动跑到河边将竹筒里的食盐水倒在里面的棉衣上,成功躲过敌人搜查。
问题4:如何将食盐“提取”出来?
过程3 淘洗蒸煮现盐形——认识结晶
成功过关卡之后,冬子和爷爷一起将棉衣放在水中浸泡,然后将盐水放到铁锅里煮,最后得到白花花的食盐。
饱和溶液改变条件后,有晶体析出。形成晶体的过程。
结晶:
【实验2 】在一个盛有10mL沸水的烧杯中不断加入硝酸钾,配制成硝酸钾饱和溶液,将烧杯放在冷水中降温,观察实验现象。
实验现象:硝酸钾的饱和溶液中析出晶体
【实验1】取10mL浓的氯化钠溶液,用酒精灯加热,用玻璃棒搅拌至出现较多晶体时停止加热,利用余温蒸发剩余的水分。
析出晶体原因:
(1)析出晶体前溶液已达到饱和状态。
(2)改变条件(蒸发溶剂、降低温度),溶剂溶解溶质的量下降(对大多数固体而言),使饱和溶液析出晶体。
溶解度/g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
氯化钠
硝酸钾
为什么食盐溶液结晶用蒸发溶剂的方法,而硝酸钾溶液结晶则用冷却热饱和溶液(即冷却结晶又叫降温结晶)的方法?你能根据二者的溶解性随温度改变的规律来做出解释吗?
饱 和 溶 液
结 晶
冷 却
溶解性随温度升高而增大,且随温度变化改变明显的溶质
蒸发溶剂
溶解性随温度改变不明显的溶质
结晶方法
如何在混有少量NaCl的KNO3中获得较纯净的KNO3
溶解度/g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
氯化钠
硝酸钾
混合物
加热溶解
KNO3
降温
KNO3析出
量少
且溶解性随温度降低变化不大
不饱和,不结晶
热溶液
量大
且溶解性随温度降低显著下降
易饱和,易结晶
NaCl
结晶方法
结晶方法 原理 适用情况 举例
冷却热饱和溶液法 (降温结晶法)
蒸发溶剂法 (蒸发结晶法)
将溶液制成较高温度下的饱和溶液,再降温冷却,析出晶体,过滤得到晶体
溶解性受温度影响变化较大的固态物质
从KNO3饱和溶液中得到KNO3晶体
将溶液加热蒸发,使其达到饱和后,继续蒸发溶剂,溶质结晶析出
溶解性受温度影响变化不大的固态物质
从NaCl饱和溶液中得到NaCl晶体
蒸发
②加热时,应不断用玻璃棒搅拌溶液,防止液体
因局部温度过高造成液滴飞溅;
③加热到蒸发皿中出现较多固体时,停止加热,
并用玻璃棒继续搅拌,利用余热将溶剂蒸干;
④热的蒸发皿应用坩埚钳夹持小心地放在陶土网上。
(1)蒸发仪器:蒸发皿、酒精灯、玻璃棒
(2)操作要点:
玻璃棒
蒸发皿
酒精灯
①蒸发皿中的液体量不宜超过蒸发皿容积的 ;
蒸发
你有听说过“夏天晒盐”、“冬天捞碱”吗,它们分别运用的是什么原理?
夏天盐田 冬天碱池
海水晒盐过程
海水
贮水池
蒸发池
结晶池
粗盐
母液
氯化钠
多种化工产品
(将泥沙沉降)
析出晶体后的溶液叫母液,对于析出的溶质来说是饱和溶液。
(也叫苦卤,是氯化钠的饱和溶液)
(利用风吹和日晒使水分蒸发)
海水晒盐制得的食盐中常有少量泥沙,如何除去泥沙获得较纯净的食盐呢?
粗盐的初步提纯
实验用品:
粗盐(含难溶性杂质)、蒸馏水;
托盘天平(含砝码)、漏斗、纸片、药匙、烧杯、量筒、胶头滴管、玻璃棒、铁架台(带铁圈)、滤纸、酒精灯、蒸发皿、坩埚钳、陶土网、火柴、剪刀等。
实验装置及步骤:
(1)称量与溶解:用托盘天平称取2g左右粗盐,并用量筒量取10mL蒸馏水,将粗盐和蒸馏水转移到烧杯中,用玻璃棒搅拌,使粗盐充分溶解。
(2)过滤:制作过滤器,并进行过滤操作。仔细观察滤纸上的剩余物及滤液的颜色。若滤液浑浊,则必须重新过滤。
(3)蒸发:将过滤后所得的溶液转移至蒸发皿中,将蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液。待蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干。
(4)转移:将所得精盐转移到滤纸称量,计算产率。
蒸发
因为海水中含有一些可溶性杂质,因此得到的精盐并不是纯净物
蒸发结晶适用于分离易溶物和难溶物
实验中多次使用玻璃棒,作用一样吗?
(1)溶解时,玻璃棒的作用是搅拌,加快溶解
(2)过滤时,玻璃棒的作用是引流
(3)蒸发时,防止液体因局部温度过高造成液滴飞溅,且加快蒸发速度
(4)转移时,玻璃棒的作用是转移固体
溶液的变化——饱和溶液与不饱和溶液的转化
棉衣浸泡后的溶液
有食盐析出的溶液
不饱和溶液
饱和溶液
蒸发溶剂
?
问题5 饱和溶液和不饱和溶液如何相互转化?
②升高温度,饱和硝酸钾溶液变为不饱和溶液;
①增加溶剂,饱和硝酸钾溶液变为不饱和溶液;
一般情况下固体溶质的溶液,饱和溶液与不饱和溶液之间的相互转化方法:
加溶剂、升高温度
加入溶质、蒸发溶剂、
降低温度
饱和
溶液
不饱和
溶液
适用于任何溶液
(其中温度影响可用于大多数固体物质)Ca(OH)2等除外!
辩一辩
饱和溶液一定是浓溶液
稀溶液一定是
不饱和溶液
他们谁是正确的?
饱和溶液,不饱和溶液与浓溶液和稀溶液的关系
(1)饱和溶液不一定是浓溶液;
(2)不饱和溶液不一定是稀溶液;
(3)相同溶质、相同温度:饱和溶液一定比不饱和溶液浓。
浓溶液
稀溶液
饱和溶液
不饱和溶液
从定量的角度来看运盐过程——物质溶解性的定量表示
潘东子利用食盐易溶于水的性质试图将食盐送给游记队战士。
问题6:一定温度下,在一定量溶剂里,溶质的溶解量是有一定限度的。如何准确表示这个限度呢?
溶解度:在一定温度下,该物质在100g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量。
条件
标准
状态
单位
在一定温度下
在100g溶剂里
(一般指水)
溶液达到饱和
“g”
溶解度的四要素
S
表示
例:在20℃时,氯化钠溶解度是36g。以下有关说法是否正确?如不正确请说明原因。
(1)20℃时,100g 水最多能溶解氯化钠固体 36g。
(2)20℃时,将 36g 氯化钠固体溶解于 100g 水中,所得溶液是氯化钠的饱和溶液。
(3)10g 水最多溶解氯化钠固体 3.6g。
例:在20℃时,氯化钠溶解度是36g。以下有关说法是否正确?如不正确请说明原因。
(4)20℃时,100g 氯化钠饱和溶液中含有氯化钠 36g。
(5)20℃时,氯化钠溶液中水与氯化钠的质量比为 25:9。
(6)20℃时,从足量氯化钠饱和溶液中蒸发 100g 水,能析出 36g 氯化钠晶体。
20℃时氯化钠和硝酸钾的溶解能力谁强?
常见物质的溶解度(20℃)
物质名称 氯化钠 氢氧化钙 蔗 糖 氯酸钾 氯化铵 硝酸钾
溶解度/克 36.0 0.165 203.9 7.4 37.2 31.6
溶解度/g(20℃) <0.01 0.01~1 1~10 >10
溶解性 难溶 微溶 可溶 易溶
举例 AgCl Ca(OH)2 KClO3 KNO3
溶解性只是定性地说明某种物质在某种溶剂里溶解能力的大小,而溶解度是衡量某种物质在某种溶剂里溶解性强弱的尺度。
常温下(20℃)溶解度与溶解性的关系
溶解度与溶解性有什么关系呢?
.
.
.
0.01g
1g
10g
难(不)溶
微溶
可溶
易溶
同一固体物质在不同温度下的溶解度不同,该用什么方法表示该物质的溶解度呢?
(1)列表法(溶解度表格)
温度/℃ 0 10 20 30 40 50 60 70
溶解 度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138
从表中你能获取到哪些信息?
溶解度/g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
饱和
不饱和
根据硝酸钾溶解度曲线,你能得到哪些信息?
(2)图像法(溶解度曲线)
物质在水中的溶解度随温度的变化而变化的曲线。横坐标表示温度,纵坐标表示溶解度。
硝酸钾
溶解度/g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
饱和
不饱和
硝酸钾
点:
曲线上的点:表示某物质在对应温度下的溶解度
线:
溶解度随温度的变化趋势:硝酸钾的溶解度随温度的升高而增大
面:
①曲线以上的区域:表示该溶质的饱和溶液且有未溶解的固体;
②曲线以下的区域:表示该溶质的不饱和溶液
2.在40℃时,比较硝酸钾的溶解度与硝酸钠的溶解度大小。
观察图示回答下列问题:
S硝酸钾<S硝酸钠
3.在80℃时,比较氯化钠、氯化钾、氯化铵、硼酸的溶解度由大到小的顺序
S氯化铵>S氯化钾>S氯化钠>S硼酸
1.两曲线交点B有何意义?
在68℃时,硝酸钾与硝酸钠的溶解度相等.
4.在80℃时,计算饱和硝酸钠的溶质质量分数。
60%
B
5.几种物质的溶解度随温度的变化趋势如何?
①陡升型:大多数固体物质的溶解度随温度的升高而增大明显。
②缓升型:少数固体物质的溶解度随温度的升高而增大不明显。
③下降型:极少数固体物质的溶解度随温度的升高而减小。
如:KNO3
如:NaCl
如:Ca(OH)2
溶解度曲线的应用
①查某种物质在某温度时的溶解度。
②判断物质的溶解度随温度变化的趋势。
③比较不同物质在同一温度时的溶解度大小。
④比较物质的溶解度受温度变化影响的大小,进一步确定该物质的结晶方法。
⑤确定某物质的饱和溶液和不饱和溶液的转化方法。
列表法和曲线图法表示物质的溶解度时,它们的优点和局限性各是什么呢?
(1)制汽水时常常需要加压,而打开汽水瓶盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
(2)喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
气体溶解度随温度升高而降低。
气体溶解度随压强的增大而增大。
议一议
气体的溶解度:气体的溶解度是指压强为101kPa和一定温度时,某气体在 1体积水里溶解达到饱和状态时的体积。
影响气体溶解度的因素
内因
外因
溶质和溶剂本身的性质
在压强不变的条件下,气体的溶解度随温度的升高而减小,反之则增大
在温度不变的条件下,气体的溶解度随压强的增大而增大,反之则减小
影响气体溶解度的因素
(1)天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
议一议
(2)探究铁生锈条件的实验中,一支试管中的蒸馏水需要煮沸迅速冷却的原因是什么?
迅速冷却的沸水
课堂小结
问题1:物质的溶解性与什么因素有关呢?
问题2:食盐(溶质)能不能无限制地溶解在一定量的水中呢?
问题3:如何判断食盐水是否已经饱和?
问题4:如何将食盐“提取”出来?
问题5 饱和溶液和不饱和溶液如何相互转化?
问题6:一定温度下,在一定量溶剂里,溶质的溶解量是有一定限度的。如何准确表示这个限度呢?
A
B
C
D
1. 硝酸钾易溶于水。室温下,若在某硝酸钾溶液中加入硝酸钾,观察到硝酸钾继续溶解,原溶液是 ________ (选填“饱和”或“不饱和”)溶液;当加入的硝酸钾固体不能继续溶解时,说明此时溶液已处于________ (选填“饱和”或“不饱和”)状态。 加热片刻,剩余的固体全部溶解,此时溶液的状态为________ (选填“饱和”“不饱和”或“无法确定”)。
不饱和
饱和
无法确定
2. 炎热的夏天,喝汽水有助于解渴消暑。
(1)打开汽水瓶盖,发现有大量的气泡逸出,这说明气体的溶解度与____有关。
(2)喝了汽水以后,常常打嗝,这说明气体的溶解度与_____有关。
(3)在家中也可以自制汽水,一般采用凉开水制汽水的原因是__________
_________________________________________________________。
压强
温度
CO2的溶解
度随温度的降低而增大,凉开水温度较低,溶解的二氧化碳较多
(4)夏天从4℃的冰箱冷藏室里拿出一杯底部还有少量蔗糖晶体的溶液 a, 在室温下放置 一段时间后(不考虑水的蒸发),
发现晶体消失了,得到溶液b。 下列有关说法
中正确的是( )
A. 溶 液 a 与溶液b 质量相等
B. 溶 液 a 一定是饱和溶液
C. 溶 液 b 中的溶质减少
D. 该过程中蔗糖的溶解度不变
B
3. 海水晒盐的大致过程如下,请回答下列问题。
(1)海水是氯化钠的________(选填"饱和"或"不饱和")溶液。
(2)将海水引入贮水池一段时间后,可以发现池底有沉淀,说明此过程的主要作用是除去 ________。
(3)在蒸发池中,主要通过___________的方式蒸发水分,在此过程中,氯化钠质量的变化情况是 ______,水的质量的变化情况是________。
不饱和
泥沙等
太阳能日晒
不变
减小
3. 海水晒盐的大致过程如下,请回答下列问题。
(4)结晶池中的粗盐是________(选填“纯净物”或“混合物”)。
(5)对母液进行加工,可以获得多种化工产品,说明海水中除氯化钠外,还含有________________。
混合物
多种矿物质等
4.实验室中有两瓶失去标签的白色固体,只知道其中一瓶是氯化钠,另一瓶是碳酸钙,为了区别这两瓶白色固体,我们可采用哪种物理方法?
分别取样,加入适量水,若能溶解,则是氯化钠,若不能溶解,则是碳酸钙。
5.已知20℃时,100克水中溶解36克NaCl刚好成为饱和溶液。
(1)在此温度下, 100克水中加入33克NaCl,得到的溶液是_______溶液。
(2)再加3克NaCl,得到的溶液是______溶液。
(3)继续加3克NaCl,得到的溶液是 ______溶液,溶液的质量为______克 。
不饱和
饱和
饱和
136
6. 甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题。
(1)t3℃时,三种物质的溶解度由小到大的顺序是____________。
(2)t2℃时,____和____的溶解度相等。
t2
溶解度/g
甲
乙
丙
t1
t3
温度/℃
甲
丙
乙 = 丙 < 甲
(3)三种物质中,___的溶解度受温度的影响最大,___的溶解度受温度的影响最小,___的溶解度随温度的升高而减小。
甲
乙
丙
(2021安徽)阅读下列短文,回答问题。
红色经典影片《闪闪的红星》中有一段儿童团员潘冬子给红军送盐的故事。冬子开始把食盐装在竹筒中,打算扮作上山砍柴的人将食盐送给红军。途中发现敌人盘查严格,冬子急中生智跑到河边,把竹筒里的食盐全部溶成盐水,再用棉袄吸收,最终顺利地将食盐送给了红军。
真题再现
(1)从微观角度分析,氯化钠是由_____(填“分子”“原子”或“离子”)构成;从元素角度分析,氯化钠溶液中+1价的元素有_______(填元素符号)。
离子
Na、H
(2)从盐水中重新得到食盐固体,需进行操作的名称是________。
(3)氯化钠的溶解度曲线如图。假设冬子的竹筒中有358 g氯化钠,10℃时最少需用________g水溶解。
(4)氯化钠在生活中的用途有_____________(写出1点即可)。
蒸发
1000
制作调味品
胡萝卜如果生吃,其中的β-胡萝卜素只有25%被吸收,如果用食用油烹调后,则能吸收95%,查阅资料了解吸收效率高低的原因。
拓展与实践
