6.2.2溶液浓度的计算课件(共14张PPT)2023-2024学年度沪教版化学九年级下册
文档属性
| 名称 | 6.2.2溶液浓度的计算课件(共14张PPT)2023-2024学年度沪教版化学九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 09:13:01 | ||
图片预览






文档简介
(共14张PPT)
课时2 溶液浓度的计算
九年级下册
沪教版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 能运用溶液的溶质质量分数公式进行简单的计算;
2. 掌握溶液的稀释的计算方法。
重难点
重点
在熬制排骨汤时,随着水分的蒸发,汤会逐渐变咸,加入水之后,汤又会变淡,这是为什么呢。在这个过程中变化的量是什么?不变的量是什么?
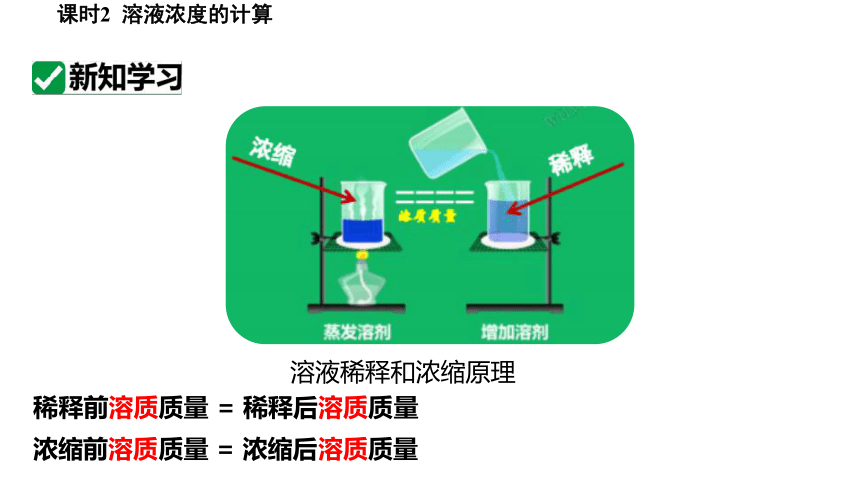
溶液稀释和浓缩原理
稀释前溶质质量 = 稀释后溶质质量
浓缩前溶质质量 = 浓缩后溶质质量
现在需要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
解:设稀释后溶液的质量为 x。
50g×98%= x × 20%
需要水的质量 = 245g - 50g = 195g
答:需要水的质量为195g。
x = 245g
有关溶液稀释问题的计算
(1)解题依据:溶液稀释前后,溶质的质量不变。
(2)公式:
浓溶液质量×浓溶液溶质质量分数 = 稀溶液质量×稀溶液溶质质量分数
m浓×ω浓% = m稀×ω稀%
如何用98%的浓硫酸配制200g 10%的稀硫酸
操作步骤:
①计算:m浓 × 98% = 200g×10%
m浓= 20.4g
m加水 = 200g-20.4g = 179.6g
②量取:用量筒量取179.6mL水(注意平视)
③溶解:烧杯、玻璃棒
④转移:装瓶贴标签
稀硫酸
H2SO4 10%
怎么增加溶液的浓度呢?
=
溶质的质量分数 =
加溶质(或加浓溶液)
蒸发溶剂
注意:“如果采取加浓溶液的方法提高溶液浓度,所加入的浓溶液的浓度一定要比目标浓度大才能达到目的”
(1)溶液稀释的过程中:_____________不变。
浓溶液质量×浓溶液溶质质量分数 = 稀溶液质量×稀溶液溶质质量分数
m浓×ω浓% = m稀×ω稀%
溶质的质量
(2)公式:
1. 某温度下把100g KNO3溶液的溶质质量分数由10%增加到20%,可采用的方法是( )
A. 保持温度不变,蒸发掉45g水
B. 保持温度不变,蒸发掉50g水
C. 加入10g KNO3固体
D. 加入15g KNO3固体
B
方法归纳:
采取蒸发溶剂法提高溶液浓度时,蒸发溶剂水的质量是原溶液质量的一半,而非蒸发一半溶剂
2. 实验室用37%的浓盐酸来配制50 g溶质质量分数为10%的稀盐酸,请回答下列问题。
(1)配制步骤是:计算→_____→搅拌均匀。
(2)实验中用到的玻璃仪器有烧杯、量筒、________。
(3)需要浓盐酸的质量为_____g(结果保留至0.1)。
(4)量取水时俯视读数会造成溶质质量分数_____(填“偏大”或“偏小”)。
量取
玻璃棒
13.5
偏大
3. 现在有100 g 10%的氯化钠溶液,若按下列三种方法使该溶液中溶质的质量分数变为20%,则:
方法一:应加入_12.5_____g的氯化钠固体。
方法二:应蒸发______g的水。
方法三:应加入___168.1___mL 25%的氯化钠溶液(25%的氯化钠溶液的密度为1.19 g/mL;计算结果精确到0.1)。
50
课时2 溶液浓度的计算
九年级下册
沪教版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 能运用溶液的溶质质量分数公式进行简单的计算;
2. 掌握溶液的稀释的计算方法。
重难点
重点
在熬制排骨汤时,随着水分的蒸发,汤会逐渐变咸,加入水之后,汤又会变淡,这是为什么呢。在这个过程中变化的量是什么?不变的量是什么?
溶液稀释和浓缩原理
稀释前溶质质量 = 稀释后溶质质量
浓缩前溶质质量 = 浓缩后溶质质量
现在需要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
解:设稀释后溶液的质量为 x。
50g×98%= x × 20%
需要水的质量 = 245g - 50g = 195g
答:需要水的质量为195g。
x = 245g
有关溶液稀释问题的计算
(1)解题依据:溶液稀释前后,溶质的质量不变。
(2)公式:
浓溶液质量×浓溶液溶质质量分数 = 稀溶液质量×稀溶液溶质质量分数
m浓×ω浓% = m稀×ω稀%
如何用98%的浓硫酸配制200g 10%的稀硫酸
操作步骤:
①计算:m浓 × 98% = 200g×10%
m浓= 20.4g
m加水 = 200g-20.4g = 179.6g
②量取:用量筒量取179.6mL水(注意平视)
③溶解:烧杯、玻璃棒
④转移:装瓶贴标签
稀硫酸
H2SO4 10%
怎么增加溶液的浓度呢?
=
溶质的质量分数 =
加溶质(或加浓溶液)
蒸发溶剂
注意:“如果采取加浓溶液的方法提高溶液浓度,所加入的浓溶液的浓度一定要比目标浓度大才能达到目的”
(1)溶液稀释的过程中:_____________不变。
浓溶液质量×浓溶液溶质质量分数 = 稀溶液质量×稀溶液溶质质量分数
m浓×ω浓% = m稀×ω稀%
溶质的质量
(2)公式:
1. 某温度下把100g KNO3溶液的溶质质量分数由10%增加到20%,可采用的方法是( )
A. 保持温度不变,蒸发掉45g水
B. 保持温度不变,蒸发掉50g水
C. 加入10g KNO3固体
D. 加入15g KNO3固体
B
方法归纳:
采取蒸发溶剂法提高溶液浓度时,蒸发溶剂水的质量是原溶液质量的一半,而非蒸发一半溶剂
2. 实验室用37%的浓盐酸来配制50 g溶质质量分数为10%的稀盐酸,请回答下列问题。
(1)配制步骤是:计算→_____→搅拌均匀。
(2)实验中用到的玻璃仪器有烧杯、量筒、________。
(3)需要浓盐酸的质量为_____g(结果保留至0.1)。
(4)量取水时俯视读数会造成溶质质量分数_____(填“偏大”或“偏小”)。
量取
玻璃棒
13.5
偏大
3. 现在有100 g 10%的氯化钠溶液,若按下列三种方法使该溶液中溶质的质量分数变为20%,则:
方法一:应加入_12.5_____g的氯化钠固体。
方法二:应蒸发______g的水。
方法三:应加入___168.1___mL 25%的氯化钠溶液(25%的氯化钠溶液的密度为1.19 g/mL;计算结果精确到0.1)。
50
