7.2.2盐复分解反应发生的条件课件(共24张PPT内嵌视频)2023-2024学年度沪教版化学九年级下册
文档属性
| 名称 | 7.2.2盐复分解反应发生的条件课件(共24张PPT内嵌视频)2023-2024学年度沪教版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 36.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
九年级下册
沪教版
课时2 盐
复分解反应发生的条件
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 可以从组成特点上认识盐及分类。
2. 根据所学过的金属、酸、碱的化学性质,归纳总结盐可能有的化学性质。
3. 根据一些复分解反应,从生成物的角度归纳复分解反应发生的条件,从微粒变化的角度知道复分解反应发生的实质。
难点
重点
盐:指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
金属离子或
铵根离子
酸根离子
Ca(OH)2 HCl Fe
Na2CO3 CaCO3 Ag
NaCl CaCl2 CuSO4
以上物质中属于盐的有哪些?你能对这些盐按照组成中含有的离子对其进行分类吗?
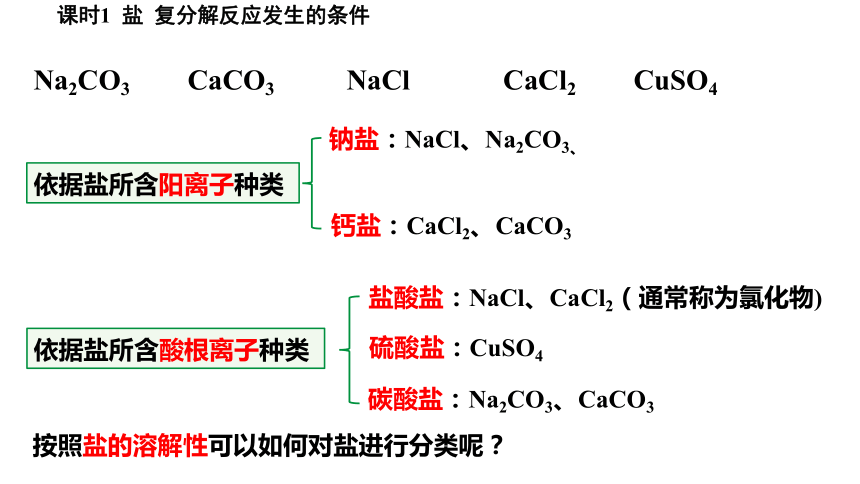
Na2CO3 CaCO3 NaCl CaCl2 CuSO4
依据盐所含阳离子种类
钠盐:NaCl、Na2CO3、
钙盐:CaCl2、CaCO3
依据盐所含酸根离子种类
盐酸盐:NaCl、CaCl2(通常称为氯化物)
硫酸盐:CuSO4
碳酸盐:Na2CO3、CaCO3
按照盐的溶解性可以如何对盐进行分类呢?
1.有气体生成的反应:
你能用化学方程式表示下列物质间符合要求的反应吗?
Ca(OH)2 HCl Fe Na2CO3 CaCO3 Ag
NaCl CaCl2 CuSO4
2.有红色固体生成的反应:
Na2CO3+2HCl===2NaCl + H2O + CO2↑
CaCO3+2HCl===2CaCl2+H2O + CO2↑
Fe+2HCl===FeCl2+H2↑
CuSO4+Fe===FeSO4+Cu
3.有蓝色沉淀生成的反应:
4.有白色沉淀生成的反应:
CuSO4+Ca(OH)2 ===CuSO4+Cu(OH)2 ↓
Na2CO3 +Ca(OH)2===2NaOH+CaCO3 ↓
Na2CO3+CaCl2===2NaCl +CaCO3↓
根据以上反应的判断,参照酸和碱性质的推断方法,你能否推断出盐有哪些相似性质?
1.有气体生成的反应:
2.有红色固体生成的反应:
Na2CO3+2HCl===2NaCl + H2O + CO2↑
CaCO3+2HCl===2CaCl2+H2O + CO2↑
Fe+2HCl===FeCl2+H2↑
CuSO4+Fe===FeSO4+Cu
3.有蓝色沉淀生成的反应:
4.有白色沉淀生成的反应:
CuSO4+Ca(OH)2 ===CuSO4+Cu(OH)2 ↓
Na2CO3 +Ca(OH)2===2NaOH+CaCO3 ↓
Na2CO3+CaCl2===2NaCl +CaCO3↓
回顾:你还记得“湿法冶金”的原理吗?
化学方程式:
CuSO4 + Fe === FeSO4 + Cu(置换反应)
现象:有红色固体析出,溶液由蓝色逐渐变浅绿色
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强到弱
在金属活动性表中,除非常活泼的金属( K、Ca、Na )外,排在前面的的金属一般可以将位于其后面的、比它不活泼的金属从它的盐溶液中置换出来。
盐能与金属反应:盐+金属 → 新金属+新盐
盐能与金属反应:盐+金属 → 新金属+新盐
①反应物中盐要溶于水;
②在金属活动性顺序表里,与盐反应的金属应排在盐溶液中金属的前面
如:
CuSO4 + Fe === FeSO4 + Cu
现象:有红色固体析出,溶液由蓝色逐渐变浅绿色
Cu + 2AgNO3 === 2Ag + Cu(NO3)2
现象:有银白色固体析出,溶液由无色变为蓝色
回顾:还记得盐酸与大理石的反应吗?
继续观察硝酸银与盐酸反应的现象
现象:有沉淀产生
AgNO3 + HCl === HNO3+ AgCl↓
现象:有气泡产生
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
盐能与酸反应:盐+酸 → 新盐+新酸(复分解反应)
生成物中有气体、水或沉淀
盐能与碱反应:盐+碱 → 新盐+新碱(复分解反应)
①反应物均可溶于水;
②生成物中有沉淀
观察碳酸钠与氢氧化钙反应的现象
Na2CO3 +Ca(OH)2===2NaOH+CaCO3 ↓
现象:有白色沉淀产生
继续观察硫酸铜与氢氧化钠反应的现象
CuSO4 +2NaOH===Na2SO4+Cu(OH)2↓
现象:有白色沉淀产生
现象:有白色沉淀产生
BaCl2 + CuSO4 === BaSO4↓ + CuCl2
观察氯化钡溶液与硫酸铜溶液反应
盐能与盐反应:盐1+盐2 → 新盐1+新盐2(复分解反应)
①反应物均可溶于水;
②生成物中有沉淀
继续观察硝酸银溶液与氯化钠溶液反应
现象:有白色沉淀产生
AgNO3+NaCl===NaNO3 +AgCl↓
盐与酸、盐与碱、盐与盐发生的反应都是复分解反应,观察以上这些反应,你有什么发现?
所以并不是所有的酸碱盐之间反应都能进行,只有当两种化合物互相交换成分时,有沉淀、气体或水生成时,才能发生复分解反应。
酸碱盐溶解性表(20℃)
酸、碱、盐的溶解性
1.常见的酸大多溶于水;
2.常见的碱中只有五种溶于水:
KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶物)、NH3·H2O;
3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
4.盐酸盐(也称氯化物)不溶于水的有AgCl;
5.硫酸盐不溶于水的有BaSO4;
6.碳酸盐:含钾、钠、铵根离子的碳酸盐溶于水。
根据复分解反应发生的条件,并利用课本后附录 所提供的有关酸、碱、盐溶解性的信息,判断稀硫酸与下表中的四种化合物的溶液之间是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断 依据
能
不能
能
能
有水生成
没有沉淀或气体或水生成
有气体、水生成
有沉淀生成
?
复分解反应的微观探析(以氢氧化钙与碳酸钠反应为例)
复分解反应的实质是两种化合物在水溶液中互相交换离子,只要离子之间能够互相结合生成气体、沉淀或水,反应就可以发生。
Ca2+、OH-
Na+、CO3 2-
Na+、OH-
Ca(OH)2 + Na2CO3 ===2NaOH+ CaCO3↓
CaCO3
①H+ + → H2O + CO2↑
(1)生成水:
(2)生成水和气体:
②H+ + → H2O + CO2↑
③ + OH- → NH3↑ + H2O
(3)生成沉淀:
①Ca2+ + → CaCO3↓
②Ba2+ + → BaCO3↓
③Ba2+ + → BaSO4↓
H+ + OH- → H2O
常见能生成水、气体、沉淀的离子组合
离子对在水中是否大量共存的依据
④Ag+ +Cl- → AgCl↓
盐
复分解反应发生的条件
盐+金属 → 新盐+新金属
盐+酸 → 新盐+新酸
盐+碱 → 新盐+新碱
盐1+盐2 → 新盐1+新盐2
盐的化学性质
复分解反应发生的条件
有沉淀、气体或水生成
1. 下列对于盐的组成叙述正确的是( )
A. 一定含有金属元素 B. 一定含有酸根
C. 一定含有氢元素 D. 一定含有原子团
B
2.判断复分解反应是否发生,不必考虑的是( )
A.是否有水生成 B.是否有气体生成
C.是否有沉淀生成 D.金属活动性顺序
D
3. 下列物质跟锌、氯化钡溶液、氢氧化钠溶液都能发生反应的是( )
A. 稀盐酸 B. CuSO4溶液
C. K2CO3溶液 D. Ca(OH)2溶液
4. 以下实验能比较出铁和铜的金属活动性强弱的是( )
A. 测定两种金属的密度 B. 将两种金属互相刻画
C. 将铁片放入硫酸铜溶液中 D. 将两种金属分别放入硝酸银溶液中
B
C
5.下列溶液中的离子能够共存的是( )
A. Na+、 Cl- 、NO3- 、 Ag+ B. Ba2+、OH- 、CO32- 、 H+
C. Cu2+、Cl- 、 SO42- 、K+ D. Fe3+、OH- 、NO3- 、 NH4+
C
6. 下列选项中各溶质的溶液混合,能大量共存且形成无色溶液的是
( )
A. KMnO4、NaCl、AgNO3 B. K2CO3、CaCl2、HNO3
C. BaCl2、Cu(NO3)2、H2SO4 D. MgCl2、AlCl3、Na2SO4
D
7. 某同学学习了常见的盐后,总结出盐的化学性质如图所示。请回答下列问题。
(1)X属于______(填物质类别)。
(2)能与盐反应的金属应满足的条件是______________________________。
(3)写出一个盐与碱反应的化学方程式______________________________
_________。
酸
金属的活动性比盐中金属的活动性强
CuSO4+2NaOH=== Cu(OH)2↓+
+Na2SO4
九年级下册
沪教版
课时2 盐
复分解反应发生的条件
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 可以从组成特点上认识盐及分类。
2. 根据所学过的金属、酸、碱的化学性质,归纳总结盐可能有的化学性质。
3. 根据一些复分解反应,从生成物的角度归纳复分解反应发生的条件,从微粒变化的角度知道复分解反应发生的实质。
难点
重点
盐:指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
金属离子或
铵根离子
酸根离子
Ca(OH)2 HCl Fe
Na2CO3 CaCO3 Ag
NaCl CaCl2 CuSO4
以上物质中属于盐的有哪些?你能对这些盐按照组成中含有的离子对其进行分类吗?
Na2CO3 CaCO3 NaCl CaCl2 CuSO4
依据盐所含阳离子种类
钠盐:NaCl、Na2CO3、
钙盐:CaCl2、CaCO3
依据盐所含酸根离子种类
盐酸盐:NaCl、CaCl2(通常称为氯化物)
硫酸盐:CuSO4
碳酸盐:Na2CO3、CaCO3
按照盐的溶解性可以如何对盐进行分类呢?
1.有气体生成的反应:
你能用化学方程式表示下列物质间符合要求的反应吗?
Ca(OH)2 HCl Fe Na2CO3 CaCO3 Ag
NaCl CaCl2 CuSO4
2.有红色固体生成的反应:
Na2CO3+2HCl===2NaCl + H2O + CO2↑
CaCO3+2HCl===2CaCl2+H2O + CO2↑
Fe+2HCl===FeCl2+H2↑
CuSO4+Fe===FeSO4+Cu
3.有蓝色沉淀生成的反应:
4.有白色沉淀生成的反应:
CuSO4+Ca(OH)2 ===CuSO4+Cu(OH)2 ↓
Na2CO3 +Ca(OH)2===2NaOH+CaCO3 ↓
Na2CO3+CaCl2===2NaCl +CaCO3↓
根据以上反应的判断,参照酸和碱性质的推断方法,你能否推断出盐有哪些相似性质?
1.有气体生成的反应:
2.有红色固体生成的反应:
Na2CO3+2HCl===2NaCl + H2O + CO2↑
CaCO3+2HCl===2CaCl2+H2O + CO2↑
Fe+2HCl===FeCl2+H2↑
CuSO4+Fe===FeSO4+Cu
3.有蓝色沉淀生成的反应:
4.有白色沉淀生成的反应:
CuSO4+Ca(OH)2 ===CuSO4+Cu(OH)2 ↓
Na2CO3 +Ca(OH)2===2NaOH+CaCO3 ↓
Na2CO3+CaCl2===2NaCl +CaCO3↓
回顾:你还记得“湿法冶金”的原理吗?
化学方程式:
CuSO4 + Fe === FeSO4 + Cu(置换反应)
现象:有红色固体析出,溶液由蓝色逐渐变浅绿色
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强到弱
在金属活动性表中,除非常活泼的金属( K、Ca、Na )外,排在前面的的金属一般可以将位于其后面的、比它不活泼的金属从它的盐溶液中置换出来。
盐能与金属反应:盐+金属 → 新金属+新盐
盐能与金属反应:盐+金属 → 新金属+新盐
①反应物中盐要溶于水;
②在金属活动性顺序表里,与盐反应的金属应排在盐溶液中金属的前面
如:
CuSO4 + Fe === FeSO4 + Cu
现象:有红色固体析出,溶液由蓝色逐渐变浅绿色
Cu + 2AgNO3 === 2Ag + Cu(NO3)2
现象:有银白色固体析出,溶液由无色变为蓝色
回顾:还记得盐酸与大理石的反应吗?
继续观察硝酸银与盐酸反应的现象
现象:有沉淀产生
AgNO3 + HCl === HNO3+ AgCl↓
现象:有气泡产生
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
盐能与酸反应:盐+酸 → 新盐+新酸(复分解反应)
生成物中有气体、水或沉淀
盐能与碱反应:盐+碱 → 新盐+新碱(复分解反应)
①反应物均可溶于水;
②生成物中有沉淀
观察碳酸钠与氢氧化钙反应的现象
Na2CO3 +Ca(OH)2===2NaOH+CaCO3 ↓
现象:有白色沉淀产生
继续观察硫酸铜与氢氧化钠反应的现象
CuSO4 +2NaOH===Na2SO4+Cu(OH)2↓
现象:有白色沉淀产生
现象:有白色沉淀产生
BaCl2 + CuSO4 === BaSO4↓ + CuCl2
观察氯化钡溶液与硫酸铜溶液反应
盐能与盐反应:盐1+盐2 → 新盐1+新盐2(复分解反应)
①反应物均可溶于水;
②生成物中有沉淀
继续观察硝酸银溶液与氯化钠溶液反应
现象:有白色沉淀产生
AgNO3+NaCl===NaNO3 +AgCl↓
盐与酸、盐与碱、盐与盐发生的反应都是复分解反应,观察以上这些反应,你有什么发现?
所以并不是所有的酸碱盐之间反应都能进行,只有当两种化合物互相交换成分时,有沉淀、气体或水生成时,才能发生复分解反应。
酸碱盐溶解性表(20℃)
酸、碱、盐的溶解性
1.常见的酸大多溶于水;
2.常见的碱中只有五种溶于水:
KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶物)、NH3·H2O;
3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
4.盐酸盐(也称氯化物)不溶于水的有AgCl;
5.硫酸盐不溶于水的有BaSO4;
6.碳酸盐:含钾、钠、铵根离子的碳酸盐溶于水。
根据复分解反应发生的条件,并利用课本后附录 所提供的有关酸、碱、盐溶解性的信息,判断稀硫酸与下表中的四种化合物的溶液之间是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断 依据
能
不能
能
能
有水生成
没有沉淀或气体或水生成
有气体、水生成
有沉淀生成
?
复分解反应的微观探析(以氢氧化钙与碳酸钠反应为例)
复分解反应的实质是两种化合物在水溶液中互相交换离子,只要离子之间能够互相结合生成气体、沉淀或水,反应就可以发生。
Ca2+、OH-
Na+、CO3 2-
Na+、OH-
Ca(OH)2 + Na2CO3 ===2NaOH+ CaCO3↓
CaCO3
①H+ + → H2O + CO2↑
(1)生成水:
(2)生成水和气体:
②H+ + → H2O + CO2↑
③ + OH- → NH3↑ + H2O
(3)生成沉淀:
①Ca2+ + → CaCO3↓
②Ba2+ + → BaCO3↓
③Ba2+ + → BaSO4↓
H+ + OH- → H2O
常见能生成水、气体、沉淀的离子组合
离子对在水中是否大量共存的依据
④Ag+ +Cl- → AgCl↓
盐
复分解反应发生的条件
盐+金属 → 新盐+新金属
盐+酸 → 新盐+新酸
盐+碱 → 新盐+新碱
盐1+盐2 → 新盐1+新盐2
盐的化学性质
复分解反应发生的条件
有沉淀、气体或水生成
1. 下列对于盐的组成叙述正确的是( )
A. 一定含有金属元素 B. 一定含有酸根
C. 一定含有氢元素 D. 一定含有原子团
B
2.判断复分解反应是否发生,不必考虑的是( )
A.是否有水生成 B.是否有气体生成
C.是否有沉淀生成 D.金属活动性顺序
D
3. 下列物质跟锌、氯化钡溶液、氢氧化钠溶液都能发生反应的是( )
A. 稀盐酸 B. CuSO4溶液
C. K2CO3溶液 D. Ca(OH)2溶液
4. 以下实验能比较出铁和铜的金属活动性强弱的是( )
A. 测定两种金属的密度 B. 将两种金属互相刻画
C. 将铁片放入硫酸铜溶液中 D. 将两种金属分别放入硝酸银溶液中
B
C
5.下列溶液中的离子能够共存的是( )
A. Na+、 Cl- 、NO3- 、 Ag+ B. Ba2+、OH- 、CO32- 、 H+
C. Cu2+、Cl- 、 SO42- 、K+ D. Fe3+、OH- 、NO3- 、 NH4+
C
6. 下列选项中各溶质的溶液混合,能大量共存且形成无色溶液的是
( )
A. KMnO4、NaCl、AgNO3 B. K2CO3、CaCl2、HNO3
C. BaCl2、Cu(NO3)2、H2SO4 D. MgCl2、AlCl3、Na2SO4
D
7. 某同学学习了常见的盐后,总结出盐的化学性质如图所示。请回答下列问题。
(1)X属于______(填物质类别)。
(2)能与盐反应的金属应满足的条件是______________________________。
(3)写出一个盐与碱反应的化学方程式______________________________
_________。
酸
金属的活动性比盐中金属的活动性强
CuSO4+2NaOH=== Cu(OH)2↓+
+Na2SO4
