7.2.4中和反应课件(共24张PPT)2023-2024学年度沪教版化学九年级下册
文档属性
| 名称 | 7.2.4中和反应课件(共24张PPT)2023-2024学年度沪教版化学九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 21:20:12 | ||
图片预览






文档简介
(共24张PPT)
课时4 中和反应
九年级下册
沪教版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 掌握中和反应的概念,能从微粒变化的角度认识酸碱中和反应的本质;
2. 认识酸碱中和反应在生活、生产中的重要作用。
重难点
重点
学习目标
酸溶液显酸性,碱溶液显碱性,如果酸与碱混合,溶液酸碱性如何变化呢?
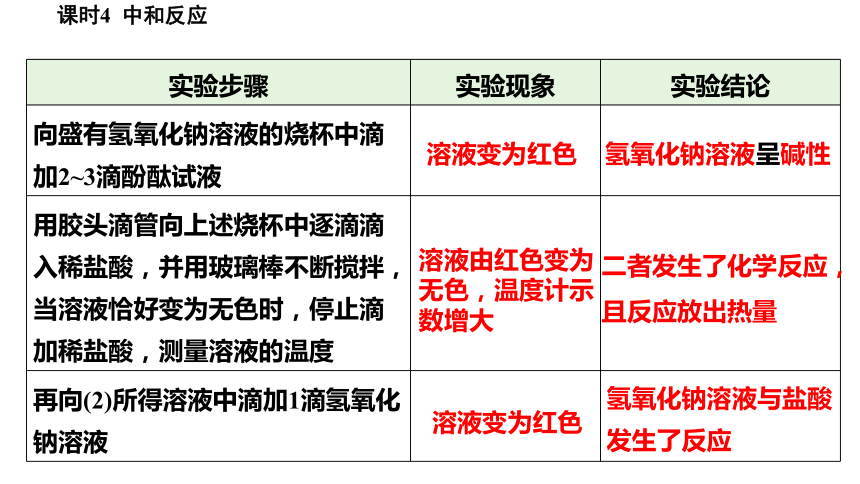
(1)向盛有氢氧化钠溶液的烧杯中滴加2~3滴酚酞试液,插入温度计,测量溶液温度;
(2)用胶头滴管向上述烧杯中逐滴滴入稀盐酸,并用玻璃棒不断搅拌,当溶液恰好变为无色时,停止滴加稀盐酸,测量溶液的温度。
实验步骤 实验现象 实验结论
向盛有氢氧化钠溶液的烧杯中滴加2~3滴酚酞试液
用胶头滴管向上述烧杯中逐滴滴入稀盐酸,并用玻璃棒不断搅拌,当溶液恰好变为无色时,停止滴加稀盐酸,测量溶液的温度
再向(2)所得溶液中滴加1滴氢氧化钠溶液
氢氧化钠溶液呈碱性
二者发生了化学反应,且反应放出热量
氢氧化钠溶液与盐酸发生了反应
溶液变为红色
溶液由红色变为无色,温度计示数增大
溶液变为红色
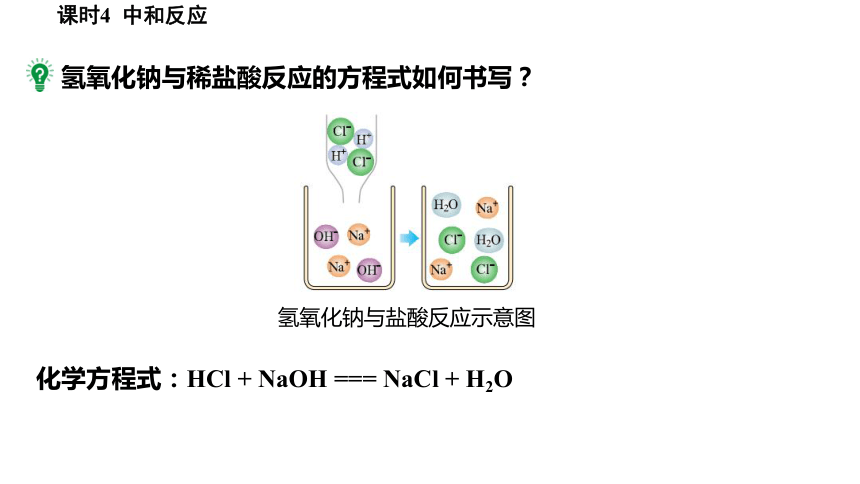
氢氧化钠与稀盐酸反应的方程式如何书写?
氢氧化钠与盐酸反应示意图
化学方程式:HCl + NaOH === NaCl + H2O
氢氧化钠溶液和盐酸反应没有明显现象,加入指示剂酚酞,通过红色褪色可以判断反应物氢氧化钠的消耗,证明二者发生了化学反应
1.实验中滴加酚酞溶液起到了什么作用?
2.在溶液恰好变为无色的时候,溶液的酸碱性是怎样的?这说明了什么?
溶液酸碱性均消失,溶液呈中性,说明氢氧化钠溶液与稀盐酸发生了反应
3.若将(2)中得到的液体蒸干,会出现什么现象?
留下白色晶体
议一议
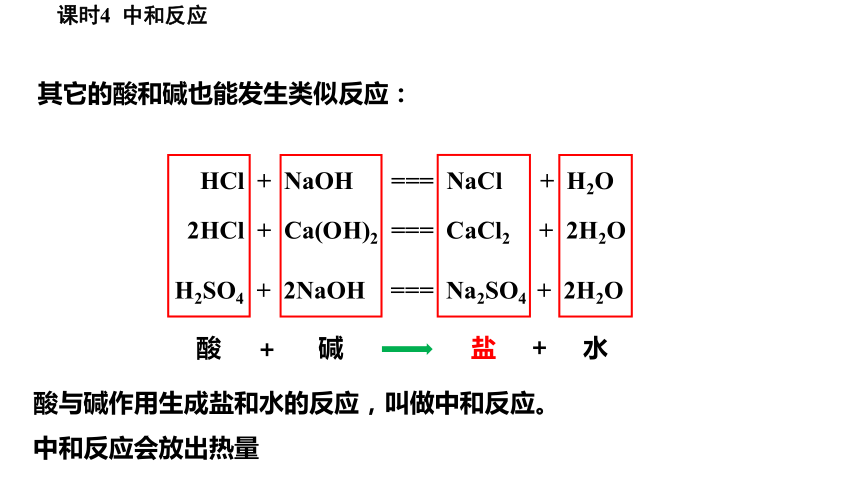
其它的酸和碱也能发生类似反应:
酸
碱
盐
水
HCl + NaOH === NaCl + H2O
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4 + 2NaOH === Na2SO4 + 2H2O
+
+
酸与碱作用生成盐和水的反应,叫做中和反应。
中和反应会放出热量
中和反应的微观实质理解
HCl → H+ + Cl
NaOH → Na+ + OH
酸和碱的中和反应生成的水从哪里来的呢?盐又从哪里来的呢?
HCl + NaOH === NaCl + H2O
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4 + 2NaOH === Na2SO4 + 2H2O
根据微观图示可知,酸和碱中和时,会互相交换成分:
实际上就是酸的阴离子和碱的阳离子结合生成盐,酸中的氢离子与碱中的氢氧根离子结合成水分子
H+ + OH- === H2O
认识了中和反应,那你知道中和反应在生产生活中有哪些应用吗?
?
农业上:可以改良酸性土壤。人们会将熟石灰加入酸性土壤中,以中和其酸性,适宜农作物生长。
为什么不用氢氧化钠固体来中和酸性土壤呢?
工业上:处理工厂废水,硫酸厂的污水中含有硫酸等物质,印染厂的废水呈碱性,在排放前,都要选择相应的碱或酸进行中和处理,以防止污染水体和土壤。
有些工厂排放的废水中含有硫酸,可用氨水(NH3·H2O)中和。反应的化学方程式为:2NH3·H2O+H2SO4===(NH4)2SO4+2H2O
医药上:人的胃液含有适量盐酸,帮助消化,如果暴饮暴食导致胃酸分泌过多会造成不适,可以遵医嘱服用含氢氧化铝的药,请同学们写出该反应的化学方程式
生活上:蚊虫能分泌出蚁酸,人被一些蚊虫叮咬后可在叮咬处涂一些含有碱性物质的溶液,如稀氨水、肥皂液等,可减轻痛痒。
你知道为什么皮蛋和碱水面加醋会更加美味吗?
课堂小结
1.什么是中和反应?
2.中和反应的微观实质是什么?
3.中和反应在生产生活中有哪些应用?
1. 下列属于中和反应的是( )
A. 2NaOH+CO2=== Na2CO3+H2O
B. 2HCl+Ca(OH)2=== CaCl2+2H2O
C. Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
D. CaCO3+2HCl=== CaCl2+H2O+CO2↑
B
2.饮食过量,胃酸会大量分泌,以致消化不良。为缓解该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
随堂练习
B
3.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如图。下列说法不正确的是( )
A.反应前后阴、阳离子的总数目不变
B.反应前后溶液的总质量不变
C.反应后溶液呈中性
D.反应前后元素种类不变
A
4.某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示。下列说法正确的是( )
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是
K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛
有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
D
5. 将一定量氢氧化钙溶液加入稀盐酸中,未观察到明显现象,为判断滴加的氢氧化钙溶液是否过量,同学们向反应后溶液中分别加入下列物质,其中判断不正确的是( )
选项 选用物质 判断方法
A 紫色石蕊试液 若溶液变红,则氢氧化钙溶液过量
B 氯化铜溶液 若产生蓝色沉淀,则氢氧化钙溶液过量
C pH试纸 若pH大于7,则氢氧化钙溶液过量
D 二氧化碳 若产生白色沉淀,则氢氧化钙溶液过量
A
6. 下列方法可以解决生活中的一些问题:
①服用含氢氧化铝[Al(OH)3)]的药物可以治疗胃酸过多症,反应的化学方程式为___________________________________。
②热水瓶用久后,瓶胆内壁常附着一层水垢(主要成分是CaCO3和Mg(OH)2),可以用___________来洗涤。写出其与Mg(OH)2反应的化学方程式_____________________________________。
稀盐酸
Al(OH)3+3HCl === AlCl3+3H2O
Mg(OH)2+2HCl === MgCl2+2H2O
③实验室中含有盐酸的废水直接倒入下水道会造成铸铁管道腐蚀,所以,需将废液处理后再排放。你的处理方法是_____________________________
_________________________。
以上三个问题的解决方法应用的共同原理是:____与____发生______反应。
先将含有盐酸的废液倒入废
酸
碱
中和
液缸中,加碱溶液中和
7.将稀盐酸缓慢滴入装有氢氧化钠溶液的烧杯中,用温度传感器测出烧杯中溶液的温度随加入稀盐酸的质量变化的图像如图:
(1)由图可知,稀盐酸与氢氧化钠溶液发生的反应是
_______(填“放热”或“吸热”)反应,当溶液温
度达到最高时,消耗稀盐酸的质量为________。
放热
36.5 g
(2)取A点处的溶液并加入一定量的硫酸铜溶液,可观察到的现象是________________。
(3)C点溶液中溶质的成分为_____________(填化学式)。
(4)如果改用氢氧化钠固体与稀盐酸反应来探究中和反应中能量的变化情况,你认为是否合理________,理由是
_________________________。
有蓝色沉淀产生
NaCl和HCl
不合理
氢氧化钠固体溶解也放热
课时4 中和反应
九年级下册
沪教版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 掌握中和反应的概念,能从微粒变化的角度认识酸碱中和反应的本质;
2. 认识酸碱中和反应在生活、生产中的重要作用。
重难点
重点
学习目标
酸溶液显酸性,碱溶液显碱性,如果酸与碱混合,溶液酸碱性如何变化呢?
(1)向盛有氢氧化钠溶液的烧杯中滴加2~3滴酚酞试液,插入温度计,测量溶液温度;
(2)用胶头滴管向上述烧杯中逐滴滴入稀盐酸,并用玻璃棒不断搅拌,当溶液恰好变为无色时,停止滴加稀盐酸,测量溶液的温度。
实验步骤 实验现象 实验结论
向盛有氢氧化钠溶液的烧杯中滴加2~3滴酚酞试液
用胶头滴管向上述烧杯中逐滴滴入稀盐酸,并用玻璃棒不断搅拌,当溶液恰好变为无色时,停止滴加稀盐酸,测量溶液的温度
再向(2)所得溶液中滴加1滴氢氧化钠溶液
氢氧化钠溶液呈碱性
二者发生了化学反应,且反应放出热量
氢氧化钠溶液与盐酸发生了反应
溶液变为红色
溶液由红色变为无色,温度计示数增大
溶液变为红色
氢氧化钠与稀盐酸反应的方程式如何书写?
氢氧化钠与盐酸反应示意图
化学方程式:HCl + NaOH === NaCl + H2O
氢氧化钠溶液和盐酸反应没有明显现象,加入指示剂酚酞,通过红色褪色可以判断反应物氢氧化钠的消耗,证明二者发生了化学反应
1.实验中滴加酚酞溶液起到了什么作用?
2.在溶液恰好变为无色的时候,溶液的酸碱性是怎样的?这说明了什么?
溶液酸碱性均消失,溶液呈中性,说明氢氧化钠溶液与稀盐酸发生了反应
3.若将(2)中得到的液体蒸干,会出现什么现象?
留下白色晶体
议一议
其它的酸和碱也能发生类似反应:
酸
碱
盐
水
HCl + NaOH === NaCl + H2O
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4 + 2NaOH === Na2SO4 + 2H2O
+
+
酸与碱作用生成盐和水的反应,叫做中和反应。
中和反应会放出热量
中和反应的微观实质理解
HCl → H+ + Cl
NaOH → Na+ + OH
酸和碱的中和反应生成的水从哪里来的呢?盐又从哪里来的呢?
HCl + NaOH === NaCl + H2O
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4 + 2NaOH === Na2SO4 + 2H2O
根据微观图示可知,酸和碱中和时,会互相交换成分:
实际上就是酸的阴离子和碱的阳离子结合生成盐,酸中的氢离子与碱中的氢氧根离子结合成水分子
H+ + OH- === H2O
认识了中和反应,那你知道中和反应在生产生活中有哪些应用吗?
?
农业上:可以改良酸性土壤。人们会将熟石灰加入酸性土壤中,以中和其酸性,适宜农作物生长。
为什么不用氢氧化钠固体来中和酸性土壤呢?
工业上:处理工厂废水,硫酸厂的污水中含有硫酸等物质,印染厂的废水呈碱性,在排放前,都要选择相应的碱或酸进行中和处理,以防止污染水体和土壤。
有些工厂排放的废水中含有硫酸,可用氨水(NH3·H2O)中和。反应的化学方程式为:2NH3·H2O+H2SO4===(NH4)2SO4+2H2O
医药上:人的胃液含有适量盐酸,帮助消化,如果暴饮暴食导致胃酸分泌过多会造成不适,可以遵医嘱服用含氢氧化铝的药,请同学们写出该反应的化学方程式
生活上:蚊虫能分泌出蚁酸,人被一些蚊虫叮咬后可在叮咬处涂一些含有碱性物质的溶液,如稀氨水、肥皂液等,可减轻痛痒。
你知道为什么皮蛋和碱水面加醋会更加美味吗?
课堂小结
1.什么是中和反应?
2.中和反应的微观实质是什么?
3.中和反应在生产生活中有哪些应用?
1. 下列属于中和反应的是( )
A. 2NaOH+CO2=== Na2CO3+H2O
B. 2HCl+Ca(OH)2=== CaCl2+2H2O
C. Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
D. CaCO3+2HCl=== CaCl2+H2O+CO2↑
B
2.饮食过量,胃酸会大量分泌,以致消化不良。为缓解该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
随堂练习
B
3.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如图。下列说法不正确的是( )
A.反应前后阴、阳离子的总数目不变
B.反应前后溶液的总质量不变
C.反应后溶液呈中性
D.反应前后元素种类不变
A
4.某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示。下列说法正确的是( )
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是
K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛
有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
D
5. 将一定量氢氧化钙溶液加入稀盐酸中,未观察到明显现象,为判断滴加的氢氧化钙溶液是否过量,同学们向反应后溶液中分别加入下列物质,其中判断不正确的是( )
选项 选用物质 判断方法
A 紫色石蕊试液 若溶液变红,则氢氧化钙溶液过量
B 氯化铜溶液 若产生蓝色沉淀,则氢氧化钙溶液过量
C pH试纸 若pH大于7,则氢氧化钙溶液过量
D 二氧化碳 若产生白色沉淀,则氢氧化钙溶液过量
A
6. 下列方法可以解决生活中的一些问题:
①服用含氢氧化铝[Al(OH)3)]的药物可以治疗胃酸过多症,反应的化学方程式为___________________________________。
②热水瓶用久后,瓶胆内壁常附着一层水垢(主要成分是CaCO3和Mg(OH)2),可以用___________来洗涤。写出其与Mg(OH)2反应的化学方程式_____________________________________。
稀盐酸
Al(OH)3+3HCl === AlCl3+3H2O
Mg(OH)2+2HCl === MgCl2+2H2O
③实验室中含有盐酸的废水直接倒入下水道会造成铸铁管道腐蚀,所以,需将废液处理后再排放。你的处理方法是_____________________________
_________________________。
以上三个问题的解决方法应用的共同原理是:____与____发生______反应。
先将含有盐酸的废液倒入废
酸
碱
中和
液缸中,加碱溶液中和
7.将稀盐酸缓慢滴入装有氢氧化钠溶液的烧杯中,用温度传感器测出烧杯中溶液的温度随加入稀盐酸的质量变化的图像如图:
(1)由图可知,稀盐酸与氢氧化钠溶液发生的反应是
_______(填“放热”或“吸热”)反应,当溶液温
度达到最高时,消耗稀盐酸的质量为________。
放热
36.5 g
(2)取A点处的溶液并加入一定量的硫酸铜溶液,可观察到的现象是________________。
(3)C点溶液中溶质的成分为_____________(填化学式)。
(4)如果改用氢氧化钠固体与稀盐酸反应来探究中和反应中能量的变化情况,你认为是否合理________,理由是
_________________________。
有蓝色沉淀产生
NaCl和HCl
不合理
氢氧化钠固体溶解也放热
