第3章 空气与生命1-3节复习
图片预览



文档简介
课件17张PPT。第3章 空气与生命
——1-3节专题复习 为测量空气中氧气的体积含量,将钟罩放入盛水的水槽中,把钟罩内水面以上的容积分为五等份,在燃烧匙内盛红磷,用酒精灯点燃后,立即放入钟罩内,同时塞紧皮塞,试说明观察到的现象,原因及结论。
现象:
原因:
结论:
若水面上升不高,则可能的原因(至少两点)
___________________________
此实验说明剩余气体有哪些性质(至少两点)。
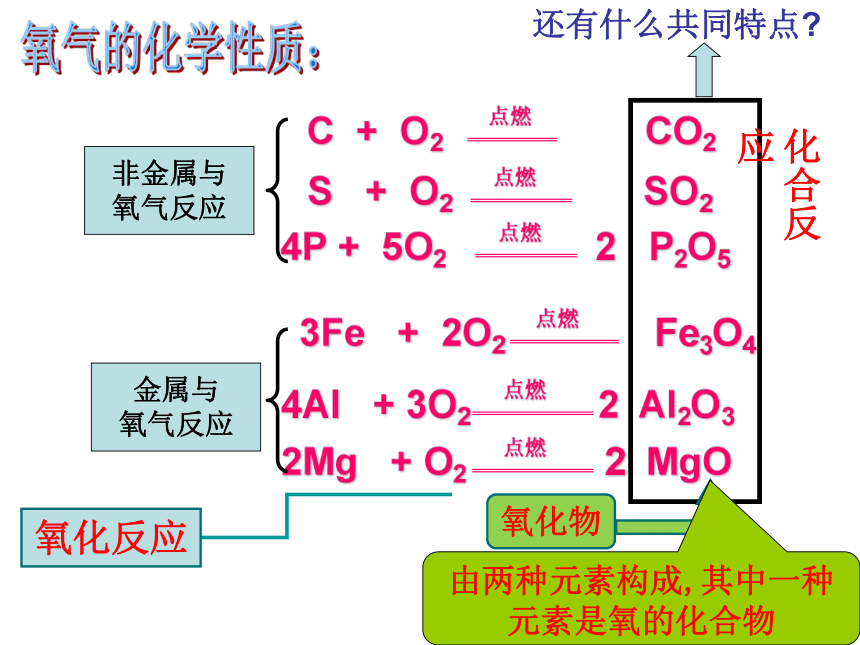
___________________________红磷燃烧,产生白烟,冷却至室温,钟罩内水面上升至总体积的1/5处红磷燃烧,消耗掉氧气,使气压降低,水面就上升。氧气的体积约占整个空气体积的1/5①气密性不好 ②红磷不足①不燃烧也不支持燃烧 ②不溶于水实验探究硫磷铁丝说一说 反应现象 写一写化学方程式氧气的化学性质:氧化物由两种元素构成,其中一种元素是氧的化合物氧化反应还有什么共同特点?化合反应
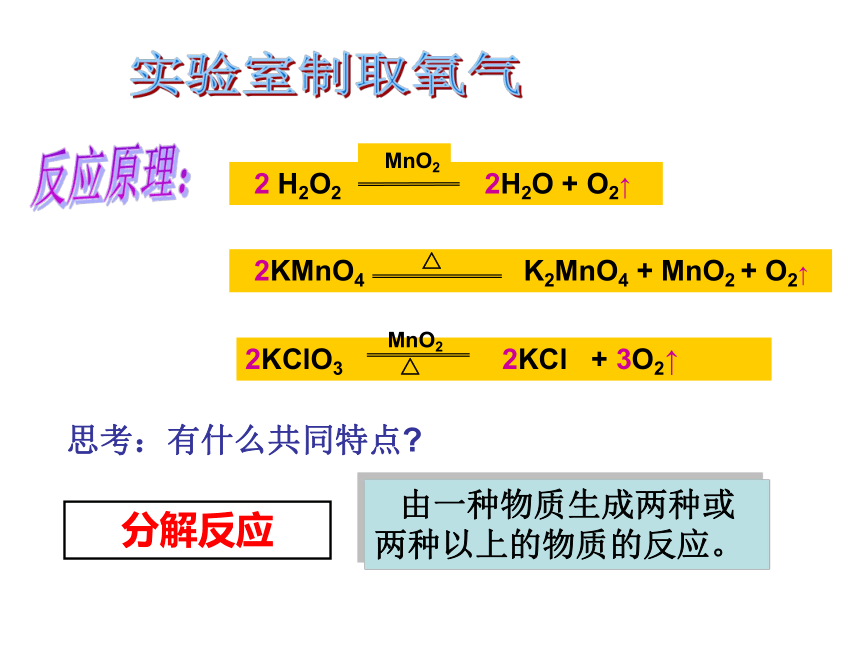
实验室制取氧气反应原理:思考:有什么共同特点?分解反应由一种物质生成两种或
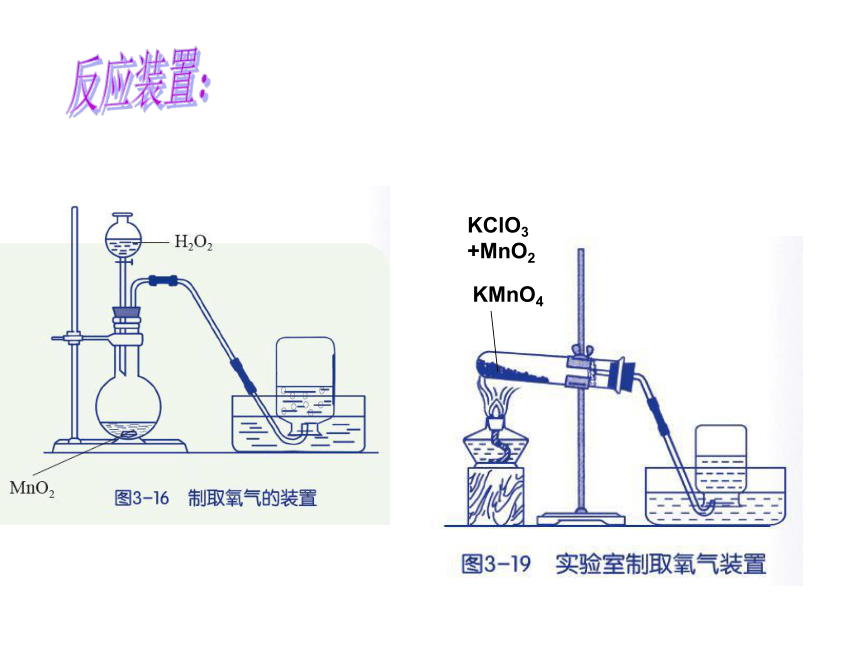
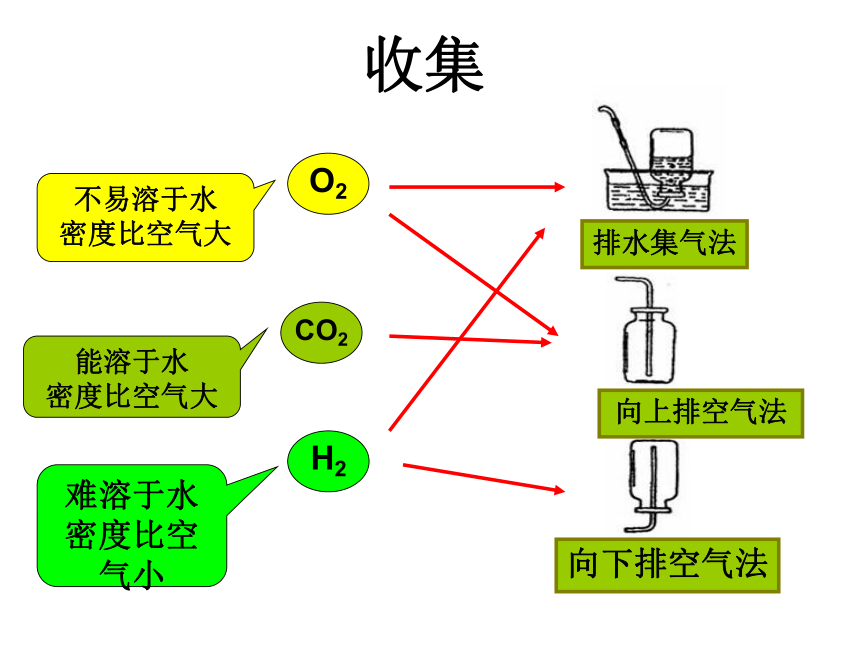
两种以上的物质的反应。 反应装置:收集不易溶于水
密度比空气大能溶于水
密度比空气大难溶于水
密度比空气小O2CO2H2排水集气法向上排空气法向下排空气法?O2O2空气空气O2O2水思考:如何正确使用“万能集气瓶”?H2空气空气H2向上排空气法向下排空气法排水法化学方程式书写原则:A.以客观事实为依据; (反应是真实存在的)B.符合质量守恒定律。
(反应前后两边的原子个数必须相等) 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和反应分子中的原子进行重新的排列和组合,在这个过程中:都不变!一、用质量守恒定律解释:
1、铁生锈后质量增加;
2、煤燃烧后质量减小。
二、已知:
2X + 3CuO ? 3Cu + 3H2O + N2
则X的化学式是( )
NH3在一密闭容器中装有一定量的A、B、C、D四种物质,反应前后质量如下表:求:1、反应后C物质的质量;
2、写出化学反应方程式;
3、要使另一种反应物反应完全,
需再增加( )物质( )克。44B8B + D = A + C+12-16-20+24表示什么物质参加反应,结果生成了什么物质表示反应物、生成物各物质间的质量比表示各物质间原子和分子的个数比
表示反应在什么条件下进行
化学方程式的涵义完全燃烧多少克镁,可生成10克氧化镁?(Mg:24 O:16)解:设需完全燃烧X克镁。488010gx = 6 g答:完全燃烧6克镁,可生成10克氧化镁。【解题步骤】(1)设未知量(2)写出反应的化学方程式(3)找:计算相关物质的相对分子质量及质量比 标出已知量、未知量(4)列比例式求解(5)简明地写出答案【书写格式】x依据化学方程式计算练习1:实验室里用加热氯酸钾和二氧化锰的混合物制取氧气,现将氯酸钾和二氧化锰混合物25克加热至气体不再产生,称得剩余固体的质量为15.4克, 问:(1)产生氧气多少克?(2)原混合物中含氯酸钾多少克?解:氧气的质量为:25克-15.4克=9.6克设原混合物中含氯酸钾X克245969.6克X答:产生氧气9.6克,原混合物中含氯酸钾24.5克。X=24.5克练习2:实验室里用50克含6.8%的过氧化氢的双氧水溶液在二氧化锰作催化剂条件下制取氧气。问:(1)可制得氧气多少克? (2)若氧气的密度是1.43克/升,求制得的氧气体积是多少升?(H:1 O:16)解:过氧化氢的质量为:50克×6.8%=3.4克设可制得氧气X克68323.4克X答:产生氧气1.6克,合体积1.12升。X=1.6克∴ V = m/ρ =1.6g÷1.43g/L = 1.12L练习3、如图所示,实验室用过氧化氢制取氧气,烧瓶内的物质的质量在完全反应前后如右图所示,问:实验前加入过氧化氢多少克? 2H2O2 2H2O + O2↑MnO2X3.268 32 68
X32
3.2X = 6.8g解:氧气质量 100 – 96.8 = 3.2g设需过氧化氢的质量为X 练习4、实验室用100克过氧化氢溶液制取氧气,完全反应后生成氧气3.2克?问:原过氧化氢溶液的质量分数是多少? 2H2O2 2H2O + O2↑MnO2X3.268 32 68
X32
3.2X = 6.8g解:6.8
100100%6.8%设需过氧化氢的质量为XH2O2 %=
——1-3节专题复习 为测量空气中氧气的体积含量,将钟罩放入盛水的水槽中,把钟罩内水面以上的容积分为五等份,在燃烧匙内盛红磷,用酒精灯点燃后,立即放入钟罩内,同时塞紧皮塞,试说明观察到的现象,原因及结论。
现象:
原因:
结论:
若水面上升不高,则可能的原因(至少两点)
___________________________
此实验说明剩余气体有哪些性质(至少两点)。
___________________________红磷燃烧,产生白烟,冷却至室温,钟罩内水面上升至总体积的1/5处红磷燃烧,消耗掉氧气,使气压降低,水面就上升。氧气的体积约占整个空气体积的1/5①气密性不好 ②红磷不足①不燃烧也不支持燃烧 ②不溶于水实验探究硫磷铁丝说一说 反应现象 写一写化学方程式氧气的化学性质:氧化物由两种元素构成,其中一种元素是氧的化合物氧化反应还有什么共同特点?化合反应
实验室制取氧气反应原理:思考:有什么共同特点?分解反应由一种物质生成两种或
两种以上的物质的反应。 反应装置:收集不易溶于水
密度比空气大能溶于水
密度比空气大难溶于水
密度比空气小O2CO2H2排水集气法向上排空气法向下排空气法?O2O2空气空气O2O2水思考:如何正确使用“万能集气瓶”?H2空气空气H2向上排空气法向下排空气法排水法化学方程式书写原则:A.以客观事实为依据; (反应是真实存在的)B.符合质量守恒定律。
(反应前后两边的原子个数必须相等) 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和反应分子中的原子进行重新的排列和组合,在这个过程中:都不变!一、用质量守恒定律解释:
1、铁生锈后质量增加;
2、煤燃烧后质量减小。
二、已知:
2X + 3CuO ? 3Cu + 3H2O + N2
则X的化学式是( )
NH3在一密闭容器中装有一定量的A、B、C、D四种物质,反应前后质量如下表:求:1、反应后C物质的质量;
2、写出化学反应方程式;
3、要使另一种反应物反应完全,
需再增加( )物质( )克。44B8B + D = A + C+12-16-20+24表示什么物质参加反应,结果生成了什么物质表示反应物、生成物各物质间的质量比表示各物质间原子和分子的个数比
表示反应在什么条件下进行
化学方程式的涵义完全燃烧多少克镁,可生成10克氧化镁?(Mg:24 O:16)解:设需完全燃烧X克镁。488010gx = 6 g答:完全燃烧6克镁,可生成10克氧化镁。【解题步骤】(1)设未知量(2)写出反应的化学方程式(3)找:计算相关物质的相对分子质量及质量比 标出已知量、未知量(4)列比例式求解(5)简明地写出答案【书写格式】x依据化学方程式计算练习1:实验室里用加热氯酸钾和二氧化锰的混合物制取氧气,现将氯酸钾和二氧化锰混合物25克加热至气体不再产生,称得剩余固体的质量为15.4克, 问:(1)产生氧气多少克?(2)原混合物中含氯酸钾多少克?解:氧气的质量为:25克-15.4克=9.6克设原混合物中含氯酸钾X克245969.6克X答:产生氧气9.6克,原混合物中含氯酸钾24.5克。X=24.5克练习2:实验室里用50克含6.8%的过氧化氢的双氧水溶液在二氧化锰作催化剂条件下制取氧气。问:(1)可制得氧气多少克? (2)若氧气的密度是1.43克/升,求制得的氧气体积是多少升?(H:1 O:16)解:过氧化氢的质量为:50克×6.8%=3.4克设可制得氧气X克68323.4克X答:产生氧气1.6克,合体积1.12升。X=1.6克∴ V = m/ρ =1.6g÷1.43g/L = 1.12L练习3、如图所示,实验室用过氧化氢制取氧气,烧瓶内的物质的质量在完全反应前后如右图所示,问:实验前加入过氧化氢多少克? 2H2O2 2H2O + O2↑MnO2X3.268 32 68
X32
3.2X = 6.8g解:氧气质量 100 – 96.8 = 3.2g设需过氧化氢的质量为X 练习4、实验室用100克过氧化氢溶液制取氧气,完全反应后生成氧气3.2克?问:原过氧化氢溶液的质量分数是多少? 2H2O2 2H2O + O2↑MnO2X3.268 32 68
X32
3.2X = 6.8g解:6.8
100100%6.8%设需过氧化氢的质量为XH2O2 %=
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
