浙教版科学 八下2.3原子结构的模型同步练习(能力提升)(含解析)
文档属性
| 名称 | 浙教版科学 八下2.3原子结构的模型同步练习(能力提升)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 792.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-02-23 15:08:19 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2.3原子结构的模型
一、单选题
1.下列关于原子核的叙述:①通常是由分子和电子构成;②通常是由质子和中子构成;③带正电荷;④不显电性;⑤不能再分;⑥跟原子比较体积较小,但却集中了原子的主要质量。其中正确的是( )
A.②④⑥ B.②③⑥ C.①③⑤ D.①④⑤
2.2020年12月17日,嫦娥五号返回器携带月壤样品回到地球。月壤中蕴含He-3,它被认为是解决未来能源问题的重要物质之一。地球上的氦元素主要以He-4形式存在,He-4原子核内有2个质子和2个中子,下列说法正确的是( )
A. He-3原子核中有2个中子 B.He-3原子核外有3个电子
C.He-3和He-4是同位素原子 D.He-3和He-4的原子质量相同
3.成至2020年底,“中国天眼"(FAST)已发现脉冲星超过240颗,脉冲星即旋转的中子星。在中子星,巨大的压力将核外电子压缩到原子核中,电子与质子“中和”为中子,整个中子星就是由这样的原子核紧挨在一起形成的。以下对中子的说法和对中子星的分析,错误的是( )
A.中子不显电性 B.中于由夸克构成
C.中子星上存在丰富的氢离子 D.中子星的密度远大于地球
4.华南理工大学研究团队利用动态“局域柔性”框架材料,实现了在室温下对重水和普通水的有效分离。一个重水分子(2H2O)中含有的质子个数为( )
A.3 B.10 C.12 D.20
5.月球上的土壤含有丰富的氦-3,地球上的氢元素主要以氦-4形式存在。下图是氦-3和氦-4的原子结构示意图,下列说法不正确的是( )
A.氦-3和氦-4属于同种元素 B.氦-3和氦-4互为同位素原子
C.一个氦-3原子核内有3个质子 D.一个氦-4原子核外有2个电子
6.据科学家推测,月球的土壤中吸附着数百万吨的3He,每一百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4He的形式存在。下列说法中正确的是( )
A.4He原子核内含有4个质子 B.3He和4He互为同位素
C.3He原子核内含有3个中子 D.4He和3He是同种元素的同种原子
7.用“”“”“”分别表示质子、中子和电子,下图表示四种原子的结构模型。下列有关说法中正确的是 ( )
A.甲、丁互为同位素 B.乙、丁属于同一种元素
C.甲、丙的核电荷数不同 D.甲、丙为同一种原子
8.科学家通常采用两种相对较“轻”的元素,让它们的原子核高速碰撞聚合为一个新的核,从而合成出新的元素,如原子序数为113、114、115等元素,这些元素最本质的区别是( )
A.中子数不同 B.电子数不同
C.质子数不同 D.相对原子质量不同
9.石墨烯是从石墨中分离出来的一层或多层碳原子构成的石墨片,下列相关说法中正确的是( )
A.石墨烯不可以转变成金刚石,因为它们组成的元素种类相同
B.超导材料适合用来做家庭电路中输电导线
C.石墨烯属于单质,但不具有可燃性
D.石墨烯和石墨互为同位素
二、填空题
10.如图实验装置,放射源发出的α粒子“轰击”金箔,并对散射的α粒子进行统计。发现:绝大多数α粒子都能沿直线穿过金箔,有少数发生很大的偏转,极少数甚至被弹回。这就是著名的卢瑟福α粒子散射实验。
(1)卢瑟福在实验基础上建立了原子的 模型。
(2)实验时,若将显微镜分别放在位置1、2、3,则能观察到粒子数量最多的是位置 。
11.人类对原子结构的认识经历了一个相当长的时期,一代代科学家不断地发现和提出新的原子结构模型。请回答:
(1)以下是科学家及其提出的原子结构假设模型(如图所示),按照原子结构模型建立的先后顺排列为 (填图中序号)。
①②③④
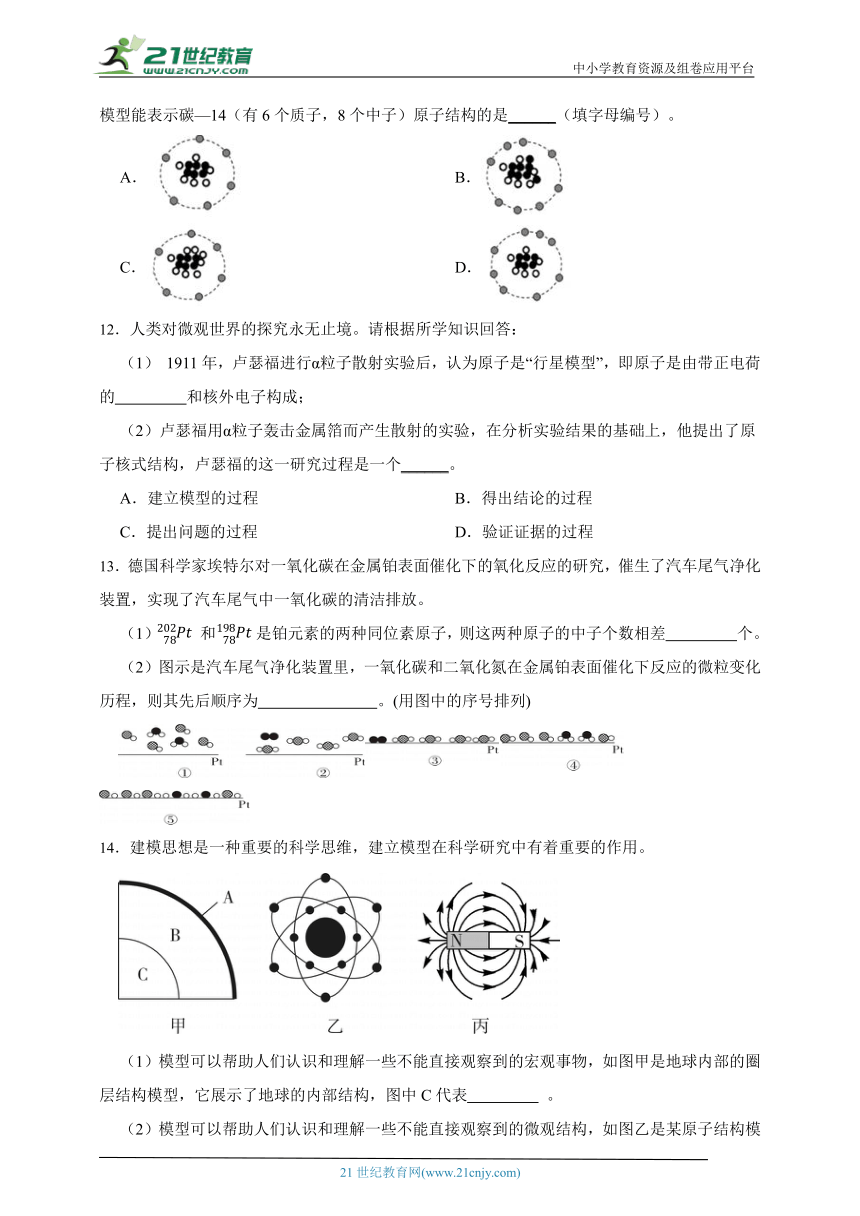
(2)2022年4月26日,我国首次国产化碳—14批量生产在中核集团秦山核电站启动。下列模型能表示碳—14(有6个质子,8个中子)原子结构的是______(填字母编号)。
A. B.
C. D.
12.人类对微观世界的探究永无止境。请根据所学知识回答:
(1) 1911年,卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由带正电荷的 和核外电子构成;
(2)卢瑟福用α粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了原子核式结构,卢瑟福的这一研究过程是一个______。
A.建立模型的过程 B.得出结论的过程
C.提出问题的过程 D.验证证据的过程
13.德国科学家埃特尔对一氧化碳在金属铂表面催化下的氧化反应的研究,催生了汽车尾气净化装置,实现了汽车尾气中一氧化碳的清洁排放。
(1) 和是铂元素的两种同位素原子,则这两种原子的中子个数相差 个。
(2)图示是汽车尾气净化装置里,一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化历程,则其先后顺序为 。(用图中的序号排列)
14.建模思想是一种重要的科学思维,建立模型在科学研究中有着重要的作用。
(1)模型可以帮助人们认识和理解一些不能直接观察到的宏观事物,如图甲是地球内部的圈层结构模型,它展示了地球的内部结构,图中C代表 。
(2)模型可以帮助人们认识和理解一些不能直接观察到的微观结构,如图乙是某原子结构模型,它表示了原了子核在原子中所占体积很小, 在核外空间高速运动。
(3)模型可以帮助人们提示客观对象的形态、特征和本质,如图丙为条形磁铁的磁感线模型,磁体周围的磁场强弱是通过 来描述的。
15.科研人员将一束镁-24的原子核加速到光速的一半左右,并将其射入由元素锁制成的金属箔靶,创造出了迄今世界上最轻的镁同位素:镁-18
(1)镁-24和镁-18互为同位素原子,本质上是因为它们有相同的 (填“质子数” “中子数”或“电子数”)
(2)若将一束镁-24的原子核沿如图所示虚线方向水平向右飞过小磁针的上方,小磁针的N极向纸内偏转;若一束电子水平向右通过小磁针上方,则小磁针的N极向 偏转(填“纸内”“纸外”或“不偏转”)
16.如图为原子核聚变(原理是让两个原子核发生聚合作用,生成一个新的原子核)的示意图,①②③表示三种原子,“”、“”、“”分别表示原子中的不同微粒,聚变前后的微粒种类不变,各微粒总数也不变。
(1)图中属于同种元素的是 (填序号);
(2)微粒“”所带的电荷类型是 (A.带正电 B.带负电 C.不带电)
17.“青团”是江南人家在清明节吃的一道传统点心,“青团”制作时通常往糯米粉中添加艾草(或艾草汁),人工种植艾草往往用其根茎而不用种子。艾草含有侧柏莲酮芳香油(C10H10O),侧柏莲酮芳香油是一种淡黄色液体、具有香脂香气,所以“青团”具有独特风味。
(1)根据上述信息,写出侧柏莲酮芳香油的一条物理性质: .
(2)侧柏莲酮芳香油由 种元素组成。
(3)如图所示为艾草开花后的植株,判断其为 植物。
答案解析部分
1.【答案】B
【知识点】原子的构成与探索过程
【解析】【分析】原子核通常由质子和中子构成,其中质子带正电荷,中子不带电,所以原子核显正电,原子核几乎占有了整个原子的质量,但是其体积和整个原子相比几乎可以忽略。
【解答】①原子核由质子和中子构成,错误;⑤原子核分为质子和中子,说明可以再分,错误;其它选项都正确。
故答案为:B
2.【答案】C
【知识点】原子的构成与探索过程;同位素
【解析】【分析】(1)相对原子质量=质子数+中子数;
(2)核外电子数等于质子数;
(3)具有相同的质子数和不同中子数的原子,称为同位素原子;
(4)相对原子质量相同时,原子的实际质量才相同,据此分析判断。
【解答】A. He-3的相对原子质量为3,质子数为2,则原子核中有中子数为:3-2=1,故A错误;
B. He-3原子核内有2个质子,根据核外电子数等于质子数可知,核外电子数为3,故B错误;
C. He-3和He-4的质子数都是2,但是中子数不同,二者为同位素原子,故C正确;
D. He-3和He-4的相对原子质量不同,则它们的实际质量不同,故D错误。
故选C。
3.【答案】C
【知识点】原子的构成与探索过程
【解析】【分析】从题目给出的资料中提取信息,结合原子结构的知识分析判断。
【解答】 A.中子不带电,对外不显电性,故A正确不合题意;
B.中子由夸克构成,故B正确不合题意;
C.在中子星,巨大的压力将核外电子压缩到原子核中,不容易失去电子,中子星上不存在丰富的氢离子,故C错误符合题意;
D.原子的质量主要集中在原子核上,整个中子星就是由这样的原子核紧挨在一起形成的,所以中子星的密度远大于地球,故D正确不合题意。
故选C。
4.【答案】B
【知识点】原子的构成与探索过程
【解析】【分析】根据分子由原子构成,氢、氧原子质子数分析。
【解答】一个重水分子由2个氢原子和1个氧原子构成,氢原子质子数为1,氧原子质子数为8,则重水分子中含有质子个数为10;
故选B。
5.【答案】C
【知识点】同位素
【解析】【分析】 同位素是指质子数相同而中子数不同的同一元素的不同原子互称为同位素 ;在原子中,质子数=核外电子数=核电荷数=原子序数;
【解答】A. 在化学中元素是指具有相同核电荷数(或质子数)的一类原子的总称。 所以 氦-3和氦-4属于同种元素,A正确;
B.氦-3和氦-4中质子数相同,中子数不同,互为同位素原子,B正确;
C.一个氦-3原子核内有2个质子,C错误;
D. 一个氦-4原子核外有2个电子 ,D正确;
故答案为:C.
6.【答案】B
【知识点】原子的构成与探索过程;同位素
【解析】【分析】(1)质子数等于原子序数;
(2)(4)具有相同质子数和不同中子数的原子称为同位素原子;
(3)中子数=相对原子质量-质子数。
【解答】A.4He原子核内含有2个质子,故A错误;
BD.3He和4He的质子数都是2,而中子数分别为1和2,应该为同位素,故B正确,D错误;
C.3He原子的质子数为2,相对原子质量为3,则中子数为:3-2=1,故C错误。
故选B。
7.【答案】B
【知识点】同位素;元素的概念
【解析】【分析】(1)具有相同质子数和不同中子数的原子称为同位素原子;
(2)元素的本质区别是质子数不同;
(3)质子数=核外电子数=核外电子数;
(4)同种原子的质子数相同。
【解答】甲的核外电子数为1,则它的质子数为1;丁的核外电子数为2,则它的质子数为2。二者的质子数不同,肯定不是同位素,故A错误;
乙的核外电子数为2,则质子数为2,那么乙和丁的质子数相同,为同种元素,故B正确;
甲的核电荷数为1,则它的质子数为1;丙的的核电荷数为1,则丙的质子数为1,则甲和乙的核电荷数相同,故C错误;
甲和丙的质子数相等,但是中子数不同,那么为同位素原子,故D错误。
故选B。
8.【答案】C
【知识点】元素的概念
【解析】【分析】根据元素的定义判断。
【解答】元素是具有相同的核电荷数(质子数)的同一类原子的统称,即元素不同,则质子数不同,故C正确,而A、B、D错误。
故选C。
9.【答案】B
【知识点】半导体和超导体;同位素;元素的概念
【解析】【分析】(1)根据二者的结构不同判断;
(2)性质决定用途;
(3)根据碳元素的性质判断;
(4)具有相同的质子数和不同中子数的原子,成为同位素原子。
【解答】A.石墨烯和金刚石的组成元素相同,只是碳原子的排列方式不同,在高温高压等特殊环境下,一旦改变结构,可以实现相互转换,故A错误;
B.超导材料的电阻很小,输送电能时发热很少,适合做导线,故B正确;
C.石墨烯是碳元素组成的单质,肯定具有可燃性,故C错误;
D.石墨烯和石墨的原子的质子数和中子数都相等,不是同位素,故D错误。
故选B。
10.【答案】(1)原子核式结构
(2)3
【知识点】显微镜的使用;原子的构成与探索过程
【解析】【分析】(1)根据原子结构的发现史分析解答;
(2)显微镜的镜头离物体越近,则放大倍数越大,但是视野内看到物体的数量减少,据此分析解答。
【解答】(1)卢瑟福在实验基础上建立了原子的原子核式结构模型。
(2)根据图片可知,显微镜在位置3时离物体最远,此时放大倍数最小,而看到粒子数量最多。
11.【答案】(1)④③②①
(2)C
【知识点】原子的构成与探索过程
【解析】【分析】(1)根据原子的研究历程分析;
(2)根据碳原子质子数=电子数=6分析。
【解答】(1)原子结构模型建立最先是道尔顿的实心球模型,然后汤姆生发现电子,提出面包葡萄干模型,然后卢瑟福通过粒子轰击金箔实验得出原子核式模型,最后玻尔的电子分层模型,即④③②① 。
(2) 碳—14 原子核内6个质子,8个中子,核外6个电子,故选C。
故答案为:(1) ④③②① ;(2)C。
12.【答案】(1)原子核
(2)A
【知识点】原子的构成与探索过程
【解析】【分析】 卢瑟福进行a粒子散射实验后,提出了图乙所示的原子核式结构,原子是由原子核和核外电子构成;这是一个建立模型的过程。
【解答】(1)原子是由原子核和核外电子构成的。
(2)A.卢瑟福用α粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了原子核式结构,这是原子的模型,所以是建立模型的过程,故A正确;
B.卢瑟福通过实验并没有得出原子结构的真正结构,只是提出了一种假设,故B错误;
C.这是通过实验建立模型的过程,而不是鹈鹕问题,故C错误;
D.这是通过实验建立模型的过程,而不是验证证据,故D错误。
故选:A。
13.【答案】(1)4
(2)①④⑤③②
【知识点】构成物质的粒子模型;原子的构成与探索过程
【解析】【分析】(1)根据相对原子质量=质子数+中子数分析;
(2)根据化学变化的实质是分子分成原子,原子重新结合成新分子分析。
【解答】(1) 和是铂元素的两种同位素原子, 这两种原子的质子数相等,都为78,则中子个数相差 202-198=4。
(2) 一氧化碳和二氧化氮在金属铂表面催化下反应,先 一氧化碳和二氧化氮分子分成碳、氧、氮原子,然后碳、氧、氮原子重新组成,生成氮分子和二氧化碳分子,先后顺序为 ①④⑤③② 。
故答案为:(1)4;(2) ①④⑤③② 。
14.【答案】(1)地核
(2)电子
(3)磁感线的疏密程度
【知识点】磁场和磁感线;原子的构成与探索过程;地球内部的结构
【解析】【解答】
(1)地球的内部结构圈层从外到内依次是地壳、地幔、地核,由图甲可知,C是地核。
(2)原子的核式结构模型为:原子是由原子核和核外电子够成的,原子核由质子(带正电)和中子(不带电)构成的,电子(带负电)绕着原子核高速做圆周运动,由图乙可知,乙是电子。
(3)磁体周围的磁场强弱是通过磁感线的疏密来描述的,磁感线越密,表示磁场越强,磁感线越疏,表示磁场越弱。
【分析】
(1)地球的内部结构圈层从外到内依次是地壳、地幔、地核。
(2)根据卢瑟福的α粒子散射实验,如图乙可知,原子内部是空心的,原子核体积占原子的体积很小,原子的原子核带正电,质量几乎占整个原子的总质量,核外有带负电的电子绕核做圆周运动。
(3)磁场的强弱是通过磁感线来描述的,磁场是真实存在的,磁感线是人们假想出来的模型,并不真实存在。
15.【答案】(1)质子数
(2)纸外
【知识点】通电直导线周围的磁场;同位素
【解析】【分析】(1)根据同位素的定义分析解答;
(2)通电导体的磁场方向与电流方向有关,据此分析解答。
【解答】(1)我们将具有相同的质子数和不同中子数的原子,成为同位素原子,则:镁-24和镁-18互为同位素原子,本质上是因为它们有相同的质子数。
(2)原子核带正电荷,则束镁-24的原子核沿如图所示虚线方向水平向右飞过小磁针的上方时,电流方向水平向右。若一束电子水平向右通过小磁针上方,则电子移动方向水平向右,而电流方向与其相反,即电流方向水平向左,那么小磁针上方的磁场方向正好与原来相反。根据电荷之间的相互作用规律可知,此时小磁针受力方向相反,偏转方向相反,也就是N极向纸外偏转。
16.【答案】(1)①②
(2)不带电
【知识点】原子的构成与探索过程;元素的概念
【解析】【分析】(1)元素的本质区别:质子数不同;
(2)在原子核中,质子带正电荷,中子不带电,据此分析解答。
【解答】(1)根据图片可知,①②的原子的电子数为1,根据“质子数=电子数”可知,①②两种原子的质子数相等,都是1,则①②表示同种元素。
(2)根据②可知,该原子的质子数为1,即○表示质子,而●表示中子,因此微粒“●”所带的电荷类型是不带电。
17.【答案】(1)淡黄色液体
(2)3
(3)被子
【知识点】种子植物;孢子植物;化学性质与物理性质的差别及应用;元素的概念
【解析】【分析】一是指物质不需要经过化学变化就表现出来的性质, 二是指物质没有发生化学反应就表现出来的性质叫做物理性质。 常见的植物从高等到低等依次为被子植物,裸子植物,蕨类,苔藓类和藻类。被子植物是指所有的绿色开花植物,有根、茎、叶、花、果实、种子;裸子植物由松、杉、柏、银杏、和苏铁,有根、茎、叶、种子;蕨类,孢子繁殖,只有根茎叶,代表满江红,胎生狗脊;苔藓类,无根,有茎叶,孢子繁殖,代表地钱、葫芦藓;藻类什么器官都没有,孢子繁殖,代表紫菜,水绵,蓝藻。
【解答】(1)一是指物质不需要经过化学变化就表现出来的性质, 二是指物质没有发生化学反应就表现出来的性质叫做物理性质。根据上述信息,写出侧柏莲酮芳香油的一条物理性质:淡黄色液体;
(2)侧柏莲酮芳香油(C10H10O) ,有碳、氢和氧三种元素;
(3)被子植物为绿色开花植物,有根茎叶花果实种子;所以如图所示为艾草开花后的植株,判断其为被子殖物。
故答案为:(1) 淡黄色液体 (2) 3 (3) 被子
试题分析部分
1、试卷总体分布分析
总分:38分
分值分布 客观题(占比) 18.0(47.4%)
主观题(占比) 20.0(52.6%)
题量分布 客观题(占比) 9(52.9%)
主观题(占比) 8(47.1%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
填空题 8(47.1%) 20.0(52.6%)
单选题 9(52.9%) 18.0(47.4%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (100.0%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 元素的概念 11.0(28.9%) 7,8,9,16,17
2 构成物质的粒子模型 2.0(5.3%) 13
3 孢子植物 3.0(7.9%) 17
4 显微镜的使用 2.0(5.3%) 10
5 原子的构成与探索过程 25.0(65.8%) 1,2,3,4,6,10,11,12,13,14,16
6 化学性质与物理性质的差别及应用 3.0(7.9%) 17
7 半导体和超导体 2.0(5.3%) 9
8 同位素 12.0(31.6%) 2,5,6,7,9,15
9 地球内部的结构 3.0(7.9%) 14
10 种子植物 3.0(7.9%) 17
11 磁场和磁感线 3.0(7.9%) 14
12 通电直导线周围的磁场 2.0(5.3%) 15
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2.3原子结构的模型
一、单选题
1.下列关于原子核的叙述:①通常是由分子和电子构成;②通常是由质子和中子构成;③带正电荷;④不显电性;⑤不能再分;⑥跟原子比较体积较小,但却集中了原子的主要质量。其中正确的是( )
A.②④⑥ B.②③⑥ C.①③⑤ D.①④⑤
2.2020年12月17日,嫦娥五号返回器携带月壤样品回到地球。月壤中蕴含He-3,它被认为是解决未来能源问题的重要物质之一。地球上的氦元素主要以He-4形式存在,He-4原子核内有2个质子和2个中子,下列说法正确的是( )
A. He-3原子核中有2个中子 B.He-3原子核外有3个电子
C.He-3和He-4是同位素原子 D.He-3和He-4的原子质量相同
3.成至2020年底,“中国天眼"(FAST)已发现脉冲星超过240颗,脉冲星即旋转的中子星。在中子星,巨大的压力将核外电子压缩到原子核中,电子与质子“中和”为中子,整个中子星就是由这样的原子核紧挨在一起形成的。以下对中子的说法和对中子星的分析,错误的是( )
A.中子不显电性 B.中于由夸克构成
C.中子星上存在丰富的氢离子 D.中子星的密度远大于地球
4.华南理工大学研究团队利用动态“局域柔性”框架材料,实现了在室温下对重水和普通水的有效分离。一个重水分子(2H2O)中含有的质子个数为( )
A.3 B.10 C.12 D.20
5.月球上的土壤含有丰富的氦-3,地球上的氢元素主要以氦-4形式存在。下图是氦-3和氦-4的原子结构示意图,下列说法不正确的是( )
A.氦-3和氦-4属于同种元素 B.氦-3和氦-4互为同位素原子
C.一个氦-3原子核内有3个质子 D.一个氦-4原子核外有2个电子
6.据科学家推测,月球的土壤中吸附着数百万吨的3He,每一百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4He的形式存在。下列说法中正确的是( )
A.4He原子核内含有4个质子 B.3He和4He互为同位素
C.3He原子核内含有3个中子 D.4He和3He是同种元素的同种原子
7.用“”“”“”分别表示质子、中子和电子,下图表示四种原子的结构模型。下列有关说法中正确的是 ( )
A.甲、丁互为同位素 B.乙、丁属于同一种元素
C.甲、丙的核电荷数不同 D.甲、丙为同一种原子
8.科学家通常采用两种相对较“轻”的元素,让它们的原子核高速碰撞聚合为一个新的核,从而合成出新的元素,如原子序数为113、114、115等元素,这些元素最本质的区别是( )
A.中子数不同 B.电子数不同
C.质子数不同 D.相对原子质量不同
9.石墨烯是从石墨中分离出来的一层或多层碳原子构成的石墨片,下列相关说法中正确的是( )
A.石墨烯不可以转变成金刚石,因为它们组成的元素种类相同
B.超导材料适合用来做家庭电路中输电导线
C.石墨烯属于单质,但不具有可燃性
D.石墨烯和石墨互为同位素
二、填空题
10.如图实验装置,放射源发出的α粒子“轰击”金箔,并对散射的α粒子进行统计。发现:绝大多数α粒子都能沿直线穿过金箔,有少数发生很大的偏转,极少数甚至被弹回。这就是著名的卢瑟福α粒子散射实验。
(1)卢瑟福在实验基础上建立了原子的 模型。
(2)实验时,若将显微镜分别放在位置1、2、3,则能观察到粒子数量最多的是位置 。
11.人类对原子结构的认识经历了一个相当长的时期,一代代科学家不断地发现和提出新的原子结构模型。请回答:
(1)以下是科学家及其提出的原子结构假设模型(如图所示),按照原子结构模型建立的先后顺排列为 (填图中序号)。
①②③④
(2)2022年4月26日,我国首次国产化碳—14批量生产在中核集团秦山核电站启动。下列模型能表示碳—14(有6个质子,8个中子)原子结构的是______(填字母编号)。
A. B.
C. D.
12.人类对微观世界的探究永无止境。请根据所学知识回答:
(1) 1911年,卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由带正电荷的 和核外电子构成;
(2)卢瑟福用α粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了原子核式结构,卢瑟福的这一研究过程是一个______。
A.建立模型的过程 B.得出结论的过程
C.提出问题的过程 D.验证证据的过程
13.德国科学家埃特尔对一氧化碳在金属铂表面催化下的氧化反应的研究,催生了汽车尾气净化装置,实现了汽车尾气中一氧化碳的清洁排放。
(1) 和是铂元素的两种同位素原子,则这两种原子的中子个数相差 个。
(2)图示是汽车尾气净化装置里,一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化历程,则其先后顺序为 。(用图中的序号排列)
14.建模思想是一种重要的科学思维,建立模型在科学研究中有着重要的作用。
(1)模型可以帮助人们认识和理解一些不能直接观察到的宏观事物,如图甲是地球内部的圈层结构模型,它展示了地球的内部结构,图中C代表 。
(2)模型可以帮助人们认识和理解一些不能直接观察到的微观结构,如图乙是某原子结构模型,它表示了原了子核在原子中所占体积很小, 在核外空间高速运动。
(3)模型可以帮助人们提示客观对象的形态、特征和本质,如图丙为条形磁铁的磁感线模型,磁体周围的磁场强弱是通过 来描述的。
15.科研人员将一束镁-24的原子核加速到光速的一半左右,并将其射入由元素锁制成的金属箔靶,创造出了迄今世界上最轻的镁同位素:镁-18
(1)镁-24和镁-18互为同位素原子,本质上是因为它们有相同的 (填“质子数” “中子数”或“电子数”)
(2)若将一束镁-24的原子核沿如图所示虚线方向水平向右飞过小磁针的上方,小磁针的N极向纸内偏转;若一束电子水平向右通过小磁针上方,则小磁针的N极向 偏转(填“纸内”“纸外”或“不偏转”)
16.如图为原子核聚变(原理是让两个原子核发生聚合作用,生成一个新的原子核)的示意图,①②③表示三种原子,“”、“”、“”分别表示原子中的不同微粒,聚变前后的微粒种类不变,各微粒总数也不变。
(1)图中属于同种元素的是 (填序号);
(2)微粒“”所带的电荷类型是 (A.带正电 B.带负电 C.不带电)
17.“青团”是江南人家在清明节吃的一道传统点心,“青团”制作时通常往糯米粉中添加艾草(或艾草汁),人工种植艾草往往用其根茎而不用种子。艾草含有侧柏莲酮芳香油(C10H10O),侧柏莲酮芳香油是一种淡黄色液体、具有香脂香气,所以“青团”具有独特风味。
(1)根据上述信息,写出侧柏莲酮芳香油的一条物理性质: .
(2)侧柏莲酮芳香油由 种元素组成。
(3)如图所示为艾草开花后的植株,判断其为 植物。
答案解析部分
1.【答案】B
【知识点】原子的构成与探索过程
【解析】【分析】原子核通常由质子和中子构成,其中质子带正电荷,中子不带电,所以原子核显正电,原子核几乎占有了整个原子的质量,但是其体积和整个原子相比几乎可以忽略。
【解答】①原子核由质子和中子构成,错误;⑤原子核分为质子和中子,说明可以再分,错误;其它选项都正确。
故答案为:B
2.【答案】C
【知识点】原子的构成与探索过程;同位素
【解析】【分析】(1)相对原子质量=质子数+中子数;
(2)核外电子数等于质子数;
(3)具有相同的质子数和不同中子数的原子,称为同位素原子;
(4)相对原子质量相同时,原子的实际质量才相同,据此分析判断。
【解答】A. He-3的相对原子质量为3,质子数为2,则原子核中有中子数为:3-2=1,故A错误;
B. He-3原子核内有2个质子,根据核外电子数等于质子数可知,核外电子数为3,故B错误;
C. He-3和He-4的质子数都是2,但是中子数不同,二者为同位素原子,故C正确;
D. He-3和He-4的相对原子质量不同,则它们的实际质量不同,故D错误。
故选C。
3.【答案】C
【知识点】原子的构成与探索过程
【解析】【分析】从题目给出的资料中提取信息,结合原子结构的知识分析判断。
【解答】 A.中子不带电,对外不显电性,故A正确不合题意;
B.中子由夸克构成,故B正确不合题意;
C.在中子星,巨大的压力将核外电子压缩到原子核中,不容易失去电子,中子星上不存在丰富的氢离子,故C错误符合题意;
D.原子的质量主要集中在原子核上,整个中子星就是由这样的原子核紧挨在一起形成的,所以中子星的密度远大于地球,故D正确不合题意。
故选C。
4.【答案】B
【知识点】原子的构成与探索过程
【解析】【分析】根据分子由原子构成,氢、氧原子质子数分析。
【解答】一个重水分子由2个氢原子和1个氧原子构成,氢原子质子数为1,氧原子质子数为8,则重水分子中含有质子个数为10;
故选B。
5.【答案】C
【知识点】同位素
【解析】【分析】 同位素是指质子数相同而中子数不同的同一元素的不同原子互称为同位素 ;在原子中,质子数=核外电子数=核电荷数=原子序数;
【解答】A. 在化学中元素是指具有相同核电荷数(或质子数)的一类原子的总称。 所以 氦-3和氦-4属于同种元素,A正确;
B.氦-3和氦-4中质子数相同,中子数不同,互为同位素原子,B正确;
C.一个氦-3原子核内有2个质子,C错误;
D. 一个氦-4原子核外有2个电子 ,D正确;
故答案为:C.
6.【答案】B
【知识点】原子的构成与探索过程;同位素
【解析】【分析】(1)质子数等于原子序数;
(2)(4)具有相同质子数和不同中子数的原子称为同位素原子;
(3)中子数=相对原子质量-质子数。
【解答】A.4He原子核内含有2个质子,故A错误;
BD.3He和4He的质子数都是2,而中子数分别为1和2,应该为同位素,故B正确,D错误;
C.3He原子的质子数为2,相对原子质量为3,则中子数为:3-2=1,故C错误。
故选B。
7.【答案】B
【知识点】同位素;元素的概念
【解析】【分析】(1)具有相同质子数和不同中子数的原子称为同位素原子;
(2)元素的本质区别是质子数不同;
(3)质子数=核外电子数=核外电子数;
(4)同种原子的质子数相同。
【解答】甲的核外电子数为1,则它的质子数为1;丁的核外电子数为2,则它的质子数为2。二者的质子数不同,肯定不是同位素,故A错误;
乙的核外电子数为2,则质子数为2,那么乙和丁的质子数相同,为同种元素,故B正确;
甲的核电荷数为1,则它的质子数为1;丙的的核电荷数为1,则丙的质子数为1,则甲和乙的核电荷数相同,故C错误;
甲和丙的质子数相等,但是中子数不同,那么为同位素原子,故D错误。
故选B。
8.【答案】C
【知识点】元素的概念
【解析】【分析】根据元素的定义判断。
【解答】元素是具有相同的核电荷数(质子数)的同一类原子的统称,即元素不同,则质子数不同,故C正确,而A、B、D错误。
故选C。
9.【答案】B
【知识点】半导体和超导体;同位素;元素的概念
【解析】【分析】(1)根据二者的结构不同判断;
(2)性质决定用途;
(3)根据碳元素的性质判断;
(4)具有相同的质子数和不同中子数的原子,成为同位素原子。
【解答】A.石墨烯和金刚石的组成元素相同,只是碳原子的排列方式不同,在高温高压等特殊环境下,一旦改变结构,可以实现相互转换,故A错误;
B.超导材料的电阻很小,输送电能时发热很少,适合做导线,故B正确;
C.石墨烯是碳元素组成的单质,肯定具有可燃性,故C错误;
D.石墨烯和石墨的原子的质子数和中子数都相等,不是同位素,故D错误。
故选B。
10.【答案】(1)原子核式结构
(2)3
【知识点】显微镜的使用;原子的构成与探索过程
【解析】【分析】(1)根据原子结构的发现史分析解答;
(2)显微镜的镜头离物体越近,则放大倍数越大,但是视野内看到物体的数量减少,据此分析解答。
【解答】(1)卢瑟福在实验基础上建立了原子的原子核式结构模型。
(2)根据图片可知,显微镜在位置3时离物体最远,此时放大倍数最小,而看到粒子数量最多。
11.【答案】(1)④③②①
(2)C
【知识点】原子的构成与探索过程
【解析】【分析】(1)根据原子的研究历程分析;
(2)根据碳原子质子数=电子数=6分析。
【解答】(1)原子结构模型建立最先是道尔顿的实心球模型,然后汤姆生发现电子,提出面包葡萄干模型,然后卢瑟福通过粒子轰击金箔实验得出原子核式模型,最后玻尔的电子分层模型,即④③②① 。
(2) 碳—14 原子核内6个质子,8个中子,核外6个电子,故选C。
故答案为:(1) ④③②① ;(2)C。
12.【答案】(1)原子核
(2)A
【知识点】原子的构成与探索过程
【解析】【分析】 卢瑟福进行a粒子散射实验后,提出了图乙所示的原子核式结构,原子是由原子核和核外电子构成;这是一个建立模型的过程。
【解答】(1)原子是由原子核和核外电子构成的。
(2)A.卢瑟福用α粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了原子核式结构,这是原子的模型,所以是建立模型的过程,故A正确;
B.卢瑟福通过实验并没有得出原子结构的真正结构,只是提出了一种假设,故B错误;
C.这是通过实验建立模型的过程,而不是鹈鹕问题,故C错误;
D.这是通过实验建立模型的过程,而不是验证证据,故D错误。
故选:A。
13.【答案】(1)4
(2)①④⑤③②
【知识点】构成物质的粒子模型;原子的构成与探索过程
【解析】【分析】(1)根据相对原子质量=质子数+中子数分析;
(2)根据化学变化的实质是分子分成原子,原子重新结合成新分子分析。
【解答】(1) 和是铂元素的两种同位素原子, 这两种原子的质子数相等,都为78,则中子个数相差 202-198=4。
(2) 一氧化碳和二氧化氮在金属铂表面催化下反应,先 一氧化碳和二氧化氮分子分成碳、氧、氮原子,然后碳、氧、氮原子重新组成,生成氮分子和二氧化碳分子,先后顺序为 ①④⑤③② 。
故答案为:(1)4;(2) ①④⑤③② 。
14.【答案】(1)地核
(2)电子
(3)磁感线的疏密程度
【知识点】磁场和磁感线;原子的构成与探索过程;地球内部的结构
【解析】【解答】
(1)地球的内部结构圈层从外到内依次是地壳、地幔、地核,由图甲可知,C是地核。
(2)原子的核式结构模型为:原子是由原子核和核外电子够成的,原子核由质子(带正电)和中子(不带电)构成的,电子(带负电)绕着原子核高速做圆周运动,由图乙可知,乙是电子。
(3)磁体周围的磁场强弱是通过磁感线的疏密来描述的,磁感线越密,表示磁场越强,磁感线越疏,表示磁场越弱。
【分析】
(1)地球的内部结构圈层从外到内依次是地壳、地幔、地核。
(2)根据卢瑟福的α粒子散射实验,如图乙可知,原子内部是空心的,原子核体积占原子的体积很小,原子的原子核带正电,质量几乎占整个原子的总质量,核外有带负电的电子绕核做圆周运动。
(3)磁场的强弱是通过磁感线来描述的,磁场是真实存在的,磁感线是人们假想出来的模型,并不真实存在。
15.【答案】(1)质子数
(2)纸外
【知识点】通电直导线周围的磁场;同位素
【解析】【分析】(1)根据同位素的定义分析解答;
(2)通电导体的磁场方向与电流方向有关,据此分析解答。
【解答】(1)我们将具有相同的质子数和不同中子数的原子,成为同位素原子,则:镁-24和镁-18互为同位素原子,本质上是因为它们有相同的质子数。
(2)原子核带正电荷,则束镁-24的原子核沿如图所示虚线方向水平向右飞过小磁针的上方时,电流方向水平向右。若一束电子水平向右通过小磁针上方,则电子移动方向水平向右,而电流方向与其相反,即电流方向水平向左,那么小磁针上方的磁场方向正好与原来相反。根据电荷之间的相互作用规律可知,此时小磁针受力方向相反,偏转方向相反,也就是N极向纸外偏转。
16.【答案】(1)①②
(2)不带电
【知识点】原子的构成与探索过程;元素的概念
【解析】【分析】(1)元素的本质区别:质子数不同;
(2)在原子核中,质子带正电荷,中子不带电,据此分析解答。
【解答】(1)根据图片可知,①②的原子的电子数为1,根据“质子数=电子数”可知,①②两种原子的质子数相等,都是1,则①②表示同种元素。
(2)根据②可知,该原子的质子数为1,即○表示质子,而●表示中子,因此微粒“●”所带的电荷类型是不带电。
17.【答案】(1)淡黄色液体
(2)3
(3)被子
【知识点】种子植物;孢子植物;化学性质与物理性质的差别及应用;元素的概念
【解析】【分析】一是指物质不需要经过化学变化就表现出来的性质, 二是指物质没有发生化学反应就表现出来的性质叫做物理性质。 常见的植物从高等到低等依次为被子植物,裸子植物,蕨类,苔藓类和藻类。被子植物是指所有的绿色开花植物,有根、茎、叶、花、果实、种子;裸子植物由松、杉、柏、银杏、和苏铁,有根、茎、叶、种子;蕨类,孢子繁殖,只有根茎叶,代表满江红,胎生狗脊;苔藓类,无根,有茎叶,孢子繁殖,代表地钱、葫芦藓;藻类什么器官都没有,孢子繁殖,代表紫菜,水绵,蓝藻。
【解答】(1)一是指物质不需要经过化学变化就表现出来的性质, 二是指物质没有发生化学反应就表现出来的性质叫做物理性质。根据上述信息,写出侧柏莲酮芳香油的一条物理性质:淡黄色液体;
(2)侧柏莲酮芳香油(C10H10O) ,有碳、氢和氧三种元素;
(3)被子植物为绿色开花植物,有根茎叶花果实种子;所以如图所示为艾草开花后的植株,判断其为被子殖物。
故答案为:(1) 淡黄色液体 (2) 3 (3) 被子
试题分析部分
1、试卷总体分布分析
总分:38分
分值分布 客观题(占比) 18.0(47.4%)
主观题(占比) 20.0(52.6%)
题量分布 客观题(占比) 9(52.9%)
主观题(占比) 8(47.1%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
填空题 8(47.1%) 20.0(52.6%)
单选题 9(52.9%) 18.0(47.4%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (100.0%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 元素的概念 11.0(28.9%) 7,8,9,16,17
2 构成物质的粒子模型 2.0(5.3%) 13
3 孢子植物 3.0(7.9%) 17
4 显微镜的使用 2.0(5.3%) 10
5 原子的构成与探索过程 25.0(65.8%) 1,2,3,4,6,10,11,12,13,14,16
6 化学性质与物理性质的差别及应用 3.0(7.9%) 17
7 半导体和超导体 2.0(5.3%) 9
8 同位素 12.0(31.6%) 2,5,6,7,9,15
9 地球内部的结构 3.0(7.9%) 14
10 种子植物 3.0(7.9%) 17
11 磁场和磁感线 3.0(7.9%) 14
12 通电直导线周围的磁场 2.0(5.3%) 15
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
