浙教版科学 八下2.5表示元素的符号同步练习(优生加练)(含解析)
文档属性
| 名称 | 浙教版科学 八下2.5表示元素的符号同步练习(优生加练)(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 604.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-02-23 16:42:09 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
八下2.5表示元素的符号同步练习(能力提升)
一、选择题
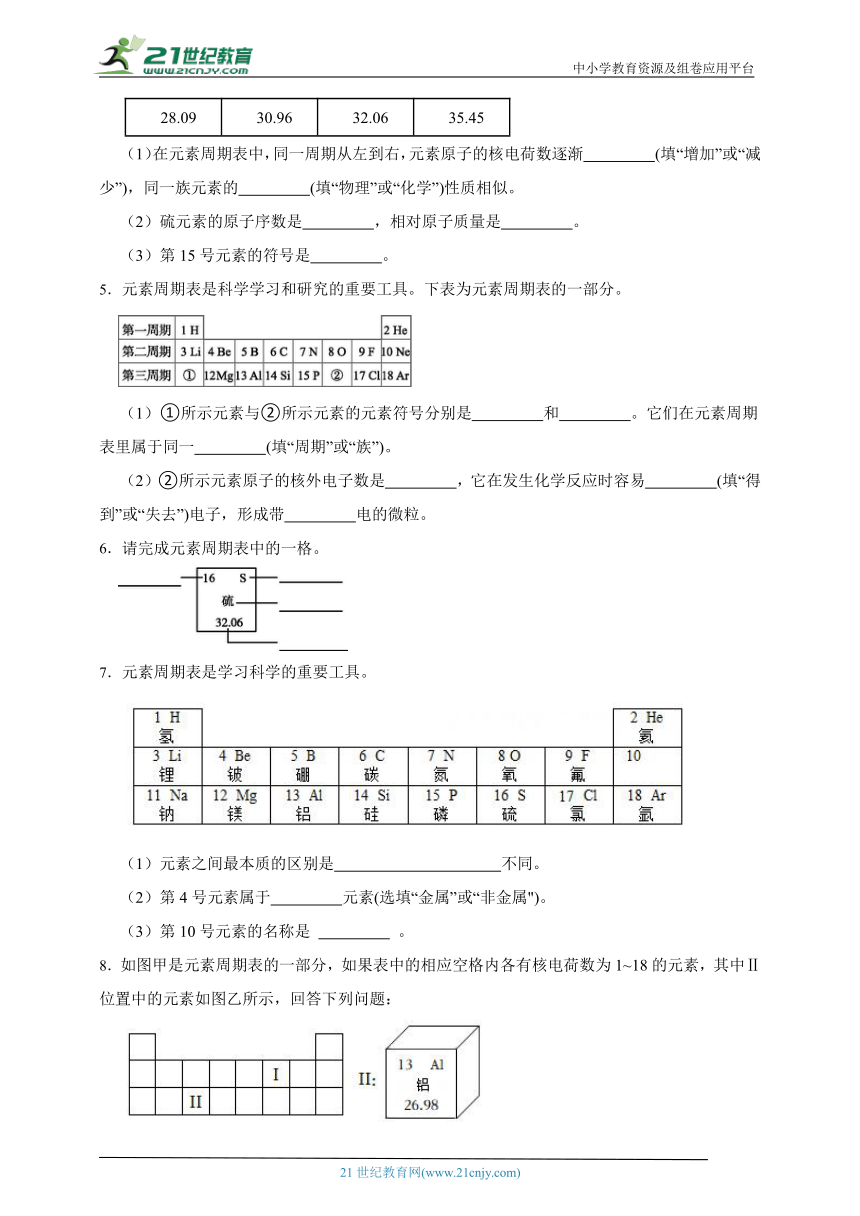
1.化学中元素符号能表示一定的意义,不同的元素符号表示的意义不同。下列对元素符号表示的意义解释正确的是( )
序号 元素符号 元素符号所表示的意义
A H 只表示氢元素
B Fe 表示铁元素,表示一个铁原子,表示铁这种物质
C N 只表示一个氮原子
D O 表示氧元素,表示一个氧原子,表示氧气这种物质
A.A B.B C.C D.D
二、填空题
2.用元素符号表示下列内容。
(1)2个氢原子: ;
(2)氧元素: ;
(3)n个铁原子: 。
3.1977年8月,国际化学会无机化学分会做出一项决议:从104号元素起,不再以人名、国名来命名,一律采用新元素的原子序数(即核电荷数)的拉丁文缩写来命名。即nil—0、un—1、bi—2、tri—3、quad—4、pent—5、hex—6、sept—7、oct—8、enn—9。按照上述规定,第104号元素的拉丁文名称按“un+nil+quad+ium(词缀)”应为“Unnilquadium”,其元素符号定为Unq;第105号元素拉丁文名称为Unnilpentium,元素符号为Unp;其余依此类推。请你分别给下列元素命名:
(1)第109号元素,拉丁文名称为 ,元素符号为 。
(2)第111号元素,拉丁文名称为 ,元素符号为 。
4.元素周期表是学习科学的重要工具,下表是元素周期表的部分信息。请分析表中信息,回答下列问题。
ⅣA ⅤA ⅥA ⅦA
6 C 碳 12.01 7 N 氮 14.01 8 O 氧 16.00 9 F 氟 19.00
14 Si 硅 28.09 15 磷 30.96 16 S 硫 32.06 17 Cl 氯 35.45
(1)在元素周期表中,同一周期从左到右,元素原子的核电荷数逐渐 (填“增加”或“减少”),同一族元素的 (填“物理”或“化学”)性质相似。
(2)硫元素的原子序数是 ,相对原子质量是 。
(3)第15号元素的符号是 。
5.元素周期表是科学学习和研究的重要工具。下表为元素周期表的一部分。
(1)①所示元素与②所示元素的元素符号分别是 和 。它们在元素周期表里属于同一 (填“周期”或“族”)。
(2)②所示元素原子的核外电子数是 ,它在发生化学反应时容易 (填“得到”或“失去”)电子,形成带 电的微粒。
6.请完成元素周期表中的一格。
7.元素周期表是学习科学的重要工具。
(1)元素之间最本质的区别是 不同。
(2)第4号元素属于 元素(选填“金属”或“非金属")。
(3)第10号元素的名称是 。
8.如图甲是元素周期表的一部分,如果表中的相应空格内各有核电荷数为1~18的元素,其中Ⅱ位置中的元素如图乙所示,回答下列问题:
(1)图甲中排在Ⅰ位置的元素X,下列说法正确的是 (填序号)。
A.“X2”的相对分子质量为32g
B.“X2”既能表示两个原子,也能表示一种气体
C.“2X”可以表示两个分子
D.“X”既能表示一种元素,也能表示一个原子
(2)图乙中,数字“13”表示铝元素的 。
三、实验探究题
9.(2023四下·巴音郭楞蒙古期末)为纪念门捷列夫制作的元素周期表问世150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表是学习化学的重要工具,它反映了元素性质的递变规律和元素之间的内在联系。如图是元素周期表一部分的电子层排布规律,我们对它们进行研究:
(1)第17号元素属于 元素(填“金属”或“非金属”),它在化学反应中容易 电子(填“得”或“失”);
(2)元素周期表中每一个横行叫做一个周期,每一个纵列叫做一个族,下列说法正确的是 。
A.同一周期,各元素原子的电子层数相同
B.同一周期,各元素原子的最外层电子数相同
C.同一族,各元素原子的电子层数相同
D.同一族,各元素原子的最外层电子数相同
10.(2019八下·秀洲月考)如图是1~18号元素原子最外层电子数与原子核电荷数的关系图。试回答:
(1)一个Mg2+核外共有 个电子;Cl﹣的最外层电子数和 原子的最外层电子数相同。
(2)通过对该图的分析,你能发现哪些规律?请写出其中一个: 。
四、解答题
11.成语是我国的文化瑰宝,请用恰当的元素符号填空。
(1)如胶似漆:胶中含有碳、氢、钙等元素,其中1种非金属元素的符号为 。
(2)争风吃醋:醋酸溶液中含有1种离子,其核内只有1个质子,此元素为 。
12.如图所示为四名同学替4种元素进行的自我介绍,请你根据所学知识回答下列问题。
(1)写出上述4种元素的元素符号。
甲: ,乙: ,
丙: ,丁: 。
(2)上述4种元素的根本区别是 (填“质子数”或“中子数”)不同。
13.“玉兔”号月球车在月球岩石中发现了曾被认为是太阳宝石的铁橄榄石,其主要成分是原硅酸亚铁(Fe SiO ),还在月球物质中捕获到来自太阳风的两种不同的氩原子(、)。
(1)化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如Ar 表示原子核内有18个质子和18个中子的氩原子。由此可知,Ar原子核中的中子数为 。
(2)原硅酸亚铁中铁元素的符号为 。
14.元素周期表中,核电荷数从 1 到 18 的元素的原子结构示意图如下图。根据已有的结 构理论回答下列问题:
(1)已知 M2-核外有 x 个电子,其中相对原子质量为 a,则该粒子含有的中子数为 ;
(2)1-18 号元素中,A 原子的核电荷数为 m,已知 A2-和 B3+具有相同的电子层结构,则 B 原子核中 的质子数为 ;
15.下图为元素周期表的一部分,请按要求填空:
(1)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同。
(2)表中9号和17号元素最外层电子数相同,都易 (填“得到”或“失去”)电子,则钠元素和氟元素组成的化合物的化学式为 。
16.(2023七上·温州期中)在“宏观﹣微观﹣符号”之间建立联系,是学习化学的一种重要思维方式。如图是元素周期表中部分元素的原子结构模型图,根据所学知识回答下列问题.
(1)A属于 元素(填元素种类);
(2)D原子与钠发生化学反应时易 (填“得到”或“失去”)电子;
(3)由B元素和D元素组成的化合物的化学式为 ;
(4)E粒子带1个单位正电荷,则该粒子的符号为 ;
(5)F为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 .
A.原子序数Z>Y
B.核外电子数:X=Y
C.Y和Z的化学性质相似
答案解析部分
1.【答案】B
【知识点】元素的符号及其意义
【解析】【分析】根据元素符号的意义分析判断。
【解答】A.H的意义:①氢元素;②1个氢原子;③氢气这种物质,故A错误;
B.Fe的意义:①铁元素;②1个铁原子;③铁这种物质,故B正确;
C.N的意义:①氮元素;②1个氮原子,故C错误;
D.O的意义:①氧元素;②1个氧原子,故D错误。
故选B。
2.【答案】(1)2H
(2)O
(3)nFe
【知识点】元素的符号及其意义
【解析】【分析】①原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字;
②离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字;
③分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字. 。
【解答】(1) 只具有微观意义的粒子,在元素符号前面书写数字,如2个氢原子 :2H;
(2) 元素符号直接写元素符号,如氧元素 :O;
(3)n个原子,直接书写n后面书写元素符号,如 n个铁原子 :nFe
故答案为:(1)2H;(2)O;(3) nFe
3.【答案】(1)Unnilennium;Une
(2)Unununium;Uuu
【知识点】元素的符号及其意义;元素周期表
【解析】【分析】本题为分析题,通过分析题意可以得出答案。元素符号的写法: ①由一个字母表示的元素符号要大写,如:H、C、 S、P,K。②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如:Na、Mg、 Ca、Zn、Si。
【解答】(1)根据题目信息中的规律,第109号元素,拉丁文名称为Unnilennium,元素符号为Une。(2)第111号元素,拉丁文名称为Unununium,元素符号为Uuu。
故答案为:(1)Unnilennium;Une;(2)Unununium;Uuu
4.【答案】(1)增加;化学
(2)16;32.06
(3)P
【知识点】元素周期表
【解析】【分析】(1)根据元素周期表中元素的排列规律解答;
(2)(3)在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数值为相对原子质量。
【解答】(1)在元素周期表中,同一周期从左到右,元素原子的核电荷数逐渐增加,同一族元素的化学性质相似。
(2)根据图片可知,硫元素的原子序数是16,相对原子质量是32.06;
(3)第15号元素为磷元素,符号为P;
5.【答案】(1)Na;S;周期
(2)16;得到;负
【知识点】元素周期表
【解析】【分析】(1)根据元素周期表确定元素名称和符号。在元素周期表中,同一列为一族,同一行为一个周期。
(2)原子的核外电子数=原子序数=质子数。一般情况下,最外层电子数少于4个的容易失去电子形成阳离子,多于4个的容易得到电子形成带负电的微粒。
【解答】(1)根据元素周期表可知,①为Na元素,②为S元素,它们在同一行,属于同一周期。
(2)②为硫元素,它的原子序数为16,根据“原子序数=核外电子数”可知,它的核外电子数为16。因为最外层电子数为6,大于4,所以在发生化学反应时容易得到电子,带负电的微粒。
6.【答案】
【知识点】元素周期表
【解析】【分析】根据元素周期表的意义分析解答。
【解答】在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数字为相对原子质量,如下图所示:
7.【答案】(1)质子数或核电荷数
(2)金属
(3)氖
(4)NaCl
【知识点】元素周期表
【解析】【分析】(1)根据元素的定义分析解答;
(2)一般情况下,如果元素名称中含有“金”字旁,那么为金属元素;
(3)根据元素周期表的知识解答;
【解答】(1)元素是具有相同和电荷数的同一类原子的统称,而质子数等于和电荷数,因此元素之间的本质区别是质子数不同;
(2)第4号元素为铍,由于含有金字旁,因此为金属元素;
(3)根据元素周期表可知,第10号元素为氖;
8.【答案】(1)D
(2)原子序数
【知识点】元素周期表
【解析】【分析】(1)根据图片确定I的原子序数,从而确定元素种类,然后根据元素符号的意义分析判断;
(2)在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数值为相对原子质量。【解答】(1)由图甲可知,X的原子序数为8,则它是氧元素;
A.“X2”即为O2,相对分子质量为16×2=32,相对分子质量单位不是g,故A错误;
B.“X2”即为O2,表示氧气或氧气由氧元素组成或1个氧分子或1个氧分子中有2个氧原子,故B错误;
C.“2X”即2O,元素符号之前数字表示原子个数,2O可以表示两个氧原子,故C错误;
D.“X”即O,元素符号表示某种元素或1个某原子,故D正确。
故选D。
(2)图乙中,数字“13”表示铝元素的原子序数。
9.【答案】(1)非金属;得
(2)A;D
【知识点】元素周期表
【解析】【分析】(1)一般情况下,如果元素名称中含有金字旁,那么为金属元素;否则为非金属元素。原子最外层电子数大于4,那么容易得到电子从而达到8个电子的稳定状态;如果最外层电子数小于4,那么容易失去电子达到8个电子的稳定结构;
(2)将电子层数相同的原子,按照最外层电子数从小到大的顺序一次排列成一行,这就是一个周期;将最外层电子数相同的原子,按照电子层数从小到大的顺序排成一列,这就是一个族,据此分析判断。
【解答】(1)根据周期表可知,第17号元素为氯元素,由于不含金字旁,所以为非金属元素。氯原子最外层电子数为7,大于4,容器得到电子达到稳定状态;
(2)同一周期,各元素原子的电子层数相同,故A正确,B错误;
同一族,各元素原子的最外层电子数相同,故C错误,D正确。
故选AD。
10.【答案】(1)10;Ar
(2)随着核电荷数的递增,最外层电子数呈周期性变化
【知识点】原子的构成与探索过程;元素周期表
【解析】【分析】(1)根据镁离子核外10个电子及氯离子最外层达到稳定结构与Ar原子电子排列相同分析;
(2)根据图示中原子核电荷数=原子序数及最外电子数的规律分析。
【解答】(1) 一个Mg2+核外共有10个电子,Cl﹣的最外层电子数为8,和Ar原子的最外层电子数相同 ;
(2)由图示可知, 随着核电荷数的递增,最外层电子数呈周期性变化 ;
故答案为:(1)10; Ar;(2)随着核电荷数的递增,最外层电子数呈周期性变化 。
11.【答案】(1)C(或 H)
(2)H
【知识点】元素的符号及其意义
【解析】【分析】(1)一般情况下,元素名字中含有“金”字旁的为金属元素,否则为非金属元素;
(2)根据原子构成的知识解答。
【解答】(1)根据元素名称碳、氢、钙可知,碳和氢没有金字旁,为非金属元素,符号为C和H;
(2)原子核内只有1个质子的原子序数为1,即为氢元素,符号为H。
12.【答案】(1)0;Al;H;Si
(2)质子数
【知识点】元素的符号及其意义
【解析】【分析】(1)根据图片中描述元素的特点确定元素名称,写出对应的元素符号;
(2)根据元素的本质区别解答。
【解答】(1)甲:地壳中含量最多的元素为氧元素,符号为O;
乙:地壳中含量最多的金属元素为铝元素,符号为Al;
丙:原子序数最小的元素为氢元素,符号为H;
丁:地壳中含量仅次于氧元素的为硅元素,符号为Si;
(2)上述4中元素的根本区别为质子数不同。
13.【答案】(1)20
(2)Fe
【知识点】元素周期表
【解析】【分析】(1)根据符号的含义确定原子核中质子数和质子数和中子数的和,然后二者相减得到中子数即可;
(2)根据元素符号的知识分析解答。
【解答】(1)根据化学式可知,该原子核内质子数为18,质子数和中子数之和为38,那么中子数为:38-18=20;
(2)根据化学式 Fe SiO 可知, 原硅酸亚铁中铁元素的符号为Fe。
14.【答案】(1)a+2-x
(2)m+5
【知识点】元素周期表
【解析】【分析】(1)原子失去电子带正电,得到电子带负电,据此计算出M原子的核外电子数,即质子数,再根据中子数=相对原子质量-质子数计算即可。
(2)原子失去电子带正电,得到电子带负电,据此计算出A2-核外电子数,再根据 B3+ 计算出B原子的核外电子数,也就是它的质子数。
【解答】(1)M2-核外有 x 个电子,那么M原子的核电荷数为:x-2。根据质子数=核电荷数可知,M的质子数为:x-2,则它的中子数为:a-(x-2)=a+2-x。
(2) A 原子的核电荷数为 m, 它得到2个电子形成A2-,则A2-的核外电子数为:m+2,因此
B3+ 的核外电子数也是:m+2。B原子失去5个电子得到B3+ ,则B原子的核外电子数:m+2+3=m+5。根据质子数=核电荷数可知,B原子的质子数为:m+5。
15.【答案】(1)电子层数
(2)得到;NaF
【知识点】元素周期表
【解析】【分析】(1)根据元素周期表的排列规律分析;
(2)根据最外层电子数大于4的易得电子,小于4的易失电子分析;
【解答】(1)元素周期表中周期数与原子核外电子层数相同;
(2) 9号和17号元素最外层电子数相同都是7,所以都易得到电子达到相对稳定结构, 钠元素和氟元素组成的化合物的化学式为 NaF ;
16.【答案】(1)非金属
(2)得到
(3)MgCl2
(4)Na+
(5)A
【知识点】元素周期表
【解析】【分析】(1)根据原子序数确定元素名称,根据名称中是否有金字旁判断它是否属于金属元素;
(2)最外层电子数大于4的容易得到电子,小于4的容易失去电子;
(3)根据质子数确定元素种类,然后写出对应的化学式;
(4)失去电子带正电荷,据此确定E原子的电子数,进而确定质子数,从而确定元素种类,并写出离子符号;
(5)①在元素周期表中,在每一行中,右边的元素比左边元素的原子序数大;在每一列中,下边的元素比上边的元素原子序数大;
②核外电子数=原子序数=质子数;
③在每一列中,具有相同的最外层电子数,因此具有相同的化学性质。
【解答】(1)A的质子数为14,那么它为硅元素,由于不含有金字旁,所以属于非金属元素;
(2)D原子的最外层电子数为7>4,因此与钠反应时容易得到电子;
(3)B的质子数为12,则为镁元素;D的质子数为17,则为氯元素,二者组成的化合物为氯化镁,化学式为MgCl2。
(4)E带1个单位的正电荷,那么E原子的核外电子数为:10+1=11,那么E为钠元素,则带一个单位正电荷的钠离子写作Na+。
(5)A.Y和Z在同一行,且Z在右边,因此原子序数Z>Y,故A正确;
B.X和Y在同一列,因此具有相同的最外层电子数,但是Y比X多一个电子层,因此二者的核外电子数肯定不同,故B错误;
C.Y和Z在同一行,最外层电子数不同,那么它们的化学性质不同,故C错误。
故选A。
试题分析部分
1、试卷总体分布分析
总分:64分
分值分布 客观题(占比) 2.0(3.1%)
主观题(占比) 62.0(96.9%)
题量分布 客观题(占比) 1(6.3%)
主观题(占比) 15(93.8%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 1(6.3%) 2.0(3.1%)
填空题 7(43.8%) 31.0(48.4%)
解答题 6(37.5%) 24.0(37.5%)
实验探究题 2(12.5%) 7.0(10.9%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (100.0%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 原子的构成与探索过程 3.0(4.7%) 10
2 元素的符号及其意义 16.0(25.0%) 1,2,3,11,12
3 元素周期表 52.0(81.3%) 3,4,5,6,7,8,9,10,13,14,15,16
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
八下2.5表示元素的符号同步练习(能力提升)
一、选择题
1.化学中元素符号能表示一定的意义,不同的元素符号表示的意义不同。下列对元素符号表示的意义解释正确的是( )
序号 元素符号 元素符号所表示的意义
A H 只表示氢元素
B Fe 表示铁元素,表示一个铁原子,表示铁这种物质
C N 只表示一个氮原子
D O 表示氧元素,表示一个氧原子,表示氧气这种物质
A.A B.B C.C D.D
二、填空题
2.用元素符号表示下列内容。
(1)2个氢原子: ;
(2)氧元素: ;
(3)n个铁原子: 。
3.1977年8月,国际化学会无机化学分会做出一项决议:从104号元素起,不再以人名、国名来命名,一律采用新元素的原子序数(即核电荷数)的拉丁文缩写来命名。即nil—0、un—1、bi—2、tri—3、quad—4、pent—5、hex—6、sept—7、oct—8、enn—9。按照上述规定,第104号元素的拉丁文名称按“un+nil+quad+ium(词缀)”应为“Unnilquadium”,其元素符号定为Unq;第105号元素拉丁文名称为Unnilpentium,元素符号为Unp;其余依此类推。请你分别给下列元素命名:
(1)第109号元素,拉丁文名称为 ,元素符号为 。
(2)第111号元素,拉丁文名称为 ,元素符号为 。
4.元素周期表是学习科学的重要工具,下表是元素周期表的部分信息。请分析表中信息,回答下列问题。
ⅣA ⅤA ⅥA ⅦA
6 C 碳 12.01 7 N 氮 14.01 8 O 氧 16.00 9 F 氟 19.00
14 Si 硅 28.09 15 磷 30.96 16 S 硫 32.06 17 Cl 氯 35.45
(1)在元素周期表中,同一周期从左到右,元素原子的核电荷数逐渐 (填“增加”或“减少”),同一族元素的 (填“物理”或“化学”)性质相似。
(2)硫元素的原子序数是 ,相对原子质量是 。
(3)第15号元素的符号是 。
5.元素周期表是科学学习和研究的重要工具。下表为元素周期表的一部分。
(1)①所示元素与②所示元素的元素符号分别是 和 。它们在元素周期表里属于同一 (填“周期”或“族”)。
(2)②所示元素原子的核外电子数是 ,它在发生化学反应时容易 (填“得到”或“失去”)电子,形成带 电的微粒。
6.请完成元素周期表中的一格。
7.元素周期表是学习科学的重要工具。
(1)元素之间最本质的区别是 不同。
(2)第4号元素属于 元素(选填“金属”或“非金属")。
(3)第10号元素的名称是 。
8.如图甲是元素周期表的一部分,如果表中的相应空格内各有核电荷数为1~18的元素,其中Ⅱ位置中的元素如图乙所示,回答下列问题:
(1)图甲中排在Ⅰ位置的元素X,下列说法正确的是 (填序号)。
A.“X2”的相对分子质量为32g
B.“X2”既能表示两个原子,也能表示一种气体
C.“2X”可以表示两个分子
D.“X”既能表示一种元素,也能表示一个原子
(2)图乙中,数字“13”表示铝元素的 。
三、实验探究题
9.(2023四下·巴音郭楞蒙古期末)为纪念门捷列夫制作的元素周期表问世150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表是学习化学的重要工具,它反映了元素性质的递变规律和元素之间的内在联系。如图是元素周期表一部分的电子层排布规律,我们对它们进行研究:
(1)第17号元素属于 元素(填“金属”或“非金属”),它在化学反应中容易 电子(填“得”或“失”);
(2)元素周期表中每一个横行叫做一个周期,每一个纵列叫做一个族,下列说法正确的是 。
A.同一周期,各元素原子的电子层数相同
B.同一周期,各元素原子的最外层电子数相同
C.同一族,各元素原子的电子层数相同
D.同一族,各元素原子的最外层电子数相同
10.(2019八下·秀洲月考)如图是1~18号元素原子最外层电子数与原子核电荷数的关系图。试回答:
(1)一个Mg2+核外共有 个电子;Cl﹣的最外层电子数和 原子的最外层电子数相同。
(2)通过对该图的分析,你能发现哪些规律?请写出其中一个: 。
四、解答题
11.成语是我国的文化瑰宝,请用恰当的元素符号填空。
(1)如胶似漆:胶中含有碳、氢、钙等元素,其中1种非金属元素的符号为 。
(2)争风吃醋:醋酸溶液中含有1种离子,其核内只有1个质子,此元素为 。
12.如图所示为四名同学替4种元素进行的自我介绍,请你根据所学知识回答下列问题。
(1)写出上述4种元素的元素符号。
甲: ,乙: ,
丙: ,丁: 。
(2)上述4种元素的根本区别是 (填“质子数”或“中子数”)不同。
13.“玉兔”号月球车在月球岩石中发现了曾被认为是太阳宝石的铁橄榄石,其主要成分是原硅酸亚铁(Fe SiO ),还在月球物质中捕获到来自太阳风的两种不同的氩原子(、)。
(1)化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如Ar 表示原子核内有18个质子和18个中子的氩原子。由此可知,Ar原子核中的中子数为 。
(2)原硅酸亚铁中铁元素的符号为 。
14.元素周期表中,核电荷数从 1 到 18 的元素的原子结构示意图如下图。根据已有的结 构理论回答下列问题:
(1)已知 M2-核外有 x 个电子,其中相对原子质量为 a,则该粒子含有的中子数为 ;
(2)1-18 号元素中,A 原子的核电荷数为 m,已知 A2-和 B3+具有相同的电子层结构,则 B 原子核中 的质子数为 ;
15.下图为元素周期表的一部分,请按要求填空:
(1)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同。
(2)表中9号和17号元素最外层电子数相同,都易 (填“得到”或“失去”)电子,则钠元素和氟元素组成的化合物的化学式为 。
16.(2023七上·温州期中)在“宏观﹣微观﹣符号”之间建立联系,是学习化学的一种重要思维方式。如图是元素周期表中部分元素的原子结构模型图,根据所学知识回答下列问题.
(1)A属于 元素(填元素种类);
(2)D原子与钠发生化学反应时易 (填“得到”或“失去”)电子;
(3)由B元素和D元素组成的化合物的化学式为 ;
(4)E粒子带1个单位正电荷,则该粒子的符号为 ;
(5)F为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 .
A.原子序数Z>Y
B.核外电子数:X=Y
C.Y和Z的化学性质相似
答案解析部分
1.【答案】B
【知识点】元素的符号及其意义
【解析】【分析】根据元素符号的意义分析判断。
【解答】A.H的意义:①氢元素;②1个氢原子;③氢气这种物质,故A错误;
B.Fe的意义:①铁元素;②1个铁原子;③铁这种物质,故B正确;
C.N的意义:①氮元素;②1个氮原子,故C错误;
D.O的意义:①氧元素;②1个氧原子,故D错误。
故选B。
2.【答案】(1)2H
(2)O
(3)nFe
【知识点】元素的符号及其意义
【解析】【分析】①原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字;
②离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字;
③分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字. 。
【解答】(1) 只具有微观意义的粒子,在元素符号前面书写数字,如2个氢原子 :2H;
(2) 元素符号直接写元素符号,如氧元素 :O;
(3)n个原子,直接书写n后面书写元素符号,如 n个铁原子 :nFe
故答案为:(1)2H;(2)O;(3) nFe
3.【答案】(1)Unnilennium;Une
(2)Unununium;Uuu
【知识点】元素的符号及其意义;元素周期表
【解析】【分析】本题为分析题,通过分析题意可以得出答案。元素符号的写法: ①由一个字母表示的元素符号要大写,如:H、C、 S、P,K。②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如:Na、Mg、 Ca、Zn、Si。
【解答】(1)根据题目信息中的规律,第109号元素,拉丁文名称为Unnilennium,元素符号为Une。(2)第111号元素,拉丁文名称为Unununium,元素符号为Uuu。
故答案为:(1)Unnilennium;Une;(2)Unununium;Uuu
4.【答案】(1)增加;化学
(2)16;32.06
(3)P
【知识点】元素周期表
【解析】【分析】(1)根据元素周期表中元素的排列规律解答;
(2)(3)在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数值为相对原子质量。
【解答】(1)在元素周期表中,同一周期从左到右,元素原子的核电荷数逐渐增加,同一族元素的化学性质相似。
(2)根据图片可知,硫元素的原子序数是16,相对原子质量是32.06;
(3)第15号元素为磷元素,符号为P;
5.【答案】(1)Na;S;周期
(2)16;得到;负
【知识点】元素周期表
【解析】【分析】(1)根据元素周期表确定元素名称和符号。在元素周期表中,同一列为一族,同一行为一个周期。
(2)原子的核外电子数=原子序数=质子数。一般情况下,最外层电子数少于4个的容易失去电子形成阳离子,多于4个的容易得到电子形成带负电的微粒。
【解答】(1)根据元素周期表可知,①为Na元素,②为S元素,它们在同一行,属于同一周期。
(2)②为硫元素,它的原子序数为16,根据“原子序数=核外电子数”可知,它的核外电子数为16。因为最外层电子数为6,大于4,所以在发生化学反应时容易得到电子,带负电的微粒。
6.【答案】
【知识点】元素周期表
【解析】【分析】根据元素周期表的意义分析解答。
【解答】在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数字为相对原子质量,如下图所示:
7.【答案】(1)质子数或核电荷数
(2)金属
(3)氖
(4)NaCl
【知识点】元素周期表
【解析】【分析】(1)根据元素的定义分析解答;
(2)一般情况下,如果元素名称中含有“金”字旁,那么为金属元素;
(3)根据元素周期表的知识解答;
【解答】(1)元素是具有相同和电荷数的同一类原子的统称,而质子数等于和电荷数,因此元素之间的本质区别是质子数不同;
(2)第4号元素为铍,由于含有金字旁,因此为金属元素;
(3)根据元素周期表可知,第10号元素为氖;
8.【答案】(1)D
(2)原子序数
【知识点】元素周期表
【解析】【分析】(1)根据图片确定I的原子序数,从而确定元素种类,然后根据元素符号的意义分析判断;
(2)在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数值为相对原子质量。【解答】(1)由图甲可知,X的原子序数为8,则它是氧元素;
A.“X2”即为O2,相对分子质量为16×2=32,相对分子质量单位不是g,故A错误;
B.“X2”即为O2,表示氧气或氧气由氧元素组成或1个氧分子或1个氧分子中有2个氧原子,故B错误;
C.“2X”即2O,元素符号之前数字表示原子个数,2O可以表示两个氧原子,故C错误;
D.“X”即O,元素符号表示某种元素或1个某原子,故D正确。
故选D。
(2)图乙中,数字“13”表示铝元素的原子序数。
9.【答案】(1)非金属;得
(2)A;D
【知识点】元素周期表
【解析】【分析】(1)一般情况下,如果元素名称中含有金字旁,那么为金属元素;否则为非金属元素。原子最外层电子数大于4,那么容易得到电子从而达到8个电子的稳定状态;如果最外层电子数小于4,那么容易失去电子达到8个电子的稳定结构;
(2)将电子层数相同的原子,按照最外层电子数从小到大的顺序一次排列成一行,这就是一个周期;将最外层电子数相同的原子,按照电子层数从小到大的顺序排成一列,这就是一个族,据此分析判断。
【解答】(1)根据周期表可知,第17号元素为氯元素,由于不含金字旁,所以为非金属元素。氯原子最外层电子数为7,大于4,容器得到电子达到稳定状态;
(2)同一周期,各元素原子的电子层数相同,故A正确,B错误;
同一族,各元素原子的最外层电子数相同,故C错误,D正确。
故选AD。
10.【答案】(1)10;Ar
(2)随着核电荷数的递增,最外层电子数呈周期性变化
【知识点】原子的构成与探索过程;元素周期表
【解析】【分析】(1)根据镁离子核外10个电子及氯离子最外层达到稳定结构与Ar原子电子排列相同分析;
(2)根据图示中原子核电荷数=原子序数及最外电子数的规律分析。
【解答】(1) 一个Mg2+核外共有10个电子,Cl﹣的最外层电子数为8,和Ar原子的最外层电子数相同 ;
(2)由图示可知, 随着核电荷数的递增,最外层电子数呈周期性变化 ;
故答案为:(1)10; Ar;(2)随着核电荷数的递增,最外层电子数呈周期性变化 。
11.【答案】(1)C(或 H)
(2)H
【知识点】元素的符号及其意义
【解析】【分析】(1)一般情况下,元素名字中含有“金”字旁的为金属元素,否则为非金属元素;
(2)根据原子构成的知识解答。
【解答】(1)根据元素名称碳、氢、钙可知,碳和氢没有金字旁,为非金属元素,符号为C和H;
(2)原子核内只有1个质子的原子序数为1,即为氢元素,符号为H。
12.【答案】(1)0;Al;H;Si
(2)质子数
【知识点】元素的符号及其意义
【解析】【分析】(1)根据图片中描述元素的特点确定元素名称,写出对应的元素符号;
(2)根据元素的本质区别解答。
【解答】(1)甲:地壳中含量最多的元素为氧元素,符号为O;
乙:地壳中含量最多的金属元素为铝元素,符号为Al;
丙:原子序数最小的元素为氢元素,符号为H;
丁:地壳中含量仅次于氧元素的为硅元素,符号为Si;
(2)上述4中元素的根本区别为质子数不同。
13.【答案】(1)20
(2)Fe
【知识点】元素周期表
【解析】【分析】(1)根据符号的含义确定原子核中质子数和质子数和中子数的和,然后二者相减得到中子数即可;
(2)根据元素符号的知识分析解答。
【解答】(1)根据化学式可知,该原子核内质子数为18,质子数和中子数之和为38,那么中子数为:38-18=20;
(2)根据化学式 Fe SiO 可知, 原硅酸亚铁中铁元素的符号为Fe。
14.【答案】(1)a+2-x
(2)m+5
【知识点】元素周期表
【解析】【分析】(1)原子失去电子带正电,得到电子带负电,据此计算出M原子的核外电子数,即质子数,再根据中子数=相对原子质量-质子数计算即可。
(2)原子失去电子带正电,得到电子带负电,据此计算出A2-核外电子数,再根据 B3+ 计算出B原子的核外电子数,也就是它的质子数。
【解答】(1)M2-核外有 x 个电子,那么M原子的核电荷数为:x-2。根据质子数=核电荷数可知,M的质子数为:x-2,则它的中子数为:a-(x-2)=a+2-x。
(2) A 原子的核电荷数为 m, 它得到2个电子形成A2-,则A2-的核外电子数为:m+2,因此
B3+ 的核外电子数也是:m+2。B原子失去5个电子得到B3+ ,则B原子的核外电子数:m+2+3=m+5。根据质子数=核电荷数可知,B原子的质子数为:m+5。
15.【答案】(1)电子层数
(2)得到;NaF
【知识点】元素周期表
【解析】【分析】(1)根据元素周期表的排列规律分析;
(2)根据最外层电子数大于4的易得电子,小于4的易失电子分析;
【解答】(1)元素周期表中周期数与原子核外电子层数相同;
(2) 9号和17号元素最外层电子数相同都是7,所以都易得到电子达到相对稳定结构, 钠元素和氟元素组成的化合物的化学式为 NaF ;
16.【答案】(1)非金属
(2)得到
(3)MgCl2
(4)Na+
(5)A
【知识点】元素周期表
【解析】【分析】(1)根据原子序数确定元素名称,根据名称中是否有金字旁判断它是否属于金属元素;
(2)最外层电子数大于4的容易得到电子,小于4的容易失去电子;
(3)根据质子数确定元素种类,然后写出对应的化学式;
(4)失去电子带正电荷,据此确定E原子的电子数,进而确定质子数,从而确定元素种类,并写出离子符号;
(5)①在元素周期表中,在每一行中,右边的元素比左边元素的原子序数大;在每一列中,下边的元素比上边的元素原子序数大;
②核外电子数=原子序数=质子数;
③在每一列中,具有相同的最外层电子数,因此具有相同的化学性质。
【解答】(1)A的质子数为14,那么它为硅元素,由于不含有金字旁,所以属于非金属元素;
(2)D原子的最外层电子数为7>4,因此与钠反应时容易得到电子;
(3)B的质子数为12,则为镁元素;D的质子数为17,则为氯元素,二者组成的化合物为氯化镁,化学式为MgCl2。
(4)E带1个单位的正电荷,那么E原子的核外电子数为:10+1=11,那么E为钠元素,则带一个单位正电荷的钠离子写作Na+。
(5)A.Y和Z在同一行,且Z在右边,因此原子序数Z>Y,故A正确;
B.X和Y在同一列,因此具有相同的最外层电子数,但是Y比X多一个电子层,因此二者的核外电子数肯定不同,故B错误;
C.Y和Z在同一行,最外层电子数不同,那么它们的化学性质不同,故C错误。
故选A。
试题分析部分
1、试卷总体分布分析
总分:64分
分值分布 客观题(占比) 2.0(3.1%)
主观题(占比) 62.0(96.9%)
题量分布 客观题(占比) 1(6.3%)
主观题(占比) 15(93.8%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 1(6.3%) 2.0(3.1%)
填空题 7(43.8%) 31.0(48.4%)
解答题 6(37.5%) 24.0(37.5%)
实验探究题 2(12.5%) 7.0(10.9%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (100.0%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 原子的构成与探索过程 3.0(4.7%) 10
2 元素的符号及其意义 16.0(25.0%) 1,2,3,11,12
3 元素周期表 52.0(81.3%) 3,4,5,6,7,8,9,10,13,14,15,16
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
