浙教版科学 八下 第2章微粒的模型与符号单元测试(二)(含答案)
文档属性
| 名称 | 浙教版科学 八下 第2章微粒的模型与符号单元测试(二)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 722.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-03-04 10:17:09 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
浙教版科学八下微粒的模型与符号单元测试(二)(含答案)
一、选择题(每小题2分,共28分)
1.模型可以帮助人们认识一些不能直接观察到的或复杂的事物。下列不属于模型的是( )
A.新冠病毒 B.节水标记
C.甲烷分子结构 D.足球烯结构
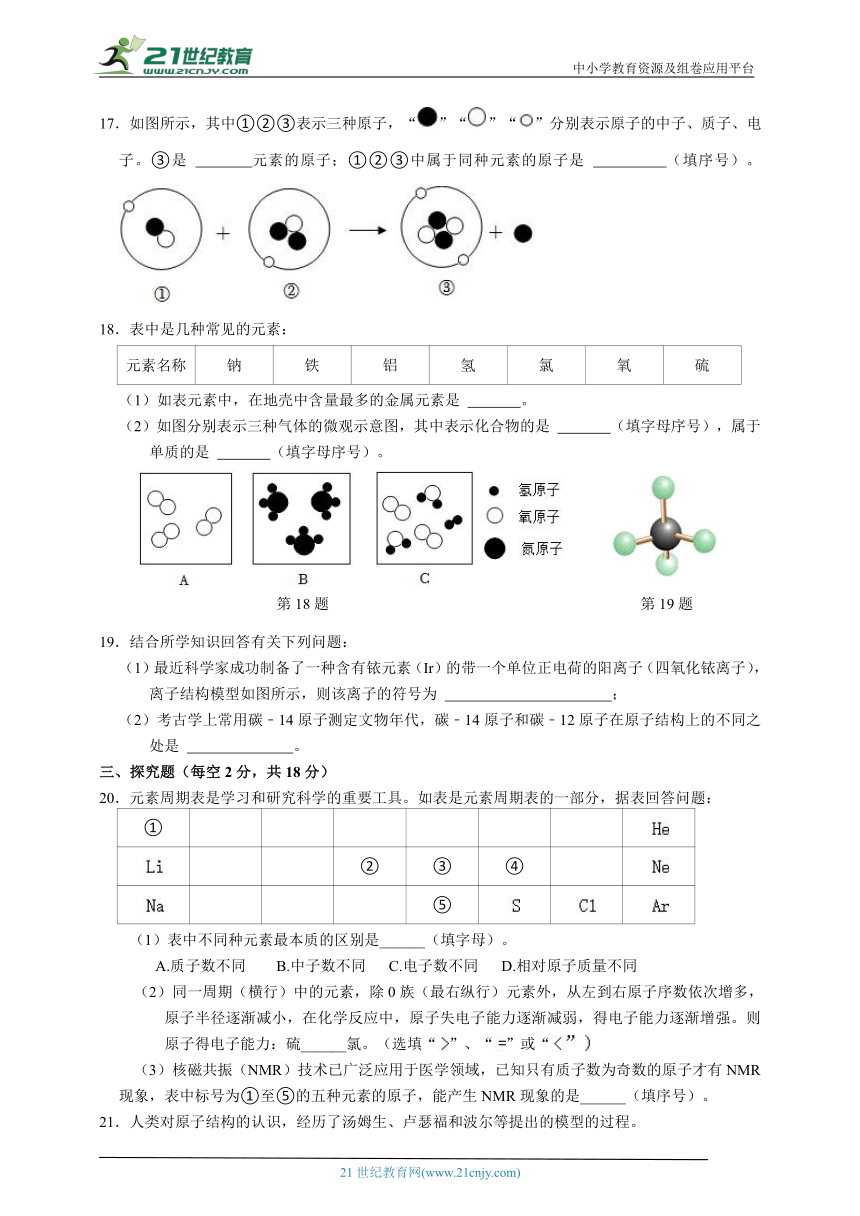
2.国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素和锂(Li)元素的本质区别是( )
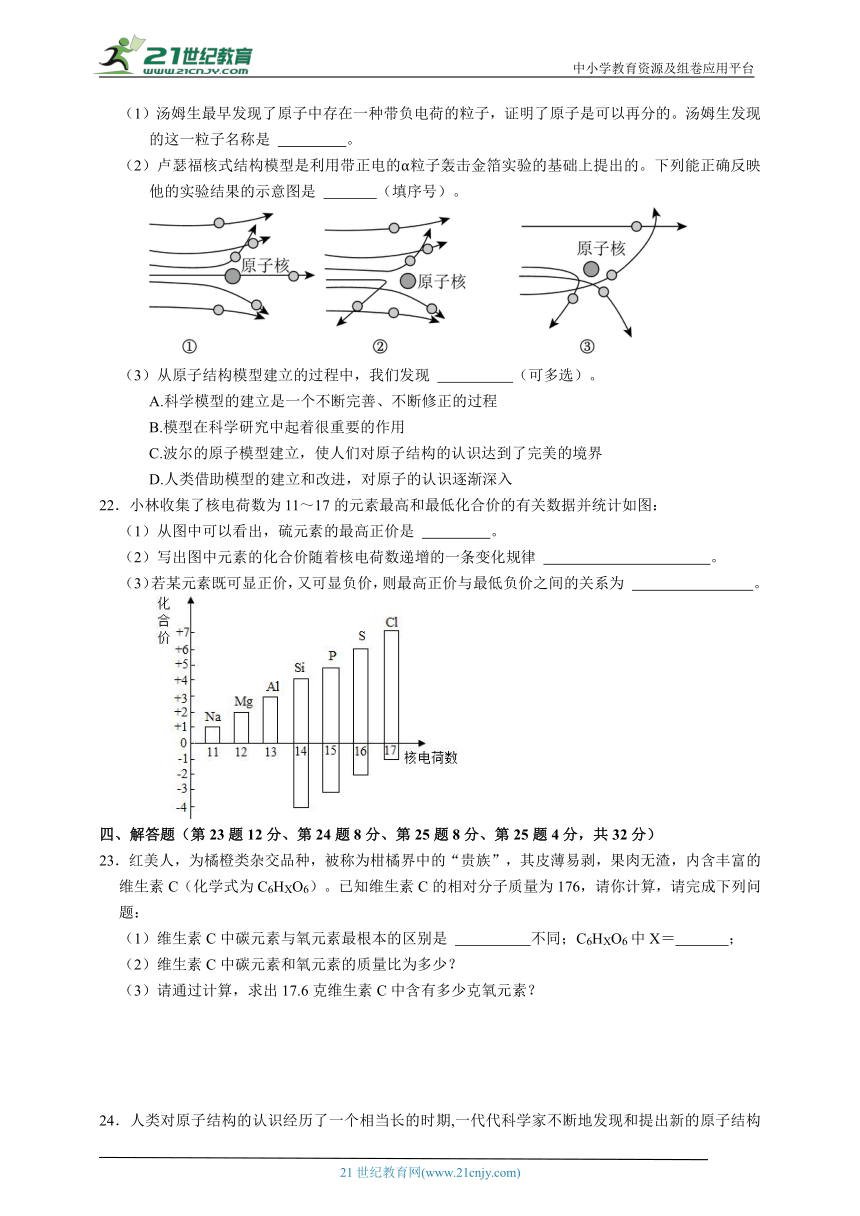
A.元素符号不同 B.原子质量不同 C.原子的质子数不同 D.原子的电子数不同
3.在O2、CO2、SO2这三种物质中都含有( )
A.氧元素 B.氧分子 C.两个氧原子 D.两个氧元素
4.氖气是芯片制造的核心材料之一,很难找到替代的产品。如图是氖元素在元素周期表中的相关信息,下列说法错误的是( )
A.氖气的化学式为Ne
B.氖原子核内有10个质子
C.氖气是由氖原子构成的
D.氖元素的相对原子质量20.18克
5.下列元素分类正确的是( )
A.金属元素:Ca Mg Fe Cu B.非金属元素:P Si Ag C
C.稀有气体元素:He Ne Ar Cl D.固体非金属元素:O S P Si
6.化学中元素符号能表示一定的意义,不同的元素符号表示的意义不同.下列对元素符号表示的意义解释正确的是( )
序号 元素符号 元素符号所表示的意义
A H 只表示氢元素
B Fe 表示铁元素,表示一个铁原子,表示铁这种物质
C N 只表示一个氮原子
D O 表示氧元素,表示一个氧原子,表示氧气这种物质
A.A B.B C.C D.D
7.下图小白球代表氢原子,大灰球代表氦原子。表示等质量氢气与氦气的混合气体是( )
A. B. C. D.
8.A、B两种元素的相对原子质量之比是2:1,由A、B两种元素组成的化合物中,A、B两种元素的质量之比是2:3,则该化合物的化学式是( )
A.AB B.AB2 C.AB3 D.A2B3
9.枯茗醛(化学式为C10H12O)是一种食用香料,下列说法正确的是( )
A.从类别上看:枯茗醛属于氧化物
B.从宏观上看:枯茗醛分子由碳、氢、氧三种元素组成
C.从微观上看:1个枯茗醛分子中含有23个原子
D.从质量上看:枯茗醛中碳元素和氢元素的质量比为5:6
10.下列化学符号中数字“2”表示的意义正确的是( )
A.O:氧化钙的化合价为+2价 B.CO2:二氧化碳中含有2个氧原子
C.2H:2个氢元素 D.Mg2+:一个镁离子带2个单位正电荷
11.下列元素符号和名称书写都正确的是( )
A.炭C B.铝Al C.氯cl D.钙Ga
12.液氮是指液态氮气,常被应用于食品冷冻、塑料和橡胶抛光、冷却、金属处理等方面。下列能表示液氮的化学式是( )
A.2N B.N2 C.N D.N2
13.若一个SO2分子质量为nkg,一个SO3分子的质量为mkg,若以一个硫原子质量的作为标准,则SO2的相对分子质量为( )
A. B. C. D.
14.逻辑推理是一种重要的科学思维方法,下列表述逻辑合理的是( )
A.氧化物中含有氧元素,所以含氧元素的物质一定是氧化物
B.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
C.氧气能使带火星的木条复燃,能使带火星的木条复燃一定是氧气
D.具有相同核电荷数的一类原子是同种元素,同种元素的原子一定含有相同的核电荷数
二、填空题(第15、16题每空1分,其余每空2分,共22分)
15.用元素符号,化学式填空:
(1)氯气
(2)3个碳酸根离子
(3)保持二氧化氮的化学性质的最小微粒
(4)碳酸氢铵
(5)氯化铁中铁的化合价为+3
(6)地壳中含量最多的金属元素
16.有水、双氧水、重水,“”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有 种,从化学性质的角度看, 与水的化学性质有较大的差异.
17.如图所示,其中①②③表示三种原子,“”“”“”分别表示原子的中子、质子、电子。③是 元素的原子;①②③中属于同种元素的原子是 (填序号)。
18.表中是几种常见的元素:
元素名称 钠 铁 铝 氢 氯 氧 硫
(1)如表元素中,在地壳中含量最多的金属元素是 。
(2)如图分别表示三种气体的微观示意图,其中表示化合物的是 (填字母序号),属于单质的是 (填字母序号)。
19.结合所学知识回答有关下列问题:
(1)最近科学家成功制备了一种含有铱元素(Ir)的带一个单位正电荷的阳离子(四氧化铱离子),离子结构模型如图所示,则该离子的符号为 ;
(2)考古学上常用碳﹣14原子测定文物年代,碳﹣14原子和碳﹣12原子在原子结构上的不同之处是 。
三、探究题(每空2分,共18分)
20.元素周期表是学习和研究科学的重要工具。如表是元素周期表的一部分,据表回答问题:
①
② ③ ④
⑤
(1)表中不同种元素最本质的区别是______(填字母)。
A.质子数不同 B.中子数不同 C.电子数不同 D.相对原子质量不同
(2)同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。则原子得电子能力:硫______氯。(选填“”、“”或“
(3)核磁共振(NMR)技术已广泛应用于医学领域,已知只有质子数为奇数的原子才有NMR现象,表中标号为①至⑤的五种元素的原子,能产生NMR现象的是______(填序号)。
21.人类对原子结构的认识,经历了汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)汤姆生最早发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的这一粒子名称是 。
(2)卢瑟福核式结构模型是利用带正电的α粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
(3)从原子结构模型建立的过程中,我们发现 (可多选)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立和改进,对原子的认识逐渐深入
22.小林收集了核电荷数为11~17的元素最高和最低化合价的有关数据并统计如图:
(1)从图中可以看出,硫元素的最高正价是 。
(2)写出图中元素的化合价随着核电荷数递增的一条变化规律 。
(3)若某元素既可显正价,又可显负价,则最高正价与最低负价之间的关系为 。
四、解答题(第23题12分、第24题8分、第25题8分、第25题4分,共32分)
23.红美人,为橘橙类杂交品种,被称为柑橘界中的“贵族”,其皮薄易剥,果肉无渣,内含丰富的维生素C(化学式为C6HXO6)。已知维生素C的相对分子质量为176,请你计算,请完成下列问题:
(1)维生素C中碳元素与氧元素最根本的区别是 不同;C6HXO6中X= ;
(2)维生素C中碳元素和氧元素的质量比为多少?
(3)请通过计算,求出17.6克维生素C中含有多少克氧元素?
24.人类对原子结构的认识经历了一个相当长的时期,一代代科学家不断地发现和提出新的原子结构模型。
(1)以下是科学家及其提出的原子结构假设模型(如图所示),其中符合原子结构模型建立先后顺序的是______。
①汤姆生:枣糕模型②卢瑟福:核式模型③道尔顿:实心球模型
(2) 1919年科学家卢瑟福用氦原子核轰击氮原子核,结果得到氧、氢两种原子。某学生说:“这是一种生成新物质的变化——化学变化,元素可以通过化学反应来制取。”小柯认为这些学生的说法不正确,其理由是 。
(3) 2022年4月26日,我国首次国产化碳﹣14批量生产在中核集团秦山核电站启动。下列模型能
表示碳﹣14(有6个质子,8个中子)原子结构的是______。
25.现代生活中,人们越来越注意微量元素的摄入。血红蛋白中的铁是人体内氧的输送者,缺铁易患贫血。
(1)一种添加了营养剂的“铁强化”酱油已经面市。根据卫生部铁强化剂添加标准,每100mL酱油中铁营养剂添加量是200mg,该营养元素质量分数为12.5%。根据实验测得,酱油中铁只有10%能被人体吸收,以某人一天食用16mL该酱油计算,他一天从酱油中吸收的铁元素是多少毫克?
(2)某贫血患者除正常饮食吸收铁元素外,还需服用含铁元素的某种药物。若治疗一个疗程需补充12g铁元素,则服用药物中的铁元素相当于需要硫酸亚铁晶体(FeSO4 7H2O)多少克?
26.碘是人体必需的微量元素之一,有“智力元素”之称。
(1)生活中常见的含碘元素的物质为:碘酒——含碘单质I2;碘片和藻类食物——含碘化钾KI;加碘盐——含碘酸钾KIO3。下列关于I2、KI、KIO3中碘元素化合价正确的是 。
A.+1、﹣1、+5 B.0、+1、+5 C.0、﹣1、+5
(2)适当食用加碘盐(含KIO3)可预防碘缺乏,但服用碘酒(含I2)却会引起碘中毒。KIO3和I2性质不同的原因是 。
答案
1.A.此图为新型冠状病毒的模型图,故A不符合题意;
B.此图为节水标记图,不属于模型,故B符合题意;
C.此图为甲烷分子结构,是化学分子的表现形式图,属于模型,故C不符合题意;
D.此图为足球烯结构的表达形式图,属于模型,故D不符合题意;
故选:B。
2.解:元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同,所以铝(Al)元素和锂(Li)元素的本质区别是质子数(即核电荷数)不同。
故选:C。
3.解:A、O2、CO2、SO2三种物质中都含有氧元素,说法正确;
B、氧气中含有氧分子,二氧化碳中含有二氧化碳分子,二氧化硫中含有二氧化硫分子,二者均不含氧分子,说法错误;
C、O2、CO2、SO2这三种物质的一个分子中都含有两个氧原子,说法错误;
D、元素是个宏观概念,只讲种类、不讲个数,说法错误。
故选:A。
4.解:A、氖气属于稀有气体单质,直接用元素符号表示其化学式,氖气的化学式为Ne,故选项说法正确。
B、根据元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数为10;根据原子中原子序数=核电荷数=质子数=核外电子数,则氖原子核内有10个质子,故选项说法正确。
C、氖气属于中稀有气体单质,是由氖原子构成的,故选项说法正确。
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为20.18,相对原子质量单位是“1”,不是“克”,故选项说法错误。
故选:D。
5.解:A、Ca Mg Fe Cu都属于金属元素,故选项分类正确;
B、P Si C属于非金属元素,Ag属于金属元素,故选项分类错误;
C、He Ne Ar属于稀有气体元素,Cl(氯)不属于稀有元素,故选项分类错误;
D、S P Si属于固态非金属元素,O不属于固态非金属元素,故选项分类错误。
故选:A。
6.解:A、H可表示氢元素或一个氢原子,故A错误;
B、金属元素的元素符号可表示3个意义,即Fe可表示铁元素,表示一个铁原子,表示铁这种物质,故正确;
C、N表示氮元素或一个氮原子,故错误;
D、元素符号表示3个意义只有金属、稀有气体、固态非金属的元素符号,O是气态非金属元素符号,只表示2个意义,即氧元素或一个氧原子,故错误;
故选:B。
7.解:氢气的相对分子质量是2,氦气是由原子构成的,相对原子质量是4,等质量氢气与氦气的混合气体,应是氢气的分子数与氦原子的个数比为2:1,观察图示可知,B符合题意。
故选:B。
8.解:设化合物的化学式为AmBn,由相对原子质量之比为2:1,
则设相对原子质量分别为2a、a,
根据AB两元素的质量比为2:3,
2a×m:a×n=2:3,
解得m:n=1:3,
即化合物的化学式为AB3,
故选:C。
9.解:A、枯茗醛是由碳、氢、氧三种元素组成的化合物,不属于氧化物,故选项说法错误。
B、分子是由原子构成的,枯茗醛分子由碳、氢、氧三种原子构成的,故选项说法错误。
C、1个枯茗醛分子是由10个碳原子、12个氢原子和1个氧原子构成的,1个枯茗醛分子中含有23个原子,故选项说法正确。
D、枯茗醛中碳元素和氢元素的质量比为(12×10):(1×12)≠5:6,故选项说法错误。
故选:C。
10.解:A、标在元素符号正上方的数字表示该元素化合价的数值,O中的“2”表示氧化钙中钙元素的化合价为+2价,故选项说法错误。
B、标在化学式中元素右下角的数字表示一个分子中所含原子的数目,CO2中的“2”表示1个二氧化碳分子中含有2个氧原子,故选项说法错误。
C、标在元素符号前面的数字表示原子的个数,2H中的“2”表示氢原子的个数为2,故选项说法错误。
D、标在元素符号右上角的数字表示1个离子所带的电荷数,Mg2+中的“2”表示一个镁离子带有两个单位的正电荷,故选项说法正确。
故选:D。
11.解:A、C是碳元素的元素符号,元素名称是碳,故选项错误;
B、铝的元素符号是Al,故选项正确;
C、氯的元素符号是Cl,故选项错误;
D、钙的元素符号是Ca,故选项错误。
故选:B。
12.解:液氮是由氮分子构成的,液氮的化学式为N2,故选:B。
13.解:1个氧原子的质量为:(m﹣n) kg;则1个硫原子的质量为:n﹣2(m﹣n) kg=(3n﹣2m)kg;
若以硫原子质量的作为原子质量的标准,则硫原子的相对原子质量==32;
氧原子的相对原子质量为:;根据相对分子的质量为组成分子的各原子的相对原子质量之和,所以SO2的相对分子质量为:32+2×=。
故选:C。
14.解:A、氧化物中含有氧元素,所以含氧元素的物质一定是氧化物错误,如高锰酸钾不是氧化物;故选项错误;
B、由同种元素组成的纯净物叫单质,单质中只含有一种元素,只含有一种元素的物质一定是单质错误,如氧气和臭氧属于混合物,不是单质;故选项错误;
C、氧气能使带火星的木条复燃,能使带火星的木条复燃一定是氧气错误,因为臭氧也具有助燃性;故选项错误;
D、具有相同核电荷数的一类原子是同种元素,同种元素的原子一定含有相同的核电荷数,这种说法正确;故选项正确;
故选:D。
15.解:(1)右下角的数字表示几个原子构成一个分子,氯气表示为Cl2;故答案为:Cl2;
(2)符号前面的数字,表示原子、分子或离子的个数;3个碳酸根离子表示为3;故答案为:3;
(3)保持二氧化氮的化学性质的最小微粒是二氧化碳分子,表示为CO2;故答案为:CO2;
(4)化学式书写的一般规律是:正前负后,然后利用十字交叉法书写;碳酸氢铵中铵根+1价,氢元素+1价,碳酸根﹣2价,碳酸氢铵表示为NH4HCO3;故答案为:NH4HCO3;
(5)元素正上方的数字表示元素的化合价表示为Cl3;故答案为:Cl3;
(6)书写元素符号时,第一个字母要大写,第二个字母要小写;表示为Al;故答案为:Al。
16.根据水、双氧水、重水的化学式可知都有氢、氧两种元素组成;物质的结构决定物质的性质,从化学性质的角度看,双氧水与水的化学性质有较大的差异;
故答案为:;双氧水.
17.解:在原子中,质子数=核外电子数=原子序数,③中质子数为2,是氦元素的原子;根据元素的种类是由质子数决定的可知,由微观结构示意图可知,①和②这两种粒子核内的质子数均为1,故属于同种元素。
故答案为:氦;①②。
18.解:(1)上表元素中,在地壳中含量最多的金属元素是铝;
(2)A、该图中只有一种分子,该物质属于纯净物,该分子是由同种原子构成的,因此该纯净物属于单质;
B、该图中只有一种分子,该物质属于纯净物,该分子是由不同种原子构成的,因此该纯净物属于化合物;
C、该图中有三种分子,该物质属于混合物;
故答案为:(1)铝;
(2)B;A。
19.解:(1)最近科学家成功制备了一种含有铱元素(Ir)的带一个单位正电荷的阳离子(四氧化铱离子),离子结构模型如图所示,则该离子的符号为;故答案为:;
(2)考古学上常用碳﹣14原子测定文物年代,碳﹣14原子和碳﹣12原子在原子结构上的不同之处是核内中子数不同;故答案为:核内中子数不同。
20.(1)元素是具有相同质子数的一类原子总称,因此不同种元素最本质的区别是质子数不同,故选;
同一周期(横行)中的元素,除族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。则原子得电子能力:硫氯;
①为,②为,③为,④为,⑤为;核磁共振技术已广泛应用于医学领域,已知只有质子数为奇数的原子才有现象,表中标号为①至⑤的五种元素的原子,能产生现象的是①③⑤。
故答案为:
;
;
①③⑤。
21.解:(1)汤姆生发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的粒子是电子;
(2)由于原子中原子核体积很小,质量却很大,所以α粒子遇到原子核就会发生偏向,例如②。
因为原子的核外电子质量很小,但所占的体积却很大,电子的质量小的可以忽略不计,所以α粒子可以直接穿过去,例如②。
由于原子核外的电子质量很小,α粒子是直接穿过,且原子核带正电荷,α粒子也带正电荷,同性相斥,所以α是不可能向原子核靠近的,应该远离原子核,故③不是α粒子在该实验中的运动轨迹;
α粒子不能穿过原子核,故①不是α粒子在该实验中的运动轨迹;
故选:②;
(3)科学模型的建立是一个不断完善、不断修正的过程;模型在科学研究中起着很重要的作用,比较直观;波尔的原子模型建立并不是很完美,还有缺点;人类借助模型的建立,对原子的认识逐渐接近本质,故ABD正确;
故选:ABD。
故答案为:(1)电子;(2)②;(3)ABD。
22.解:(1)由核电荷数为11~17的元素最高和最低化合价的有关数据图,硫元素的最高正价是+6价。
(2)由核电荷数为11~17的元素最高和最低化合价的有关数据图,随着核电荷数的递增,元素的最高化合价依次增大。
(3)某元素既可显正价,又可显负价,例如:氯的最高正价是+7,最低负价是﹣1,硫的最高正价是+6,最低负价是﹣2,磷的最高正价是+5,最低负价是﹣3,则可以看出最高正价与最低负价绝对值的代数和为8。
故答案为:
(1)+6;
(2)随着核电荷数的递增,元素的最高化合价依次增大;
(3)最高正价与最低负价绝对值的代数和为8。
23.解:维生素C(化学式为C6HXO6),维生素C的相对分子质量为176,
(1)具有相同质子数的一类原子的总称为元素,维生素C中碳元素与氧元素最根本的区别是质子数不同;C6HXO6中,176=(12×6)+X+(6×16),X=8;
(2)维生素C的分子式为C6H8O6,碳元素和氧元素的质量比:(12×6):(6×16)=3:4;
答:维生素C中碳元素和氧元素的质量比为3:4;
(3)17.6克维生素C中含有氧元素质量为17.6g××100%=9.6g。
答:17.6克维生素C中含有氧元素质量为9.6g。
故答案为:
(1)质子数;8;
(2)3:4;
(3)9.6g。
24.21. (1)③①②(2)化学变化中元素种类是不变化的,粒子轰击过程中原子种类发生了变化,这个过程一定不是化学变化,所以元素不能用化学反应来制取(3)C
25.解:(1)此人一天从酱油中吸收铁元素的质量为200mg÷100mL×12.5%×10%×16mL=0.4mg
(2)需要的硫酸亚铁晶体的质量为12g÷×100%≈59.6g
答:(1)此人一天从酱油中吸收的铁元素是0.4mg;
(2)服用药物中的铁元素相当于需要硫酸亚铁晶体59.6g。
26.解:(1)单质中元素的化合价为0,化合物中各元素的化合价的代数和为0,I2中碘元素为0价;KI中钾元素为+1价,则碘元素为﹣1价;KIO3中钾元素为+1价,氧元素为﹣2价,则碘元素化合价+5价,所以选B;
(2)结构决定性质,KIO3和I2性质不同的原因是因为构成物质的微粒不同而导致的。
故答案为:
(1)B;
(2)构成物质的微粒不同。
第18题 第19题
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
浙教版科学八下微粒的模型与符号单元测试(二)(含答案)
一、选择题(每小题2分,共28分)
1.模型可以帮助人们认识一些不能直接观察到的或复杂的事物。下列不属于模型的是( )
A.新冠病毒 B.节水标记
C.甲烷分子结构 D.足球烯结构
2.国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素和锂(Li)元素的本质区别是( )
A.元素符号不同 B.原子质量不同 C.原子的质子数不同 D.原子的电子数不同
3.在O2、CO2、SO2这三种物质中都含有( )
A.氧元素 B.氧分子 C.两个氧原子 D.两个氧元素
4.氖气是芯片制造的核心材料之一,很难找到替代的产品。如图是氖元素在元素周期表中的相关信息,下列说法错误的是( )
A.氖气的化学式为Ne
B.氖原子核内有10个质子
C.氖气是由氖原子构成的
D.氖元素的相对原子质量20.18克
5.下列元素分类正确的是( )
A.金属元素:Ca Mg Fe Cu B.非金属元素:P Si Ag C
C.稀有气体元素:He Ne Ar Cl D.固体非金属元素:O S P Si
6.化学中元素符号能表示一定的意义,不同的元素符号表示的意义不同.下列对元素符号表示的意义解释正确的是( )
序号 元素符号 元素符号所表示的意义
A H 只表示氢元素
B Fe 表示铁元素,表示一个铁原子,表示铁这种物质
C N 只表示一个氮原子
D O 表示氧元素,表示一个氧原子,表示氧气这种物质
A.A B.B C.C D.D
7.下图小白球代表氢原子,大灰球代表氦原子。表示等质量氢气与氦气的混合气体是( )
A. B. C. D.
8.A、B两种元素的相对原子质量之比是2:1,由A、B两种元素组成的化合物中,A、B两种元素的质量之比是2:3,则该化合物的化学式是( )
A.AB B.AB2 C.AB3 D.A2B3
9.枯茗醛(化学式为C10H12O)是一种食用香料,下列说法正确的是( )
A.从类别上看:枯茗醛属于氧化物
B.从宏观上看:枯茗醛分子由碳、氢、氧三种元素组成
C.从微观上看:1个枯茗醛分子中含有23个原子
D.从质量上看:枯茗醛中碳元素和氢元素的质量比为5:6
10.下列化学符号中数字“2”表示的意义正确的是( )
A.O:氧化钙的化合价为+2价 B.CO2:二氧化碳中含有2个氧原子
C.2H:2个氢元素 D.Mg2+:一个镁离子带2个单位正电荷
11.下列元素符号和名称书写都正确的是( )
A.炭C B.铝Al C.氯cl D.钙Ga
12.液氮是指液态氮气,常被应用于食品冷冻、塑料和橡胶抛光、冷却、金属处理等方面。下列能表示液氮的化学式是( )
A.2N B.N2 C.N D.N2
13.若一个SO2分子质量为nkg,一个SO3分子的质量为mkg,若以一个硫原子质量的作为标准,则SO2的相对分子质量为( )
A. B. C. D.
14.逻辑推理是一种重要的科学思维方法,下列表述逻辑合理的是( )
A.氧化物中含有氧元素,所以含氧元素的物质一定是氧化物
B.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
C.氧气能使带火星的木条复燃,能使带火星的木条复燃一定是氧气
D.具有相同核电荷数的一类原子是同种元素,同种元素的原子一定含有相同的核电荷数
二、填空题(第15、16题每空1分,其余每空2分,共22分)
15.用元素符号,化学式填空:
(1)氯气
(2)3个碳酸根离子
(3)保持二氧化氮的化学性质的最小微粒
(4)碳酸氢铵
(5)氯化铁中铁的化合价为+3
(6)地壳中含量最多的金属元素
16.有水、双氧水、重水,“”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有 种,从化学性质的角度看, 与水的化学性质有较大的差异.
17.如图所示,其中①②③表示三种原子,“”“”“”分别表示原子的中子、质子、电子。③是 元素的原子;①②③中属于同种元素的原子是 (填序号)。
18.表中是几种常见的元素:
元素名称 钠 铁 铝 氢 氯 氧 硫
(1)如表元素中,在地壳中含量最多的金属元素是 。
(2)如图分别表示三种气体的微观示意图,其中表示化合物的是 (填字母序号),属于单质的是 (填字母序号)。
19.结合所学知识回答有关下列问题:
(1)最近科学家成功制备了一种含有铱元素(Ir)的带一个单位正电荷的阳离子(四氧化铱离子),离子结构模型如图所示,则该离子的符号为 ;
(2)考古学上常用碳﹣14原子测定文物年代,碳﹣14原子和碳﹣12原子在原子结构上的不同之处是 。
三、探究题(每空2分,共18分)
20.元素周期表是学习和研究科学的重要工具。如表是元素周期表的一部分,据表回答问题:
①
② ③ ④
⑤
(1)表中不同种元素最本质的区别是______(填字母)。
A.质子数不同 B.中子数不同 C.电子数不同 D.相对原子质量不同
(2)同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。则原子得电子能力:硫______氯。(选填“”、“”或“
(3)核磁共振(NMR)技术已广泛应用于医学领域,已知只有质子数为奇数的原子才有NMR现象,表中标号为①至⑤的五种元素的原子,能产生NMR现象的是______(填序号)。
21.人类对原子结构的认识,经历了汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)汤姆生最早发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的这一粒子名称是 。
(2)卢瑟福核式结构模型是利用带正电的α粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
(3)从原子结构模型建立的过程中,我们发现 (可多选)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立和改进,对原子的认识逐渐深入
22.小林收集了核电荷数为11~17的元素最高和最低化合价的有关数据并统计如图:
(1)从图中可以看出,硫元素的最高正价是 。
(2)写出图中元素的化合价随着核电荷数递增的一条变化规律 。
(3)若某元素既可显正价,又可显负价,则最高正价与最低负价之间的关系为 。
四、解答题(第23题12分、第24题8分、第25题8分、第25题4分,共32分)
23.红美人,为橘橙类杂交品种,被称为柑橘界中的“贵族”,其皮薄易剥,果肉无渣,内含丰富的维生素C(化学式为C6HXO6)。已知维生素C的相对分子质量为176,请你计算,请完成下列问题:
(1)维生素C中碳元素与氧元素最根本的区别是 不同;C6HXO6中X= ;
(2)维生素C中碳元素和氧元素的质量比为多少?
(3)请通过计算,求出17.6克维生素C中含有多少克氧元素?
24.人类对原子结构的认识经历了一个相当长的时期,一代代科学家不断地发现和提出新的原子结构模型。
(1)以下是科学家及其提出的原子结构假设模型(如图所示),其中符合原子结构模型建立先后顺序的是______。
①汤姆生:枣糕模型②卢瑟福:核式模型③道尔顿:实心球模型
(2) 1919年科学家卢瑟福用氦原子核轰击氮原子核,结果得到氧、氢两种原子。某学生说:“这是一种生成新物质的变化——化学变化,元素可以通过化学反应来制取。”小柯认为这些学生的说法不正确,其理由是 。
(3) 2022年4月26日,我国首次国产化碳﹣14批量生产在中核集团秦山核电站启动。下列模型能
表示碳﹣14(有6个质子,8个中子)原子结构的是______。
25.现代生活中,人们越来越注意微量元素的摄入。血红蛋白中的铁是人体内氧的输送者,缺铁易患贫血。
(1)一种添加了营养剂的“铁强化”酱油已经面市。根据卫生部铁强化剂添加标准,每100mL酱油中铁营养剂添加量是200mg,该营养元素质量分数为12.5%。根据实验测得,酱油中铁只有10%能被人体吸收,以某人一天食用16mL该酱油计算,他一天从酱油中吸收的铁元素是多少毫克?
(2)某贫血患者除正常饮食吸收铁元素外,还需服用含铁元素的某种药物。若治疗一个疗程需补充12g铁元素,则服用药物中的铁元素相当于需要硫酸亚铁晶体(FeSO4 7H2O)多少克?
26.碘是人体必需的微量元素之一,有“智力元素”之称。
(1)生活中常见的含碘元素的物质为:碘酒——含碘单质I2;碘片和藻类食物——含碘化钾KI;加碘盐——含碘酸钾KIO3。下列关于I2、KI、KIO3中碘元素化合价正确的是 。
A.+1、﹣1、+5 B.0、+1、+5 C.0、﹣1、+5
(2)适当食用加碘盐(含KIO3)可预防碘缺乏,但服用碘酒(含I2)却会引起碘中毒。KIO3和I2性质不同的原因是 。
答案
1.A.此图为新型冠状病毒的模型图,故A不符合题意;
B.此图为节水标记图,不属于模型,故B符合题意;
C.此图为甲烷分子结构,是化学分子的表现形式图,属于模型,故C不符合题意;
D.此图为足球烯结构的表达形式图,属于模型,故D不符合题意;
故选:B。
2.解:元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同,所以铝(Al)元素和锂(Li)元素的本质区别是质子数(即核电荷数)不同。
故选:C。
3.解:A、O2、CO2、SO2三种物质中都含有氧元素,说法正确;
B、氧气中含有氧分子,二氧化碳中含有二氧化碳分子,二氧化硫中含有二氧化硫分子,二者均不含氧分子,说法错误;
C、O2、CO2、SO2这三种物质的一个分子中都含有两个氧原子,说法错误;
D、元素是个宏观概念,只讲种类、不讲个数,说法错误。
故选:A。
4.解:A、氖气属于稀有气体单质,直接用元素符号表示其化学式,氖气的化学式为Ne,故选项说法正确。
B、根据元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数为10;根据原子中原子序数=核电荷数=质子数=核外电子数,则氖原子核内有10个质子,故选项说法正确。
C、氖气属于中稀有气体单质,是由氖原子构成的,故选项说法正确。
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为20.18,相对原子质量单位是“1”,不是“克”,故选项说法错误。
故选:D。
5.解:A、Ca Mg Fe Cu都属于金属元素,故选项分类正确;
B、P Si C属于非金属元素,Ag属于金属元素,故选项分类错误;
C、He Ne Ar属于稀有气体元素,Cl(氯)不属于稀有元素,故选项分类错误;
D、S P Si属于固态非金属元素,O不属于固态非金属元素,故选项分类错误。
故选:A。
6.解:A、H可表示氢元素或一个氢原子,故A错误;
B、金属元素的元素符号可表示3个意义,即Fe可表示铁元素,表示一个铁原子,表示铁这种物质,故正确;
C、N表示氮元素或一个氮原子,故错误;
D、元素符号表示3个意义只有金属、稀有气体、固态非金属的元素符号,O是气态非金属元素符号,只表示2个意义,即氧元素或一个氧原子,故错误;
故选:B。
7.解:氢气的相对分子质量是2,氦气是由原子构成的,相对原子质量是4,等质量氢气与氦气的混合气体,应是氢气的分子数与氦原子的个数比为2:1,观察图示可知,B符合题意。
故选:B。
8.解:设化合物的化学式为AmBn,由相对原子质量之比为2:1,
则设相对原子质量分别为2a、a,
根据AB两元素的质量比为2:3,
2a×m:a×n=2:3,
解得m:n=1:3,
即化合物的化学式为AB3,
故选:C。
9.解:A、枯茗醛是由碳、氢、氧三种元素组成的化合物,不属于氧化物,故选项说法错误。
B、分子是由原子构成的,枯茗醛分子由碳、氢、氧三种原子构成的,故选项说法错误。
C、1个枯茗醛分子是由10个碳原子、12个氢原子和1个氧原子构成的,1个枯茗醛分子中含有23个原子,故选项说法正确。
D、枯茗醛中碳元素和氢元素的质量比为(12×10):(1×12)≠5:6,故选项说法错误。
故选:C。
10.解:A、标在元素符号正上方的数字表示该元素化合价的数值,O中的“2”表示氧化钙中钙元素的化合价为+2价,故选项说法错误。
B、标在化学式中元素右下角的数字表示一个分子中所含原子的数目,CO2中的“2”表示1个二氧化碳分子中含有2个氧原子,故选项说法错误。
C、标在元素符号前面的数字表示原子的个数,2H中的“2”表示氢原子的个数为2,故选项说法错误。
D、标在元素符号右上角的数字表示1个离子所带的电荷数,Mg2+中的“2”表示一个镁离子带有两个单位的正电荷,故选项说法正确。
故选:D。
11.解:A、C是碳元素的元素符号,元素名称是碳,故选项错误;
B、铝的元素符号是Al,故选项正确;
C、氯的元素符号是Cl,故选项错误;
D、钙的元素符号是Ca,故选项错误。
故选:B。
12.解:液氮是由氮分子构成的,液氮的化学式为N2,故选:B。
13.解:1个氧原子的质量为:(m﹣n) kg;则1个硫原子的质量为:n﹣2(m﹣n) kg=(3n﹣2m)kg;
若以硫原子质量的作为原子质量的标准,则硫原子的相对原子质量==32;
氧原子的相对原子质量为:;根据相对分子的质量为组成分子的各原子的相对原子质量之和,所以SO2的相对分子质量为:32+2×=。
故选:C。
14.解:A、氧化物中含有氧元素,所以含氧元素的物质一定是氧化物错误,如高锰酸钾不是氧化物;故选项错误;
B、由同种元素组成的纯净物叫单质,单质中只含有一种元素,只含有一种元素的物质一定是单质错误,如氧气和臭氧属于混合物,不是单质;故选项错误;
C、氧气能使带火星的木条复燃,能使带火星的木条复燃一定是氧气错误,因为臭氧也具有助燃性;故选项错误;
D、具有相同核电荷数的一类原子是同种元素,同种元素的原子一定含有相同的核电荷数,这种说法正确;故选项正确;
故选:D。
15.解:(1)右下角的数字表示几个原子构成一个分子,氯气表示为Cl2;故答案为:Cl2;
(2)符号前面的数字,表示原子、分子或离子的个数;3个碳酸根离子表示为3;故答案为:3;
(3)保持二氧化氮的化学性质的最小微粒是二氧化碳分子,表示为CO2;故答案为:CO2;
(4)化学式书写的一般规律是:正前负后,然后利用十字交叉法书写;碳酸氢铵中铵根+1价,氢元素+1价,碳酸根﹣2价,碳酸氢铵表示为NH4HCO3;故答案为:NH4HCO3;
(5)元素正上方的数字表示元素的化合价表示为Cl3;故答案为:Cl3;
(6)书写元素符号时,第一个字母要大写,第二个字母要小写;表示为Al;故答案为:Al。
16.根据水、双氧水、重水的化学式可知都有氢、氧两种元素组成;物质的结构决定物质的性质,从化学性质的角度看,双氧水与水的化学性质有较大的差异;
故答案为:;双氧水.
17.解:在原子中,质子数=核外电子数=原子序数,③中质子数为2,是氦元素的原子;根据元素的种类是由质子数决定的可知,由微观结构示意图可知,①和②这两种粒子核内的质子数均为1,故属于同种元素。
故答案为:氦;①②。
18.解:(1)上表元素中,在地壳中含量最多的金属元素是铝;
(2)A、该图中只有一种分子,该物质属于纯净物,该分子是由同种原子构成的,因此该纯净物属于单质;
B、该图中只有一种分子,该物质属于纯净物,该分子是由不同种原子构成的,因此该纯净物属于化合物;
C、该图中有三种分子,该物质属于混合物;
故答案为:(1)铝;
(2)B;A。
19.解:(1)最近科学家成功制备了一种含有铱元素(Ir)的带一个单位正电荷的阳离子(四氧化铱离子),离子结构模型如图所示,则该离子的符号为;故答案为:;
(2)考古学上常用碳﹣14原子测定文物年代,碳﹣14原子和碳﹣12原子在原子结构上的不同之处是核内中子数不同;故答案为:核内中子数不同。
20.(1)元素是具有相同质子数的一类原子总称,因此不同种元素最本质的区别是质子数不同,故选;
同一周期(横行)中的元素,除族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。则原子得电子能力:硫氯;
①为,②为,③为,④为,⑤为;核磁共振技术已广泛应用于医学领域,已知只有质子数为奇数的原子才有现象,表中标号为①至⑤的五种元素的原子,能产生现象的是①③⑤。
故答案为:
;
;
①③⑤。
21.解:(1)汤姆生发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的粒子是电子;
(2)由于原子中原子核体积很小,质量却很大,所以α粒子遇到原子核就会发生偏向,例如②。
因为原子的核外电子质量很小,但所占的体积却很大,电子的质量小的可以忽略不计,所以α粒子可以直接穿过去,例如②。
由于原子核外的电子质量很小,α粒子是直接穿过,且原子核带正电荷,α粒子也带正电荷,同性相斥,所以α是不可能向原子核靠近的,应该远离原子核,故③不是α粒子在该实验中的运动轨迹;
α粒子不能穿过原子核,故①不是α粒子在该实验中的运动轨迹;
故选:②;
(3)科学模型的建立是一个不断完善、不断修正的过程;模型在科学研究中起着很重要的作用,比较直观;波尔的原子模型建立并不是很完美,还有缺点;人类借助模型的建立,对原子的认识逐渐接近本质,故ABD正确;
故选:ABD。
故答案为:(1)电子;(2)②;(3)ABD。
22.解:(1)由核电荷数为11~17的元素最高和最低化合价的有关数据图,硫元素的最高正价是+6价。
(2)由核电荷数为11~17的元素最高和最低化合价的有关数据图,随着核电荷数的递增,元素的最高化合价依次增大。
(3)某元素既可显正价,又可显负价,例如:氯的最高正价是+7,最低负价是﹣1,硫的最高正价是+6,最低负价是﹣2,磷的最高正价是+5,最低负价是﹣3,则可以看出最高正价与最低负价绝对值的代数和为8。
故答案为:
(1)+6;
(2)随着核电荷数的递增,元素的最高化合价依次增大;
(3)最高正价与最低负价绝对值的代数和为8。
23.解:维生素C(化学式为C6HXO6),维生素C的相对分子质量为176,
(1)具有相同质子数的一类原子的总称为元素,维生素C中碳元素与氧元素最根本的区别是质子数不同;C6HXO6中,176=(12×6)+X+(6×16),X=8;
(2)维生素C的分子式为C6H8O6,碳元素和氧元素的质量比:(12×6):(6×16)=3:4;
答:维生素C中碳元素和氧元素的质量比为3:4;
(3)17.6克维生素C中含有氧元素质量为17.6g××100%=9.6g。
答:17.6克维生素C中含有氧元素质量为9.6g。
故答案为:
(1)质子数;8;
(2)3:4;
(3)9.6g。
24.21. (1)③①②(2)化学变化中元素种类是不变化的,粒子轰击过程中原子种类发生了变化,这个过程一定不是化学变化,所以元素不能用化学反应来制取(3)C
25.解:(1)此人一天从酱油中吸收铁元素的质量为200mg÷100mL×12.5%×10%×16mL=0.4mg
(2)需要的硫酸亚铁晶体的质量为12g÷×100%≈59.6g
答:(1)此人一天从酱油中吸收的铁元素是0.4mg;
(2)服用药物中的铁元素相当于需要硫酸亚铁晶体59.6g。
26.解:(1)单质中元素的化合价为0,化合物中各元素的化合价的代数和为0,I2中碘元素为0价;KI中钾元素为+1价,则碘元素为﹣1价;KIO3中钾元素为+1价,氧元素为﹣2价,则碘元素化合价+5价,所以选B;
(2)结构决定性质,KIO3和I2性质不同的原因是因为构成物质的微粒不同而导致的。
故答案为:
(1)B;
(2)构成物质的微粒不同。
第18题 第19题
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
